Методическое пособие по педиатрии ббк. Методическое пособие по педиатрии включает в себя материал, соответствующий требованиям Программы для студентов по Педиатрии
 Скачать 5.78 Mb. Скачать 5.78 Mb.
|
|
Глава V. Гипоксия плода и асфиксия новорожденного В акушерской и педиатрической практике термины «гипоксия плода» и «асфиксия новорожденного» включают патологические состояния, проявляющиеся расстройствами деятельности жизненно важных систем (ЦНС, кровообращение, дыхание), развивающиеся вследствие острой или хронической кислородной недостаточности и метаболического ацидоза (Савельева Г. М., 1981). В клинической практике термином «асфиксия новорожденного» обозначают клинический синдром, проявляющийся в первые минуты жизни новорожденного затруднением или отсутствием дыхания. При этом отмечается угнетение ЦНС и острая сердечная недостаточность. Факторы риска и причины гипоксии Многочисленные факторы риска возникновения кислородной недостаточности у плода и новорожденного включают 3 большие группы (Федорова М. В., 1982). К первой группе относят состояния, приводящие к развитию гипоксемии и гипоксии у беременной: анемия, врожденные пороки сердца, хронические заболевания легких, массивное кровотечение в период беременности и в родах. Развитию гипоксемии у беременной способствуют неполноценное питание, курение, неблагоприятная экологическая обстановка. Вторую, наиболее обширную группу факторов риска, составляют состояния, приводящие к нарушению (снижению) плодо-материнского кровообращения, среди них основное значение имеет плацентарная недостаточность, при которой внутриутробная гипоксия наблюдается у 75-90% плодов. Плацентарная недостаточность наиболее часто развивается при таких экстрагенитальных заболеваниях беременной, как гипертоническая болезнь, артериальная гипотония, ожирение, хронический пиелонефрит, анемия, а также при осложнениях беременности – гестозах, нефропатии с частотой 25-45%. Переношенная беременность также сопровождается нарушением плодо-материнского кровообращения и развитием гипоксии плода в 50% случаев. К акушерским факторам, наиболее часто приводящим к тяжелой асфиксии, относится сдавление пуповины, несоответствие размеров головки плода и таза, тазовое предлежание. Сдавление пуповины, играющее немаловажную роль в возникновении асфиксии, встречается в 30% всех родов. Третья группа риска перинатальной асфиксии включает заболевания плода (иммунологическая несовместимость крови матери и плода, внутриутробные инфекции, родовая травма ЦНС). Этиология и патогенез Хроническая гипоксия плода развивается при осложненном течении беременности, фето-плацентарной недостаточности или при заболеваниях беременной, протекающих с гипоксемией (пороки сердца, тяжелая анемия, хронические болезни легких). Острая гипоксия (асфиксия) чаще возникает в процессе родов в результате нарушения маточно-плацентарного кровообращения при преждевременной отслойке плаценты, пролапсе пуповины, аномальном предлежании плода и плаценты, гипертонусе и разрывах матки, острой гипоксии у роженицы, а также вследствие замедления кровотока при сжатии головки плода и полости малого таза. У плода гипоксия приводит к сдвигу реакцию крови и тканей в кислую сторону, развивается метаболический ацидоз, снижается активность ферментов, обеспечивающих «синтез роста», нарушается функция миокарда. Появляются тахикардия и децелерация сердечного ритма, экстрасистолии. Регистрируется положительный – нереактивный – нестрессовый тест. Кратковременная умеренная внутриутробная гипоксия вызывает включение механизмов компенсации, направленных на поддержание адекватной оксигенации тканей плода. Увеличивается выброс глюкокортикоидов, число циркулирующих эритроцитов в объеме циркулирующей крови. Возникает тахикардия, некоторое повышение систолического давления без увеличения сердечного выброса. Увеличивается двигательная активность плода и частота «дыхательных» движений грудной клетки при закрытой голосовой щели, что также способствует компенсации гемодинамических нарушений. Продолжающаяся гипоксия приводит к активации анаэробного гликолиза. Нарастающий дефицит кислорода заставляет организм снизить оксигенацию кишечника, кожи, печени, почек; происходит перераспределение кровообращения с преимущественным кровоснабжением жизненно важных органов (головной мозг, сердце, надпочечники). Централизация кровообращения, в свою очередь, усугубляет тканевой метаболический ацидоз (резко увеличивается в крови уровень лактата). Развивается снижение двигательной активности плода, частотной активности на ЭЭГ, числа «дыхательных» экскурсий грудной клетки, появляется брадикардия. Тяжелая и/или длительная гипоксия влечет за собой срыв механизмов компенсации, что проявляется, прежде всего, истощением симпато-адреналовой системы и коры надпочечников, артериальной гипотензией, брадикардией, коллапсом. Патологический ацидоз увеличивает проницаемость сосудистой стенки и клеточных мембран. Это, в свою очередь, приводит к гемоконцентрации, сладжированию эритроцитов, образованию внутрисосудистых тромбов, выходу жидкой части крови в интерстициальное пространство, гиповолемии. Повышение проницаемости клеточных мембран вызывает дисэлектролитемию (гиперкалиемию, гипомагниемию, гипокальциемию), что может спровоцировать синдром диссеминированного внутрисосудистого свертывания. Гипоксическая энцефалопатия, которая является грозным клиническим проявлением тяжелой асфиксии, возникает, прежде всего, вследствие ишемии ткани головного мозга (артериальная гипотензия при артериальном давлении на локтевой артерии менее 50 мм рт. ст., тромбозы венул и артериол, нарушение венозного оттока из-за отека головного мозга), дисэлектролитемии, мелких кровоизлияний в ткань мозга и субарахноидальное пространство. Наличие таких кровоизлияний не служит главным прогностическим признаком, как в остром периоде, так и для дальнейшего нервно-психического развития. Поражения головного мозга обусловлены не только изменениями его в момент гипоксии, но и могут возникать в процессе реанимации ребенка, в постгипоксическом периоде, что объясняют накоплением в крови и тканях избытка свободных радикалов и продуктов перекисного окисления липидов («кислородный парадокс» - токсичность избытка кислорода после периода длительной гипоксии), протеолитических ферментов, ионов кальция, и др. Отсюда возникает опасность чрезмерно активной, неконтролируемой оксигенотерапии в неонатологии.                         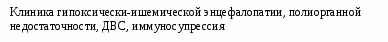 Рис. 2.1. Схема патогенеза асфиксии Классификация. Выделяют средней тяжести, или умеренную, и тяжелую асфиксию. Исследования Объем лабораторных исследований, необходимый для подтверждения диагноза, определения степени тяжести, выявления ранних постасфиктических осложнений: общий анализ крови и мочи, уровень гематокрита, глюкоза крови, сахар мочи, электролиты плазмы, общий белок, мочевина сыворотки крови, коагулограмма, показатели КОС, парциальное давление газов крови (РаО2, РаСО2). Объем лабораторных исследований, необходимый для проведения дифференциального диагноза: посевы крови, кала, мочи, любого отделяемого из местного очага, из слухового прохода, кожи; билирубин сыворотки, трансаминазы. Анамнез, клиника. При сборе анамнеза необходимо выявить патологические состояния (антенатальные и интранатальные факторы риска), приведшие к развитию асфиксии (см «Факторы риска, этиология»). Клиника умеренной (средней тяжести) асфиксии при рождении: нормальное дыхание не установилось в течение 1-й минуты после рождения, частота сердцебиений 100 и более в минуту, незначительное снижение мышечного тонуса, слабая реакция на раздражение. Оценка по шкале Апгар 4-6 баллов. Табл. 2.10. Шкала Апгар
* Проверяется с помощью одного из двух приемов: реакция на катетер при отсасывании содержимого ротоглотки или пяточный рефлекс Аршавского. Общее состояние ребенка при рождении расценивается как средней степени тяжести. Выявляются умеренная вялость, спонтанная двигательная активность, реакция на осмотр и раздражение слабая. Физиологические рефлексы угнетены, крик малоэмоциональный, акроцианоз или общий цианоз кожи. При оксигенации кожа розовеет. Со стороны сердца - тахикардия, тоны сердца звучные или слегка приглушены. Дыхание ритмичное (после первичного апноэ), в легких непостоянные разнокалиберные влажные хрипы. В первые же часы жизни со стороны ЦНС появляется гипервозбудимость – тремор, раздраженный крик, нарушение сна, гиперестезии и гиперакузии, спонтанный рефлекс Моро. Выявляют изменения физиологических рефлексов и мышечного тонуса. Описанные нарушения преходящие и носят функциональный характер, являясь следствием метаболических нарушений и преходящей внутричерепной гипертензии. Состояние нормализуется к 3-5 суткам жизни. Тяжелая первичная асфиксия – оценка по шкале Апгар 1-3 балла, пульс при рождении менее 100 ударов в минуту, дыхание отсутствует или затруднено, кожа бледная, мышцы атоничны. Состояние ребенка при рождении тяжелое. Мышечный тонус, спонтанная двигательная активность, реакция на осмотр снижены или отсутствуют. Физиологические рефлексы угнетены. Цвет кожных покровов бледный или цианотичный, при оксигенации восстанавливается медленно. Тоны сердца глухие, выслушивается систолический шум. Физикальные данные над легкими вариабельны. Меконий отходит до или во время родового акта. Клиническая картина может соответствовать гипоксическому шоку (бледность или землистость кожи, симптом «белого пятна» 3 секунды и более, АД снижено, дыхание отсутствует, реакции на осмотр нет, адинамия, арефлексия, атония, миоз или мидриаз, нистагм, тоны сердца глухие, систолический шум, в легких разнокалиберные влажные хрипы, гепатомегалия, вялая перистальтика кишечника). Динамика неврологической картины вялая. Степень гипоксии и толерантность нервной системы к гипоксическому воздействию у каждого новорожденного индивидуальны, в связи с чем и тяжесть церебральных расстройств также различна. Диагноз гипоксии плода в антенатальном периоде основывается на следующих признаках: - наличие факторов риска в анамнезе беременной; - нарушение частоты сердцебиений плода (тахи- или брадикардия); - нереактивный нестрессовый тест: отсутствие учащения сердцебиений плода (акцелераций). У здоровых плодов наблюдается 2 и более акцелераций в среднем на 15 ударов в минуту с продолжительностью периода акцелерации 15 секунд. При наличии нереактивного нестрессового теста рекомендуется провести стрессовый тест, т. е. оценку сердечной деятельности плода в ответ на спонтанные или стимулированные сокращения матки; - наличие поздних децелераций (урежений сердцебиения плода) в ответ на сокращения матки за период более чем 50% сокращений указывает на фетальную гипоксию. Эти тесты могут быть выполнены с помощью стандартных электронных мониторов. С помощью УЗИ диагностика гипоксии плода осуществляется на основании анализа оценки «биофизического профиля плода»; при этом кроме частоты сердечных сокращений, по данным УЗИ, оцениваются общая активность плода, частота и характер дыхательных движений оценивается состояние маточно-фетального кровообращения. Диагноз асфиксииустанавливается на основании клинических данных, в частности, оценки по шкале Апгар, а также динамики основных клинико-лабораторных параметров. Все эти дети подлежат мониторному наблюдению. Мониторинг делят на клинический, лабораторный, аппаратный (см. «Исследования»). При асфиксии средней тяжести суммарная оценка по шкале Апгар на 1-й минуте составляет 4-6 баллов (при этом обязательно снижение оценки дыхания), но к 5-й минуте оценка по шкале Апгар должна достигнуть 8-10 баллов. Такую же динамику оценки по шкале Апгар могут иметь и депрессивные дети, без асфиксии, что, однако, не влияет на характер реанимационных мероприятий ребенку при рождении. Общепринято, что только оценка по шкале Апгар не может быть единственным критерием асфиксии, т.к. низкая оценка по Апгар через 1 минуту после рождения не всегда является синонимом асфиксии. Например, оценка по шкале Апгар на 1-й минуте при асфиксии новорожденных и медикаментозной депрессии снижается за счет разных признаков. При асфиксии оценка снижается за счет дыхания, рефлекторной возбудимости, сердцебиений и цвета кожных покровов, в то время как при медикаментозной депрессии цвет кожных покровов и сердцебиения не страдают, а оценка за мышечный тонус снижается в обоих случаях. Если причины кардиореспираторной депрессии ребенка при рождении четко установлены и дальнейшая динамика клиники (после оказания, конечно, адекватной экстренной помощи при рождении) подтверждает ее, то диагноз асфиксия нецелесообразен. Тяжелую асфиксию диагностируют у ребенка, имеющего оценку по шкале Апгар через 1 минуту после рождения 1-3 балла и если через 1 или через 5 минут после рождения оценка по шкале Апгар менее 7 баллов. Обязательным является снижение балльной оценки за дыхание и тесно связанной с ней оценки за рефлекторную возбудимость. Оценка состояния новорожденного по шкале Апгар осуществляется на 1-й и 5-й минутах после рождения: у большинства новорожденных сумма баллов составляет 7-10. При количестве баллов 7 и ниже на 5-й минуте жизни оценку проводят далее каждые 5 минут ( на 10-й, 15-й и 20-й минутах) до достижения оценки 8 баллов или до достижения 20 минут жизни. Оценка по шкале Апгар на 5-й минуте имеет более достоверно прогностическое значение чем сумма баллов на 1-й минуте. Нейросонография у доношенного ребенка выявляет ишемические поражения чаще в области серого вещества (кора, базальные ганглии), иногда гипоксические некрозы могут развиться и в белом веществе. У недоношенных – обнаруживают признаки перивентрикулярной лейкомаляции. Перивентрикулярный некроз приводит к классической кистозной фазе, к пассивной внутренней гидроцефалии. Часто можно увидеть отек или набухание мозгового вещества, что приводит к повышению эхогенности отдельных групп ядер базальных ганглиев, внутренней капсулы, перивентрикулярных зон. Может появиться на 4-6 сутки жизни гипоксически-ишемический некроз в виде разрозненных мелкоочаговых участков с повышенной эхогенностью. Критерии диагностики тяжелой асфиксии: оценка по шкале Апгар через 5 минут – 3 балла и ниже; клинические признаки полиорганной недостаточности (хотя бы два признака + резистентный к инотропным препаратам шок, т.е. необходимость введения допамина и/или добутрекса при инфузионной терапии более 1 часа на фоне адекватной ИВЛ и согревания ребенка). Критерии диагностики среднетяжелой асфиксии: оценка по шкале Апгар через 5 минут менее 6 баллов + признаки шока II степени, проявляющиеся в необходимости проведения ИВЛ, потребности в инфузионной терапии в сочетании с инотропными препаратами. Дифференциальный диагноз асфиксии проводят с состояниями, вызывающими кардиореспираторную депрессию, с острыми кровопотерями, внутричерепными кровоизлияниями, пороками развития мозга, с болезнями сердца, легких, диафрагмальной грыжей, спинальными травмами. Табл. 2-11. Дифференциальный диагноз асфиксии и внутричерепных кровоизлияний
Лечение. Задачи лечения: восстановление проходимости дыхательных путей, самостоятельного адекватного дыхания и сердечной деятельности, предупреждение полиорганной недостаточности. В РФ для выведения ребенка из состояния асфиксии в родильном зале с 2010 года проводится на основании Методического письма «Первичная и реанимационная помощь новорожденным детям» от 21 апреля 2010 г № 15-4/2-3204). Предлагается следующая последовательность первичная реанимационная помощь новорожденным. На каждых родах должен присутствовать медицинский работник, умеющий оказывать первичную реанимацию новорожденным. Для оказания эффективной реанимационной помощи родовспомогательное учреждение должно быть оснащено современным оборудованием. Навыками оказания первичной реанимационной помощи детям при асфиксии должны владеть все, принимающие участие в родах. Необходимо прогнозировать рождение ребенка в состоянии асфиксии. Прогнозирование проводят на основе анализа анте- и интранатальных данных. Антенатальные факторы риска развития асфиксии новорожденных: - сахарный диабет; -гестоз (преэкслампсия); - гипертензивные синдромы; -резус-сенсибилизация; -мертворожденность в анамнезе; -клинические признаки инфекции у матери; - кровотечение во ІІ или ІІІ триместрах беременности; - многоводие; -маловодие; - многоплодная беременность; - задержка внутриутробного роста плода; - употребление матерью наркотиков и алкоголя; -применение матерью лекарственных препаратов, угнетающих дыхание новорожденного; -наличие аномалий развития, выявленных при пренатальной диагностике; -аномальные показатели кардиотокографии накануне родов. Интранатальные факторы риска: -преждевременные роды (срок менее 37 недель); - запоздалые роды (срок более 42 недель); -операция кесарева сечения; - отслойка плаценты; - выпадение петель пуповины; - патологическое положение плода; -применение общего обезболивания; - аномалии родовой деятельности; - наличие мекония в околоплодной жидкости; -нарушение ритма сердца плода; - дистоция плечиков; - инструментальные роды (акушерские щипцы, вакуум-экстракция). Необходимо обеспечить готовность персонала и оборудования к проведению реанимации. В родильном зале должен быть обеспечен оптимальный температурный режим (не ниже + 24 0С). При рождении недоношенного ребенка в сроке гестации 32 недели и менее в родильном зале должна присутствовать реанимационная бригада. После рождения ребенка необходимо зафиксировать время и провести оценку новорожденного по шкале Апгар на 1 и 5 минутах после рождения. При продолжающейся реанимации более 5 минут третью оценку провести через 10 минут после рождения. Первичная реанимация не проводится в случае получения следующей информации: 1) ребенок доношенный?; 2) околоплодные воды чистые, явные признаки инфекции отсутствуют?; 3) новорожденный дышит и кричит?; 4) у ребенка хороший мышечный тонус? При ответе на все вопросы «ДА» ребенка выкладывают на грудь матери. В остальных случаях показано проведение реанимационных мероприятий. Первичные реанимационные мероприятия начинают при наличии у ребенка показаний и при условии наличия хотя бы одного признака живорождения: самостоятельное дыхание, сердцебиение (ЧСС), пульсация пуповины, самопроизвольное движение мышц. Схема проведения реанимационных мероприятий у детей, родившихся доношенными и недоношенными в настоящее время разная. Этапы первичной реанимации для детей, родившихся после завершение 32 недели беременности После рождения ребенка в состоянии А его укладываю на реанимационный столик и для профилактики гипотермии обтирают, также убирают все мокрые одеяла и покрывала. На оценку состояния мышечного тонуса, дыхания, ЧСС, обтирание должно уходить не более 30 секунд. Ребенку необходимо придать положение на спине, со слегка запрокинутой головой. При наличии патологических типов дыхания или отсутствии дыхания необходимо выполнить восстановление проходимости дыхательных путей (после перемещения ребенка на реанимационный столик). Манипуляция показана детям, у которых в течение 10 с не появилось самостоятельное адекватное дыхание, или имеется большое количество отделяемого. Продолжительность санации не более 5 секунд. При меконеальных околоплодных водах проводят интубацию трахеи с последующей санацией через интубационную трубку. Если после обсушивания и санации дыхательных путей самостоятельное дыхание не появилось, следует провести тактильную стимуляцию (не более 10-15 с). При отсутствии или нерегулярном дыхании, ЧСС менее 100 в минуту начинают ИВЛ. ИВЛ можно проводить через маску или интубационную трубку. Для проведения ИВЛ используют саморасправляющиеся или поточнорасправляющиеся мешки, ИВЛ с Т-коннектором, традиционным аппаратом ИВЛ. При проведении ИВЛ через лицевую маску необходимо установить параметры ИВЛ (РIР 25-30 в минуту; РЕЕР +5 см. вод. ст. 21% кислород). В таком режиме ИВЛ проводят в течение 30 секунд. Если масочная ИВЛ затягивается более 3-5 минут необходимо установить желудочный зонд. При ЧСС более 100 в минуту и после появления регулярного дыхания в течение 3 минут ИВЛ прекращают. При ЧСС от 60 до 100 в минуту ИВЛ продолжают 21% кислородом через маску. При отсутствии эффекта (нет экскурсии грудной клетки) кратковременно увеличивают PIP до 35 см Н2О у недоношенных и до 40-50 см Н2О у доношенных детей. При недостаточной эффективности масочной ИВЛ санируют дыхательные пути, проверяют положение маски, изменяют положение головы, увеличивают давление на вдохе до максимально допустимого для детей данного возраста. При центральном цианозе (SаО2 менее 80%), сохраняющемся более 5 минут жизни оксигенотерапию продолжают, а при необходимости ребенка переводят на ИВЛ. При ЧСС менее 60 в минуту ребенка интубируют. При отсутствии эффекта (через 30 с) начинают непрямой массаж сердца с продолжением ИВЛ через интубационную трубку 100% кислородом. Непрямой массаж сердца проводится в соотношении с частотой ИВЛ 3 : 1. При повышении ЧСС выше 60 в минуту прекращают непрямой массаж сердца и продолжают ИВЛ до восстановления самостоятельного дыхания. Концентрацию кислорода увеличивают постепенно на 10-20% каждую минуту до нормализации ЧСС. При отсутствии эффекта от перечисленных мероприятий (ЧСС менее 60 в минуту) выполняют катетеризацию пупочной вены, с последующим внутривенным введением (или эндотрахеально) адреналина в дозе 0,1-0,3 мл/кг. При эндотрахеальном введении доза адреналина – 0,3-1,0 мл/кг. В это время необходимо продолжить непрямой массаж сердца и ИВЛ 100% кислородом.
Если через 10 минут от начала проведения реанимационных мероприятий в полном объеме у ребенка отсутствует сердцебиение реанимационные мероприятия прекращают (оценка в «0» баллов по шкале Апгар). Алгоритм проведения первичных реанимационных мероприятий у недоношенных детей, родившихся до завершения 32 недели беременности После рождения ребенка в состоянии А его укладываю на реанимационный столик под источник лучистого тепла и для профилактики гипотермии обтирают, также убирают все мокрые одеяла и покрывала. На оценку состояния мышечного тонуса, дыхания, ЧСС, обтирание должно уходить не более 30 сек. Ребенку необходимо придать положение на спине, со слегка запрокинутой головой. У недоношенных, родившихся до 28 недели беременности, используют дополнительные меры по предупреждению гипотермии (термоустойчивый пластик (пакет) пищевого класса)). На правое предплечье новорожденного накладывают датчик SаO2. По показаниям проводится санация дыхательных путей. Важным этапом оказания реанимационной помощи является своевременная оценка дыхания и ЧСС. При наличии регулярного дыхания и ЧСС более 100 в минуту начинают проведение СРАР 21% кислородом с РЕЕР +5-6 см. Н2О. Показаниями для проведения СРАР являются: недоношенность (27-32 недели). СРАР в родильном зале проводится при помощи биназальных канюль, назальной или лицевой маски. При необходимости следует пошагово увеличивать концентрацию кислорода на 10-20% в минуту, если SаО2 ниже 80% на 5 минуте жизни и 85% на 10 минуте. При отсутствии дыхания, дыхании типа гаспс, при нерегулярном дыхании или ЧСС менее 100 в минуту начинают ИВЛ через маску. При сроке беременности 29-30 недель первые вдохи проводят с PIP 20 см Н2О. В случае отсутствия экскурсии грудной клетки PIP можно увеличить до 25 см Н2О (не превышая это значение). У новорожденных детей гестационного возраста 31-32 недели при проведении масочной ИВЛ давление при первых вдохах можно увеличить до 30-35 см Н2О, если при более низких значениях PIP нет экскурсии грудной клетки; при переводе ребенка на ИВЛ через интубационную трубку следует изменить PIP таким образом, чтобы экскурсия грудной клетки отмечалась, но не была чрезмерной. При ЧСС менее 60 в минуту следует заинтубировать ребенка и проводить ИВЛ 21% кислородом в течение 30 секунд. При сохранении низких значений ЧСС начинают непрямой массаж сердца, ИВЛ 100% кислородом. При сохранении ЧСС менее 60 в минуту проводят катетеризацию пупочной вены, введение адреналина, продолжают непрямой массаж сердца, ИВЛ 100% кислородом. При отсутствии эффекта повторяют введение адреналина, начинают введение физиологического раствора. При ЧСС от 60 до 100 в минуту начинают ИВЛ через лицевую маску 21% кислородом. При недостаточной эффективности – проводят санацию верхних дыхательных путей, проверяют положение маски, изменяют положение головы, немного переразогнув шею, увеличивают давление на вдохе до максимально допустимого для данного гестационного возраста. При отсутствии эффекта проводят интубацию (если она ранее не была выполнена), продолжают ИВЛ 40% кислородом в течение 30 секунд. Концентрацию кислорода постепенно увеличивают (см. выше). При отсутствии эффекта (ЧСС менее 60 в минуту переходят к медикаментозной терапии (см. выше). При ЧСС более 100 в минуту и после появления регулярного дыхания ИВЛ прекращают. При этом ориентируются на показатели SaО2; процент дополнительного кислорода изменяют (увеличивать или уменьшать на 10-20% в минуту), если уровень SaО2 ниже 80% на 5 минуте жизни, ниже 85% на 10 минуте или превышает 95% на любом этапе реанимационных мероприятий. Если, несмотря на эффективную ИВЛ маской, при ЧСС более 100 в минуту в течение 5-10 минут, дыхание не восстановилось, рассматривают вопрос об интубации. Перевод ребенка с ИВЛ на СРА осуществляют на основании эффекта от введения сурфактанта, после перевода ребенка в палату интенсивной терапии. Профилактическое введение сурфактанта проведите при наличии: -недоношенности менее 27 недель; - новорожденным, родившимся на 27-29 неделях беременности, матери которых не получили курс антенатальной профилактики РДС глюкокортикоидными препаратами; - новорожденным, родившимся в сроки 27-29 недель беременности, потребовавшим интубации трахеи в родильном зале; - детям, родившимся на 30-31 неделе беременности и потребовавшим интубации и перевода на ИВЛ, в связи с тяжелыми дыхательными нарушениями. Особенности проведения ИВЛ у глубоконедоношенных детей - наличие устройства контроля давления в дыхательных путях; - обязательное подержание РЕЕР + 4-6 см Н2О; - возможность плавной регулировки доставляемой концентрации О2 от 21 до 100%; - непрерывный мониторинг ЧСС и SaО2. Стартовые параметры ИВЛ: PIP – 20 см Н2О; РЕЕР – 5 см Н2О, частота 40-60 вдохов в минуту. При неэффективности давление на вдохе можно увеличить до 25 см Н2О у детей, родившихся на сроке 29-30 недель беременности, и до 30-35 см Н2О у детей, родившихся на сроке более 30 недель беременности. ИВЛ у детей, родившихся после 28 недель беременности, начинать с 30-40% кислорода, а у детей, родившихся ранее 28 недель беременности, с 30-40% кислорода. При необходимости плановую инфузию начинают через 40-50 минут после рождения. При наличии массивной кровопотери инфузионную терапию следует начинать сразу по окончанию первичных реанимационных мероприятий. Объем инфузионной терапии в первые сутки жизни для доношенного ребенка (при наличии гиповолемии!) составляет 60-65 мл/кг/сут - т.е. больше, чем физиологическая потребность ребенка в жидкости. У недоношенных детей с массой менее 750 г объем инфузионной терапии в 1-й день жизни может быть увеличен до 100-150 мл/кг. При признаках отека легких, сердечной недостаточности объемы вводимой жидкости сократите до 80% от физиологической потребности. Жидкость необходимо вводить перфузором равномерно в течение суток. При шоке скорость внутривенного введения растворов должна определяться степенью тяжести процесса, вводимый струйно объем может достигнуть 10 мл/кг. В качестве основного инфузионного раствора у доношенных детей обычно используют 10% раствор глюкозы. Применение 5% раствора глюкозы у доношенных детей нежелательно, т.к. при этом снижается энергетическая емкость инфузионной среды. |
