практикак. Практика. Министерство высшего и среднего специального образования республики узбекистана
 Скачать 1.4 Mb. Скачать 1.4 Mb.
|
|
ПРОИЗВОДСТВО ВИНИЛОВЫХ МОНОМЕРОВ. Виниловые мономеры— общая формула СН2=CHR. Они используются в качестве мономеров при синтезе полимеров и сополимеров. Примеры: пропилен СН2═СНСН3, винилхлорид СН2═СНС1, винилфторид (фторэтилен) CH2C═HF, винилацетат СН═2СНООССН3, акриловая кислота CH2═CH-СООН, акрилонитрил CH2═CHCN, стирол СН2═СНСбН5 Пропилен окисляется в паровой фазе кислородом в присутствии молибденовых, кобальтовых или висмутовых катализаторов.: СН2═СН–СН3 + O2→ СН2═СН–СООН (акриловая кислота) СН≡СН + СО + Н2О → СН2═СН–СООН Реакция формальдегида с кетеном.: СН2 ═СО + H2C═O → СН2═СН–СООН Способы получения винилацетата.СН≡СН + CH3COOH →CH2═CHCOOCH3 CH2═CH2+CH3COOH +0,5O2 → CH2═CHCOOCH3 Стирол. Стирол — бесцветная легковоспламеняющаяся жидкость со специфическим запахом, нерастворимая в воде. Температура воспламенения 43ºС; температура кипения 145,2ºС; Третья группа опасности – вещества средней опасности. Области применения стирола. Стирол используется в производстве различных полимеров: от эластичного пенопласта до технических пластиков. Стирол в основном используется для производства полистирола, но также используется в производстве бутадиен-стирольных каучуков и ненасыщенных полиэфиров. Полистирол – это диэлектрическое вещество, устойчивое к химическим веществам и воде. Основная часть стирола используется в автомобильной, радиотехнической промышленности, для производства одноразовых предметов быта. Пенополистирол широко используется в строительстве, производстве сополимеров, автомобилестроении, машиностроении и других областях. На основе ненасыщенных полиэфиров получают литую изоляцию, цементы, стекловолокно. Физико-химические основы процесса. Стирол получают каталитической дегидратацией этилбензола и последующей ректификацией продуктов дегидрирования с чистотой 99,8%. Способы получения винилхлорида. Винилхлорид является одним из наиболее важных мономеров. По объему производства винилхлорид занимает третье место в мире после полиэтилена и этиленоксида.. Винилхлорид (CH2 = CHCl) — бесцветный газ с запахом хлороформа. температура кипения -13,37ºС; температура разжижения -153,8ºС; плохо растворим в воде, растворим в этаноле, хорошо растворим в эфире, хлороформе, дихлорэтане. Способы получения винилхлорида. Винилхлорид получают дегидрохлорированием 1,2-дихлорэтана в спиртовом растворе гидроксида натрия или калия (в жидкой фазе) (60-70ºC). СН2Cl ═ СН2Cl + NaOH СН2 ═ СНCl + NaCl + H2O Гидрохлорирование ацетилена проводят в присутствии газообразного или жидкофазного катализатора (HgCl2).: СН СН + НCl СН2 ═ СНCl Термическое дегидрирование 1,2-дихлорэтана в паровой фазе с катализатором или без него: СН2Cl ═ СН2ClСН2═ СНCl + HСl (5) В присутствии катализатора в газовой фазе (оксид алюминия) при хлорировании этилена: СН2═ СН2 + Cl2 СН2═ СНCl + HСl (4) Получение винилхлорида на основе ацетилена.В газовой фазе винилхлорид синтезируют в промышленности на основе ацетилена и хлористого водорода гетерогенным каталитическим процессом. Связывание хлороводорода с ацетиленом представляет собой экзотермическую реакцию, характерную для трехсвязных соединений. СН СН + НCl СН2 ═ СНCl -Нo298қ112,4 кДж/моль Эта реакция протекает экзотермически и выделяет в два раза больше тепла, чем процесс гидрохлорирования олефинов. Связывание NCl с ацетиленом происходит поэтапно, сначала с образованием винилхлорида, а затем с образованием 1,1-дихлорэтана:  В промышленности производство винилхлорида на основе ацетилена и хлористого водорода представляет собой гетерогенно-каталитический процесс, протекающий в однофазном режиме в газовой фазе. В этом процессе катализатор готовят путем замачивания активированного угля в воде. Полученный катализатор содержит 1,0% (масс.) HgCl2. Требуется строгое соблюдение правил техники безопасности и охраны труда, так как сулеман очень токсичен и может взорвать ацетилен. Процесс проводят в трубчатом реакторе при температуре 160-180°С в присутствии стационарного (стационарного) катализатора. Смесь ацетилена и хлористого водорода направляют в заполненные катализатором трубки. В реакции получается хлористый водород в избытке (5-10%) по сравнению с ацетиленом. Сырье высушивают от влаги для уменьшения количества образования ацетальдегида и защиты аппарата от коррозии. Производство винилхлорида на основе этилена. В способе получения винилхлорида из этилена протекают три разные реакции: 1) CH2 ═ CH2 + Cl2 → ClCH2 – CH2Cl 2) 2 ClCH2 – CH2Cl → 2 CH2 ═ CHCl + 2 HCl 3) CH2═ CH2 + HCl + 0,5O2 → ClCH2 – CH2Cl + H2O 2 CH2═ CH2 + Cl2 + 0,5O2 → 2 CH2 ═ CHCl + H2O Следовательно, это комбинация трех реакций: 1. Получение 1,2-дихлорэтана при соответствующем аддитивном хлорировании этилена; 2. Производство винилхлорида термическим дегидрированием 1,2-дихлорэтана; 3. Оксихлорирование этилена с использованием HCl, образующейся при дегидрохлорировании. На сегодняшний день немецкая компания Vinnilit является лидером в Европе по производству дихлорэтана (ДХЭ), винилхлорида (ВХ) и поливинилхлорида (ПВХ). Он производит 63 000 тонн VX и 65 000 тонн ПВХ в год. По технологии, разработанной этой компанией, производство ВХ на основе этилена осуществляется в три стадии: 1. ДХЭ получают путем правильного хлорирования этилена. 2. Этилен оксихлорируется. 3. ДХЭ подвергается крекингу в печи пиролиза. КОНТРОЛЬНЫЕ ВОПРОСЫ 1– упражнение а) Получение эпихлоргидрина. б) Способы получения винилхлорида. в) Производство эпихлоргидрина. г) Получение винилхлорида путем каталитической дегидратации хлористого этилена.. 2 – упражнение Объясните, что получается по следующей технологической схеме. а) Технология получения винилхлорида гидрохлорированием ацетилена. б) Способы и технология производства винилхлорида на основе этилена. в) Физические и химические свойства винилхлорида.. 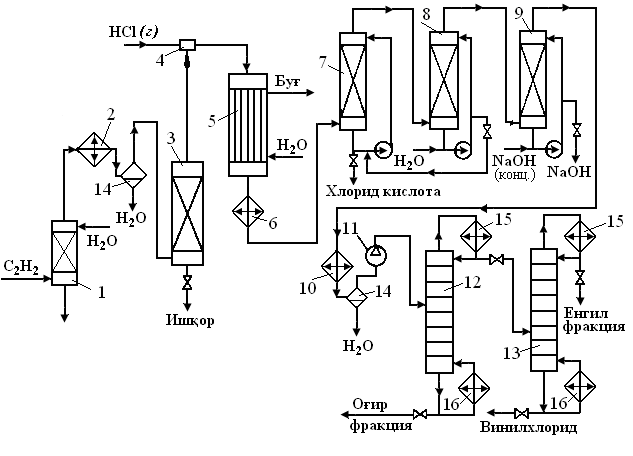 3- упражнение а) Объясните, что получается по следующей технологической схеме 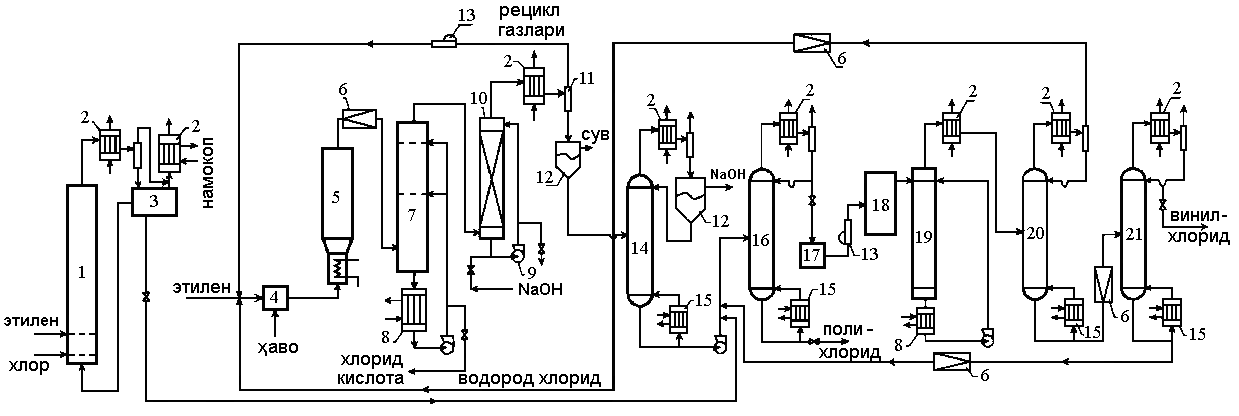 б) Метод Фрица Клатте получения винилхлорида. в) В результате чьих исследований и какой фирмой впервые был произведен винилхлорид в промышленных масштабах. г) Получить винилхлорид реакцией пятихлоридов фосфора с ацетальдегидом.. 4– упражнение а) Термическое дегидрирование 1,2-дихлорэтана в паровой фазе с катализатором или без него б) Хлорирование этилена в присутствии катализатора в газовой фазе (оксид алюминия). в) Производство винилхлорида на основе ацетилена. г) На чем основан процесс промышленного производства винилхлорида на основе ацетилена и хлористого водорода. 5 – упражнение а) Производство винилхлорида на основе этилена. б) Технологическое производство винилхлорида комбинированным способом. в) Производство винилхлорида на основе этилена в Германии. 6– упражнение а) Виниловые мономеры, виды, свойства и получение. б) Свойства стирола, применение. в) Способы получения стирола. 7– упражнение а) Схема дегидрирования этилбензола в стирол. б) Способы получения винилацетата. в) Способы получения акриловой кислоты. ТЕСТЫ: 1. Кто впервые синтезировал винилхлорид? а) Либикс. б) Бауман. с) Клатте. г) Эрленнейер. 2. Катализатор, применяемый в производстве винилхлорида гидрохлорированием ацетилена.? а) FeCl3. б) AlCl3 . с) НgCl2. д) ёруғлик. 3. Катализатор, используемый в производстве винилхлорида с помощью хлорирования этилена? а) Al2О3. б) FeCl3 . в) СаО. г) Б,С. 4. Сколько различных реакций используется для получения винилхлорида из этилена? а) 3. б) 1. в) 4 . г) 5 5. Фреоны... а) Нагревательные устройства. б) Получение энергии от солнца. в) Хладагенты. г) а, б, с 6. Винилхлорид.... а) CH2 = CHCl2 б) CH3 = CH 2Cl в) CH= CCl2 г) CH2 = CCl2 7. СH3-CHO+ PCl5 какое вещество выделяется в конечном продукте? а) POCl3 . б) СН3 - СНСl2 . в) CH2=CCl2 . г) CН2= CHCl 8. CН2 -Cl- CH2Cl+NaOH CH2=CHCl как щелочной раствор? а) Спиртовой б) Водный. в) Нейтральный. г) кислая. 9. CН2 = CH2+Cl2 катализартор Al2O3 какое вещество образуется ? а) CH2Cl – CH2Cl. б) CH2= CHCl. в) CCl3 – CCl3. г) CH3Cl. 10. Какой катализатор действует при образовании винилацетата действием уксусной кислоты на ацетон? А) ZnCl2. Б) CaCl2. В) (СН3СОО)2Zn. Г) Al2O3. 11. Виниловый катализатор при нагревании уксусной кислоты под действием воздуха в этилене? а) Pt . б) Al. В) Нg . г)Zn. 12. CHF2Cl 700% какое вещество образуется в результате пиролиза? а) CF2= CF2 б) CF3= CF3 в) CF2= CCl2 г) CFCl – CF3 ПРОИЗВОДСТВО АКРИЛОВЫХ МОНОМЕРОВ Акриловые мономеры, т.е.: акриловая кислота CH2=CH СООН; метакриловая кислота CH2=C(СН3)СООН; акрилонитрил CH2=CHCN; метилметакрилат СН2=С(СН3)СООСН3. Важными мономерами являются акриловая и метакриловая кислоты, их сложные эфиры, нитрилы и амиды, а при их полимеризации полиакриловая кислота, полиакрилаты, сложные эфиры: бутил-, трет-бутил-, изобутил-, метил- и этилакрилаты, полиакрилонитрил. Акрилатные каучуки могут быть получены полимеризацией эфиров акриловой кислоты и сополимеризацией с виниловыми мономерами. Акрилатные каучуки представляют собой соединения, устойчивые к теплу, озону и кислороду, ультрафиолетовым лучам. Полиакриловая кислота является гидрофильным загустителем для различных водных растворов, используемых в промышленности. Полиакрилаты и полиметакрилаты широко используются в целлюлозно-бумажной, лакокрасочной, текстильной и кожевенной промышленности в качестве органического стекла, синтетического волокна, акриловых смол и различных эмульсий. Особенно полиметилметакрилат широко используется в качестве прозрачного органического стекла. Акрилонитрил представляет собой бесцветную прозрачную жидкость с резким запахом.Т. кип. 350,3 К (77,3оС), Т.раз. 191 К (-82оС), d420қ0,8064г/см3, nD 20қ1,3914. Мало растворим в воде (7,3% (масс.) при 293 К), хорошо смешивается с большинством органических растворителей. Существует два различных метода приготовления катализаторов Трегера: совместное осаждение носителя и каталитически активных компонентов и вымачивание раствора каталитически активного компонента в инертном носителе. В процессе получения акрилонитрила из пропилена методом окислительного аммонолиза помимо основных реакций протекают и дополнительные реакции: Окисление пропилена до акролеина: CH2=CH—CH3 + O2 → CH2=CH—CHO + H2O; Окисление акролеинпропилена до ацетальдегида и формальдегида: CH2=CH—CH3 + O2 →CH3—CHO + HCHO ; Окисление пропилена до ацетона. CH2=CH—CH3 + 0,5O2 → CH3—CO—CH3 ; Пропилен в углекислый газ и воду: CH2=CH—CH3 + 3O2 → 3CO + 3H2O ; и окисление углерода до четырех оксидов и воды: CH2=CH—CH3 + 4,5O2 → 3CO2 + 3H2O; Образование синильной кислоты при совместном окислении пропилена и аммиака: CH2=CH—CH3 + NH3 + 2O2 → HCN + CH4 + CO2 + 2H2O ; Образование цианэтиламина и ацетонитрила в результате взаимодействия акрилонитрила с аммиаком: CH2=CH—CN + NH3 → H2N—CH2—CH2—CN H2N—CH2—CH2—CN → CH2=NH + CH3—CN Принципиальная схема процесса представлена на рисунке 1. Процесс состоит из следующих шагов: - синтез акрилонитрила; - нейтрализация аммиака и разделение реакционной смеси; - выделение синильной кислоты и очистка акрилонитрила от легких и тяжелых примесей; - выделение технического акрилонитрила; - Разделение товарного ацетонитрила и первичной очистки сточных вод. КОНТРОЛЬНЫЕ ВОПРОСЫ 1-упражнение Способы получения акриловой кислоты. Синтез и технология азотфиксирующих реагентов. Акриловые мономеры, виды. 2-упражнение Способы получения акрилонитрила. Добыча и использование полиакриловой кислоты. Физические и химические свойства акрилонитрила. 3-упражнение Получение акрилонитрила окислительным аммонолизом пропилена. Взаимодействие акрилонитрила с аммиаком. Технология экстракции акрилонитрила. 4-упражнение 1. Какие вещества можно использовать в синтезе алифатических аминосоединений. 2. Вещество, реагирующее с HCN. 3. Вещество, образующееся при взаимодействии ацетилена с NaNH2. 5-упражнение 1. Катализатор для получения анилина аминолизом бензойной кислоты. 2. Какое вещество образуется как побочный продукт при производстве анилина методом аминолиза бензойной кислоты. 3. Каковы температура и давление бензойной кислоты при воздействии на водный раствор аммиака под катализатором оксида меди (II)?. ТЕСТЫ. 1. Во сколько лет был впервые синтезирован акрилонитрил? а) 1893. б) 1930. в) 1899. г) 1928. 2. Кто впервые синтезировал акрилонитрил?? а) Море. б) Трегер. в) Гриньяр. г) Шеле 3. Найдите формулу акрилонитрила.. а) СН2=СН-СN . б) H2N—CH2—CH2—CN в) HCN. г) NH3 4. Определить акриловые мономеры. а) CH2=CH СООН, CH2=C(СН3)СООН, CH2=CHCN, СН2=С(СН3)СООСН3 б) СН2=СНСН3,СН2=СНС1, CH2=CHF, C6H5CH=CH2 в) CH2=CHF, C6H5CH=CH2, CH2=CHCN, СН2=С(СН3)СООСН3 г) CH2=CH СООН CH2=CHCN 5. Какой полимер широко используется в промышленности в качестве прозрачного органического стекла? а) Полиметилметакрилат. б) Полиакрилат в) Полиакрилонитрил. г) Мочивена 6 . Какая компания наладила производство акрилонитрила аммонолизом окиси пропилена в промышленных масштабах? а) “Сохио” (США). б) “Asahi Glass Co. “ в) “Харкон-процесс”. г) “Orilfiks”. 7. Какие виды аминов делятся по природе углеводородного радикала? а) Первичный, вторичный, третичный. б) Алифатические. ароматный, смешанный в) основные и кислые. г) Дипептид и полипептид. 8. Какие виды аминов делятся по их структурному состоянию. а) Первичный, вторичный, третичный. б) Алифатические. ароматный, смешанный. в) основные и кислые. г) дипептидные и полипептидные. 9. Определите последовательность алифатических аминов.. a) C6H5NH2, (C6H5)2NH, (C6H5) 3N. б) CH3NH2, (CH3)2NH, (CH3)3N в) C6H5-NH-CH3. г) C6H5-NH-CH3 ,(C6H5)2NH, (C6H5) 3N. 10. Определить ряд ароматических аминов. a) C6H5NH2, (C6H5)2NH, (C6H5) 3N.. б) CH3NH2, (CH3)2NH, (CH3)3N в) C6H5-NH-CH3. г) C6H5-NH-CH3 ,(C6H5)2NH, (C6H5) 3N. 11. Определите химическую формулу аминокислоты аланин.. а) NH2C6H4 COOH. б) CH3COOH. в) NH2CH2COOH. г) NH2CH2 (CH3)COOH. 12. Как изменяется плотность анилина при повышении температуры? а) Не меняется. б) Увеличивается. в) Уменьшается. г) сначала увеличивается, а затем уменьшается. 13. Какой процент анилина используется в США для производства гербицидов и полиамидных волокон? а) 36% . б) 40 % . в) 50%. г) 20% 14. Назовите компанию, производящую анилин в Англии. а) Мобей Кемикал. б) ИКИ. в) Лонза. г) БАСФ 15. В чем преимущество синтеза анилина из нитробензола? а) Высокая урожайность. б) Отсутствие промежуточных продуктов. в) Дешевизна возвращаемого автомобиля. г) Все верно. 16. Кем определен возврат нитросоединений с железом, особенно чугунного лома? а) Б.В.Иванов. б) Б.О.Лукашевич в) М.И.Бертло. г) Г.Н.Суренко 17. В каких интервалах температур происходит быстрое превращение нитробензола в анилин в присутствии медного катализатора? а) 100, 120 ва 1500C. б) 230, 300 ва 4000C в) 300, 400 ва 5000C г)500, 550 ва 6000C 20. Когда и где аминолизом был получен анилин бензойной кислоты? а) 1970, Ангиля. б) 1970, США в) 1970, Германя . г) 1965, США |
