практикак. Практика. Министерство высшего и среднего специального образования республики узбекистана
 Скачать 1.4 Mb. Скачать 1.4 Mb.
|
|
Алифатические спирты. Соединения общей формулы ROH называются спиртами, где R может быть любой алкильной или замещенной алкильной группой.  Третичный бутиловый, спирт аллиловый , спирт циклогексанол Эти группы являются первичными, вторичными или третичными; может быть линейным или кольцевым, содержать двойную связь, содержать атом галогена или ароматическое кольцо:  Бензиловый спирт этиленхлорид глицерин (β- хлорэтиловый спирт)  Каждый класс соединений производит разные продукты. Например, для производных спиртов - простые эфиры ROR', для продуктов карбоновых кислот - эфиры RCOOR', амиды RCONH2, ангидриды (RCO)2O, хлоргидриды RCOCl и другие. Кроме того, большую группу составляют гетерофункциональные соединения с разными функциональными группами: - гидроксиальдегиды HO – R – CHO, - гидроксикетоны HO-R-CO-R’, - оксикислоты HO – R – COOH и др. Углеводы Cx(H2O)y относятся к важнейшей группе оксигенированных гетерофункциональных соединений, молекула которых содержит гидроксильные, карбонильные и производные от них группы. Терефталевая кислота и ее эфиры 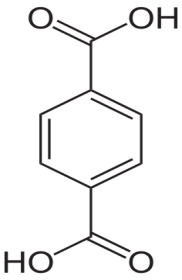 Терефталевая кислота (1,4-бензолдиугольная кислота) представляет собой двухосновную ароматическую кислоту в форме пара. Производство терефталевой кислоты из н-ксилола. Существует несколько способов получения терефталевой кислоты путем окисления н-ксилола. В качестве окислителя используют азотную кислоту или кислород воздуха. В некоторых схемах процесс проводят в 2 этапа. С воздухом на 1-й ступени, с HNO3 на 2-й ступени. 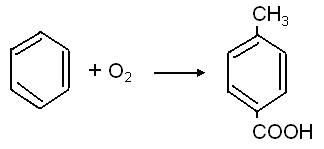 На 2 стадии под действием HNO3 образуется терефталевая кислота. 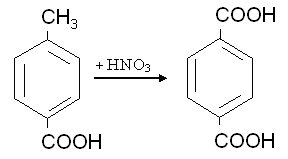 Каталитический синтез н-ксилола кислородом воздуха в жидкой среде в настоящее время является одним из наиболее удобных методов. Принцип получения терефталевой кислоты этим методом заключается в следующем. Процесс проводят в присутствии тяжелых металлов Mg и Co, катализатора переменной валентности Br. н - воздух пропускают через раствор ксилола в методе кислоты. Это связано с выбором растворителя: тенефталовая кислота нерастворима в уксусе, а вспомогательные продукты растворимы.. Производство терефталевой кислоты и диметилтерефталата из толуола. получают хлорметилированием толуола с последующим окислением хлорметилтолуола окислением толуола до бензойной кислоты с последующим получением и диспропорционированием бензоата калия. Для хлорметилирования толуола действием толуола получают 37%-ный водный раствор насыщенного водородом формальдегида. При проведении в присутствии катализатора (ZnCl2) процесс значительно ускоряется, но при этом образуются дополнительные продукты, в основном продукты конденсации (метан-толуол) и дихмерные соединения метина. Диметилтерефталат является важным химическим продуктом, используемым в производстве полиэфирных волокон, полиоксадиазолов, полибензимидазолов, алкидных смол и пластификаторов. Способы производства диметилтерефталата. Процесс производства диметилтерефталата состоит из четырех стадий: 1. Получение н-толуиловой кислоты оксидом н-ксилола: 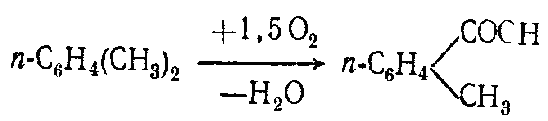 2. Получение монометилового эфира н-толуиловой кислоты (метил-п-толулят) путем этерификации н-толуиловой кислоты метиловым спиртом: 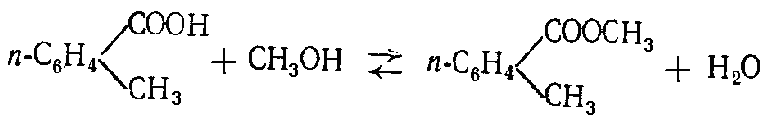 3. Окисление монометилового эфира н-толуиловой кислоты с получением монометилового эфира терефталевой кислоты: 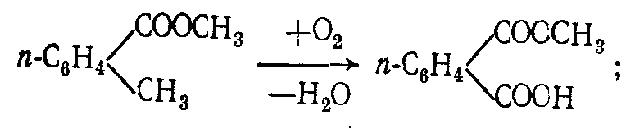 4. Диметилтерефталат образуется путем этерификации монометилового эфира терефталевой кислоты метиловым спиртом. 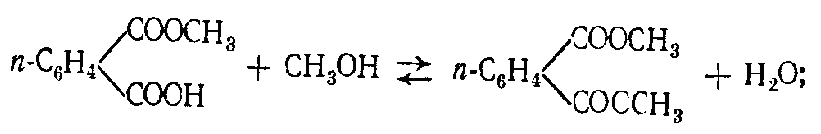 КЛАСТЕР  КОНТРОЛЬНЫЕ ВОПРОСЫ 1 – упражнение а) В каких областях техники применяют терефталевую кислоту? б) Напишите схемы реакций моносульфатирования бензола, толуола и нитробензола. в) Дайте информацию о нафтеновых углеводородах. 2 – упражнение а) Дайте информацию о гетерофункциональных соединениях, таких как гидроксиальдегиды, гидроксикетоны, оксикислоты. б) Свойства аминокислот. 3-упражнение а) Если при нитровании 40 г бензола образуется 52 г нитробензола, каков % выхода реакции? б) Области применения ПЭТ? в) Объясните технологический процесс производства диметилтерефталата. 4 – упражнение а) Дайте информацию о Нафтфлин. б) Напишите реакцию экстракции трех мезиновых кислот и объясните процесс? в) Свойства и применение диметилтерефталата. г) свойства терефталевой кислоты. 5 – упражнение а) Получение синтетических полиэфирных волокон на основе N-ксилола и метанола. б) Получение терефталевой кислоты и кислоты и диметилтерефталата из Толуола. в) Способы и технология производства диметилтерефталата. г) Преимущества и недостатки метода DUNAMIT NOBEL (Германия) и технологии MITSUI PETROCHEMICAL (ЯПОНИЯ). ТЕСТЫ: 1. Мономер, используемый для реакции поликонденсации? а) Терефталевая кислота. б) акриловая кислота в) метакриловая кислота. г) Аллилацетат 2. Найдите формулу терефталевой кислоты? а) 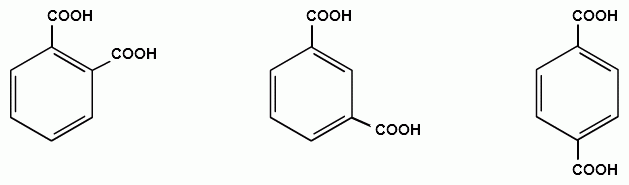 б) б) 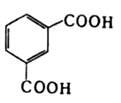 в) в)  3. Какой катализатор используется в процессе получения терефталевой кислоты из толуола? а) хлорид цинка. б) хлорид алюминия в) Катализаторы Трегера. г) нет правильного ответа 4. Сколько существует способов получения терефталевой кислоты и диметилфталата из толуола? а) 2 вида. б) 3 вида. в) 4 вида. г) 5 вида 5. Определите химическую формулу аминокислоты глицина.. а) NH2C6H4 COOH. б) CH3COOH в) NH2CH2COOH. г) NH2CH2 CH2COOH 6. Из скольких стадий состоит процесс производства диметилтерефтала? а) 4 б) 2 в) 3 г) 5 7. Найдите формулу диметилтерефталата.. а) 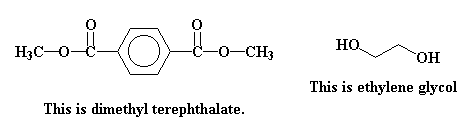 б) в) 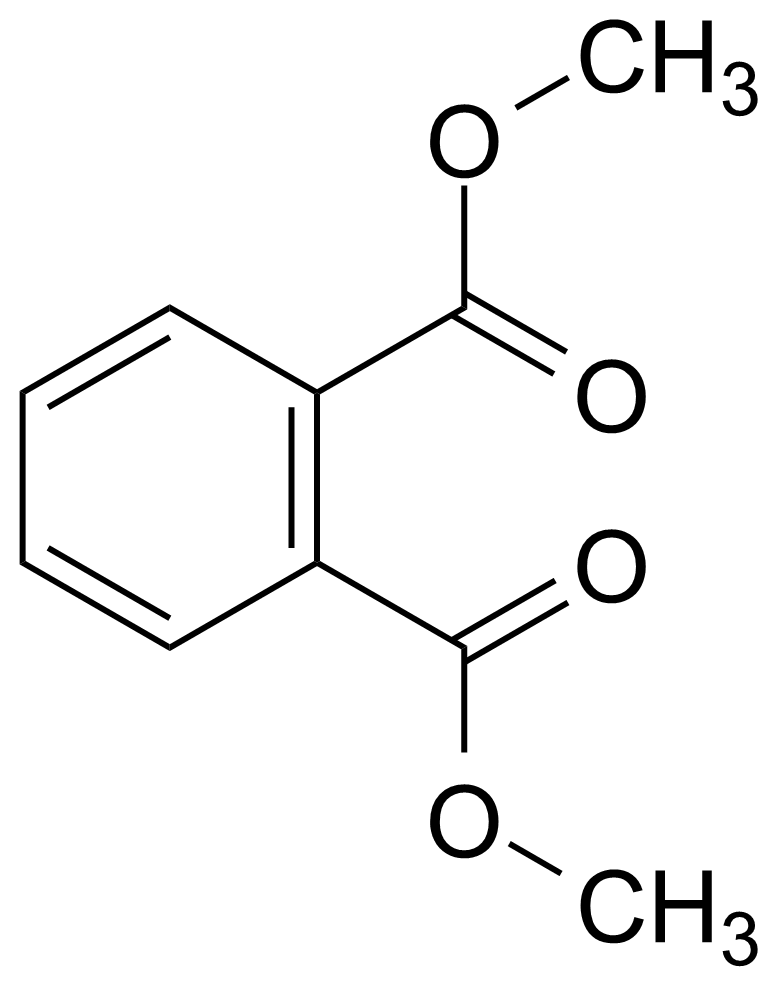 ) ) 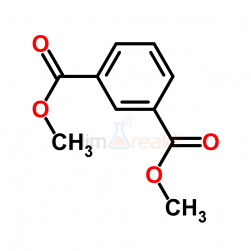 8. Выберите сырье для получения трефталевой кислоты. а) Для ксилола. б) метаксилол в) Средний ксилол. г) Метилбензол 9. Окислитель для реакций окисления? а) Азотная кислота. б) Серная кислота в) Угарный газ. г) Хлорная кислота 10. Укажите вещество, полученное возвратом нитробензола в жидкую фазу.? а) C6H5NH2. б) C6H5CH3 . в) C6H5NO. г) C6H5Cl. 11. Найдите общую формулу гидроксильных альдегидов? а) НО-R-CHO. б) HO-R-COOH в) HO-R-COR. г) HO-R-COOR 12. К какой функциональной группе относятся углеводы? а) Кислород гетерофункционален. б) Азот гетерофункционален. в) Галогенгетерофункциональный. г) Верны ответы а и б. 13. Какие вещества называют фенолами? а) Вещества, содержащие бензол и гидроксил б) Вещества, содержащие бензольные и карбонильные группы в) Вещества, содержащие бензольную вакарбоксильную группу 14. Как называется продукт реакции окисления толуола кислородом? а) Бензойная кислота. б) фталевая кислота в) бензальдегид. г ) Мойевая кислота 15. Реакция окисления…. а) Взаимодействие молекул первичных реагентов под действием кислорода б) Разложение молекулы первичных реагентов под действием кислорода в) Гидролиз молекулы первичных реагентов под действием кислорода г) Перераспределение исходной молекулы реагента СИНТЕЗ И ТЕХНОЛОГИЯ ВАЖНЫХ АЗОТНЫХ РЕАГЕНТОВ 1. Азотсодержащие органические соединения являются одним из важнейших видов органических соединений. Соединения азота можно классифицировать в соответствии со следующей таблицей. Классификация соединений азота
Амины (или аминосоединения). Их можно рассматривать как органические соединения аммиака.Амины делятся на следующие классы по их структурному состоянию: Благодаря взаимодействию неспаренных электронов в атоме азота с электронами в бензольном кольце ароматические амины проявляют слабоосновные свойства по сравнению с алкиламинами. Аминогруппа бензола облегчает превращение водорода в кольце в галоген, такой как бром; 2,4,6-триброманилин образуется из анилина: Получение: а) Восстанавливая нитросоединения атомарным водородом. 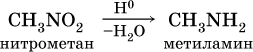 б) Реакция Зинина. 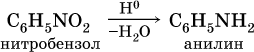 Амины могут найти применение в промышленности в качестве растворителей полимеров, лекарственных препаратов, кормовых добавок, удобрений, красителей. Они чрезвычайно токсичны, особенно анилин. Аминокислоты – органические соединения, содержащие две функциональные группы - кислотную СООН и аминогруппу NH2. Примеры: 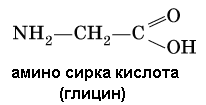 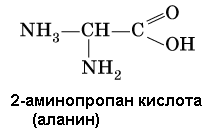 Аминокислоты проявляют свойства кислот и аминов. Это связано с тем, что карбоксильная группа в них образует соль, поскольку она проявляет кислотные свойства: и образует сложный эфир: При взаимодействии с сильными кислотами проявляет основное свойство и образует соль в соответствии с основным свойством аминогруппы:  Белок – органические природные соединения; биополимеры, состоящие из аминокислотных остатков. В белках азот находится в виде амидной группы – С(O) – NH – (пептидная связь называется S – N). Белки — это, конечно, S, N, N, O, почти всегда S, часто состоящие из P и других элементов. При гидролизе белков образуется смесь аминокислот, Например: 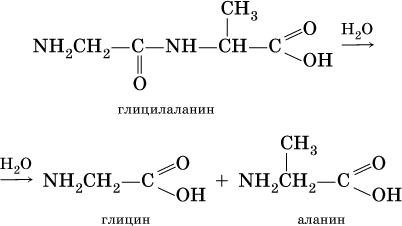 Белки по остатку аминокислот в молекуле делятся на дипептиды, рипептиды и др. можно устроить. Природные белки (белки) содержат от 100 до 1•105 аминокислотных остатков с относительной молекулярной массой 1•104—1•107. Образование макромолекулы белка, то есть присоединение молекулы аминокислоты к длинной цепи, происходит при наличии группы СООН в одной молекуле и группы NH2 во второй молекуле.: 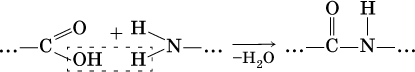 Производство анилина. Механизм возврата нитросоединений с железом, особенно чугунного лома, подробно изучен В. О. Лукашевичем. Он показал, что реакция протекает в две стадии: на первой стадии с железом возвращаются нитросоединения, в которых железо окисляется и образуется гидроксид железа: С6Н5NO2 + 3Fe + 4H2O → С6Н5NH2 + 3Fe(OH)2, Оба гидроксида железа возвращаются в нитросоединения с образованием гидроксида железа (III) и анилина: С6Н5NO2 + 6Fe(OH)2 + 4H2O → С6Н5NH2 + 6Fe(OH)3, Реакция протекает с большой скоростью. Fe + 8Fe(OH)3 → 3Fe3O4 + 12H2O, Общее уравнение реакции ароматических нитросоединений с железом в присутствии электролитов имеет вид: 4С6Н5NO2 + 9Fe + 4H2O → 4С6Н5NH2 + 3Fe3O4, Из приведенных уравнений видно, что реакция восстановления происходит только за счет железа и воды. Восстановление нитробензола в анилин осуществляется в промышленности двумя различными способами: периодическим и непрерывным. ДИАГРАММА ВЕННА  КОНТРОЛЬНЫЕ ВОПРОСЫ 1 – упражнение а) В каких интервалах температур происходит быстрое превращение нитробензола в анилин в присутствии медного катализатора? б) Напишите схемы реакций моносульфатирования бензола, толуола и нитробензола. в) Как амино, нитро и амидные группы проявляют кислотные свойства в органических соединениях. г) Приведите примеры свойств и применения анилина.. 2 – упражнение а) Какие катализаторы используются при каталитическом восстановлении нитробензола б) Воздействие о-хлорнитробензола NH3, спирта и щелочи. Почему хлорбензол с этими реагентами в особых условиях и в очень агрегатной реакции. в) Какими способами получают анилин. г) Состав и свойства белков. 3-упражнение а) Если при нитровании 40 г бензола образуется 52 г нитробензола, каков % выхода реакции? б) Что лежит в основе реакции Зинина? в) Объясните периодический способ процесса восстановления нитробензола до анилина. 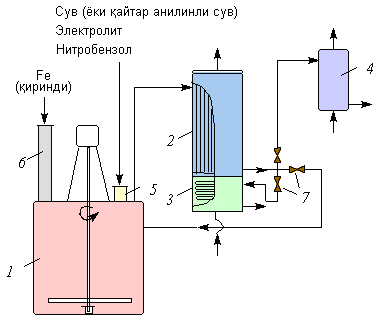 4 – упражнение а) Воздействие σ-хлорнитробензола NH3, спирта и щелочи б) В чем преимущество синтеза анилина из нитробензола? в) Объясните непрерывный способ восстановления нитробензола до анилина.. 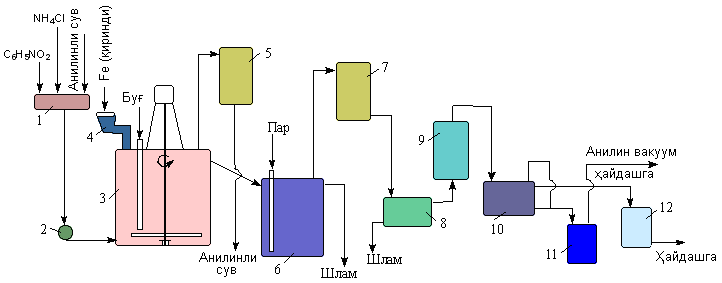 ТЕСТЫ: 1. Отметьте вторичный амин. а) R-NH-R. б) R ( CONH2 ). в) R-CN. г) R-NO2 2. Укажите нитриловую группу. а) R-NH2. б) R ( CONH2 ) в) R-CN г) R-COOH. д) R-NO2 3. Определить группу ароматических аминов. а) C6H5NH2 , (C6H5)2NH, (C6H5)3N. б) CH3NH2, (CH3)2NH, (CH3)3N. в) C6H5-NH-CH3. г) C6H5-NH-CH3 ,(C6H5)2NH, (C6H5) 3N. 4. Отметьте смешанный амин. а) C6H5NH2, (C6H5)2NH, (C6H5) 3N. б) CH3NH2, (CH3)2NH, (CH3)3N в) C6H5-NH-CH3. г) C6H5-NH-CH3 ,(C6H5)2NH, (C6H5) 3N. 5. Определите химическую формулу аминокислоты глицина. а) NH2C6H4 COOH. б) CH3COOH в) NH2CH2COOH. г) NH2CH2 CH2COOH 6.Определите амидную группу. а) R-NH2. б) R(CONH2). в) R-CN. г) R-COOH 7. Определите химическую формулу аминокислоты аланина. а) NH2C6H4 COOH б) CH3COOH в) NH2CH2COOH г) NH2CH2 (CH3)COOH 8. В каких интервалах температур быстро протекает превращение нитробензола в анилин в присутствии катализатора? а) 100, 120 и 1500C. б) 230, 300 и 4000C в) 300, 400 и 5000C. г) 500, 550 и 6000C 9. Когда и где было создано получение анилина методом аминолиза бензойной кислоты? а) 1970, Ангиля. б) 1970, США. в) 1970, Германя. г) 1965, США 10. Определите химическую формулу анилинового желтого, используемого в качестве красителя. а) (C6H5)2 NH. б) C6H5-NN-C6H4-NH2 в) C6H5-NN-C6H5 г) C6H5-NN-CH3 Какое вещество образуется как побочный продукт при получении анилина методом аминолиза бензойной кислоты? а) Бензойная кислота. б) Аминотолуол в) Бензамид. г) пиррол. 12. На какие виды аминов делятся по их структурному состоянию. а) Первичный, вторичный, третичный. б) Алифатические. ароматный, смешанный в) основные и кислые. г) Дипептид и полипептид. 13. Какие виды аминов делятся по природе углеводородного радикала? а) Первичный, вторичный, третичный. б) Алифатические. ароматный, смешанный в) основные и кислые. г) Дипептид и полипептид. 14. Отметьте аминогруппу. а) NH2. б) R(CONH2)в) R-CN. в) R-COOH 15.Продукт восстановления нитробензола? а) C6H5NH2 б) C6H5CH3 в) C6H5NO г) C6H5Cl |
