практикак. Практика. Министерство высшего и среднего специального образования республики узбекистана
 Скачать 1.4 Mb. Скачать 1.4 Mb.
|
|
НИТРОБЕНЗОЛЬНЫЙ КАТАЛИТИЧЕСКИЙ ВОССТАНОВЛЕНИЕ Направление реакции и скорость восстановления нитросоединения часто зависят от условий процесса и природы используемого катализатора. В реакциях гидрирования нитросоединений часто используют металлические катализаторы, особенно металлы VIII группы таблицы Менделеева — платину, палладий, родий, никель, кобальт, а также сплавы никеля и хрома, никеля и меди. Каталитическая активность дополнительно усиливается добавлением активаторов-промоторов. В качестве носителей используются пористые материалы: активированный уголь, асбест, пемза. Способ приготовления катализатора оказывает большое влияние на его активность. Восстановление паровой фазе. В парофазном процессе нитросоединения испаряются, смешиваются с избытком водорода и проходят через заполненный твердым катализатором контактный аппарат. Процесс восстановления протекает на поверхности катализатора до полного превращения нитросоединения в анилин. В качестве катализаторов в этом процессе используются сплавы никеля, алюминия, вольфрама, меди, нанесенные на оксид кремния. Медь наиболее подходит для восстановления нитробензола, так как ее действие направлено только на нитрогруппу и не влияет на ароматическое ядро. Восстановление жидкой фазе. Восстановление нитробензола в жидкой фазе проводят в среде растворителя. Образовавшийся в результате реакции анилин может выступать в роли растворителя. Природа растворителя влияет на скорость реакции гидрирования. Процесс гидрирования быстро протекает в спиртах и воде, ароматических углеводородах (за счет их сорбции активными центрами катализатора). Области применения анилина. Анилин применяют в фармацевтической промышленности в качестве сульфамидных препаратов и синтетических заменителей сахара. В химии фотоматериалов анилин используется в производстве гидрохинона. Анилин как ингибитор коррозии; производные анилина в качестве катализаторов и отвердителей эпоксидных смол; различные соли анилина применяются в качестве присадок к топливным и сурковым маслам; Ряд продуктов анилина и их смеси используются в качестве ракетного топлива; небольшая часть анилина широко применяется в текстильной, бумажной и металлургической промышленности, в производстве поверхностно-активных веществ, в качестве катализаторов, стабилизаторов, ингибиторов полимеризации. В США, например, расход анилина на производство гербицидов и полиамидного волокна составляет 20%.  КОНТРОЛЬНЫЕ ВОПРОСЫ 1 – упражнение а) В каких интервалах температур происходит быстрое превращение нитробензола в анилин в присутствии медного катализатора? б) Напишите схемы реакций моносульфатирования бензола, толуола и нитробензола. в) Как амино, нитро и амидные группы проявляют кислотные свойства в органических соединениях. г) Объясните процесс восстановления в жидкой фазе. 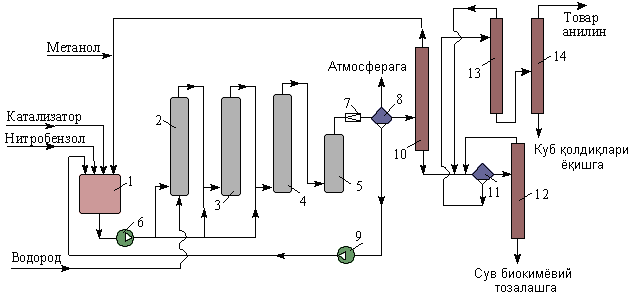 2 – упражнение а) Какие катализаторы используются при каталитическом восстановлении нитробензола б) Воздействие о-хлорнитробензола NH3, спирта и щелочи. в)Почему хлорбензол с этими реагентами в особых условиях и в очень агрегатной реакции. г) Реакция нитробензола с водородом. 3-упражнение а) Если при нитровании 40 г бензола образуется 52 г нитробензола, каков % выхода реакции? б) Что лежит в основе реакции Зина. в) Требования к сокращению паровой фазы. 4 – упражнение а) Воздействие σ-хлорнитробензола NH3, спирта и щелочи б) В чем преимущество синтеза анилина из нитробензола? в) Объясните схему получения этого анилина. 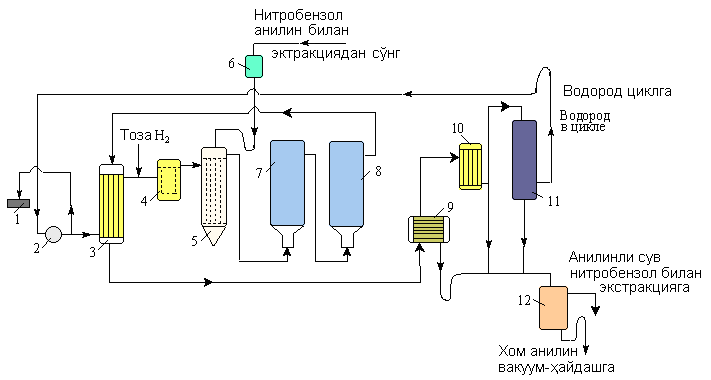 ТЕСТЫ: 1. Обратку нитробензола впервые исследовал Кем А) Бин. б) Бешан. в) Бертоле. г) Берцелиус. 2. Как в первый раз вернули нитробензол? а) Вернулся с железом в слабой среде. б) Окисление атомарным кислородом. в) Возврат с водородом в щелочной среде. г) в присутствии KMnO4. 3. За сколько лет первая реакция восстановления нитробензола была применена в промышленности? а) В 1856 г. б) В 1828 году. в) в 1854 году. г) 1822 год. 4. Определите последовательность ароматических аминов.. а) C6H5NH2 , (C6H5)2NH, (C6H5)3N. б) CH3NH2, (CH3)2NH, (CH3)3N в) C6H5-NH-CH3 г) CH5-NH-CH3 ,(C 6 H 5)2NH, (C 6 H 5 )3N. 5. Укажите вещество, полученное возвратом нитробензола в жидкую фазу? а) C6H5NH2 б) C6H5CH3 в) C6H5NO г) C6H5Cl 6.В каких интервалах температур быстро протекает превращение нитробензола в анилин в присутствии медного катализатора? а) 100, 120 и 1500C б) 230, 300 и 4000C в) 300, 400 и 5000C г) 500, 550 и 6000C 7. Возврат нитробензола впервые исследовал кем. а) Бин. б) Бешан. в) Бертоле. г) Берцелиус. 8. Как в первый раз вернули нитробензол? а) Вернулся с железом в слабой среде. б) Окисление атомарным кислородом. в) Возврат с водородом в щелочной среде. г) в присутствии KMnO4. 9. За сколько лет первая реакция восстановления нитробензола была применена в промышленности? а) В 1856 г. б) В 1828 году. в) в 1854г. г) в 1822г. 10. На какие виды аминов делятся по их структурному состоянию. а) Первичный, вторичный, третичный. б) Алифатические. ароматный, смешанный в) основные и кислые. г) Дипептид и полипептид. 11. Какие виды аминов делятся по природе углеводородного радикала? а) Первичные, вторичные, третичные. б) Алифатические. ароматный, смешанный в) основные и кислые. г) дипептидные и полипептидные. 12. Продукт восстановления нитробензола? а) C6H5NH2 б) C6H5CH3 в) C6H5NO г) C6H5Cl 13. Специфические свойства нитробензола, отличающие его от других производных бензола. а) Бесцветная светлая жидкость. б) нерастворим в воде. в) Кислый миндальный запах. г) легковоспламеняющиеся. Какие катализаторы используются в каталитическом восстановлении нитробензола а) Ba б) KMnO4 в) Pb г) C6H5Cl. ПОЛУЧЕНИЕ АНИЛИНА ИЗ ТОЛУОЛА. В промышленности бензойную кислоту получают окислением толуола в жидкой фазе под катализатором из солей кобальта. 2С6Н5СН3 + 3O2 → 2С6Н5СООН + Н2О При воздействии бензойной кислоты на водный раствор аммиака под катализатором оксида меди (II) образуется анилин при температуре 215-220°С и давлении 3,5-4,2 МПа. Расход анилина составляет 37%. Процесс аммонолиза бензойной кислоты состоит из двух стадий: 1) При взаимодействии оксида меди(II), бензойной кислоты и аммиака образуется анилин: С6Н5СООН + NH3 + 2CuO → С6Н5NH2 + Cu2O + СO2 + Н2О Регенерация оксида меди (II), т.е. окисление оксида меди (II) кислородом воздуха.: 2Cu2O + O2 → 4CuO Помимо основной реакции образуется дополнительный продукт бензамид C6H5CONH2.Принципиальная технологическая схема получения анилина из толуола описана ниже.. 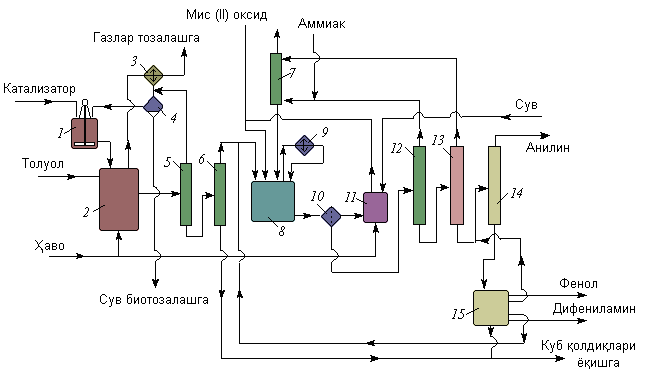 Рисунок 5. Принципиальная технологическая схема производства анилина из толуола: 1-аппарат приготовления суспензии катализатора; 2-реактор оксида толуола; 3-конденсатор; 4-сепаратор; 5,6,12 приводные колонки; 7-абсорбер; 8-реактор аммонолиза; 9 обратный холодильник; 10-фильтр; реактор окисления 11-Cu2O; 13-анилиновая сушильная колонна; Ректификационная колонна товарного анилина 14; 15 Устройство разделения реакционной смеси. Процесс получения анилина из толуола в промышленности начинается с приготовления суспензии катализатора в толуоле в аппарате 1, ремонтируемом мешалкой. Нафтенат кобальта используется в качестве катализатора. Приготовленную суспензию направляют в реактор 2, в нижнюю часть реактора подают воздух.Окисление толуола проводят при давлении 130-140°С и 0,21-0,22 МПа. Поскольку процесс является экзотермическим, тепло регулярно отводится. Степень превращения толуола в бензойную кислоту составляет 30-40%. Газы из реактора 2 направляются в конденсатор 3, где конденсируются органические продукты, поступающие с отработанным воздухом. Полученный конденсат разделяют на органический и водный слои в 4-жидкостном сепараторе. Богатое толуолом органическое вещество возвращается в реактор, а водный слой направляется на биохимическую очистку. Отработавшие газы из конденсатора 3 очищают угольными адсорбентами, адсорберы обрабатывают водяным паром для десорбции поглощенных газов. Полученную смесь делят на слои. Органический слой, содержащий толуол, возвращается в реактор, а вода направляется на очистку. Реакционную массу в реакторе 2 фильтрованием переносят в приводную колонну 5 после отделения катализатора, при этом колонна работает при атмосферном давлении. Дистиллят состоит из толуола, который возвращается в реактор. Кубовая жидкость поступает в 6-ю вакуумную колонну, где бензойная кислота отделяется от высококипящих соединений. Бензойная кислота направляется в процесс аммонолиза в жидком виде для получения анилина. В абсорбере 7 готовят водный раствор аммиака. Бензойную кислоту, суспензию двухоксидов меди и аммиачную воду вместе направляют в модернизированный реактор 8 со смесителем и хладагентом. Мольное соотношение бензойной кислоты, воды, аммиака и оксида меди составляет 1,5:1,8:3,4:1. Хотя вода в реакции не участвует, она препятствует образованию промежуточного продукта бензамида. Реакцию аммонолиза проводят при давлении 220°С и 3,5 МПа, при которой вступает в реакцию 35% поступающей бензойной кислоты, из которой 88% превращается в анилин. Он также производит 10% фенола и 2% дифениламина. После апонолиза реакционную массу фильтруют от катализатора и направляют в каскад ректификационных колонн. Остаток на фильтре 10 переносится в реактор 11, где образовавшийся Cu2O окисляется до CuO. Воздух направляется в нижнюю часть реактора, где при нормальной температуре и атмосферном давлении происходит эндотермическая реакция, и Cu2O полностью превращается в CuO. Суспензию CuO в реакторе 11 возвращают в реактор 8. В колонне 12 аммиак десорбируется из фильтрата и собирается в абсорбере 7, который возвращается в реакционный процесс. В колонну 13 подается вода и возвращается на абсорбцию аммиака. Одну часть воды очищают промывкой CuO на фильтре. В колонну 14 под низким давлением закачивают анилин. Фенол, анилин, бензойную кислоту, дифениламин выделяют из куба колонны в вакууме и возвращают в реактор 8. Остатки куба сжигаются. По сравнению с толуолом выход анилина составляет 79,2%.. ДИАГРАММА ВЕННА  КОНТРОЛЬНЫЕ ВОПРОСЫ 1 – упражнение а) Катализаторы для получения анилина из толуола и их свойства. б) Где и сколько лет применялось в промышленности производство анилина методом аммонолиза. в) Сделать симм-тринитробензол из толуола. г) Анилин, свойства, применение. 2 – упражнение а) Объясните преимущества получения анилина из толуола б) Воздействие о-хлорнитробензола NH3, спирта и щелочи. Почему хлорбензол с этими реагентами в особых условиях и в очень агрегатной реакции. в) Роль анилина на мировом рынке. 3-упражнение а) Если при нитровании 40 г бензола образуется 52 г нитробензола, каков % выхода реакции? б) Напишите структурные формулы о-нитротолуола, м-нитробензолсульфокислоты, м-толуолсульфохлорида. 4 – упражнение а) Воздействие о-хлорнитробензола NH3, спирта и щелочи. б) Объясните технологическую схему производства анилина и какое вещество используется в качестве сырья? ТЕСТЫ: 1. Как называется продукт реакции окисления толуола кислородом? а) Бензойная кислота. б) Фталевая кислота. в) бензальдегид. г) Мойевая кислота 2.Определите строку, где указана формула анилина.. а) C6H5NH2 б) C6H5CH3 в) C6H5NO г) C6H5Cl 3. Определите строку, в которой указан толуол. а) C6H5NH2 б) C6H5CH3 в) C6H5NO г) C6H5Cl 4. Синтетические поверхностно-активные вещества - это... а) Вещества, молекулы которых имеют гидрофильные и гидрофобные группы. б) Вещества, молекулы которых имеют хромофорные и ауксиромные группы. в) Вещества с молекулами групп азота и хлора. г) Вещества, молекулы которых имеют альдегидные и кетоновые группы. 5. Специфические свойства толуола, отличающие его от других производных бензола. а) Бесцветная светлая жидкость. б) нерастворим в воде. в) Кислый миндальный запах. г ) легковоспламеняющиеся. 6. Укажите вещество, полученное из толуола в жидкой фазе.? а) C6H5NH2 б) C6H5CH3 в) C6H5NO г) C6H5Cl 7. Как в первый раз вернули нитробензол? а) Вернулся с железом в слабой среде. б) Окисление атомарным кислородом. в) Возврат с водородом в щелочной среде. г) в присутствии KMnO4. 8. За сколько лет первая реакция восстановления нитробензола была применена в промышленности? а) В 1856 г. б) В 1828 году. в) в 1854г. г) в 1822г. 9. Продукт, полученный окислением толуола в жидкой фазе под катализатором из солей кобальта? а) C6H5NH2 б) C6H5CH3 в) C6H5NO г) C6H5CООH 10. Укажите катализатор, используемый при получении анилина из толуола. а) Ba б) KМnO4 в) СuO г) C6H5Cl. 11. На чем основана реакция Зинина? а) Окисление бензола в присутствии кислорода воздуха б) Окисление аминов до аминокислот. в) Получить анилин из нитробензола. г) Для определения гибридизации азота в аминах. СИНТЕЗ МЕТАЛЛООРГАНИЧЕСКИХ СОЕДИНЕНИЙ Синтез кремнийорганических соединений. Кремний используется в качестве органического полимера, сурков масел и жидкостей. Они обладают высокой термической стабильностью благодаря прочности кремниевых связей Si-O-Si. При производстве таких веществ используют в основном диалкил- или алкиларилдихлорсиланы R2SiCl2, которые при воздействии воды образуют силандионы, которые также конденсируются с образованием линейных полимеров: R2SiCl2 + 2H2O →R2Si(OH)2 + 2HCl 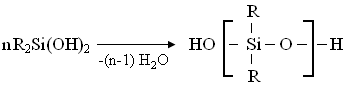 Правильный синтез органохлорсиланов. Органические соединения кремния долгое время получали методом органического синтеза магния. Взаимодействие хлоралканов с металлическим кремнием в присутствии меди при 300-450°С приводит к Si-алкилированию и образованию комплексных соединений. Наряду с самым основным диалкилдихлорсиланом 2RCl + Si → R2 Si Cl2 Моноалкилтрихлороксиланы RSiCl3, триалкилмонохлорсиланы R3SiCl3, тетрахлорид кремния SiCl4, гидрохлороксиланы (RSiHCl2, R2SiHCl), а также водород, метан, этилен и др. образуются продукты распада. Они происходят по свободнорадикальному механизму. На первой стадии алкилхлорид реагирует с медью с образованием алкила или алкилхлорида, а затем их разложение приводит к образованию свободных углеводородных радикалов и атомов хлора: RCl + 2Cu → RCu + 0,5 Cu2Cl2 → R∙ + 2Cu + Cl∙ RCl + Cu → RCuCl → Cu + R∙ + Cl∙ Свободные атомы и радикалы взаимодействуют с атомом кремния с образованием алкилхлосиланов: Si + 4Cl → SiCl4; Si + 2R∙ + 2 Cl∙→ R2SiCl2; Si + R∙ + 3 Cl∙→ RSiCl3; Si + 3R∙ + Cl∙→ R3SiCl Димеризация свободных радикалов и атомов, а также дегидрирование углеводородов и соединение промежуточных продуктов с водородом. R∙ + R∙ → R-R CH3-CH3 → CH2=CH2 + H2 2R∙ + Si +Cl∙→ R2Si∙Cl + H∙ → R2SiHCl R∙ + Si + 2Cl∙→ RsiCl2+ H∙ → RsiHCl2 и т.д. При контакте кремний-медь простые хлоралканы глубоко разлагаются, а винилхлорид имеет низкие реакционные свойства, что приводит к меньшему общему расходу продукта. В присутствии хлорметана и хлорметана для реакции требуется 300-370ºС, а для хлорбензола 430-470ºС и даже 500-600ºС.. Смесь, образующаяся при реакции хлорэтана с кремний-медным контактом, состоит из 35-40 % (С2Н5)2SiCl2, 20-30 % С2Н5SiCl3, 10-15 % С2Н5Si HCl2 и небольшого количества других веществ. Основной дихлордиэтилсилан (С2Н5) 2SiCl2 кипит при 129ºС. Конверсия обычного кремний-медного контакта в реакции хлора с бензолом не очень высока, поэтому рекомендуется увеличить количество меди в контакте до 30%. Продукты реакции состоят в основном из фенилтрихлорсилана C6H5SiCl3 и небольшого количества дефинилдихлорсилана (C6H5)2SiCl2. Другие реакции алкилирования атома кремния. Правильный синтез алкилхлорцеланов показывает хорошие результаты для веществ с низким содержанием (метил-, этил-, аллилхлориланы), поэтому для получения других кремнийорганических соединений следует использовать другие методы синтеза, что должно позволить использовать их в промышленности. Среди них важную роль играют реакции алкилирования атома кремния. Гидрохлоселаны SiHCl3 используются в качестве исходных соединений кремния для этих процессов. Его получают на основе хлористого водорода кремниймедного контакта, особенно алкилгидрихлорцелана RSiHCl2, образующегося в качестве промежуточного продукта при правильном синтезе. Известно, что атомы водорода, связанные с кремнием, имеют свойство обмениваться на различные алкильные группы под действием соответствующих алкилирующих агентов. Одним из таких типов реакций является взаимодействие олефинов с гидритхлоселанами и алкилгидрихлорцеланами, происходящее под действием ультрафиолета с пероксидами в присутствии галогенидов алюминия, бария или цинка и платиновых катализаторов (платиновый носитель или H2PtCl6): 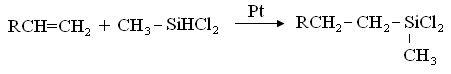 Сочетание гидрохлорсиланов происходит таким образом, что группа, содержащая кремний, направлена к наиболее гидрированному атому углерода. Подобно олефинам, ацетилен реагирует с гидридами и алкилгидрихлорсиланами с образованием винила на атоме кремния: 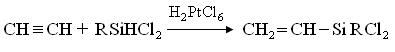 Таким путем получают неорганические соединения винилкремния, а правильный синтез не дает хороших результатов. Таким образом, комбинируя правильный синтез, описанный выше, можно получить многие органические соединения кремния. Синтез органических соединений алюминия. Одним из способов получения алюминийорганических соединений является диспропорция безводного хлорида алюминия с триэтилалюминием в бензине при 50-60°С. 2Al + 3C2H5Cl → (C2H5)2AlCl + C2H5AlCl2 2(C2H5)3Cl + AlCl3 → 3 (C2H5)2AlCl Правильный синтез алкилалюминия на основе алюминия и олефина был открыт в 1955 году Циглером. Реакция легче всего осуществляется с изобутином, который образует триизобутилалюминий в бензине при давлении 140-150ºС и 4-5МПа: Al + 3(CH3)2C═CH2 + 1,5H2 → Al[-CH2-CH(CH3)2]3 Распространен другой способ получения триэтилалюминия, при котором отсутствует стадия синтеза триизобутилалюминия, но затем осуществляется рециркуляция триэтилалюминия. Этот метод также состоит из двух шагов. На первой стадии в результате взаимодействия алюминия с рециркулирующим триэтилалюминием и водородом образуется гидрид диэтилалюминия: Аl + 2Al(C2H5)3 + 1,5H2 → 3(C2H5)2AlH Реакция протекает при 100-140°С и давлении 2-5 МПа. На второй стадии гидрид диэтилалюминия взаимодействует с этиленом в мягких условиях (60-70 ºС и ≈2 МПа), при которых развитие цепи практически невозможно: 3(C2H5)2AlH+ 3 C2H4 → 3Al(C2H5)3 Это означает, что на каждый 1 моль произведенного триэтилалюминия циркулирует 2 моля продукта, что указывает на отсутствие двухстадийного процесса. Важным условием успешной реализации вышеперечисленных гетерогенных процессов является высокая степень дисперсности алюминия и необходимость активации его поверхности путем измельчения в химических реагентах (бромистый этил, триэтилалюминий, AlCl3) или в мельнице. Кроме того, было установлено, что с очень чистым алюминием реакция не идет, однако из-за присутствия в нем смеси переменных металлов (Ti и др.) процесс относительно ускоряется. Поэтому применяют легированный титаном (0,8-4,0%) алюминий. Или в качестве катализатора добавляют титангидрид. Технология производства триэтилалюминия. Триэтилалюминий – жидкость с температурой кипения 128-130°С (при давлении 6,65 кПа). Реагирует с водой, воспламеняется на воздухе. |
