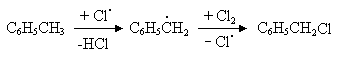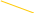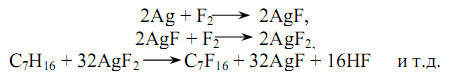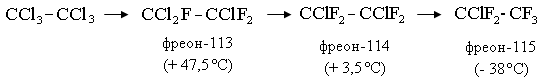|
|
практикак. Практика. Министерство высшего и среднего специального образования республики узбекистана
ПРОИЗВОДСТВО УГЛЕВОДОРОДОВ И СОЕДИНЕНИЙ ХЛОРА
Наиболее часто используемым реагентом для хлорирования является газообразный хлор. Иногда в ходе реакции используют хлорвыделяющие соединения, например гипохлорит натрия - NaOCl, соляную кислоту, хлорат натрия, сульфохлорид - SO2Cl2 и другие.
В качестве катализатора хлорирования FeCl3, J2, AlCl3, Al2O3, TiCl4, TiCl3, H2SO4 и другие. Это наиболее часто используемый - FeCl3 ва AlCl3.
Как было сказано выше, процесс хлорирования гомологов бензола в боковой цепи осуществляется без катализатора, при значительно более высокой температуре, чем хлорирование в ядре. Скорость этой реакции ускоряют за счет освещения реакционной массы и добавления небольшого количества (
0,1%) инициатора. В качестве инициаторов используют органические пероксиды (бензоилпероксид (С6H5OO)2), азобиосоединения (азобисдиизобутиронитрил).
Процесс хлорирования гомологов бензола в боковой цепи протекает по радикально-цепному механизму, в котором реагирующая частица выступает в роли галоген-радикала.
Когда в реакционной массе присутствует кислород, он замедляет реакцию, разрывая цепь:
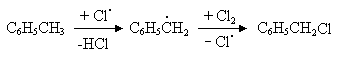
При низких температурах толуол также может присоединять к ядру хлор и образовывать различные метилхлорциклогексаны. Для хлорирования толуола в боковой цепи процесс необходимо проводить при температуре 90-150ºС. При этом скорость смещения в боковой цепи значительно превышает скорость накопления хлора в ядре..
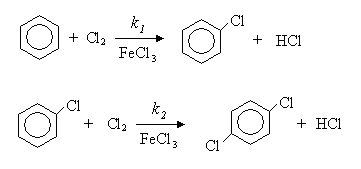
Методы хлорирования бензола. Хлорирование бензола дает хлорбензол, который также можно хлорировать с образованием дихлорбензола.:
Метод окислительного хлорирования бензола состоит из 4 стадий:
приготовление исходных смесей паров бензола, хлористого водорода и воздуха;
перенос паров полученной смеси над катализатором;
охлаждение, конденсация и разделение продуктов реакции;
отделение бензола от выхлопных газов..
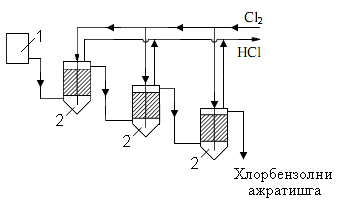
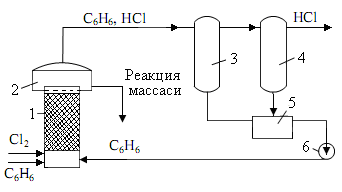
Хлораторы. Хлоратор для получения хлорбензола.. Состоит из стальной колонны с широкой 1-секцией на верхней стороне. Внутри устройство покрыто диабазовой плиткой, внизу имеется 5-ти чугунная решетка, которая заполнена насадками (керамические и стальные кольца 25х25 или 50х50 мм). Стальные кольца являются источником образования хлорида железа, а FeCl3 действует как катализатор хлорирования. Под решеткой расположены патрубки, необходимые для поступления хлора и бензола, и патрубок 6 для очистки оборудования при ремонте.
Периодическое хлорирование бензола имеет ряд недостатков: используемое оборудование имеет низкую производительность. Кроме того, очень трудно поддерживать одинаковую температуру всей реакционной массы, так как процесс хлорирования является экзотермическим и выделяется большое количество тепла (117-135 кДж/моль).
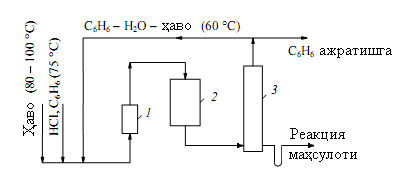
В настоящее время в промышленности используется непрерывный способ при температуре кипения реакционной массы в присутствии катализатора для получения хлорбензола. Процесс хлорирования начинается с подготовки сырья. Важно очищать используемый бензол. Потому что он может содержать тиофен и сероуглерод. Тиофен реагирует с трихлоридом железа и бензолом с образованием «черного осадка», нерастворимого в бензоле. Кроме того, в этих условиях теофен может хлорироваться, что затрудняет контроль над хлорированием, поскольку плотность образующихся хлорофефенов близка к плотности полихлорированного бензола. При перегонке сырого хлорбензола из хлоротефенов выделяется хлороводород, что приводит к коррозии оборудования.
В ряде случаев реакционную массу нейтрализуют раствором щелочи для разделения хлористого водорода и FeCl3, а иногда промывают водой. Однако в результате этих шагов увеличатся потери бензола и потребление электроэнергии.
Другим способом получения хлорбензола в промышленности является процесс окислительного хлорирования бензола. Этот метод осуществляется в присутствии катализатора в паровой фазе. В качестве хлорирующих агентов используют хлористый водород и кислород воздуха. Это включает две последовательные реакции — окисление и хлорирование хлороводорода.
4 HCI + O2 = 2CI2 + 2H2O
Метод окислительного хлорирования бензола состоит из 4 стадий:
1) приготовление исходных смесей паров бензола, хлористого водорода и воздуха;
2) перенос паров полученной смеси над катализатором;
3) охлаждение, конденсация и разделение продуктов реакции;
4) отделение бензола от выхлопных газов.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1– упражнение
а) Теоретические основы процессов хлорирования.
б) хлорирующие агенты.
в) Методы хлорирования бензола.
г) Хлораторы
2 – упражнение
а) Окислительное хлорирование бензола.
б) Непрерывное хлорирование бензола.
в) Способы получения винилхлорида.
г) Производство эпихлоргидрина.
3 – упражнение
а) Какие катализаторы используются при хлорировании.
б) По какому механизму протекает процесс хлорирования гомологов бензола в боковой цепи.
г) Хлорирование без бензольного катализатора.
д) Хлорирование толуола.
4– упражнение
а) Объясните технологический процесс получения хлорбензола и дихлорбензола.
б) Назовите стадии метода окислительного хлорирования бензола:
в) Хлораторы для получения хлорбензола.
г) Методы хлорирования бензола.
д)Объясните технологический процесс получения хлорбензола и дихлорбензола.
5– упражнение
а) Метод хлорирования по Б. Э. Беркману.
б) Объясните функцию следующей технологической схемы.
в) Объясните следующий метод хлорирования оксидов.
г) Предложите схему образования м-иодхлорбензола из бензола.
д) Получить 2,4,6-трибромбензойную кислоту из м-нитробензойной кислоты.
ТЕСТЫ:
1. Кем определено различие введения Cl2 в молекулу гомологов бензола?
а) Бейльштейн. б) Бертло. в) Кокле. г) Зинин.
2. Что бензол соединяется с Cl2 на свету?
а) хлорбензол. б) гексахлоран. в) гексохлорциклический. г) б, с
3. При каких условиях Cl2 присоединяется с образованием хлобизола?
а) CH4. б) свет. в) FeCl3. г) Факел.
4. Кто создал непрерывное хлорирование бизола?
а) Бертло. б) Байльштейн. в) Лебедев. г) Воройцов.
5. Метод окислительного хлорирования бензола протекает в ....стадии?
А) 3. Б) 4. В) 5. Г) 2.
6. Какой промежуточный продукт образуется гидрогидриновым методом?
а) пропиленхлорид. б) дихлорпропан. в) пропан
7. В каком случае при хлорировании бутановой кислоты атом водорода заменяется на хлор?
А) α. Б) β. В) γ. Г) γ.
8. Выберите сырье для получения трефталевой кислоты.
а) для ксилола. б) метаксилол. в) средний ксилол. г) метилбензол.
9. Кто открыл, что непрерывный процесс хлорирования бизола связан с кипением реакционной массы?
а) Беркман.б) Воройцов. в) Бертло. г) Бейльштейн.
ПРОИЗВОДСТВО ФТОРИДНЫХ СОЕДИНЕНИЙ УГЛЕВОДОРОДОВ
Фторирование углеводородов, даже простых, из-за взрывного характера процесса и полного разложения молекул углеводородов долгое время не представлялось возможным. Это было связано с выделением большого количества тепла в реакциях прямого фторирования. Например, расчетная температура реакции фторирования гептана составляет
1660 ккал/моль.
Реакция присоединения атома фтора к молекуле органического вещества называется фторированием. Наиболее практичными из реакций присоединения атома фтора являются:
а) фторирование молекулярным фтором и фторидами некоторых металлов в высоковалентном состоянии (AgF2, СoF3); это в основном связано с заменой атома водорода на фтор;
б) фторирование фтористым водородом HF и его солями (AgF, HgF2 и др.); фтор в основном обменивается с атомами хлора, промежуточной стадией получения фторорганических соединений является хлорорганический синтез.
КЛАСТЕР
КЛАСТЕР
Технология процесса.
Каталитическое фторирование.
Процессы фторирования

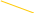
Электрохимическое фторирование.
  
Процесс фторирования металлов.
Фторирование в присутствии фтороводорода и его солей
Технология процесса. В промышленности применяются следующие методы фторирования: каталитическое фторирование, фторирование фторидами металлов, электрохимическое фторирование, фторирование фтористым водородом и его солями..
Каталитическое фторирование. Этот процесс осуществляется в аппарате, заполненном посеребренным медным ломом. Функция меди основана на ее высокой теплопроводности, которая аккумулирует излучаемое ею тепло. AgF2 подвергается непосредственному воздействию фтора, что приводит к относительно низкому выходу от 40 до 80-90%..
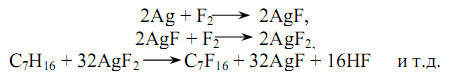
Процесс фторирования металлов. Этот процесс является наиболее распространенным. Он основан на использовании высокометаллических фторидов (СoF3, MnF3), реакция которых с углеводородами осуществляется гораздо более мягким путем с меньшим тепловыделением. Реакционная способность фторидов металлов может быть связана с окислительным потенциалом иона металла, т.е. чем выше потенциал, тем выше реакционная способность. Следующая линия может быть образована реакцией фторидов металлов:
Электрохимическое фторирование. Этот процесс имеет ряд преимуществ перед каталитическим фторированием. Суть муки заключается в следующем: при электролизе безводного фтористого водорода фтор, выделяющийся на аноде, немедленно вступает в реакцию с растворенными или эмульгированными в жидкости органическими веществами. В реакции, протекающей при перемешивании в жидкой фазе, хорошо идет отвод тепла, что позволяет контролировать процесс. Не требует выделения молекулярного фтора и его очистки, так как осуществляется методом электролиза. При электрохимическом фторировании образуются перфорированные угольные кислоты, простые и сложные эфиры, амины, сульфиды и другие соединения.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1-упражнение
Фторирующие агенты.
Физические и химические свойства фреонов.
Реакции присоединения атомов фтора.
Фторирование фтором и фторидами металлов с высоким содержанием металлов.
2– упражнение
Производство фреонов.
Фторорганические мономеры.
Объясните назначение и функции следующей технологической схемы.
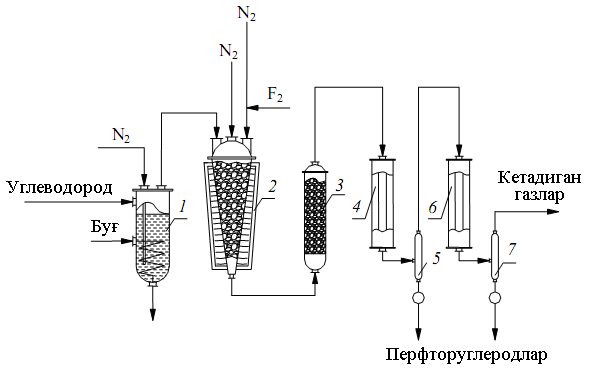
Каталитическое фторирование углеводородов.
3-упражнение
Технология производства фреона-12.
Объясните процесс электрохимического фторирования.
Способы получения тетрафторэтилена.
Объясните назначение и функции следующей технологической схемы.
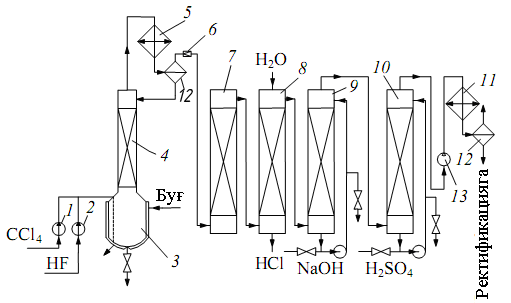
4-упражнение
1. Способы получения монохлортрифторэтилена.
2. Кем и в каком году впервые получен фтор.
3. Приведите примеры того, что называется фторированием.
4. Есть такие способы фторирования в промышленности..
5-упражнение
Объясните процесс каталитического фторирования.
Объясните процесс фторирования металлов.
Физико-химические свойства монохлортрифторэтилена.
Физико-химические свойства винилфторида, винилиденфторида.
ТЕСТЫ:
1. Фреоны...
а) Отопительные приборы б) Солнечная энергия.
в) хладагенты г) А, Б, С.
2. В каком году впервые получен фтор.
а) 1886 г. б) 1889 г. в) 1868 г.). г) 1918 год.
3. Самый распространенный процесс фторирования.
а) Каталитическое фторирование. б) Процесс фторирования металлов.
в) Электрохимическое фторирование. г) Фторирование в присутствии фтористого водорода и его солей.
4. Что такое фреоны?
а). Пропан и бутан в хлорированный, фторированный продукт. б). К продукту хлорирования бутана и пентана. в). Фтор и хлорпроизводные метана и этана. г) к продукту хлорирования пентана и гексана.
5. Технология производства винилфторида.
а) Метилацетилен подвергается воздействию фтора.
б) Ацетилен подвергается воздействию фтористого водорода в присутствии катализатора.
в) Изопрен подвергается воздействию фтористого водорода в присутствии катализатора..
ФТОРИРОВАНИЕ В ПРИСУТСТВИИ ФТОРИСТОГО ВОДОРОДА И ЕГО СОЛЕЙ.
Хлор, атом хлора в хлоргидридах и атом галогена или соединения винильной группы в а-положении в ароматическом ядре плавно обмениваются под действием безводного фтороводорода:
Было обнаружено, что активность трихлорида сурьмы значительно повышается в присутствии SbF5 или хлора. За счет образования этих комплексов, то есть реакция идет только с соединениями хлора, при этом если галогенов в одном углероде не менее двух, то могут образовываться следующие структурные комплексы:
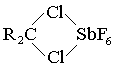
Следующая реакция происходит за счет ослабления связи между углеродом и хлором, а также обмена между атомами свинца и фтора.
Полученные хлориды свинца могут быть преобразованы во фториды с использованием HF и использованы для фторирования.:
SbCl3 + 3HF → SbFl3 + 3 HCl
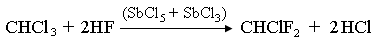
Обмен атома хлора происходит в виде последовательно-параллельных реакций, а состав продукта зависит от соотношения исходных реагентов.:
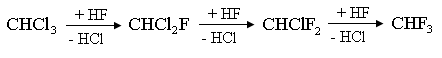
Однако в ряде случаев можно управлять конечной стоимостью продукта. Это связано с тем, что температура кипения веществ, образующихся при обмене атомов хлора на фтор, постепенно снижается..
Фреоны. Фтор и хлорпроизводные метана и этана называются фреонами. Это газообразные или легкокипящие жидкости с резким запахом, негорючие и малотоксичные. Наличие таких свойств позволяет использовать их в качестве хладагентов в холодильном оборудовании. Фреоны также являются промежуточными продуктами при производстве фторолефинов.
Наиболее важные в промышленности фреоны получают обменом атомов хлора на фтор в хлороформе, тетрахлорметане, тетра-, пента- и гексахлорэтане, метилхлороформе. Ниже указано название некоторых фреонов, температура кипения (или конденсации) при атмосферном давлении:
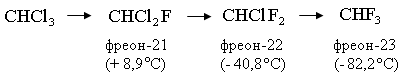
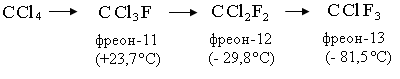
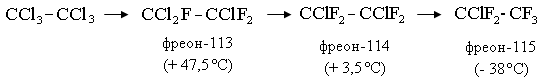
Производство фреонов. Низкотемпературная ректификация используется для разделения фторхлорсодержащих продуктов. При давлении 1,0-1,2 МПа пары сжимают с помощью компрессора 13 и охлаждают до температуры минус -10-15ºC с помощью номокоба в 1-м холодильнике. Образующийся конденсат направляется на разделительное устройство, состоящее из нескольких ректификационных колонн. Легкая фракция состоит из монохлортрифторметана (смесь мелкого дифторхлорметана), который является промежуточным продуктом производства.
Тяжелый остаток состоит из монофтортрихлорметана после ректификации, который возвращается в реактор. Образовавшийся фреон-12 получают в виде жидкости под давлением. Для использования в качестве хладагента его дополнительно сушат - вымораживанием влаги или обработкой твердыми адсорбентами, например цеолитами.
В последнее время разработан и внедрен в промышленность процесс синтеза гетерогенного катализатора со скольжением в движущемся слое на основе SCl4 и HF в газовой фазе при 400ºC для получения фреонов. Предлагается проводить хлорирование углеводородов (СН4, С2Н6) и замену хлора на фтор с использованием HF.
Фторорганические мономеры. Среди фторорганических мономеров наибольшее значение имеют тетрафторэтилен и монохлортрифторэтилен.. ТетрафторэтиленF2=CF2 (газ; при атмосферном давлении tконд.қ76,3 оС). Тетрафторэтилен можно получить несколькими способами. Для получения тетрафторэтилена с высоким выходом (90-95%) используют монохлордеформитан (хладон-22) методом пиролиза при температуре 650-700ºС без катализатора при давлении, близком к атмосферному. Процесс приводит к образованию тетрафторэтилена и выделению HCl.:
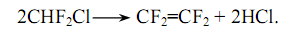
Наибольший расход тетрафторэтилена (около 90%) приходится на процесс пиролиза в графитовых, серебряных или платиновых трубах, а также на неполную конверсию монохлоргидрометана (25-30%).
В другом способе получения тетрафторэтилена дихлорэтрафторэтан реагирует с порошком цинка в присутствии растворителя при давлении 110-130ºС и 40 атм.:

Соединение в молекуле тетрафторэтилена определяет его химические свойства. Тетрафторэтилен взаимодействует с 47%-ной серной кислотой, легко связывает хлор и бром, вступает в другие реакции, характерные для олефинов, в частности в реакцию полимеризации.
Полимеры тетрафторэтилена впервые были получены в 1941 г. Он полимеризуется легче, чем этилен. В результате полимеризации тетрафторэтилена получается политетрафторэтилен, который был выпущен в 1947 году под названием тефлон, в России его называют фторопласт-4:
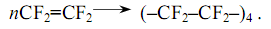
Монохлортрифторэтилен CClF═CF2- представляет собой газообразное вещество с температурой конденсации -26,8ºC при атмосферном давлении. В промышленности цинк, активированный соляной кислотой, для его получения наносят на спиртовой раствор 1,1,2-трифтортрихлорэтана (фреон-113).:

Расход продукта ближе к теории, но высокий расход цинка вызвал необходимость поиска других методов синтеза. Гидрирование гидрированных катализаторов (Cu, Co) может приводить к выделению хлора и образованию CClF=CF2 при большом расходе (77-96%).:
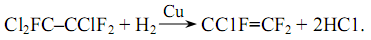
Монохлортрифторэтилен полимеризуется в присутствии радикальных инициаторов с образованием полихлорфторэтилена (фторопласта-3):

Винилфторид - СН2=СНF. Для получения винилфторида ацетилен обрабатывают фтористым водородом в присутствии катализатора. В качестве катализатора используется активированный уголь, пропитанный сулемой и хлоридом бария. В результате реакции образуется промежуточный продукт этилиденфторид.:
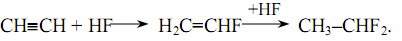
Винилиденфторид - СН2=СF2. Его получают дехлорированием 1,1-дифтер-1,2-дихлорэтана в присутствии цинка.:

На основе винилиденфторида получают высокотермически и химически стойкие фторуглероды. Для этого винилиденфторид сополимеризуют с тетрафторэтиленом, перфторпропиленом или монохлортрифторэтиленом:
КОНТРОЛЬНЫЕ ВОПРОСЫ
1-упражнение
1. Фторирование в присутствии фтористого водорода и его солей.
2.Трифторный синтез этана.
3. Объяснить фреон-113.
2-упражнение
1. Фторорганические мономеры.
2. Производство фреонов.
3. Объясните назначение и функции следующей технологической схемы..

3—упражнение
1. Технология производства фреона-12.
2. Физические свойства и получение тетрафторэтилена.
3. Производство тетрафторэтилена, физико-химические свойства.
4-упражнение
1. Способы получения монохлортрифторэтилена.
2. Образование гексафторпропилена.
3. Экстракция винилфторида.
5-упражнение
а) Производство диметилтерефталата.
б) Производство терефталевой кислоты и диметилтерефталата из толуола.
в) Фторирование в присутствии фтороводорода и его солей.
ТЕСТЫ
1. CHF2C 700% какое вещество образуется в результате пиролиза?
а) CF2= CF2. б) CF3= CF3.
в) CF2= CCl2. г) CFCl – CF3.
2. Фреоны...
а) Нагревательные устройства. б) солнечная энергия.
в) Хладагенты. г) А, Б, С.
3. Фреоны...
а) Нагревательные устройства. б) Получение энергии от солнца.
в) Хладагенты. г) А, Б, С
|
|
|
 Скачать 1.4 Mb.
Скачать 1.4 Mb.