Биология. Министерство здравоохранеия украины
 Скачать 1.5 Mb. Скачать 1.5 Mb.
|
|
Рис. 9. Виды трипаносом: А -Trichomonas vaginalis,Б - Trichomonas hominis, В - Trichomonas tenax. 1 – жгутики, 2 – ядро, 3 – ундулирующая мембрана, 4 - аксостиль Trichomonasvaginalis (Влагалищная трихомонада) — жгутиковое простейшее, возбудитель урогенитального трихомонадоза. Влагалищная трихомонада имеет грушевидное тело длиной 14—30 мкм. На переднем конце тело имеет 4 жгутика и ундулирующую мембрану, доходящую только до середины тела. Ближе к переднему концу располагается ядро (рис. 9 и V Пр). Сквозь все тело проходит осевая нить (аксостиль), выступающая на заднем конце в виде шипика. Цитоплазма содержит вакуоли. Цист не образует, во внешней среде быстро погибает. Играет заметную роль в патологии мочеполовой системы, особенно у женщин. Трихомонады этого вида передаются половым путем, а также при пользовании общей постелью, бельем и предметами личной гигиены. Отсюда вытекают соответствующие профилактические мероприятия. Иногда высказываемое мнение о том, что трихомонады могут переселиться во влагалище из кишечника, неверно, так как кишечная и влагалищная трихомонады — это разные виды с различными требованиями к условиям среды обитания. При урогенитальном трихомонадозе возбудитель болезни внедряется в слизистые оболочки мочеполовых путей, повреждая эпителиальные клетки и способствуя развитию воспалительного процесса. Основными симптомами при мочеполовом трихомонозе являются зуд, боль, жжение в мочеполовых путях, серозно-гнойные выделения (бели). Наблюдается и длительное бессимптомное носительство, чаще у мужчин. Заболевание встречается повсеместно. Trichomonashominis(Кишечная трихомонада) имеет грушевидное тело длиной 8—20 мкм. От переднего конца тела отходят обычно 5 жгутиков (рис. 9). С одной стороны тела по всей его длине расположена волнообразная перепонка (ундулирующая мембрана), по наружному краю которой проходит тонкая нить, выступающая своим свободным концом в виде жгутика. В цитоплазме при окраске видны ядро и осевая нить, или аксостиль. Движение трихомонады активное, беспорядочное, «суетливое». Наряду с поступательным движением трихомонады вращаотея вокруг продольной оси. Мембрану удается заметить только при замедлении движения трихомонады или при ее остановке в виде периодически пробегающих волн по одной из сторон тела. Размножается делением. Цист не образует. Обитает в толстом кишечнике человека. В жидких испражнениях может обнаруживаться в очень больших количествах. В ряде случаев играет определенную роль в развитии или ухудшении течения заболеваний толстого кишечника, особенно у детей раннего возраста.Кишечные трихомонады существуют только в виде вегетативных форм, которые локализуются в толстой кишке человека. Их размножение усиливается при диете богатой клетчаткой и другими углеводами, а также при различных заболеваниях, сопровождающихся разжижением содержимого толстой кишки. Являясь условно-патогенными организмами, кишечные трихомонады под действием ряда факторов могут приобретать патогенные свойства и вызывать кишечный трихомониаз, который протекает в форме колитов и энтероколитов. Возникают поносы от одного до 8 раз в сутки. Испражнения жидкие, водянистые или кашицеобразные, часто с примесью слизи, но без крови. Нередко отмечаются боли в животе различного характера. При ректороманоскопии слизистая оболочка прямой и сигмовидной кишок чрезмерно влажная в результате усиленной эксудации, блестящая, не гиперемированная, без слизи, эрозий и язв, как бы обмытая очистительной клизмой. Усиленное размножение трихомонад в вызванных дизентерийными бактериями и амебами изъязвлениях замедляет их заживление. Трихомонады обнаруживались также в тканях кишечной стенки, в гнойном содержимом абсцессов печени и других органов. Диагноз кишечного трихомониаза , при наличии соответствующей клинической картины, устанавливается в случае обнаружения трихомонад в испражнениях методом нативного мазка. При этом надо дифференцировать их от нередко совместно с ними встречающихся хиломастиксов (Chilomastix mesnili) и энтеромонад (Enteromonas hominis). Trichomonastenax(Ротовая трихомонада)по строению похожа на кишечную форму, ее длина 6—13 мкм, ундулируюшая мембрана не достигает конца тела (рис. 9). Цист не образует. Патогенное значение не доказано, хотя и имеются данные о значительно более частой встречаемости у лиц с различными заболеваниями полости рта и зубов (гингивит, пародонтоз, кариес зубов) и о неблагоприятной роли этих простейших в поддержании патологического процесса. Некоторые исследователи обнаруживали трихомонад в мокроте больных легочными заболеваниями, а также в удаленных хирургическим путем бронхоэктазах и абсцессах легких. Все это заставляет обратить внимание на необходимость более широкого применения лабораторных методов исследования с целью выявления ротовых трихомонад в стоматологических и терапевтических медицинских учреждениях. Лабораторная диагностика. Трихомонад обнаруживают при микроскопии нативных или окрашенных мазков из соскоба ротовой полости (с зубов, десен, из очагов воспаления и нагноения), в бронхиальной слизи и мокроте. Диагностика урогенитального трихомониаза основывается на выявлении клинических признаков заболевания и обнаружении в исследуемом материале Trichomonas vaginalis. Основными методами лабораторной диагностики трихомониаза являются: микроскопический; культуральный; полимеразная цепная реакция (ПЦР); Серологические методы используются как вспомогательные, поскольку антитрихомонадные антитела могут циркулировать в сыворотке крови в течение длительного времени после лечения, что затрудняет дифференцирование текущей и перенесенной в прошлом трихомонадной инфекции. Чувствительность метода микроскопии по различным данным варьирует от 38% до 82%. Несмотря на то, что этот метод среди диагностических тестов является определённо экономически наиболее целесообразным и простым, он имеет низкую чувствительность и специфичность. Это может быть обусловлено, в первую очередь, потерей трихомонадами характерной подвижности после того, как простейшее уже извлечено из среды человеческого организма. Особенно большая доля субъективизма проявляется в случае препаратов с низким титром или препаратов, содержащих огромное количество клеток эпителия, лейкоцитов и различного деструктивного материала из очага поражения. В очаге поражения влагалищная трихомонада часто представлена округлыми формами, напоминающими полиморфоядерные лейкоциты, и естественно, типичные морфологические признаки теряются во время фиксации и окрашивания, создавая трудность для этиологической идентификации. 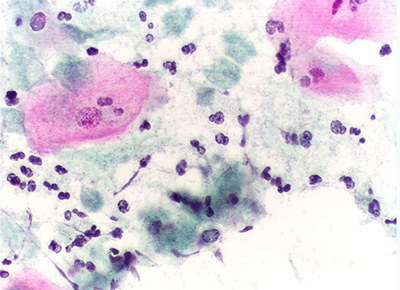 Мазок Папаниколау, показывающий инвазию простейшими Trichomonas vaginalis А  Б Б 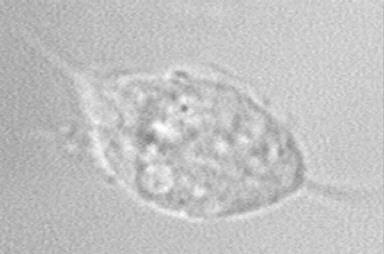 Рис. V.Trichomonasvaginalis(1): А – мазок со слизистой влагалища, Б – трихомонада, выделенная из культуры. 1.4. Организационная структура практического занятия. 1.4.1. Теоретические вопросы, которые необходимо усвоить для достижения целей занятия. а) систематика, морфология, цикл развития и лабораторная диагностика первичножгутиковых (трипаносома и лейшмания); б) систематика, морфология, цикл развития и лабораторная диагностика многожгутиковых (лямблия и трихомонада); в) механизм заражения и меры профилактики заболеваний паразитическими жгутиковыми. 1.4.2.Проверка уровня знаний по тестам исходного контроля 1.В каких органах и тканях человека находятся следующие паразиты?
2. Каким путем человеку передаются паразиты следующих болезней?
3. Сколько жгутиков имеется у Trypanosomagambiense ? а) 2. б) 4, в) 3, г) 1, д) 6 4. Выберите специфических переносчиков протозойных заболеваний. а) вольфартова муха, б) муха це-це, в) москит, г) комар кулекс-самец, д) комар анофелес - самка. 5. Выберите основные звенья в цепи трансмиссивного заболевания. а) транслокация, б) донор, в) трансформация, г) реципиент, д) переносчик 6. Переносчиком Trypanosomagambiense является: а) комар самка-анофелес, б) муха цеце, в) москит, г) никто из перечисленных переносчиков д) комнатная муха КРОК 1
1.4.3.Самостоятельная работа студентов 1. Найти в мазке крови при большом увеличении микроскопа и зарисовать Trypanosomagambiense (трипаносому), отметив детали строения. 2. Найти на микропрепарате при большом увеличении (под иммерсией) Leishmaniadonovani (лейшманий). Зарисовать жгутиковую и безжгутиковую формы лейшмании, отметив детали строения. 3. Найти на микропрепарате при большом увеличении (под иммерсией) Lambliaintestinalis (лямблию). Зарисовать, отметив детали строения. 4. Зарисовать трихомонад (Trichomonas vaginalis, Trichomonas hominis и Trichomonas tenax). Обозначить на рисунке детали строения трихомонады. 5. Зарисовать циклы развития трипаносомы и лейшмании. 1.4.4. Проведение заключительного тестового контроля 1. В каких органах и тканях человека находятся следующие паразиты ?
2. Кто является специфическим переносчиком Leishmaniatropica ? а) муха це-це, б) москит, в) комар анофелес - самка, г) комар кулекс – самец, д) комнатная муха 3. На чем основывается лабораторная диагностика трихомониаза ? а) анализ крови, б) иммунологические исследования, в) копрологические исследования, г) исследование выделений половых путей. д) анализ мочи 4. На чем основывается лабораторная диагностика трипаносомоза ? а) копрологичесрое исследование, б) гематологическое исследование, в) анализ мочи, г) рентгенография. д) исследование выделений половых путей 5. Жгутиковая форма Leishmaniadonovani локализуется в организме у: а) грызунов, б) собаки, в) человека, г) москита. д) кошки 6. Сколько жгутиков у лямблии ? а) 2, б) 3, в) 1. г) 6. д) 8. 7. Какое из перечисленных простейших образует цисты ? а) Trypanosoma gambiense, б) Leishmania donovani, в) Lamblia intestinalis, г) Trichomonas hominis, д) никто из перечисленных простейших не образует цист. КРОК 1
1.4.5. АНАЛИЗ И Подведение итогов занятия 1.5. Место и время занятия - учебная комната, 2 акад. часа. 1.6. Оснащение занятия: микроскопы, микропрепараты, таблицы. занятие 3 представители типа Apicomplexa – паразиты человека. класс Sporozoa 1.1. Значение темы. Знание морфологии, цикла развития и диагностики паразитических форм класса споровиков позволяет выработать правильную тактику для профилактики и лечения заболеваний, вызываемых ими. 1.2. Цели занятия: Общая - изучить представителей класса споровиков (малярийный плазмодий и токсоплазма), которые паразитируют у человека, усвоить их морфологические особенности, получить представление о циклах развития и характере заболеваний, вызываемых паразитами. 1.3.Конкретные цели занятия: 1.3.1.Уметь находить и определять на микропрепарате различные формы малярийного плазмодия. 1.3.2.Уметь находить на микропрепарате токсоплазму. 1.3.3.Представлять механизм заражения и меры профилактики при малярии и токсоплазмозе. 1.3.4.Уметь решать задачи КРОК 1. Основные теоретические сведения К классу Споровиков относят около 3600 видов, ведущих паразитически образ жизни. Они не имеют органелл передвижения; пищеварительных, сократительных вакуолей, питание и выделение происходит осмотически. Жизненный цикл сложный и связан со сменой хозяина. Бесполое размножение обычно осуществляется в форме шизогонии или множественного деления. При этом ядро делится сразу на несколько частей, затем на столько же частей делится цитоплазма и образуется соответствующее число дочерних особей. Бесполое размножение происходит в теле позвоночных животных и человека, а половое в организме безпозвоночных (малярийного комара). Подцарство - Protozoa Класс - Sporosoa (Cпоровики) Отряд - Eucoccidiida Вид - Plasmodium vivax, P. Malariae, P. ovale, P. falciparum Toxoplasmagondii (Токсоплазма) Малярийные плазмодии (кровяные споровики) — простейшие паразиты. Известны четыре вида плазмодиев, вызывающих малярию, — широко распространенное заболевание у человека: Паразиты человека относятся к отряду кровяных споровиков. Наибольший интерес представляет малярийный плазмодий, вызывающий заболевание человека - малярию. Описал малярийного плазмодия французский врач А.Лаверан в 1878 г. У человека вызывают заболевание 4 вида малярийных плазмодиев: возбудитель трехдневной малярии (Plasmodiumvivax), возбудитель четырехдневной малярии (Plasmodiummalariae), возбудитель тропической малярии (Plasmodiumfalciparum) и возбудитель малярии типа трехдневной (Plasmodiumouale) (рис. 330).  Рис. 330. Малярийные плазмодии. Сравнительная морфология возбудителей малярии человека в мазке крови: А - Plasmodiumvivax; Б - Plasmodiummalaria', В - Plasmodiumfalciparum: 1,2 - стадия кольца; 3,4 - амебовидные шизонты; 5,6 - схизогенез (меруляция); 7,8 -гаметоциты. Plasmodium vivax, P. Malariae, P. ovale, P. falciparum. Они отличаются по ряду признаков: степенью вирулентности, способностью заражать комаров, длительностью периодов развития в организме человека, устойчивостью к лекарственным препаратам. Жизненный цикл у всех видов малярийного плазмодия протекает сходно и может быть разбит на три периода (рис.10): 1) шизогония — бесполое размножение, протекает в организме человека, 2) гаметогония — половое размножение, начинается в организме человека и заканчивается в теле комара, 3) спорогония — происходит в организме комара самки Anopheles. Человек для малярийного плазмодия – промежуточный хозяин, в теле которого протекает шизогония. Окончательным хозяином является переносчик возбудителя — самка комара рода Anopheles(рис. Х Пр).  Рис. 10. Жизненный цикл малярийного плазмодия: 1 – выход спорозоитов из протока слюнной железы и внедрение их в клетки печени, 2 – 4 – шизогония в клетках печени, 5 – 8 – шизогония в эритроцитах, 9 – 12 – гаметогония, 13 и 14 – макро- и микрогаметы, 15 – оокинета, 16 – 17 – ооциста, 18 – миграция спорозоитов в союнные железы комара. К 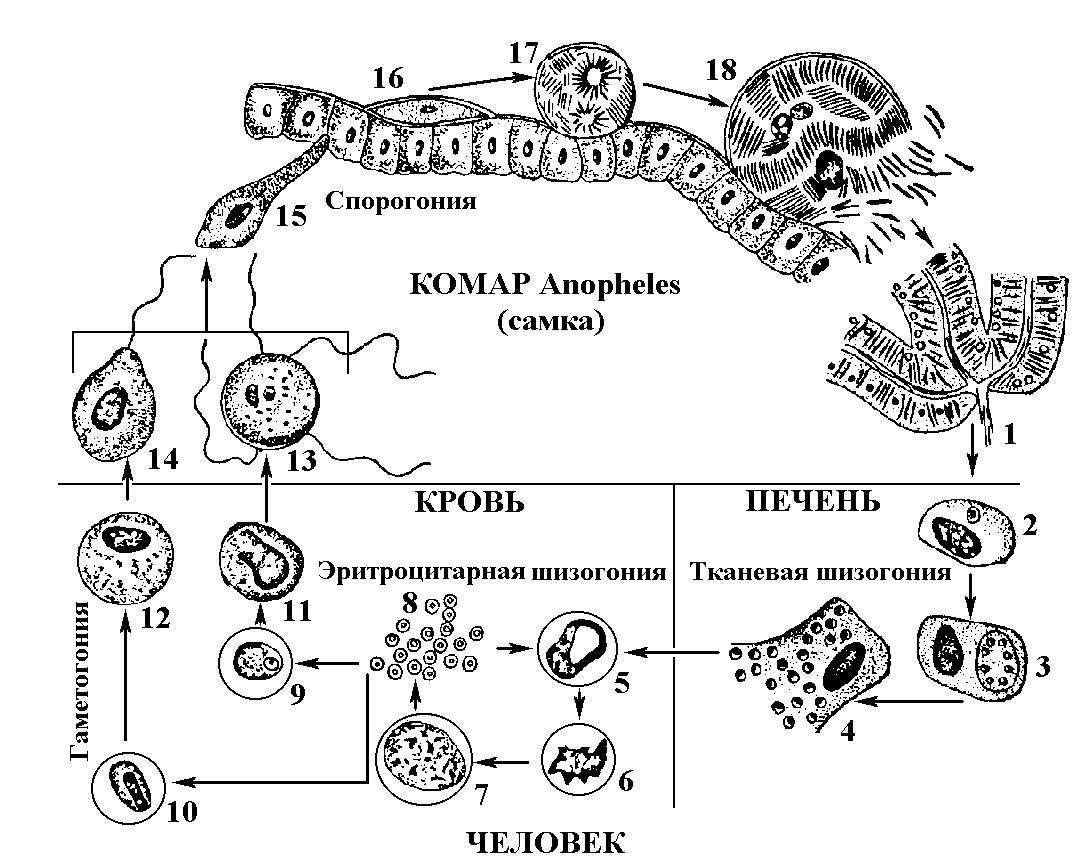 омары, в слюнных железах которых имеются возбудители на определенных стадиях развития (спорозоиты), служат источником заражения человека. Спорозоиты представляют одноядерные веретеновидные клетки длиной 10—15 мкм при ширине 1 мкм. омары, в слюнных железах которых имеются возбудители на определенных стадиях развития (спорозоиты), служат источником заражения человека. Спорозоиты представляют одноядерные веретеновидные клетки длиной 10—15 мкм при ширине 1 мкм. Период шизогонии. При укусе человека комаром спорозоиты со слюной попадают в кровь и заносятся в печень, где начинается тканевой (экзоэритроцитарный) этап развития. В клетках печени они быстро растут и превращаются в делящуюся стадию тканевых шизонтов. Последние имеют округлую форму, достигая в диаметре 40—60 мкм. В результате множественного деления ядра шизонта образуются мелкие 1,5—2,0 мкм овальные клетки мерозоиты. Процесс тканевого развития у P. falciparum длится около 6 суток, а у P. vivax – от 8 суток до нескольких месяцев. Преэритроцитарный цикл осуществляется однократно. Это инкубационный (скрытый) период болезни. Затем тканевые мерозоиты попадают из клеток печени в кровяное русло. У больного начинается эритроцитарный этап развития малярийного плазмодия. Мерозоиты прикрепляются к эритроцитам, а затем проникают в них. Первая стадия развития в эритроците — рост. Вначале паразит имеет вид кольца (стадия кольца). Подобная форма обусловлена наличием центральной вакуоли, смещающей ядро к периферии (рис. VIII Пр). По мере увеличения размеров клетки вакуоль исчезает, в цитоплазме накапливаются гранулы пигмента, появляется способность образовывать псевдоподии (стадия амебоидного шизонта). Активно поглощая содержимое эритроцита, шизонт заполняет почти весь его объем, втягивает псевдоподии, ядро делится последовательно несколько раз. Вокруг каждого фрагмента обособляется цитоплазма. В результате возникают мерозоиты. Они представляют очень мелкие клетки, диаметром не более 2,0 мкм. Клеточная мембрана эритроцита разрывается и мерозоиты вместе с токсичными продуктами их жизнедеятельности поступают в плазму крови. Это сопровождается клиническими симптомами, характеризующими приступ малярии. Подвижные мерозоиты внедряются в новые эритроциты и все развитие повторяется. После каждой шизогонии число паразитов в крови значительно возрастает. Затем наступают качественные изменения: часть мерозоитов приобретает способность превращаться в незрелые половые клетки — гаметоциты. Период гаметогонии. Мерозоиты в эритроцитах образуют две категории клеток — макро- и микрогаметоциты. Макрогаметоциты (женские незрелые половые клетки) имеют небольшое ядро и обильную интенсивно окрашивающуюся цитоплазму. У микрогаметоцитов (мужские незрелые половые клетки) большое ядро и бледный ободок цитоплазмы. Макро- и микрогаметы. В тех случаях, когда самка комара Anopheles питается кровью больного, незрелые половые клетки в желудке насекомого превращаются в зрелые макро- и микрогаметы. При этом микрогаметоциты претерпевают значительные изменения. Ядро делится на 4—8 частей, из цитоплазмы выбрасываются тонкие подвижные бичи (эксфлагеляция). Происходит слияние подвижных микрогамет с макрогаметами и образуется оокинета — подвижная зигота. Последняя внедряется в стенку желудка комара и под его наружной оболочкой превращается в ооцисту. Период спорогонии. Ооцисты, число которых может достигать 200—500, быстро растут, внутри них происходит многократное деление ядра. Этот процесс заканчивается образованием большого количества спорозоитов. Зрелая ооциста разрывается и спорозоиты с гемолимфой разносятся по телу комара, активно мигрируя в слюнные железы. При укусе здорового человека спорозоиты вводятся в кровь. МАЛЯРИЯ — трансмиссивное заболевание, вызываемое малярийными плазмодиями. После укуса комара инкубационный период в зависимости от вида малярии равен 8—25 дням, но при трехдневной малярии длительность инкубации достигает 8-14 месяцев. Для малярии типичен приступ лихорадки, который наблюдается в момент выхода мерозоитов из разрушенных эритроцитов. Начало болезни острое, обычно утром или днем появляется недомогание, быстро повышается температура, сопровождаясь ознобом. Примерно через 30 мин — 2 час температура достигает 40° С и выше, озноб сменяется сильным жаром. Через несколько часов температура быстро снижается, нередко до 35—36° С. С момента снижения температуры появляется обильный пот, слабость. Приступы повторяются через день при трехдневной или через 2 дня при четырехдневной малярии, при тропической форме приступы нередко повторяются ежедневно. Число приступов без лечения достигает 10—15, затем они прекращаются, хотя паразиты в крови еще могут обнаруживаться в течение некоторого времени, и больной становится паразитоносителем. Правильное чередование приступов при малярии связано с периодичностью шизогонии в эритроцитах. Начало приступа (озноб) совпадает с распадом эритроцитов и поступлением в плазму крови мерозоитов и продуктов их метаболизма. 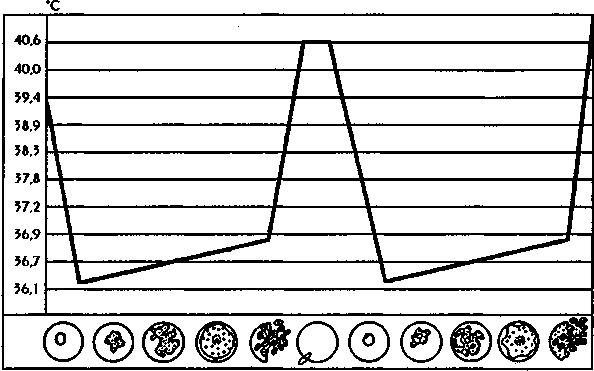 Длительность течения малярии, включая рецидивы и носительство, составляет 2—3 года при трехдневной малярии (P. vivax), 6—12 месяцев - при тропической (P.falciparum), 2—4 года - при овале-малярии (P. ovale). При четырехдневной малярии (P. malariae) больные выздоравливают обычно в течение 2—3 лет, но носительство в отдельных случаях может продолжиться до 50 лет. Описаны рецидивы четырехдневной малярии после травмы или хирургической операции спустя 10—20 лет после первичного заболевания. Малярия falciparum имеет наиболее тяжелое течение и дает до 98% всех летальных исходов от малярии. Существует глобальный ареал малярии, представляющий совокупность ареалов четырех ее форм, вызываемых вышеназванными специфическими возбудителями. Мировым эпицентром малярии является Африка, но заболевание встречается и на других континентах, периодически давая эпиде-мические подъемы. Эпидемиология малярии. В естественных условиях малярия - природно-эндемичная, протозойная, антропонозная, трансмиссивная инфекция. Источником инфекции является больной или паразитоноситель, в крови которого имеются гаметоциты. Более эффективным источником является больной, как правило, с более высокой паразитемией и малой напряженностью иммунитета. Паразитоносители имеют меньшее значение, т. к. имеют более сформированный антипаразитарный иммунитет и циркулирующие в крови антитела блокируют развитие гаметоцитов в организме переносчика. Наиболее эффективным источником инфекции являются дети, которые более доступны для укусов комаров, т. к. поверхность их тела более оголена, и они не используют благовоний, которые отпугивают комаров. Кроме того, отсутствие иммунитета у детей сопровождается более высокой паразитемией. Больной или паразитоноситель заразен для комара в течение всего периода наличия гаметоцитов в его крови. При трехдневной, овале- и четырехдневной малярии гаметоциты появляются с первых дней болезни и исчезают из крови одновременно с шизонтами. При тропической малярии гаметоциты поступают в кровь больного на 7 - 10-й день после начала приступов и остаются в крови достаточно долго - 1,5 - 2 месяца после исчезновения шизонтов, т. е. больные тропической малярией позже становятся источником инфекции, но дольше остаются им после исчезновения клинических симптомов. Возбудители малярии находят хозяев у разных представителей животного мира (обезьян, грызунов и др.), но как зоонозная инфекция малярия встречается крайне редко. Существует три пути заражения малярией: трансмиссивный, парентеральный (шприцевой, постгемотрансфузионный) и вертикальный (трансплацентарный). Главный путь передачи трансмиссивный. Переносчиками малярии человека являются самки комаров рода Anopheles. Самцы питаются нектаром цветов. Основные переносчики в Украине: An. messae, An. maculipennis, An. atroparvus, An. sacharovi, An. superpictus, An. pulcherrimus и др. Жизненный цикл комаров состоит из ряда стадий: яйцо - личинка (I - IV возраста) - куколка - имаго. Оплодотворенные самки нападают на человека вечером или ночью и питаются кровью. У самок, не напитавшихся кровью, яйца не развиваются. Напитавшиеся кровью самки остаются в темных углах жилых или хозяйственных помещений, зарослях растительности до конца переваривания крови и созревания яиц. Чем выше температура воздуха, тем быстрее завершается развитие яиц в организме самки - (гонотрофический цикл): при температуре +30°С - до 2-х суток, при + 15°С - до 7 у P. vivax. Затем они устремляются на водоем, где откладывают яйца. Такие водоемы называют анофелогенными. Созревание водных стадий развития переносчика также зависит от температуры и длится 2-4 недели. При температуре ниже +10°С комары не развиваются. За теплый сезон года может появиться в средних широтах до 3 - 4 поколений комаров, на юге 6 - 8, в тропиках до 10 - 12. На процесс развития плазмодиев малярии в организме комара влияет также температура воздуха и степень адаптированности паразитов к данному виду переносчиков. Для спорогонии требуется температура не ниже +16°С. Спорогония P. vivax при +16°С завершается за 45 суток, при +30°С - за 6,5 суток. Минимальная температура для спорогонии P. falciparum +19 - 20°С, при которой она завершается за 26 суток, при +30°С - за 8 суток. От этого зависит сезон передачи малярии. В тропиках сезон передачи малярии достигает 8-10 месяцев, в странах экваториальной Африки - круглогодичный. В зонах умеренного и субтропического климата сезон передачи малярии ограничен летне-осенними месяцами и длится от 2 до 7 месяцев. В комарах, находящихся на зимовке, спорозоиты погибают, поэтому вылетевшие весной самки не являются носителями малярийных плазмодиев, и в каждый новый сезон заражение комаров происходит от больных малярией. Заражение малярией возможно также при переливании крови, а также при использовании загрязненных кровью игл и шприцов. При хранении крови при +4°С паразиты сохраняются до 2 недель. Возможно внутриутробное заражение плода через плаценту при наличии инфекции у беременной матери, но чаще это происходит во время родов. При этих формах заражения развивается шизонтная малярия, при которой отсутствует фаза тканевой шизогонии. Восприимчивость к малярии всеобщая. Только к P. vivax невосприимчивы представители негроидной расы. Распространение малярии обусловлено географическими, климатическими и социальными факторами. Границами распространения являются 60 - 64° северной широты и 30° южной широты. Однако видовой ареал малярии неравномерен. Самый широкий ареал имеет P. vivax - возбудитель трехдневной малярии, распространение которого определяется пределами географических границ. Ареал тропической малярии меньше, т. к. для развития P. falciparum требуется более высокая температура. Он ограничен 45° - 50° с. ш. и 20° ю. ш. Мировым очагом тропической малярии является Африка. Второе место по распространению в Африке занимает четырехдневная малярия, ареал которой достигает 53° с. ш. и 29° ю. ш. и которая имеет очаговый, гнездный характер. P. ovale встречается преимущественно в странах Западной и Центральной Африки и на некоторых островах Океании (Новая Гвинея, Филиппины, Таиланд и др.). В Украине малярия практически ликвидирована и регистрируется главным образом завозная малярия и единичные случаи местного заражения - вторичные от завозных. Завозят малярию на территорию Украины из тропических стран и из ближнего зарубежья - Азербайджана и Таджикистана, где существуют остаточные очаги. Наибольшую часть завозных случаев составляет трехдневная малярия, которая наиболее опасна в связи с возможной передачей комарами, чувствительными к этому виду возбудителя. На втором месте стоит завоз тропической малярии, наиболее тяжелой клинически, но менее опасной эпидемиологически, так как комары Украины к P. falciparum, завозимым из Африки, не чувствительны. Регистрируются случаи завоза с неустановленной причиной заражения - «аэропортная», «багажная», «случайная», «трансфузионная» малярии. Лабораторная диагностика основана на микроскопическом изучении мазков крови и обнаружении эритроцитарных форм развития паразитов. Используются также серологические реакции для выявления специфических антител.Диагностика малярии базируется на анализе клинических проявлений болезни, данных эпидемиологического и географического анамнеза и подтверждается результатами лабораторного исследования крови, Окончательный диагноз видовой формы малярийной инфекции основан на результатах лабораторного исследования крови.  Рис. Плазмодии тропической малярии в эритроцитах и гаметоцит.  Рис.VIII. Plasmodiumfalciparum (1) в эритроцитах (стадия кольца). 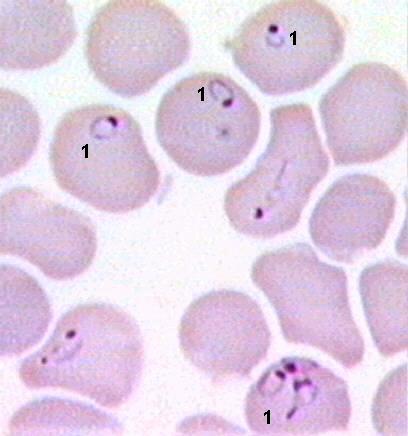 Для лабораторной диагностики применяют паразитологический и иммунологический методы исследования. Паразитологический метод - гемоскопия тонкого мазка и толстой капли крови является ведущим. Диагноз подтверждается при обнаружении в крови любых эритроцитарных стадий плазмодиев. Надежность паразитологической диагностики зависит от уровня профессиональной подготовки лаборанта и качественного выполнения методики исследования. Вероятность обнаружения плазмодиев в толстой капле в 20 - 40 раз выше, чем в тонком мазке, однако для определения вида возбудителя надо исследовать мазок. Кровь нужно брать независимо от подъема температуры, т. к. паразиты циркулируют в крови и в интервалах между приступами и при отсутствии клинических проявлений болезни у паразитоносителей. При режиме исследований, рекомендуемом ВОЗ для массовых обследований, необходимо тщательно просмотреть 100 полей зрения в толстой капле. Исследование двух толстых капель в течение 2,5 мин. на каждую более эффективно, чем исследование одной толстой капли в течение 5 мин. При выявлении плазмодиев малярии в первых же полях зрения просмотр препаратов не прекращают до тех пор, пока не будут просмотрены 100 полей зрения, чтобы не пропустить возможную микст-инфекцию. От концентрации паразитов в крови зависит вероятность их обнаружения. Минимальная концентрация паразитов, которая может быть выявлена при исследовании толстой капли, называется порогом обнаружения. При режиме, рекомендуемом ВОЗ для массовых обследований (просмотр 100 полей зрения толстой капли или 0,2 мкл крови), порог обнаружения составляет 5 паразитов в 1 мкл. Паразитемия выше порога обнаружения носит название патентной, а ниже его - субпатентной. При выявлении у больного косвенных признаков малярийной инфекции (пребывание в малярийной зоне, гипохромная анемия, наличие пигментофагов в крови - моноцитов с глыбками малярийного пигмента почти черного цвета в цитоплазме) надо исследовать толстую каплю более тщательно и не две, а серию - 4 - 6 при одном уколе. Кроме того, при отрицательном результате в подозрительных случаях рекомендуется забор крови проводить многократно (4-6 раз в сутки) в течение 2-3 дней. В лабораторном ответе указывают латинское название возбудителя, родовое название Plasmodium сокращается до «Р», видовое не сокращается, а также стадии развития возбудителя (обязательно при обнаружении P. falciparum). Для контроля эффективности лечения и выявления возможной резистентности возбудителя к применяемым противомалярийным препаратам проводят подсчет численности плазмодиев. Через сутки после начала лечения уровень паразитемии должен снизиться на 25% и более. На 3-й день от начала лечения уровень паразитемии не должен превышать 25% исходного до начала лечения. Наличие паразитов в препаратах крови на 4-й день после начала лечения служит показателем резистентности возбудителя к применяемому препарату. По рекомендации ВОЗ, для определения численности (степени паразитемии) можно руководствоваться впечатлением от просмотра, если: при 5-минутном просмотре толстой капли можно обнаружить не более 10 плазмодиев, это ориентировочно соответствует от 5 до 50 плазмодиев в 1 мкл; паразитов немного, но они попадаются в первых же полях зрения - 50 - 500 в 1 мкл; паразиты есть почти в каждом поле зрения, часто по несколько штук - 500 - 5000 в 1 мкл; паразитов много, все поле усеяно ими - более 5000 в 1 мкл. Существует и более точный метод подсчета, основанный на сравнении числа паразитов с числом форменных элементов крови - лейкоцитов или эритроцитов. Обнаружение в периферической крови зрелых трофозоитов и шизонтов - морул при тропической малярии свидетельствует о злокачественном течении болезни, о чем лаборатория должна срочно сообщить лечащему врачу. У жителей эндемичных районов, обладающих частичным иммунитетом, бывает низкая паразитемия, что приводит к необходимости исследования серии толстых капель и повторения анализов крови. Затрудняют диагностику также изменения морфологии паразитов, что может быть следствием приема химиопрепаратов, а также результатом нарушений методики приготовления и окраски. Иммунологические методы диагностики малярии основаны на обнаружении: в сыворотке крови обследуемого антител; растворимых паразитарных антигенов. В практике нашли большее применение первые. Чаще других тест-систем применяется непрямая реакция иммунофлуоресценции (НРИФ). В качестве антигена для диагностики трехдневной и четырехдневной малярии служат мазки и капли крови с большим количеством шизонтов. Для диагностики тропической малярии антиген готовится из культуры P. falciparum in vitro, поскольку у большинства больных в периферической крови шизонты отсутствуют. Новые методы диагностики малярии разработаны на основе люминесцирующих иммуноферментных сывороток, а также с применением моноклональных антител. ПРОФИЛАКТИКА. Борьба с малярией состоит в выявлении, изоляции и лечении больных, которые являются источником заражения комаров. Уничтожение комаров на всех стадиях развития. Применение реппелентов для отпугивания комаров. Toxoplasmagondii (Токсоплазма) — простейший облигатный внутриклеточный паразит, способный существовать во всех типах ядерных клеток человека и теплокровных животных (млекопитающих, птиц). Вызывает заболевание - токсоплазмоз. К классу споровиков относят также токсоплазму (Toxoplasmagondii) -возбудитель токсоплазмоза. Токсоплазмоз - облигатный внутриклеточный паразит (рис. 333) 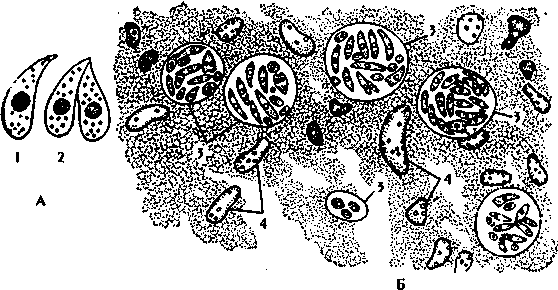 Рис. 333. Токсоплазма (Toxoplasmagondii). A- отдельные особи токсоплазмы. Б - токсоплазмы в вакуолях в мозге крысы: 1 - покоящаяся форма, 2 - токсоплазма в момент почти полного разделения, 3 - многочисленные токсоплазмы в вакуолях мозга, 4 - ядра клеток мозга. Этот вид токсоплазмы был впервые описан в 1908 г. у грызунов гонди французскими учеными Николем и Мансо. Паразитирование токсоплазмы распространено повсеместно у многих видов млекопитающих и птиц. В 1970 г. удалось полностью расшифровать цикл развития токсоплазмы, который проходит в организме двух хозяев. Окончательными хозяевами могут быть домашние кошки и другие представители семейства кошачьих. В их организме проходит кишечная фаза развития. Промежуточными хозяевами могут быть человек, многие виды млекопитающих, в том числе кошки и птицы. В организме промежуточных хозяев проходит внекишечная фаза развития. Полный цикл может осуществляться только в организме кошачьих (рис. 334, 335). 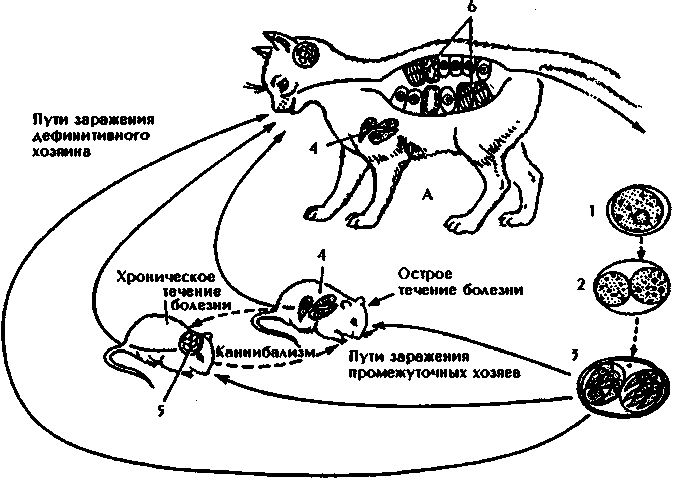 Рис. 334. Жизненный цикл и пути заражения хозяина Toxoplasmagondii(по Френкелю). А -дефинитивный хозяин - кошка. Б - промежуточные хозяева - грызуны: 1 - 3 спорогония во внешней среде, 4 - трофозоиты во внутренних органах, 5 - цисты, 6 - шизогония и гаметогония в клетках кишечного эпителия. В жизненном цикле токсоплазмы выделяют вегетативную стадию (мерозоиты) и цисты (рис. VII Пр). Трофозоит имеет форму полумесяца с заостренным концом. Его размеры 4—6 мкм на 2—4 мкм. По данным электронной микроскопии клетка покрыта оболочкой, имеющей поры. Под оболочкой находится система микротрубочек, которые выполняют опорную и двигательную функцию. Ядро занимает центральное положение. На заостренном конце клетки расположен коноид, в виде спирального цилиндра. Коноид выполняет перфоративную и опорную функцию, способствуя внедрению паразита в клетки хозяина (рис. 11 и VI Пр). В 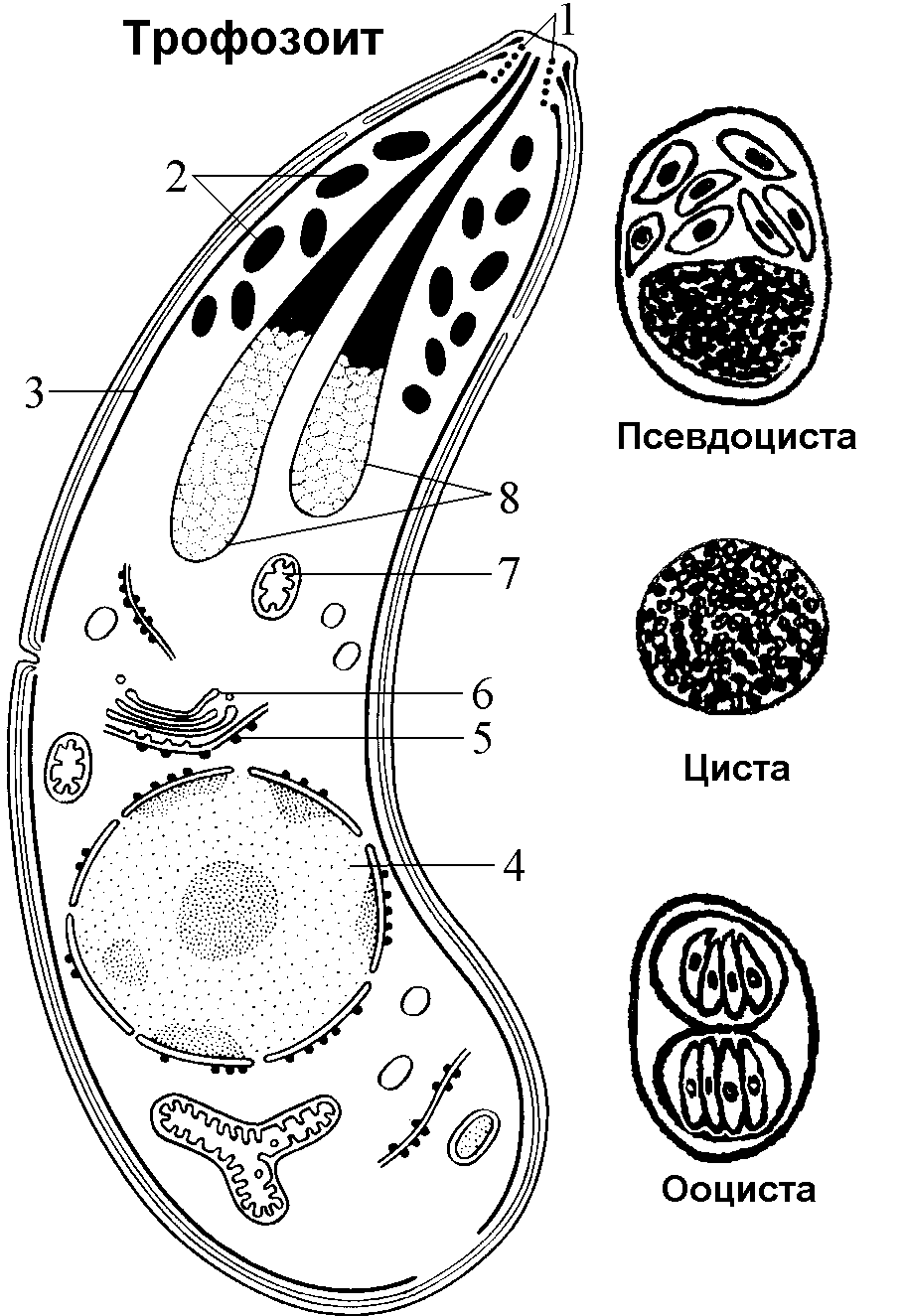 случае инвазирования человека мерозоиты попадают в кровь, внедряются в лейкоциты и проникают в различные ткани. Размножаясь внутриклеточно, путем деления надвое, мерозоиты образуют скопления, называемые псевдоцнстами. Последние не имеют специальной оболочки, ее роль выполняет цитолемма клетки хозяина. В дальнейшем паразиты могут образовывать крупные скопления, до нескольких сот особей. Такие конгломераты покрываются толстой оболочкой, в результате чего формируются истинные цисты. Они высоко устойчивы к действию лекарственных препаратов и способны длительно сохраняться в иммунологически мало активных тканях, какими являются нервная и мышечная ткани. случае инвазирования человека мерозоиты попадают в кровь, внедряются в лейкоциты и проникают в различные ткани. Размножаясь внутриклеточно, путем деления надвое, мерозоиты образуют скопления, называемые псевдоцнстами. Последние не имеют специальной оболочки, ее роль выполняет цитолемма клетки хозяина. В дальнейшем паразиты могут образовывать крупные скопления, до нескольких сот особей. Такие конгломераты покрываются толстой оболочкой, в результате чего формируются истинные цисты. Они высоко устойчивы к действию лекарственных препаратов и способны длительно сохраняться в иммунологически мало активных тканях, какими являются нервная и мышечная ткани.  Рис. 11. Toxoplasma gondii: 1 – коноид,2 – микронемы, 3 – микротрубочки, 4 – ядро, 5 – ЭПС, 6 – комплекс Гольджи, 7 – митохондрии, 8 - роптрии Вегетативные стадии, а также цисты инвазионны. Человек, являясь для токсоплазмы промежуточным хозяином, заражается пищевым путем или через кожу при обработке туш больных животных. Окончательные хозяева — представители семейства кошачьих, в частности кошка, животное тесно связанное с человеком. При попадании паразитов в организм кошки пищевым путем они инвазируют клетки эпителия кишок. Здесь вначале происходит шизогония, и образуются мерозоиты. Затем часть мерозоитов дает начало макрогаметоцитам и подвижным микрогаметоцитам, имеющим три жгутика. В результате оплодотворения образуется подвижная зигота, называемая ооцистой. Ооцисты с фекалиями выделяются во внешнюю среду, где дозревают и представляют опасность как возможный источник заражения токсоплазмозом. Паразит распространен повсеместно. 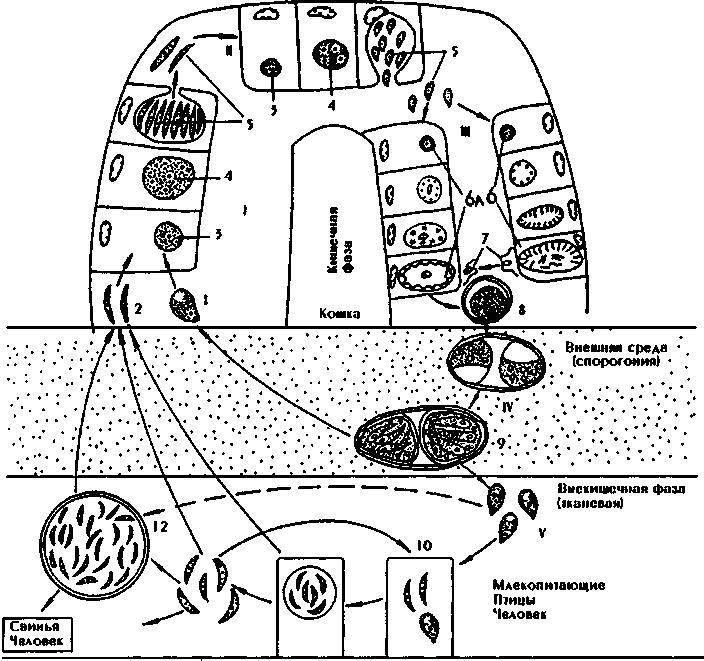 Рис. 335. Жизненный цикл возбудителя токсоплазмоза. I- первое поколение шизогонии в клетках кишечника основного хозяина. II - второе поколение шизогонии. III - гематогония. IV -спорогония. V - внекишечная (тканевая) фаза (эндодиогения и эндополигения) в организме промежуточных хозяев. 1 - спорозоиты, 2 - эндозоиты и цистозоиты, 3 - молодой шизонт, 4 -растущий шизонт с множеством ядер, 5 - шизонт, распавшийся на мерозиты, 6 - развитие микрогамет, 6а - развитие макрогамет, 7 - микрогаметы, 8 - незрелая ооциста, 9 - зрелая ооциста с двумя спороцистами, в каждой из которых по 4 спорозоита, 10 - эндозоиты, 11 - псевдоциста (эндозоиты в паразитифорной вакуоли), 12 - истинная тканевая циста с тысячами цистозоитов. Пути проникновения токсоплазм в организм человека: 1. Через рот с проуктами животного происхождения (недостаточно проваренное мясо, сырые молочные продукты, яйца), руками, загрязненными в период контакта с животными (кошкой). 2. Перкутанный – через поврежденную кожу и слизистые оболочки (у работников мясокомбинатов), при проведении лабораторных и клинических исследований (у акушеров, врачей-лаборантов). Внутриутробное заражение плода человека через плаценту (трансплацентарно). Самый опасный период – 8-9 месячная беременность. 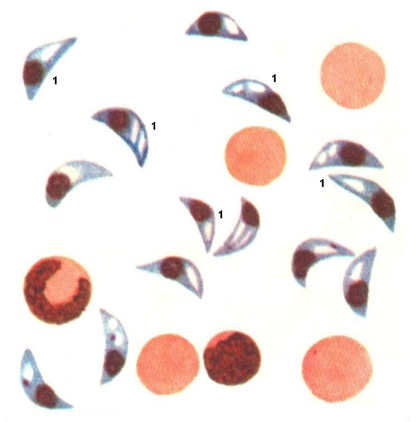 Б Б  Рис. VI. Toxoplasmagondii: А – в мазке крови (1), Б – трофозоит (сканирующая электронная микроскопия). ТОКСОПЛАЗМОЗ характеризуется хроническим течением, поражением нервной системы, лимфаденитами, увеличением печени и селезенки, частым поражением скелетных мышц, миокарда и глаз. |
