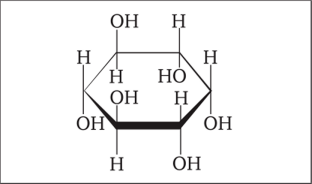
Моносахариды
 Скачать 3.73 Mb. Скачать 3.73 Mb.
|
1.По строениюПо химическому строению молекул все белки подразделяют на простые и сложные. Простые белки (протеины) состоят только из аминокислот. Сложные белки (протеиды) состоят из глобулярных белков и небелкового компонента. Небелковая часть сложного белка называется простетической группой. Простетическая группа может быть представлена различными по химической природе соединениями. В зависимости от ее строения и свойств сложные белки подразделяются: хромопротеины – содержат в качестве небелковой части окрашенный компонент (гемоглобин, миоглобин, цитохромы, хлорофилл); гликопротеины – содержат углеводы; нуклеопротеины – содержат нуклеиновые кислоты; липопротеины – содержат липиды; фосфопротеины – содержат остаток ортофосфорной кислоты; металлопротеины – содержат комплексно связанный металл. 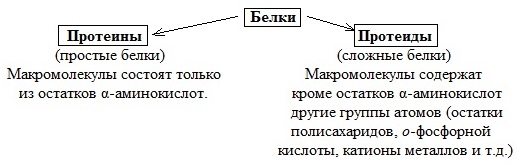 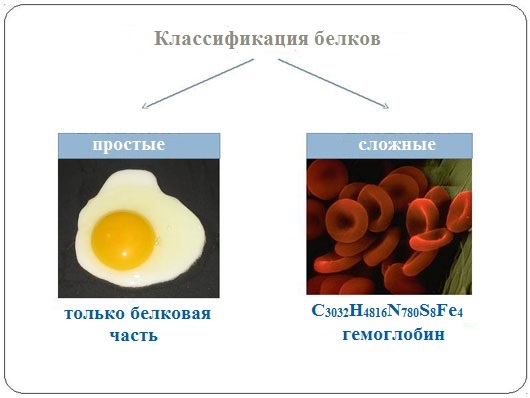 Простые белкиК простым белкам относят альбумины, глобулины, протамины, гистоны, проламины, глютелины, протеиноиды. Альбумины и глобулины белки, которые есть во всех тканях. Сыворотка крови наиболее богата этими белками. На долю альбуминов приходится более половины белков плазмы крови. Альбумины Альбумины – составляют основную часть белков животных и растительных тканей. Альбумины – это глобулярные белки. Альбумины – белки относительно небольшой молекулярной массы 25000-70000, они имеют выраженный кислый характер, так как содержат большое количество аспарагиновой и глутаминовой кислот. Они растворяются в чистой воде и разбавленных растворах кислот, щелочей и солей. Из водных растворов альбумины осаждаются сернокислым аммонием только при полном насыщении раствора, т.к. это сильно гидратированые белки. При кипячении свертываются и выпадают в осадок в виде густых хлопьев денатурированного белка. Образование пенки на молоке, загустение содержимого яиц при варке объясняется денатурацией альбуминов. Пена, образующаяся при варке плодов и овощей, частично состоит из свернувшихся растительных альбуминов. Альбумины – белки преимущественно животного происхождения. К ним относятся альбумины сыворотки крови, лактальбумин молока, овальбумин яичного белка, миоальбумин мышц животных, а также лейкозин пшеницы, ржи и ячменя, легуменин гречихи и сои, рицин касторовых бобов. Альбумины выполняют в организме питательную, транспортную, обезвреживающую функции. Характерным свойством альбуминов является их высокая адсорбционная способность. Они адсорбируют полярные и неполярные молекулы, выполняя транспортную роль. Они транспортируют гормоны, холестерол, билирубин, лекарственные вещества, ионы кальция. Альбумины связывают токсичные соединения – алкалоиды, тяжелые металлы, билирубин. Благодаря высокой гидрофильности, небольшим размерам молекул, значительной концентрации альбумины играют важную роль в поддержании осмотического давления крови. Альбумины обеспечивают на 80% осмотическое давление крови от всех других сывороточных белков. Альбумины синтезируются преимущественно в печени и быстро обновляются. Глобулины Глобулины – широко распространённая группа глобулярных белков, обычно сопутствующая альбуминам. Глобулины имеют более высокую молекулярную массу, чем альбумины. Глобулины слабокислые или нейтральные белки. Глобулины растворимы в слабых солевых растворах, не растворимы в дистиллированной воде и выпадают в осадок при 50% и более насыщении растворов сернокислым аммонием, при нагревании свертываются. К глобулинам относятся сывороточный, молочный, яичный, мышечный и другие глобулины. Глобулинов много в пищевых продуктах. В горохе содержится белок легумин, в сое – глиципин, в семенах фасоли - фазеолин, в картофеле - туберин, в крови - фибриноген, в молоке - лактоглобулин, в яйцах - яичный глобулин, в конопле – эдестин. Глобулины в организме выполняют питательную, защитную, транспортную функции. В крови глобулины транспортируют холестерин, фосфолипиды, триглицериды, ионы железа (Fe2+), меди (Cu2+), витамин В12. В молоке лактоглобулины и лактальбумины также выполняют транспортную функцию. Глобулины вырабатываются печенью и иммунной системой. Протамины Протамины – низкомолекулярные положительно заряженные ядерные белки с резко выраженными основными свойствами (щелочные белки), с низкой молекулярной массой – 4000–12000, содержат 60-85% аргинина. Протамины являются составной частью многих важных сложных белков (нуклеопротеидов), входящих в состав клеточных ядер. В ядрах клеток они находятся в комплексе с ДНК. Протамины хорошо растворяются в воде, кислой и нейтральной среде и осаждаются в щелочных средах, не осаждаются при кипячении. Протамины обнаружены в ядрах сперматозоидов у рыб. Составляют фракцию основного белка в зрелой сперме рыб. Протамины содержатся в сперме некоторых видов рыб (сальмин – семга, клупеин – сельдь), скумбрин – скумбрия. Выполняют главным образом структурную функцию, поэтому и присутствуют в клетках не способных к делению. Гистоны Гистоны представляют собой низкомолекулярные (11000–22000) белки с третичной структурой, обладают выраженными основными (щелочными) свойствами, т.к. содержат большое количество аргинина и лизина. Гистоны содержатся в ядрах клеток высших организмов в соединении с нуклеиновыми кислотами, образуя нуклеопротеиды. Гистоны играют важную роль в регуляции генной активности. Это белки хромосом, они входят в структуру хроматина. В клетках положительно заряженные гистоны связаны с отрицательно заряженными ДНК в составе хроматина. Гистоны в хроматине формируют остов, на который накручивается молекула ДНК. Это очень стабильные белки, молекулы которых могут сохраняться в течение всей жизни клетки. Гистоны находятся в виде нуклеопротеидов в лейкоцитах и красных кровяных шариках (гемоглобин). Гистоны по своим свойствам близки к протаминам, растворимы в воде и разбавленных кислотах, нерастворимы в водном аммиаке и не свертываются при нагревании. Молекулы гистонов полярны, очень гидрофильны, поэтому они с трудом высаливаются из растворов. Основные функции гистонов – структурная и регуляторная. Структурная – гистоны участвуют в стабилизации пространственной структуры ДНК, а следовательно хроматина, хромосом и нуклеосом. Регуляторная – заключается в способности блокировать передачу генетической информации от ДНК к РНК. Проламины Проламины – белки растительного происхождения, содержатся в клейковине семян злаковых растений, где выполняют роль запасных белков. В их состав входит большое количество глутаминовой кислоты и пролина (отсюда название проламин). Проламины почти не содержат глицина и лизина, что делает невысокой их пищевую ценность. Характерной особенностью проламинов является то, что они не растворимы в воде, солевых растворах, щелочах, хорошо растворимы в 60-80% растворе этилового спирта (это связано с наличием большого количества неполярной аминокислоты пролина), в то время как все другие белки денатурируют и выпадают в осадок. К ним относятся глиадин (белок пшеницы, ржи), гордеин (белок ячменя), зеин (белок кукурузы), авенин (белокян овса), эдестин (белок конопли). Проламины практически отсутствуют в бобовых и масличных культурах. Глютелины Глютелины – белки растительного происхождения, характеризующиеся высоким содержанием аминокислот пролина и глутаминовой кислоты. Глютелины играют важную роль в питании человека, т. к. их питательная ценность высока. Они присутствуют в семенах злаковых культур вместе с проламинами. Глютелины занимают промежуточное положение между проламинами и глобулинами. Глютелины растворяются в разбавленных кислотах и щелочах, не растворяются в воде, спирте и разбавленных солевых растворах. Представителями данного класса простых белков является оризенин (белок риса), глютелин (белок кукурузы) и глютенин (белок пшеницы). У риса 80% всего белка приходится на глютелины (оризенин), этим можно объяснить высокое содержание лизина в белке рисового зерна. Эти белки в ржаной муке не образуют клейковины, что обусловлено качественным различием белков ржи и пшеницы. Протеиноиды Протеиноиды – фибриллярные белки, их молекулы образуют многомолекулярные нитевидные комплексы – фибриллы. Протеиноиды – белки животного происхождения, богаты глицином, пролином, цистином. Они могут иметь третичную и четвертичную структуры. Протеиноиды – белки опорных тканей (костей, хрящей, сухожилий, связок). Они представлены коллагеном, эластином и кератином. Протеиноиды не растворяются в воде, солевых растворах, разведенных кислотах и щелочах. Не перевариваются в желудочно-кишечном тракте большинства животных и человека и поэтому не могут выполнять питательную функцию. Однако, некоторые членистоногие приспособились к питанию фибриллярными белками кожи, перьев птиц, шерсти (например, моль). К протеиноидам относятся коллаген – основной белок кожи, костей и хрящей, эластин – белок сухожилий и соединительной ткани, кератин – белок волос, шерсти, копыт, рогов и фиброин шелка. Коллаген Коллаген – основной белок соединительной ткани животных и человека, состоящий из трех белковых нитей, закрученных в спираль. Коллаген защищает ткани от механических воздействий, поддерживая прочность кожного покрова. Коллаген – широко распространённый в организме белок, составляет около трети всех белков организма. Более 80% всего коллагена организма находится в межклеточном веществе соединительной ткани кожи, костей, связок, сухожилий, хрящей. Эти ткани обладают малой растяжимостью и высокой прочностью.  К особенностям аминокислотного состава коллагена относится, прежде всего, высокое содержание глицина, пролина. Полипептидные цепи коллагена содержит около 1000 аминокислот. 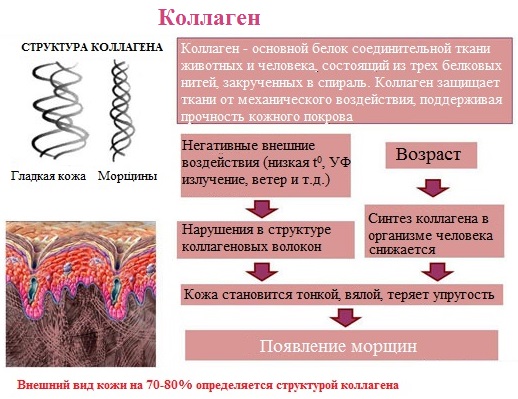 Коллаген, долго нагреваемый в воде при 56-1000С, переходит в растворимый клей, или глютин (желатин), который охлаждаясь, застывает и образует студень. На этом свойстве желатина основано приготовление заливных блюд. Эластин Эластин – основной белок эластических волокон, которые в больших количествах содержатся в межклеточном веществе таких тканей, как кожа, стенки кровеносных сосудов, связки, лёгкие. Эти ткани обладают очень важными свойствами: они могут растягиваться в несколько раз по сравнению с исходной длиной, сохраняя при этом высокую прочность на разрыв, и возвращаться в первоначальное состояние после снятия нагрузки. Эластичность связана с присутствием в эластине большого количества межцепочечных сшивок при участии аминокислоты лизина. 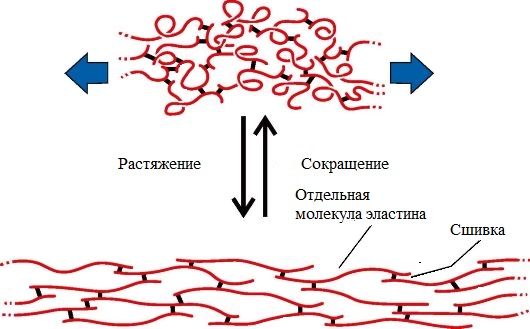 Эластин не растворим в воде, не способен к набуханию. В составе эластина содержится много гидрофобных аминокислот — глицина, валина, аланина, лейцина, пролина. 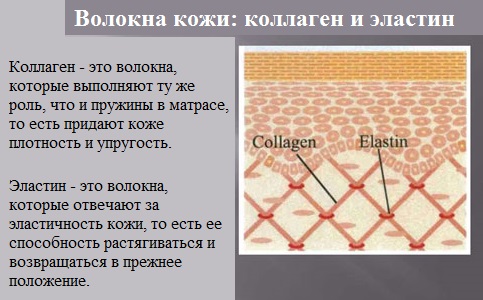 Кератин Кератины — семейство фибриллярных белков, обладающих механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину. Волосы (шерсть), ногти, перья, иглы, когти, рога и копыта животных состоят главным образом из кератина. Кератины могут иметь α-структуру и β-структуру. α-Кератин - структурный белок, построенный преимущественно в виде α-спирали. В α-кератинах три α-спирали объединяются в суперспираль. Молекулы α-кератина ориентированы параллельно и соединены дисульфидными связями (содержат много цистеина), что придает прочность структуре. 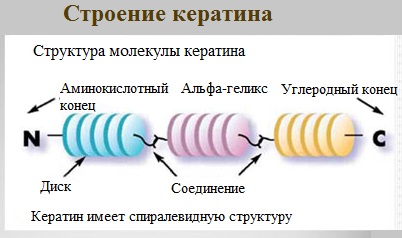 Примером β-кератинов является фиброин шелка. Кератины не растворимы в растворах солей, кислот, щелочей. Их молекулярная масса очень высока. Фиброин шелка Фиброин шелка – фибриллярный белок, выделяемый паукообразными и некоторыми насекомыми и составляющий основу нитей паутины и коконов насекомых, в частности, шёлка тутового шелкопряда. Его β-структура состоит из антипараллельных полипептидных цепей, связанных между собой водородными связями. Фиброин состоит в основном из глицина, аланина, серина, тирозина. 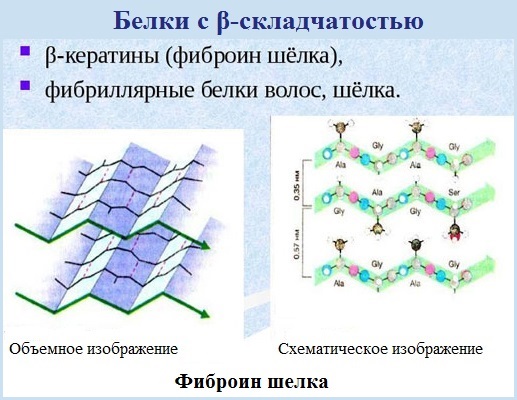 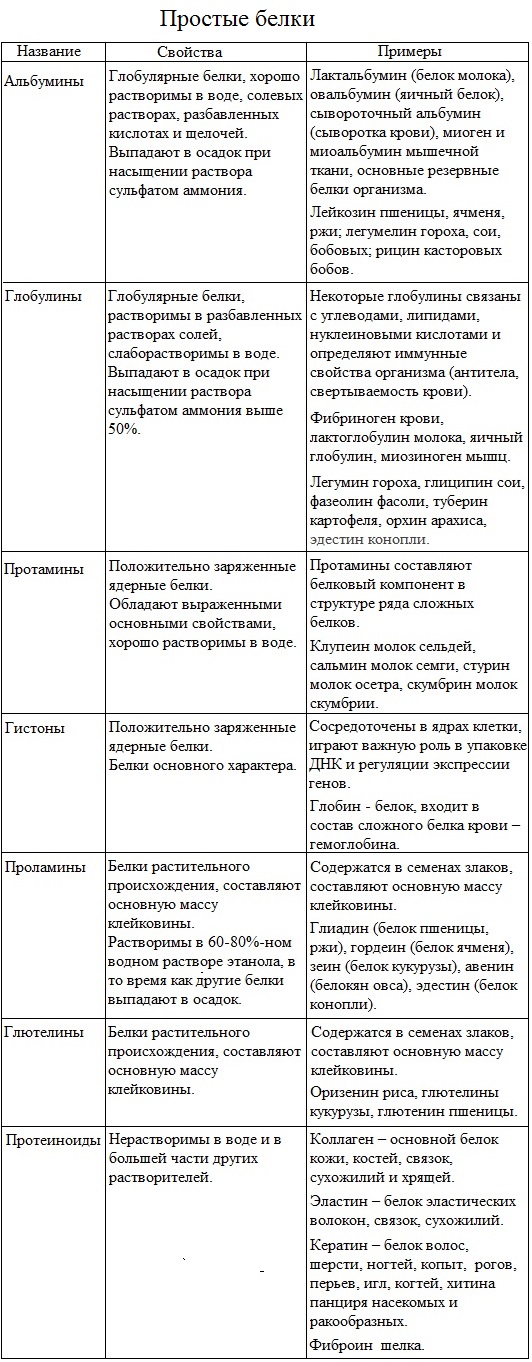 Сложные белкиФосфопротеины Фосфопротеины – это сложные белки, простетической группой которых является остаток фосфорной кислоты. Она связывается с пептидной цепью через остатки тирозина, серина и треонина, т.е. тех аминокислот, которые содержат ОН-группу. 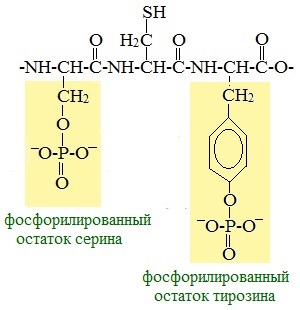 К белкам этого класса относятся: казеин молока, в котором содержание фосфорной кислоты достигает 1%; вителлин, вителлинин и фосвитин, выделенные из желтка куриного яйца; овальбумин, открытый в белке куриного яйца; ихтулин, обнаруженный в икре рыб и, который играет немаловажную роль в развитии эмбриона рыб. Биологическая роль фосфопротеинов заключается в том, что они являются питательными веществами необходимыми для растущих организмов. Фосфопротеины – это ценный источник энергетического и пластического материала для развития зародыша и дальнейшего роста и развития организма. Например, казеин (казеиноген) молока содержит все незаменимые аминокислоты и фосфорную кислоту. В его состав также входят ионы кальция. Фосфор и кальций необходимы растущему организму в больших количествах для формирования скелета. Гликопротеины Гликопротеины (гликоконъюгаты) – это сложные белки, которые содержат в качестве простетической группы углеводный компонент. У некоторых гликопротеидов углеводная часть непрочно связана с белком и может легко от него отделяться. Простетические группы некоторых гликопротеидов могут встречаться в тканях и в свободном состоянии. Гликопротеины широко распространены в природе. Они встречаются в секретах (слюне и т.д.), в составе клеточных мембран, клеточных стенок, межклеточного вещества, соединительной ткани. Многие ферменты и транспортные белки являются гликопротеинами. Гликопротеины разделяют на истинные гликопротеины и протеогликаны. Истинные гликопротеины Углеводная часть гликопротеинов представлена небольшими гетерополисахаридами или олигосахаридами нерегулярного строения и содержит маннозу, галактозу, глюкозу, и их аминопроизводные. Белок в них составляет 80-85% массы макромолекулы. Для гликопротеинов характерна ковалентная гликозидная связь. N-гликозидная связь возникает между углеводным компонентом и амидной группой аспарагина в белках. Например, в иммуноглобулинах, ферментах и гормонах). О-гликозидная связь – моносахарид связан с ОН-группой серина или треонина (в муцинах), а иногда с ОН-группой гидроксилизина или гидроксипролина (коллагены). 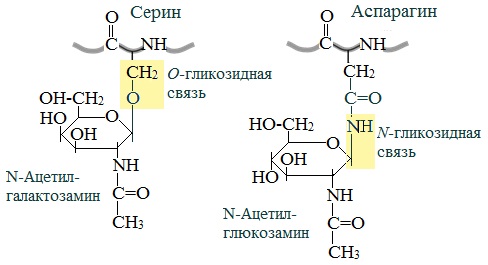 К типичным гликопротеинам относят большинство белковых гормонов, секретируемые в жидкие среды организма вещества, мембранные сложные белки, все антитела (иммуноглобулины), белки плазмы крови, молока, интерфероны, группы крови. Функциии гликопротеинов Структурная – коллаген, эластин. Защитная – антитела (иммуноглобулины), интерферон, факторы свертывания крови (протромбин, фибриноген). Рецепторная – присоединение эффектора приводит к изменению конформации белка-рецептора, что вызывает внутриклеточный ответ. Гормональная – гонадотропный, адренокортикотропный и тиреотропный гормоны. Ферментативная – ферменты: холинэстераза, нуклеаза. Транспортная – перенос веществ в крови и через мембраны (трансферрин, транскортин, альбумин, Na+,К+-АТФаза). Протеогликаны Особую группу гликопротеинов составляют протеогликаны, в составе которых углеводный компонент преобладает и на его долю приходится от 90% и выше. Более того, эти вещества по своим свойствам более сходны с полисахаридами, чем с белками. Простетическая группа протеогликанов представлена гетерополисахаридами, имеющими регулярное строение. Углеводная часть, аналогично с гликопротеинами, связывается с белком через остатки серина и аспарагина. Углеводные фрагменты усиливают гидрофильные свойства белка за счёт большого количества ОН-групп и кислотных группировок. Цепи последних недостаточно гибкие и стремятся принять конформацию очень рыхлого случайного клубка, занимая огромный объём. Будучи гидрофильными, они притягивают много воды и даже в низких концентрациях образуют гидратированные гели. Подобная способность создаёт во внеклеточном пространстве – тургор. Протеогликаны образуют основное вещество межклеточного матрикса (межклеточного пространства). Протеогликаны хрящевого матрикса содержат гиалуроновую кислоту, образующую студенистый гель, выполняющий роль амортизатора в хрящах и суставных поверхностях. 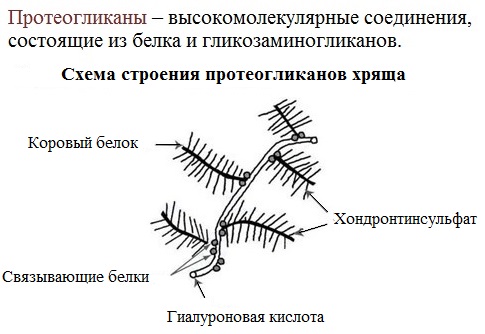 По функции протеогликаны значимы для межклеточного пространства, особенно соединительной ткани, в которое погружены коллагеновые волокна. Они имеют древовидную структуру, в центре находится гиалуроновая кислота. Т.к. их молекулы гидрофильны, они создают сетчатый желеподобный матрикс и заполняют пространство между клетками, являясь преградой для крупных молекул и микроорганизмов. 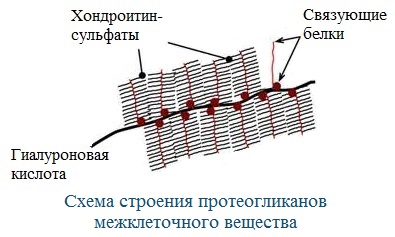 В межклеточном матриксе присутствуют разные протеогликаны. Среди них есть очень крупные – например агрекан и ворсикан. В межклеточном пространстве имеется также целый набор так называемых малых протеогликанов, которые широко распространены в разных видах соединительной ткани и выполняют там разнообразные функции.  По соотношению белковой и углеводной частей гликопротеины подразделяются на нейтральные и кислые. К нейтральным гликопротеинам относятся яичный белок (овальбумин), гликопротеины плазмы крови, белок щитовидной железы (тиреоглобулин). К кислым гликопротеинам относятся – муцины и мукоиды. Муцины являются основой слизей организма (слюны, желудочного и кишечного сока). Выполняют защитную функцию — предохраняют стенки пищеварительного тракта от механических, химических повреждений. Муцины устойчивы к действию ферментов, которые гидролизуют белок. Мукоиды – это белки синовиальной жидкости суставов, хрящей, жидкости глазного яблока. Выполняют защитную функцию, являются смазочным материалом в аппарате движения. В состав кислых гликопротеинов входит уроновая кислота, которая принимает участие в обезвреживании билирубина и лекарственных средств. Нуклеопротеины Нуклеопротеины (ДНП и РНП) – это сложные белки, простетической группой которых являются нуклеиновые кислоты (РНК и ДНК). В природе обнаружено 2 типа нуклеопротеинов – дезоксирибонуклеопротеины (ДНП) – комплексы белков с дезоксирибонуклеиновой кислотой (ДНК) и рибонуклеопротеиды (РНП) – комплексы белков с рибонуклеиновой кислотой (РНК). ДНП преимущественно локализованы в ядре, митохондриях, а РНП – в цитоплазме, а в ядре (ядрышке) обнаружены также высокомолекулярные РНП. Выделяют два вида нуклеиновых кислот в зависимости от пентозы, входящей в их состав – рибонуклеиновая кислота (РНК), если в ее состав входит рибоза и дезоксирибонуклеиновая кислота (ДНК), если в ее состав входит дезоксирибоза. Отличия между РНК и ДНК количество цепей: в РНК одна цепь, в ДНК две цепи; размеры: ДНК намного крупнее; локализация в клетке: ДНК находится в ядре, почти все РНК – вне ядра; вид моносахарида: в ДНК – дезоксирибоза, в РНК – рибоза; азотистые основания: в ДНК имеется тимин, в РНК – урацил; функция: ДНК отвечает за хранение наследственной информации, РНК – за ее реализацию. 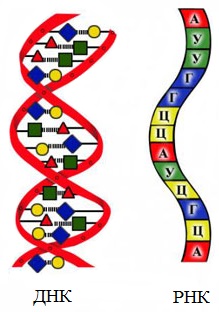 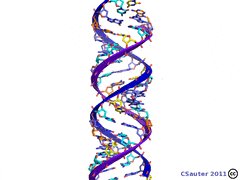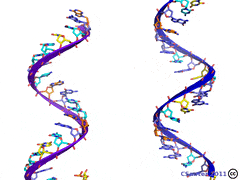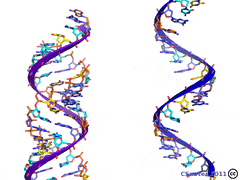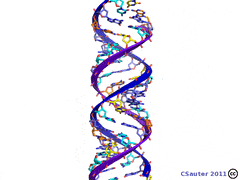 ДНК преимущественно сосредоточена в ядре клеток в составе хромосом, митохондриях и хлоропластах. Функции ДНК Хранение, воспроизводство и передача по наследству генетического материала, экспрессия генов. Различают три главных вида РНК: матричная (информационная) – мРНК (иРНК) содержится в ядре и цитоплазме. транспортная – тРНК в основном содержится в цитоплазме клетки. рибосомная – рРНК составляет существенную часть рибосомы. Функции РНК мРНК (иРНК) – считывает информацию с участка ДНК о первичной структуре белка и несет эту информацию к рибосомам (несет информацию из ядра в цитоплазму). тРНК – транспортирует аминокислоты к месту синтеза белка (из цитоплазмы к рибосомам). рРНК – входит в состав рибосом (из нее построен каркас рибосом), участвует в синтезе белковой (полипептидной) цепи. РНК в некоторых вирусах является носителем генетической информации вместо ДНК. Видеофильм «Нуклеиновые кислоты в биосинтезе белка» Липопротеины Липопротеины –сложные белки, простетическая группа которых представлена каким-либо липидом. Липиды играют важную роль в организме человека. Они содержатся во всех клетках и тканях и участвуют во многих обменных процессах. Они составляют структурную основу всех биологических мембран, в свободном состоянии присутствуют в основном в плазме крови и лимфе. Липопротеины плазмы, сыворотки крови растворимы в воде. Липопротеины мембранных стенок клеток, нервных волокон нерастворимы в воде. В состав липопротеинов могут одновременно входить свободные триглицериды, жирные кислоты, нейтральные жиры, фосфолипиды и холестерин (холестерол). 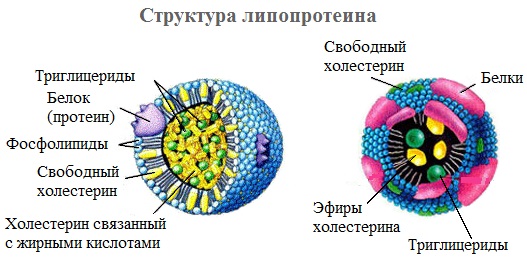 Все типы липопротеинов имеют сходное строение: гидрофобное ядро и гидрофильный слой на поверхности. Гидрофильный слой образован белками (апопротеинами), фосфолипидами и холестеролом. Триацилглицеролы (ТАГ) и эфиры холестерола составляют гидрофобное ядро. 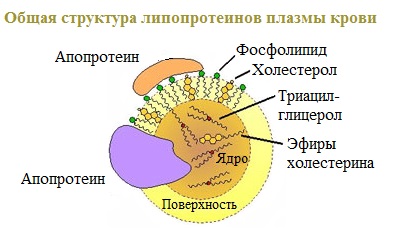 Гидрофильные группы этих молекул ориентированы в водную фазу, а гидрофобные части – к гидрофобному ядру липопротеина, в котором находятся транспортируемые липиды. Липиды не растворяются в воде, потому не могут переноситься кровью в чистом виде. Поэтому для транспорта липидов кровью в организме образуются комплексы липидов с белками – липопротеины. В организме синтезируются следующие типы липопротеинов: хиломикроны (ХМ), липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП). Каждый из типов ЛП образуется в разных тканях и транспортирует определенные липиды. Общая функция всех липопротеинов – это транспорт липидов. Липопротеины хорошо растворимы в крови, так как имеют небольшой размер и отрицательный заряд на поверхности. Некоторые липопротеины легко проходят через стенки капилляров кровеносных сосудов и доставляют липиды к клеткам. Большой размер хиломикронов не позволяет им проникать через стенки капилляров, поэтому из клеток кишечника они сначала попадают в лимфатическую систему и потом через главный грудной проток вливаются в кровь вместе с лимфой. Липопротеины очень низкой и низкой плотности вызывают при повышении их концентрации в крови атеросклероз. При нарушениях транспорта липидов и липидного обмена снижается энергетический потенциал организма, ухудшается передача нервных импульсов, снижается скорость ферментивных реакций. Без участия липопротеинов невозможен транспорт жирорастворимых витаминов: витаминов групп А, Е, К, D. Хромопротеины Хромопротеины («цветные белки») – сложные белки, содержащие в качестве простетической группы окрашенный компонент. Хромопротеины участвуют в таких процессах жизнедеятельности, как фотосинтез, дыхание, транспорт кислорода и диоксида углерода, окислительно-восстановительные реакции, свето- и цветовосприятие и др. В зависимости от их строения различают гемопротеины, флавопротеины, родопсин. Гемопротеины (красные) – сложные белки, простетической группой которых служит гем. К группе гемопротеинов относятся гемоглобин, миоглобин, хлорофиллсодержащие белки и ферменты (цитохромы, каталаза и пероксидаза). Все они содержат в качестве небелкового компонента железо- (или магний) порфирины, но различные по составу и структуре белки, и выполняют разнообразные биологические функции. Хлорофилл (магнийпорфирин) вместе с белком обеспечивает фотосинтетическую активность растений, катализируя расщепление молекулы воды на водород и кислород (поглощением солнечной энергии). Гемопротеины (железопорфирины), напротив, катализируют обратную реакцию — образование молекулы воды, связанное с освобождением энергии. Гемоглобин – главный компонент эритроцита и основной дыхательный пигмент, обеспечивает перенос кислорода (О2) из легких в ткани и углекислого газа (СО2) из тканей в легкие. Поддерживает кислотно-основное равновесие крови. У гемоглобина белковый компонент представлен глобином, а небелковым компонентом является гем – пигмент. Ион железа расположен в центре гема-пигмента, придающего крови характерный красный цвет. Гем представлен порфирином, состоящим из 4-х пиррольных колец. Каждая из 4 молекул гема «обернута» одной полипептидной цепью. 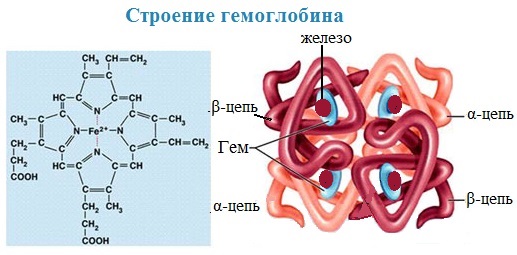 Гем является простетической группой и у миоглобина, каталазы, пероксидазы, цитохромов. Гем встречается также в растительных гемопротеинах и участвует в процессе фотосинтеза. Миоглобин (белок мышц) – небольшой глобулярный белок, молекула его состоит из одной полипептидной цепи и одного гема. Миоглобин создает в мышцах резерв кислорода, используемый мышечными волокнами. К хромопротеинам относятся и флавопротеиды, простетическими группами у которых являются изоаллоксазиновые производные. Флавопротеиды входят в состав оксидоредуктаз – ферментов, катализирующих окислительно-восстановительные реакции в клетке. В некоторые флавоноиды включены ионы металлов и молекула гема. Родопсин – это белок, простетической группой которого служит активная форма витамина А – ретиналь. Родопсин — основное светочувствительное вещество палочек сетчатки глаза. Его функция состоит в восприятии света в сумерках, т.е. отвечает за сумеречное зрение. Металлопротеины Металлопротеины – сложные белки, где роль небелкового компонента выполняют ионы металлов. К числу металлопротеинов относятся около сотни ферментов. Важная функция металлопротеинов связана с транспортированием металлов и их хранением в организме. Типичными металлопротеинами являются белки, содержащие негемовое железо – трансферрин, ферритин, гемосидерин, имеющие важное значение в обмене железа в организме. Трансферрин – растворимый в воде железопротеин, содержащийся в сыворотке крови в составе β-глобулинов. Молекула трансферрина содержит два иона Fe3+. Этот белок служит переносчиком железа в организме. Трансферрин синтезируется в печени. Ферритин – внутриклеточный глобулярный белок, содержится главным образом в селезенке, печени, костном мозге, выполняя роль депо железа в организме. Благодаря ферритину цитозольные запасы железа поддерживаются в растворимой и нетоксичной форме. Гемосидерин, в отличие от ферритина и трансферрина, является водонерастворимым железосодержащим белковым комплексом. Он содержится главным образом в клетках печени и селезенки, накапливается при избытке железа в организме, например, при частых переливаниях крови. Церулоплазмин – сывороточный белок, содержащий медь и принимающий участие в ее метаболизме, а также обменных процессах железа. Относится к α-2-глобулинам.  Каталаза — обезвреживает перекись водорода. Цитохромоксидаза — в комплексе с другими ферментами дыхательной цепи митохондрий участвует в синтезе АТФ. Алкогольдегидрогеназа — обеспечивает метаболизм этанола и других спиртов Лактатдегидрогеназа — участвует в метаболизме молочной кислоты Карбоангидраза — образует угольную кислоту из CO2 и H2O. Ксантиноксидаза — отвечает за последние реакции катаболизма пуриновых оснований. Тиреопероксидаза — участвует в синтезе гормонов щитовидной железы. Глутатионпероксидаза — антиоксидантный фермент. Уреаза — отвечает за распад мочевины. 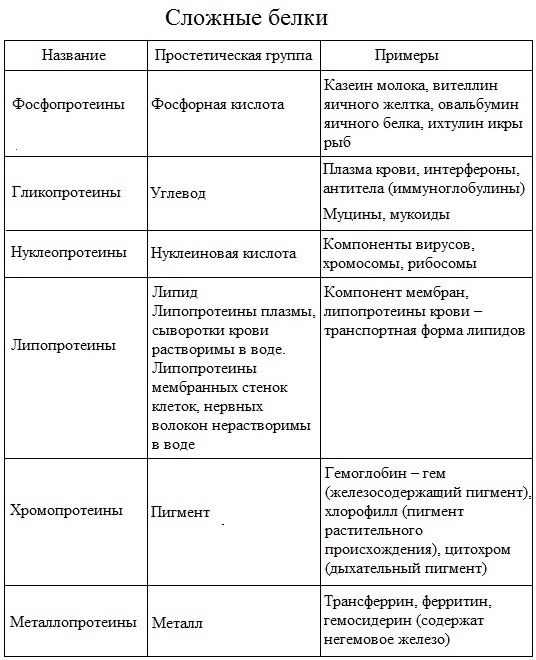 2.По форме молекул (фибриллярные и глобулярные)Белки можно классифицировать по форме молекул и некоторым физически свойствам на два больших класса: фибриллярные и глобулярные белки. Фибриллярные белки представляют собой длинные нитевидные молекулы, полипептидные цепи которых расположены параллельно друг другу вдоль одной оси и образуют длинные волокна (фибриллы) или слои. Наиболее важна вторичная структура (третичная почти совсем не выражена). Большинство фибриллярных белков не растворяется в воде, имеет большую молекулярную массу. Эти белки отличаются высокой механической прочностью, выполняют структурную функцию. К фибриллярным белкам относятся кератины (волосы, шерсть, рога, копыта, ногти, перья), миозин (мышцы), коллаген (сухожилия и хрящи), фиброин (шелк, паутина). 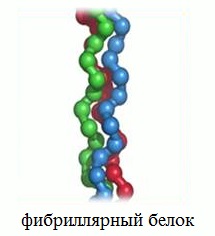 Глобулярные белки характеризуются компактной трехмерной укладкой полипептидных цепей, их молекулы имеют форму глобулы. Наиболее важна третичная структура. Глобулярные белки растворяются в воде или в разбавленных солевых растворах. Из-за большого размера молекул эти растворы – коллоидные. Глобулярные белки выполняют функции ферментов, антител (глобулины сыворотки крови определяют иммунологическую активность) и в некоторых случаев гормонов (инсулин). Они играют важную роль в протоплазме, удерживая в ней воду и некоторые другие вещества, способствуют поддержанию молекулярной организации. Глобулярные белки встречаются в физиологических жидкостях (сыворотке крови, молоке, пищеварительных жидкостях), в тканях организма. 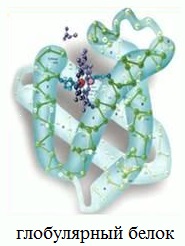  Существуют также и промежуточные белки фибриллярной природы, но растворимые. Примером служит фибриноген, превращающийся в нерастворимый фибрин при свертывании крови. 3.По растворимости в отдельных растворителяхКлассификация простых белков основана преимущественно на растворимости в воде, спирте, солевых растворах, растворах щелочей и кислот. 4.По аминокислотному составуС точки зрения пищевой ценности белков, определяемой их аминокислотным составом и содержанием незаменимых аминокислот, белки подразделяются на полноценные и неполноценные. Полноценными считаются белки, включающие в состав восемь незаменимых аминокислот, которые самостоятельно организм синтезировать не может. Неполноценными считаются белки, которые содержат недостаточное количество одной или нескольких незаменимых аминокислот, которые не могут быть синтезированы организмом. Полноценные белки содержатся в продуктах животного происхождения (кроме желатина), а также некоторой растительной пище (горох, фасоль, соя). Неполноценные белки – преимущественно растительного происхождения. Белки Моносахариды содержат асимметрические углеродные атомы: тетрозы — два асимметрических углеродных атома, пентозы — три, гексозы — четыре. Благодаря этому у моносахаридов мы встречаем большое число стереоизомеров, которые удобно изображать, пользуясь проекционными формулами Э. Фишера. Упрощенное проекционное изображение углеродного скелета молекулы гексозы (с четырьмя асимметрическими атомами углерода) дано на рис. 40. Для альдогексозы, имеющей четыре асимметрических атома углерода, число стереоизомеров, в согласии с формулой N= 2n, будет равно 24= 16 (одним из них является природная глюкоза). У альдогексоз (так же как и у кетогексоз) половина оптически деятельных стереоизомеров является антиподами другой половины. Таким образом, 16 стереоизоме  ров альдогексоз образуют 8 пар антиподов, подобно тому как 4 стереоизомера системы с двумя Рис. 40. асимметрическими атомами образуют 2 пары антиподов. Например, природной D-глюкозе соответствует синтетически полученный антипод: ров альдогексоз образуют 8 пар антиподов, подобно тому как 4 стереоизомера системы с двумя Рис. 40. асимметрическими атомами образуют 2 пары антиподов. Например, природной D-глюкозе соответствует синтетически полученный антипод: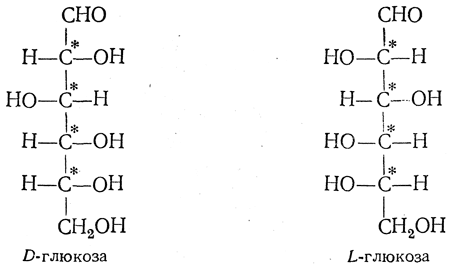 Определение взаимного расположения атомов водорода и гидроксильных групп у каждого асимметрического углеродного атома представляет трудную задачу, в разрешении которой большая заслуга принадлежит Э. Фишеру. Он показал, что конфигурация трех асимметрических атомов в молекулах всех известных в то время природных гексоз одинакова, например: 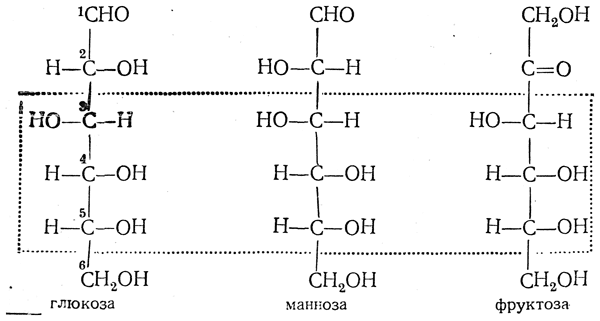 Тождество конфигураций трех асимметрических атомов 3, 4, 5 доказывалось реакцией с фенилгидразином, при которой исчезали различия в системах углеродных атомов 1 и 2, в результате чего из приведенных выше гексоз получалось одно и то же соединение. Э. Фишер предложил относить эту группу сахаров к D-ряду, подчеркивая сходство их конфигурации с конфигурацией природной (правовращающей) D-глюкозы. Антиподы этих сахаров, получаемые синтетически, были отнесены к L-ряду. В дальнейшем было признано более удобным (М. А. Розанов) устанавливать принадлежность сахара к D- или L-ряду, сравнивая расположение атома водорода и гидроксила у последнего асимметрического атома углерода с расположением их у правовращающего и левовращающего глицеринового альдегида. Следует напомнить, что буквы D и L не дают никаких указаний о направлении вращения плоскости поляризации. Для этого применяют знаки (+)- и (—)-. Например, природная фруктоза обозначается D(—)-фруктоза, так как она относится к D-ряду и обладает левым вращением. Витамин B1 Витамин В1 (тиамин; антиневритный), как отмечалось, был первым кристаллическим витамином, выделенным К. Функом в 1912 г. Позже был осуществлен его химический синтез. Наряду с аминогруппой витамин B1 содержит атомы серы, поэтому он был назван тиамином. В химической структуре его содержатся два кольца – пиримидиновое и тиазоловое, соединенных метиленовой связью. Обе кольцевые системы синтезируются отдельно в виде фосфорилированных форм, затем объединяются через четвертичный атом азота. 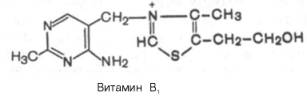 Тиамин хорошо растворим в воде. Водные растворы тиамина в кислой среде выдерживают нагревание до высоких температур без снижения биологической активности. В нейтральной и особенно в щелочной среде витамин B1, наоборот, быстро разрушается при нагревании. Этим объясняется частичное или даже полное разрушение тиамина при кулинарной обработке пищи, например выпечке теста с добавлением гидрокарбоната натрия или карбоната аммония. При окислении тиамина образуется тио-хром, дающий синюю флюоресценцию при УФ-облучении. На этом свойстве тиамина основано его количественное определение. Витамин B1легко всасывается в кишечнике, но не накапливается в тканях и не обладает токсическими свойствами. Избыток пищевого тиамина быстро выводится с мочой. В превращении витамина B1в его активную форму – тиаминпирофосфат (ТПФ), называемый также тиамин-дифосфатом (ТДФ), участвует специфический АТФ-зависимый фермент тиаминпирофосфокиназа, содержащаяся главным образом в печени и ткани мозга. Опытами с меченным 32Р АТФ доказан перенос на тиамин целиком пирофосфатной группы в присутствии фермента. ТПФ имеет следующее строение: 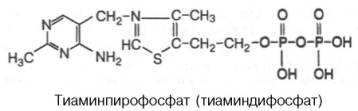 Если витамин B1поступает с пищей в виде ТПФ, то пирофосфатная группа отщепляется от него под действием кишечных пирофосфатаз. При отсутствии или недостаточности тиамина развивается тяжелое заболевание – бери-бери, широко распространенное в ряде стран Азии и Индокитая, где основным продуктом питания является рис. Следует отметить, что недостаточность витамина B1встречается и в европейских странах, где она известна как симптом Вернике, проявляющийся в виде энцефалопатии, или синдром Вейса с преимущественным поражением сердечно-сосудистой системы. Специфические симптомы связаны с преимущественными нарушениями деятельности и сердечно-сосудистой, и нервной систем, а также пищеварительного тракта. В настоящее время пересматривается точка зрения, что бери-бери у человека является следствием недостаточности только витамина В1. Более вероятно, что это заболевание представляет собой комбинированный авитаминоз или полиавитаминоз, при котором организм испытывает недостаток также в рибофлавине, пиридоксине, витаминах РР, С и др. На животных и добровольцах получен экспериментальный авитаминоз Bl. В зависимости от преобладания тех или иных симптомов различают ряд клинических типов недостаточности, в частности полиневритную (сухую) форму бери-бери, при которой на первый план выступают нарушения в периферической нервной системе. При так называемой отечной форме бери-бери преимущественно поражается сердечно-сосудистая система, хотя отмечаются также явления полиневрита. Наконец, выделяют остро протекающую кардиальную форму болезни, называемую пернициозной, которая приводит к летальному исходу в результате развития острой сердечной недостаточности. В связи с внедрением в медицинскую практику кристаллического препарата тиамина летальность резко сократилась и наметились рациональные пути лечения и профилактики этого заболевания. К наиболее ранним симптомам авитаминоза В1 относятся нарушения моторной и секреторной функций пищеварительного тракта: потеря аппетита, замедление перистальтики (атония) кишечника, а также изменения психики, заключающиеся в потере памяти на недавние события, склонности к галлюцинациям; отмечаются изменения деятельности сердечно-сосудистой системы: одышка, сердцебиение, боли в области сердца. При дальнейшем развитии авитаминоза выявляются симптомы поражения периферической нервной системы (дегенеративные изменения нервных окончаний и проводящих пучков), выражающиеся в расстройстве чувствительности, ощущении покалывания, онемения и болей по ходу нервов. Эти поражения завершаются контрактурами, атрофией и параличами нижних, а затем и верхних конечностей. В этот же период развиваются явления сердечной недостаточности (учащение ритма, сверлящие боли в области сердца). Биохимические нарушения при авитаминозе В1 проявляются развитием отрицательного азотистого баланса, выделением в повышенных количествах с мочой аминокислот и креатина, накоплением в крови и тканях α-кетокислот, а также пентозосахаров. Содержание тиамина и ТПФ в сердечной мышце и печени у больных бери-бери в 5-6 раз ниже нормы. Биологическая роль. Экспериментально доказано, что витамин B1в форме ТПФ является составной часть минимум 5 ферментов, участвующих в промежуточном обмене веществ. ТПФ входит в состав двух сложных ферментных систем – пируват - и α - кетоглутарат дегидрогеназных комплексов, катализирующих окислительное декарбоксилирование пировиноградной и α-кетоглутаровой кислот. В составе транскетолазы ТПФ участвует в переносе гликоальдегидного радикала от кетосахаров на альдосахара (см. главу 10). ТПФ является коферментом пируватдекар-боксилазы клеток дрожжей (при алкогольной ферментации) и дегидро-геназы γ-оксикетоглутаровой кислоты. Приведенными примерами, вероятнее всего, не ограничиваются биологические функции тиамина. В частности, ТПФ участвует в окислительном декарбоксилировании глиоксиловой кислоты и α-кетокислот, образующихся при распаде аминокислот с разветвленной боковой цепью; в растениях ТПФ является эссенциальным кофактором при синтезе валина и лейцина в составе фермента ацетолактатсинтетазы. Распространение в природе и суточная потребность. Витамин В1 широко распространен в природе. Основное количество его человек получает с растительной пищей. Много витамина B1содержится в дрожжах, пшеничном хлебе из муки грубого помола, оболочке и зародышах семян хлебных злаков, сое, фасоли, горохе, меньше – в картофеле, моркови, капусте. Из продуктов животного происхождения наиболее богаты витамином B1печень, почки, мозг. Некоторые бактерии, населяющие кишечник животных, способны синтезировать достаточное количество тиамина: например, количества витамина В1, синтезированного микрофлорой кишечника коров, оказывается вполне достаточно для покрытия потребностей организма. Рекомендуемые Институтом питания РАМН нормы суточного потребления тиамина для отдельных групп населения составляют от 1,2 до 2,2 мг. Вариант 41 1. Что представляют собой пептиды, полипептиды, белки? Молекулярная масса белков и методы ее определения: химический, ультрацентрифугирования, молекулярных сит ( гель - фильтрация). 2. Строение гликогена, его мономер, связи в молекуле гликогена и его роль в организме. 3. Химическая природа, строение, физико-химичесие свойства и значение фосфоглицеридов и гликолипидов в пищевой промышленности. Фосфолипиды или фосфатиды относятся к сложным липидам. По химической природе являются производными ацилглицеринов, в которых одна из жирных кислот замещена фосфорной кислотой с присоединенным к ней азотистым основанием или другим полярным соединением. Общая формула фосфоглицеринов имеет вид 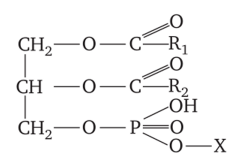 где Rl3 R2 — остатки жирных кислот, одна из которых, как правило, насыщенная, другая — ненасыщенная; X — гидрофильный заместитель (азотистое или другое соединение). Таблица 4.4 Наиболее распространенные фосфолипиды растений
Окончание табл. 4.4
Примечание. Гидроксильная группа, этерифицируемая фосфорной кислотой, подчеркнута. Таким образом, молекулы фосфоглицеринов всегда содержат одну полярную часть («голову») в виде остатка глицерина, фосфорной кислоты и радикала X и две неполярные («хвосты») в виде остатков жирных кислот. Углеводородные радикалы жирных кислот представляют гидрофобную часть молекулы, а остатки глицерина, фосфорной кислоты и азотистое соединение проявляют гидрофильные свойства, вследствие чего в водном растворе и на границе двух фаз они приобретают определенную ориентацию. Благодаря этим свойствам фосфолипиды играют важную роль в формировании структуры клеточных мембран. В составе мембран они находятся в соединении с белками в виде липопротеидов и могут участвовать в регуляторных процессах. В зависимости от химической природы радикала X фосфолипиды подразделяют на несколько групп. Наиболее распространенные фосфолипиды растений показаны в табл. 4.41. Строение основных фосфолипидов растений показано на следующей схеме: 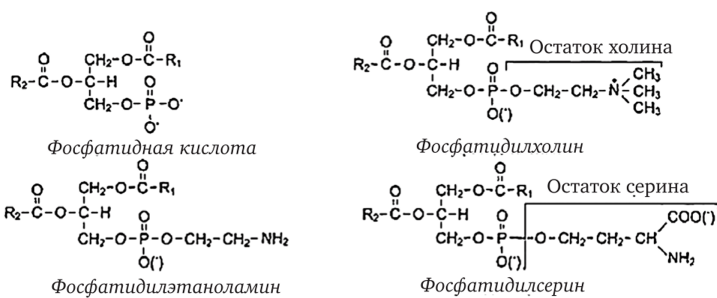 Фосфолипиды очень широко распространены в живой природе. Они присутствуют во всех клетках в составе клеточных мембран или запасных веществ, но особенно их много в репродуктивных органах. В значительных количествах присутствуют в семенах растений, грибах, дрожжах, яичном желтке. В семенах растений фосфолипиды содержатся в количестве 0,25—2,0 % от массы (наибольшее количество их обнаружено в семенах сои — 1,6—2,0 %; в зародыше сои — свыше 3 %). Большая часть фосфолипидов растений представлена лецитином, кефалином, фосфатидилинозитом. Фосфатидные кислоты содержатся в растениях в небольших количествах, так как они являются промежуточными продуктами липидного обмена. В табл. 4.51 приведен состав фосфолипидов семян подсолнечника (по данным различных авторов). Таблица 4.5 Состав фосфолипидного комплекса семян подсолнечника, % от суммы фосфолипидов
Фосфолипиды являются веществами, которые в значительной мере повышают питательную и кормовую ценность семян сельскохозяйственных растений. Как и другие структурные липиды, фосфолипиды при обезжиривании семян в условиях производства переходят в масло. Содержание фосфолипидов в растительных маслах колеблется в зависимости от способа получения масла (табл. 4.62). Таблица 4.6 Содержание фосфолипидов в растительных маслах (в пересчете на лецитин) (В. П. Ржехин, 1960)
Фосфолипиды, особенно лецитин, обладая поверхностно-активными свойствами, являются прекрасными эмульгаторами. Они широко применяются в пищевой промышленности для изготовления шоколада, маргарина и в качестве антиоксидантов, предохраняющих жиры от прогоркания. Будучи поверхностно-активными веществами, они зарекомендовали себя как средство, улучшающее хлебопекарное достоинство пшеничной муки. ГликолипидыГликолипиды также относятся к сложным липидам, но в отличие от фосфолипидов не содержат остатков ортофосфорной кислоты. В их молекулах к диацилглицерину гликозидной связью присоединяются остатки галактозы или сульфоглюкозы. Наиболее важные представители гликолипидов в растениях — моногалактозилдиацилглицерины и дигалактозилдиацилглицерины. Углеводным компонентом в этих гликолипидах выступает галактоза, жирные кислоты чаще всего представлены полиненасыщенной линоленовой кислотой: 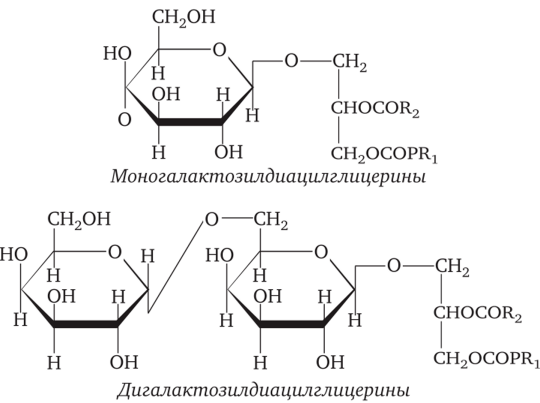 Такие липиды в большом количестве содержатся в мембранах хлоро- пластов растений и некоторых водорослей. Гликоге́н — полисахарид состава (C6H10O5)n, образованный остатками глюкозы, соединёнными связями α-1→4 (в местах разветвления — α-1→6). В клетках животных служит основным запасным углеводом и основной формой хранения глюкозы. Откладывается в виде гранул в цитоплазме в клетках многих типов (главным образом в клетках печени и мышц). Белок используется для обозначения полной биологической молекулы в стабильной конформации (в контексте функциональных перестроек третичные или четвертичные структуры обычно называют «конформацией»), следовательно, функциональной единицей. Белки представляют собой большие макромолекулы, состоящие из одной или нескольких длинных цепочек аминокислотных остатков, и именно последовательность аминокислот приводит к складыванию белка в специфическую трехмерную структуру, которая определяет его активность. Полипептид представляет собой длинную, непрерывную и неразветвленную пептидную цепь и в основном первичную структуру белка. Полипептид относится к любой одиночной линейной цепи аминокислот, обычно независимо от длины, но часто подразумевает отсутствие определенной конформации. Короткие полипептиды, содержащие менее 20–30 остатков, принято называть пептидами. Пептиды (от греч. peptos — питательный) — продукты конденсации двух или более молекул аминокислот, соединённых пептидной связью . При соединении двух молекул аминокислот образуется дипептид, трёх — трипептид и т. д. Пептиды, в состав молекул которых входит аминокислотных остатков, называются олигопептидами; при большем количестве аминокислотных остатков пептиды называются полипептидами. В состав молекул полипептидов могут также входить неаминокислотные остатки, например углеводные. К пептидной цепи может присоединяться неограниченное количество аминокислотных остатков, что приводит к образованию веществ с очень большой молекулярной массой — белкам. Пептидная связь образуется между двумя молекулами аминокислот за счёт отщепления молекулы воды: 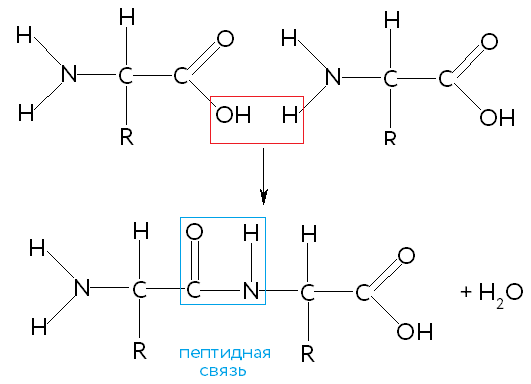 При составлении формул пептидов свободную аминогруппу аминокислотного остатка обычно записывают слева, а свободную -карбоксильную группу — справа. Пептиды различаются по составу аминокислот, их количеству, а также по расположению и соединению аминокислотных остатков в полипептидную цепочку. Пептидная связь имеет свойства частично двойной связи. Это проявляется в уменьшении длины этой связи ( нм) по сравнению с длиной простой связи ( нм), например, в молекулах аминов. Такой характер пептидной связи делает невозможным свободное вращение заместителей вокруг нее, поэтому пептидная группировка является плоской и обычно имеет транс-конфигурацию: 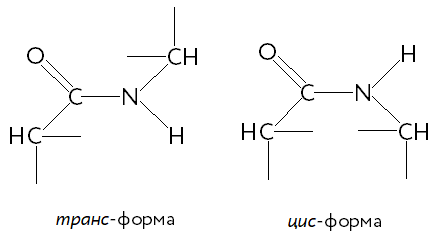 Рис. 1. Транс- и цис-конфигурация пептидной связи Tаким образом, пептидная цепь представляет собой ряд жёстких плоскостей с подвижным («шарнирным») сочленением в месте, где расположены асимметрические атомы углерода. |