зайко. Н. Н. Зайко Патологическая физиология Введение Предмет и задачи патологической физиологии Патологическая физиология есть наука, изучающая жизнедеятельность больного организма. Программа
 Скачать 7.32 Mb. Скачать 7.32 Mb.
|
|
Действие гормонов на эффекторные органы-мишениреализуется по трем направлениям: 1. влияние на биологические мембраны; 2. стимуляция или угнетение активности ферментов; 3. влияние на генетический аппарат клетки. Первоначальным обязательным этапом при этом является взаимодействие гормонов со специфическими циторецепторами. Рецепторы инсулина, соматотропина, рилизинг-факторов и других белковых гормонов встроены в клеточную мембрану. Их действие на клетку опосредуется аденилат-циклазной системой. Стероиды же проникают внутрь клетки к связываются с цитоплазматическими рецепторными белками. Затем активированный стероидрецепторный комплекс перемещается в ядро, где связывается с акцепторными участками хроматина. Результатом этого является изменение активности генов, ответственных за синтез тех или иных ферментов и других белков (). Допускается возможность взаимодействия стероидов с цитоплазматической мембраной клетки. Нарушение гормональной рецепции в клетках органов-мишеней изменяет биологические эффекты гормонов. Например, при врожденном отсутствии циторецепторов андрогенов развивается синдром тестикулярной феминизации. Он характеризуется появлением женских вторичных половых признаков у лиц с мужским генотипом и наличием яичек, продуцирующих достаточное количество тестостерона. Идиопатический гирсутизм[1] женщин связывают с повышенной чувствительностью волосяных фолликулов к эндогенным андрогенам. 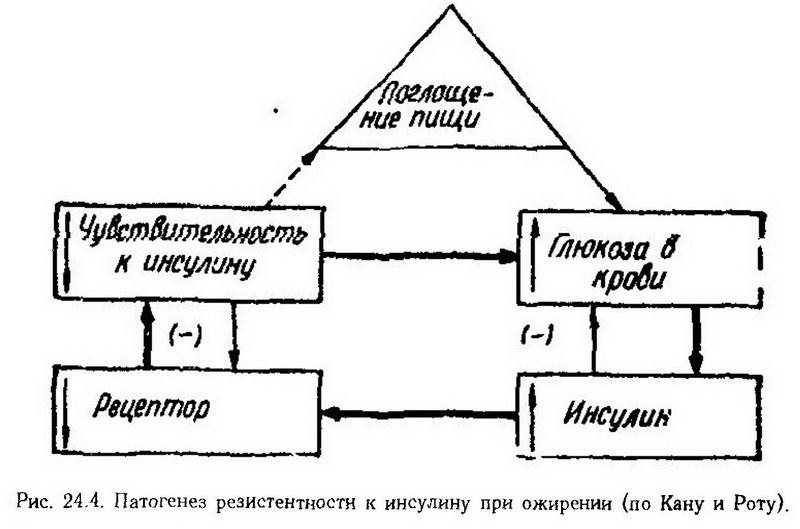 На рис. 24.4 показан механизм развития резистентности к инсулину при ожирении. Гиперинсулинемия, возникающая в ответ на гипергликемию, вызванную избыточным потреблением пищи с большим содержанием углеводов, снижает количество рецепторов инсулина. В результате уменьшается чувствительность тканей к инсулину, чем усугубляется повышение уровня глюкозы в крови с дальнейшим уменьшением количества рецепторов инсулина. Таким образом, характер основных проявлений эндокринной патологии (гипо- и гиперфункции) зависит от направленности функциональных изменений (повреждения) на всех уровнях регуляции, начиная от центральной регуляции секреции гормонов и заканчивая регуляцией реализации их биологических эффектов (табл. 8). Таблица 8. Патогенез эндокринных нарушений
Компенсаторно-приспособительные механизмы. В патогенезе эндокринных, как и других, болезней различают, с одной стороны, механизмы повреждения, т. е. возникновения и развития гормо нальных нарушений, а с другой – механизмы компенсации и восстановления. К последним относится, например, компенсаторная гипертрофия яичника или семенника после гемикастрации. Гипертрофия и гиперплазия секреторных клеток коркового вещества надпочечных желез способны полностью компенсировать адренокортикальную недостаточность при удалении большей части паренхимы железы. Эти реакции обеспечиваются отрицательной обратной связью между гипофизом и периферическими эндокринными органами. Один из эффективных путей приспособления организма к патологическим сдвигам в секреции гормонов состоит в регуляции связывания гормонов белками крови. Так, повышенное связывание гликокортикоидов с транскортином плазмы, обнаруживаемое при адренокортикальной недостаточности, защищает эти гормоны от метаболической инактивации и тем самым способствует поддержанию их нормальной концентрации в крови. Напротив, при гиперсекреции гликокортикоидов их связывание с транскортином уменьшается, благодаря чему они быстрее инактивируются и выводятся из организма. Устранение неблагоприятного влияния гипо- и гиперсекреции гормонов достигается также изменением активности ферментов печени и других органов, в которых эти гормоны разрушаются и инактивируются. Роль эндокринных нарушений в патогенезе неэндокринных заболеваний. Нарушение гормонального равновесия в организме создает благоприятный фон для возникновения и развития неэндокринных болезней. Так, относительная или абсолютная кортикостероидная недостаточность способствует развитию ревматизма, бронхиальной астмы. Артериальная гипертензия может быть усилена избыточной секрецией гликокортикоидов, альдостерона, катехоламинов. Нарушения функций гипоталамо-гипофизарной системы. Нарушения функций гипофиза Пангипопитуитаризм. Полную недостаточность гипофиза (пангипо-питуитаризм) воспроизводят в эксперименте удалением всей железы или ее передней доли. Наиболее подробно последствия гипофизэктомии изучены у собак и крыс. У молодых животных после удаления гипофиза развивается сложный симптомокомплекс, обусловленный дезорганизацией обмена веществ и регуляции эндокринных функций. Самым заметным внешним проявлением этого состояния является резкое нарушение роста и общего развития животных. Остановка роста связана с выпадением соматотропной и тиреотропной функций гипофиза. Большинство других нарушений обусловлено недостаточным образованием гормонов в периферических железах – щитовидной, надпочечных и половых, которые подвергаются атрофии вследствие выпадения соответствующих функций гипофиза. У гипофизэктомированных животных наблюдаются вялость и малоподвижность, снижение основного обмена, склонность к гипогликемии, гипотермия, гипотензия, понижение резистентности к различным неблагоприятным воздействиям. У человека полная недостаточность функции гипофиза бывает врожденной и приобретенной. Наиболее частые причины заболевания – опухоль, послеродовой некроз гипофиза, травма основания черепа, воспаление, тромбоз, вирусная инфекция. Поражение железы в эмбриональном или препубертатном периоде ведет к карликовости, половому недоразвитию, ослаблению функций щитовидной железы, эндокринообменным нарушениям, снижению реактивности. При разрушении более 95% массы железы у взрослых людей развивается гипофизарная кахексия, или болезнь Симмондса, характеризующаяся сильнейшим истощением, атрофией щитовидной, надпочечных и половых желез, мышечной ткани, висцеральных органов, разрушением костной ткани, выпадением зубов и волос, расстройством функций вегетативной нервной системы, гипогликемией, повышением чувствительности к инсулину. Большинство нарушений связано с прекращением выработки соматотропина и кортикотропина. Гипофункция аденогипофиза. Патогенез и симптомы гипофункции аденогипофиза в основном совпадают с таковыми при пангипопитуитаризме. Для парциальной недостаточности аденогипофиза характерно уменьшение продукции какого-нибудь одного гормона. Например, раннее выпадение или угнетение соматотропной функции влечет за собой развитиекарликовости, или гипофизарного нанизма. Генерализованное уменьшение скорости синтеза белков ведет к атрофии мышечной и соединительной тканей, которая внешне проявляется общим постарением, дряблостью кожи. Половые органы остаются в инфантильном состоянии. Парциальная гонадотропная недостаточность приводит кинфантилизму: у девочек – к отсутствию менструаций, бесплодию, у мальчиков – к гипоплазии яичек, физическому и половому недоразвитию. Гиперфункция аденогипофиза. Большинство патологических изменений, наблюдающихся у человека при гиперфункции аденогипофиза, можно воспроизвести в эксперименте введением экстрактов гипофиза или отдельных гормонов. Гиперпродукция соматотропина у человека проявляется в виде гипофизарного гигантизма или акромегалии, в зависимости от того, в каком возрасте возникла патология. Гипофизарный гигантизм развивается при избыточной секреции соматотропина в молодом возрасте, до закрытия эпифизарных хрящей. Аналогичные гормональные сдвиги в более позднем возрастном периоде, после закрытия эпифизарных швов и завершения роста, являются причиной акромегалии. Источником повышенной секреции соматотропина при акромегалии является эозинофильная аденома гипофиза. Отдельные части тела при этом непропорционально увеличиваются, черты лица резко укрупняются. Одновременно развивается спланхномегалия (увеличение печени, селезенки, сердца и др.). Эти изменения обусловлены усилением периостального роста и разрастанием мягких тканей. При акромегалии концентрация соматотропина в крови может превышать нормальные показатели в 100 раз и более. Патологическое влияние избытка соматотропина на организм определяется способностью гормона повышать проницаемость клеточных оболочек для аминокислот, ускорять их включение в синтезируемый белок, тормозить распад белков. В результате усиления липолиза и торможения образования жира из углеводов увеличивается мобилизация жира из депо, содержание неэстерифицированных жирных кислот в крови, их окисление в печени и образование кетоновых тел. Благодаря воздействию соматотропина на различные звенья регуляции углеводного обмена при акромегалии часто наблюдается гипергликемия, снижение толерантности к углеводам, уменьшение чувствительности к инсулину. Патологическое воздействие соматотропина на соединительную, костную и хрящевую ткани при акромегалии обусловлено, в частности, способностью гормона стимулировать образование оксипролина (важнейшего компонента коллагена) и хондроитинсульфата. Эти и ряд других эффектов соматотропина опосредуются особым белковым фактором – соматомедином, который образуется в печени под его влиянием. Другая распространенная форма гиперфункции аденогипофиза – болезнь Иценко-Кушинга, характеризующаяся увеличением выработки кортикотропина и как следствие – чрезмерной секреции кортизола и других гликокортикоидов надпочечными железами. Гиперпролактинемия, источником которой чаще всего является доброкачественная опухоль, происходящая из лактотропоцитов аденогипофиза, вызывает у женщин синдром галактореи – аменореи. Основу его патогенеза составляют стимуляция образования и выделения молозива, а также нарушение созревания фолликулов в яичниках и подавление овуляции. У мужчин повышенная секреция пролактина может служить причиной угнетения сперматогенеза и бесплодия. Эффекты повышения секреции кортикотропина, тиротропина и гонадотропинов сводятся главным образом к гиперфункции надпочечных, щитовидной и половых желез и будут рассмотрены в соответствующих разделах. Нарушения функций нейрогипофиза. Повышение секреции вазопрессина способствует накоплению жидкости в организме. Оно играет важную роль в патогенезе рефлекторной анурии (например, при болевом шоке) и отеков, в частности при циррозе печени, когда нарушается инактивация гормона. Результатом чрезмерной секреции вазопрессина или введения его лабораторным животным является также повышение тонуса периферических сосудов. Недостаточность вазопрессина возникает при удалении нейрогипофиза, при поражении супраоптического, паравентрикулярного ядер гипоталамуса или гипоталамо-нейрогипофизарного нервно-проводникового пути. В результате развивается несахарный диабет, или несахарное мочеизнурение. У некоторых больных несахарный диабет развивается на фоне нормального или даже повышенного содержания вазопрессина в крови. По-видимому, в этих случаях патогенез заболевания связан с повышенной инактивацией гормона или, что более вероятно, с недостаточной чувствительностью к нему дистальных частей канальцев нефронов, в которых происходит обратное всасывание воды. И абсолютная, и относительная недостаточность вазопрессина нарушают реабсорбцию воды в канальцах нефронов, что ведет к полиурии, полидипсии и гипотензии. Больные выделяют за сутки 3 – 8 л, мочи с низкой относительной плотностью. Нередко диурез составляет 10 – 12 л, а в отдельных случаях доходит до 40 – 43 л. Некоторые патологические изменения, наблюдаемые после удаления нейрогипофиза, связаны, вероятно, с дефицитом окситоцина. Предполагают, что изменение секреции окситоцина играет роль в патогенезе нарушения родовой деятельности и лактации, дискинезии желчных путей. Нейроэндокринные заболевания Одни и те же патологические процессы могут развиваться как при поражении гипоталамуса, так и при первичном нарушении функций гипофиза. И при несахарном диабете, и при нарушении полового развития или роста нередко обнаруживают признаки изменения нейросекреции, нарушения функций гипоталамо-гипофизарной системы. Даже в тех случаях, когда первичный патологический очаг появляется в гипофизе, в процесс всегда вовлекается гипоталамус. Так, эозинофильная аденома аденогипофиза, которая является источником повышенной продукции соматотропина и причиной гигантизма или акромегалии, может сопровождаться несахарным диабетом. Многие расстройства обмена веществ, терморегуляции, полового и физического развития, осложняющие течение основного эндокринного заболевания, обусловлены поражением промежуточного мозга. Иногда нарушения нейроэндокринной регуляции возникают в результате поражения внегипоталамических структур – миндалевидного тела, гиппокампа и др. Эндокринно-обменные нарушения диэнцефально-гипофизарного происхождения выделяют в группу нейроэндокринных заболеваний. Типичным примером являетсяадипозогенитальная дистрофия, которая возникает в результате ослабления гонадотропной активности гипофиза и нарушения гипоталамической регуляции жирового обмена. Это ведет к задержке полового развития, гипоплазии половых органов, крипторхизму, аменорее. Развивается ожирение с характерным отложением жира в области плеча, груди, живота, таза и бедер. Основной обмен и температура тела понижены, в ряде случаев отмечают полиурию, жажду и постоянное чувство голода. Нейроэндокринные нарушения могут быть результатом патологических влияний на развивающийся головной мозг в раннем онтогенезе. Некоторые формы эндокринного бесплодия у женщин, обусловленные нарушением половой цикличности, связывают с приемом их матерями во время беременности гормональных и других лекарственных средств. В эксперименте данную патологию воспроизводят однократным введением тестостерона новорожденным крысятам-самкам. До пубертатного возраста такие животные по своему росту и развитию внешне ничем не отличаются от интактных крыс того же помета. Однако в то время, как у контрольных крыс половозрелого возраста наблюдается регулярный 4–5-дневный эстральный цикл, у андрогенизированных животных обнаруживается постоянная течка, поликистоз яичников. Перечисленные нарушения обусловлены первичным воздействием андрогенов на структурные образования гипоталамуса, ответственные за циклическую секрецию лютропина гипофиза, которая обеспечивает процессы овуляции. Экспериментально доказана возможность формирования нейроэндокринной патологии вследствие неадекватного воздействия на развивающийся мозг нейромедиаторов, опиоидов, глюкокортикоидов, тироксина и других гормонов, а также пренатального стресса. Данное явление известно как гормонально-медиаторный импринтинг нейроэндокринной патологии (А. Г. Резников). Нарушения функций щитовидной железы Гипофункция щитовидной железы. Гипотиреозвоспроизводят у животных полным или частичным удалением железы, разрушением ее с помощью радиоактивного йода, который избирательно накапливается в паренхиме железы, а также введением тиреостатических препаратов, препятствующих синтезу и выделению тиреоидных гормонов (метилтиоурацил, мерказолил, бетазин, калия перхлорат). Состояние, возникающее после тиреоидэктомии, обозначают как тиреопривную кахексию. Последствия тиреоидэктомии тем тяжелее, чем раньше произведена операция. У молодых собак, крыс, кроликов и других животных отмечают резкую задержку роста (рис. 24.5), половое недоразвитие, расстройство всех видов обмена веществ, трофические нарушения. В результате снижения уровня окислительных процессов уменьшается на 25 – 40% основной обмен, снижается температура тела, имеется склонность к гипогликемии и повышение толерантности к глюкозе. Из-за уменьшения распада холестерина и утилизации его в тканях в 2 – 3 раза повышается концентрация холестерина в крови. На этом фоне усиливается действие атерогенных факторов. Результаты радиологических исследований свидетельствуют о торможении включения меченых аминокислот в белки. Наблюдается задержка воды в тканях.  Тиреоидэктомированные животные малоподвижны. Изменения высшей нервной деятельности проявляются в отсутствии выработки условных рефлексов, преобладании тормозных процессов, нарушениях дифференцировки. Этиологическими факторами развития гипотиреоза у людей являются врожденные дефекты биосинтеза тиреоидных гормонов, врожденная гипоплазия или аплазия щитовидной железы, аутоиммунные и инфекционные воспалительные процессы в железе, удаление большого количества железистого эпителия при хирургических вмешательствах, повреждение железы тиреостатическими препаратами, радиоактивным йодом вследствие превышения допустимых лечебных доз, радиоактивного заражения местности и др. Наиболее частой причиной гипотиреоза является недостаточное поступление в организм йода и, возможно, кобальта. При тяжелой степени недостаточности щитовидной железы, врожденной или возникшей в раннем детстве, развиваетсякретинизм, у взрослых людей – микседема (гипотиреоз, сопровождающийся слизистым отеком). Характерные для гипотиреоза нарушения высшей нервной деятельности, трофики, водно-электролитного, белкового и жирового обменов, роста и полового развития, терморегуляции и других функций жизнедеятельности организма при кретинизме достигают крайней степени. Для микседемы типичны снижение обмена веществ, ожирение, малоподвижность, снижение температуры тела. В результате усиленной гидратации кожи и подкожной клетчатки и избыточного накопления в них гидрофильных слизистых веществ лицо становится одутловатым, с бедной мимикой, утолщенным носом и губами. Отмечаются ломкость ногтей, выпадение волос и другие трофические нарушения. Половая функция постепенно угасает, снижается интеллект, притупляется память, появляются апатия, сонливость, а в позднем периоде болезни – слабоумие. Увеличение щитовидной железы при недостаточности йода известно под названием эндемический зоб. Это заболевание распространено в Альпах, Карпатах, Гималаях, Андах и других горных районах земного шара, где в почве и воде недостаточное содержание йода. Дефицит йода обусловливает снижение синтеза тироксина и трийодтиронина, вследствие чего в гипофизе усиливается выработка тиротропина. Это в свою очередь вызывает гиперплазию щитовидной железы, масса которой иногда достигает нескольких килограммов. Этиологическая роль недостаточности йода в происхождении эндемического зоба подтверждается следующим экспериментом. Если собаку в течение первых полутора лет жизни поить водой, не содержащей йода, масса щитовидной железы достигает 100 г при норме 1 г. Наиболее убедительным доказательством являются успешные результаты профилактики йодом эндемического зоба в очагах его распространения (добавление натрия или калия йодида к питьевой воде или к поваренной соли). Гиперфункция щитовидной железы. Повышение продукции тиреоидных гормонов (гипертиреоз), ослабление прочности связи тироксина с тироксинсвязывающим глобулином, нарушение метаболизма гормонов щитовидной железы или повышение чувствительности тканей-мишеней к их действию ведут к развитию тиреотоксикоза. Наиболее частым проявлением его является диффузный токсический зоб (базедова болезнь, болезнь Гревса). Базедова болезнь характеризуется типичным симптомокомплексом: увеличением щитовидной железы, пучеглазием, повышением основного обмена, усилением теплопродукции, тахикардией, дрожанием пальцев рук, повышением психической возбудимости. Эти и многие другие патологические явления обусловлены токсическим действием избыточного количества тироксина и трийодтиронина. Важнейшим этиологическим фактором тиреотоксикоза у человека является психическая травма. Предрасполагающими факторами служат инфекция, переохлаждение, а также физиологические колебания функциональной активности железы, связанные с менструальным циклом. Представления о гиперпродукции тиротропина как ведущем патогенетическом звене базедовой болезни в настоящее время подвергнуты пересмотру. Основное значение придают нарушению иммунологических процессов и увеличению чувствительности адренорецепторов к катехоламинам. В крови больных присутствует длительно действующий стимулятор щитовидной железы (LATS)[1] – иммуноглобулин типа IgG (см. раздел VII – "Аллергия"). Доказана патогенная роль простагландинов щитовидной железы в нарушениях ее функции. В патогенезе тиреотоксикоза и его осложнений имеют значение также циркулирующие с кровью антитела к белкам головного мозга, рецепторам тиреотропина и другим антигенам. Пучеглазие вызывается экзофтальмическим фактором, который имеет гипофизарное происхождение и сходен по ряду признаков с тиротропином. Эти факторы продолжают действовать и после хирургического лечения базедовой болезни и могут стать причиной посттиреотоксической энцефалоофтальмопатии или гипертонии. Основные проявления тиреотоксикоза изучены на животных, которым вводили препараты тиреоидных гормонов или добавляли к пище высушенную щитовидную железу. При этом у собак наблюдалась потеря массы тела, усиление деятельности сердца и легких, повышение основного обмена, температуры тела, трофические расстройства, понос, рвота. Повышалась чувствительность к гипоксии, усиливалась возбудимость всех звеньев рефлекторной дуги, увеличивалась двигательная активность. При избытке тироксина и трийодтиронина происходит увеличение числа митохондрий в клетке, их набухание ("болезнь митохондрий"), повышение активности окислительных ферментов (сукцинатдегидрогеназы, цитохромоксидазы, ос-глицерофосфатдегидрогеназы), Na+, К+-АТФазы и др. Точка зрения, что повышение температуры тела у больных с тиреотоксикозом является следствием разобщения окислительного фосфорилирования, не получила подтверждения [Теппермен Дж., 1989]. Глубокая перестройка метаболизма клетки делает ее более чувствительной к ?-миметическим эффектам катехоламинов. Отрицательный азотистый баланс при тиреотоксикозе свидетельствует о преобладании катаболизма белков. Вследствие усиленного распада гликогена в печени и мышечной ткани отмечается гипергликемия. Утилизация глюкозы тканями ускорена, активность гексокиназы повышена. Избыток тиреоидных гормонов тормозит переход углеводов в жиры, ускоряет распад холестерина и его утилизацию в тканях, интенсифицирует окисление жиров в печени, а также повышает чувствительность жировой ткани к липолитическому действию адреналина. Следствием перечисленных изменений являются усиленная мобилизация жира из депо, объясняющая похудание больных тиреотоксикозом, гипохолестеринемия и гиперкетонемия. Тиреоидные гормоны нарушают метаболизм сердечной мышцы. Обнаруживаются дистрофические изменения в миокарде, нарушение предсердно-желудочковой проводимости, перегрузка левого желудочка. Нарушается энергетическое и пластическое обеспечение сердечной деятельности. "Тиреотоксическое" сердце неадекватно реагирует на холинэргические и адренэргические воздействия. Нарушение секреции кальцитонина. Некоторые последствия тиреоидэктомии, по-видимому, обусловлены выпадением секреции белкового гормона щитовидной железы – кальцитонина. Образование кальцитонина нарушается также при гипофункции щитовидной железы, вызванной тиреостатическими веществами, и гипертиреозе эндогенного и экзогенного происхождения. Некоторые случаи избыточной секреции кальцитонина связаны с опухолями, происходящими из интерфолликулярных С-клеток щитовидной железы, в которых синтезируется этот гормон. О нарушении секреции кальцитонина у человека известно очень мало. Возможно, с ее увеличением связано происхождение ложного гипопаратиреоза – заболевания, при котором, несмотря на нормальное функционирование околощитовидных желез, наблюдаются гипокальциемия и другие сдвиги фосфорно-кальциевого обмена. Нарушения функций околощитовидных желез Гипофункция околощитовидных желез. Выпадение функции околощитовидных желез ведет к развитиюпаратиреопривной тетании. В эксперименте ее воспроизводят удалением желез у собак и кошек. Через 1 – 2 сут после операции животные становятся вялыми, отказываются от пищи, у них отмечается жажда, снижение температуры тела, одышка. В результате уменьшения концентрации кальция в крови (с 2,25 – 2,99 до 1 – 1,25 ммоль/л) изменяется соотношение одновалентных (Na+, К+) и двухвалентных (Ca2+, Mg2+) ионов. Следствием этого является резкое повышение нервно-мышечной возбудимости. Появляется мышечная ригидность, нарушается походка. При этом наблюдаются множественные фибриллярные сокращения мышц всего тела, к которым затем присоединяются приступы клонических судорог. Клонические судороги переходят в тонические, наступает опистотонус (резкое выгибание туловища с запрокинутой головой). Судорожные сокращения могут распространяться и на внутренние органы (пилороспазм, ларингоспазм). Во время одного из таких приступов животное погибает. Одновременно с гипокальциемией в крови увеличивается содержание неорганического фосфора. Нарушения минерального обмена обусловлены торможением резорбции костной ткани, всасывания кальция в кишках и увеличением реабсорбции фосфатов в канальцах нефронов. В патогенезе паратиреопривной тетании определенное значение придают нарушению дезинтоксикационной функции печени. Кормление паратиореоидэктомированных собак мясом усиливает тетанию в результате недостаточного обезвреживания продуктов азотистого обмена, в частности ослабления способности печени превращать аммиак в мочевину. При наличии добавочных околощитовидных желез (у кроликов, крыс) или сохранении во время операции кусочка железы у паратиреоидэктомированных животных развивается хронический гипопаратиреоз, клиническая картина которого известна как паратиреопривная кахексия. Она характеризуется исхуданием, анорексией, повышенной нервно-мышечной возбудимостью, диспепсией и разнообразными трофическими расстройствами. Гипопаратиреоз у людей развивается чаще всего в результате случайного повреждения или удаления околощитовидных желез при оперативном вмешательстве на щитовидной железе. Относительная гипофункция желез отмечается при интенсивном росте, беременности, лактации и других состояниях, при которых повышена потребность организма в солях кальция. Патогенез и клиническая картина гипопаратиреоза у человека близки к наблюдаемым в эксперименте. Повышение нервно-мышечной возбудимости обнаруживают по появлению мышечных сокращений при раздражении двигательных нервов гальваническим током определенной силы, при сдавливании руки выше локтя или легком постукивании по коже в месте выхода лицевого нерва кпереди от наружного слухового прохода. У детей на первом-втором году жизни, обычно в сочетании с рахитом, нередко наблюдается спазмофилия – периодические судороги мышц, возникающие при повышении окружающей температуры и других неблагоприятных воздействиях. Большую опасность при этом представляет ларингоспазм, который может вызвать асфиксию и смерть. Гиперфункция околощитовидных желез. При повышенной секреции паратирина усиливается образование и активность остеокластов, осуществляющих резорбцию кости, и тормозится их дифференцировка в остеобласты, участвующие в новообразовании костной ткани. Наряду с этим повышается всасывание кальция в кишках, уменьшается обратное всасывание фосфатных ионов в канальцах нефронов, повышается образование растворимых солей кальция в костной ткани и нерастворимого фосфата кальция в различных органах, в том числе в почках (см. раздел XIV – "Нарушения водноэлектролитного обмена"). Гиперпаратиреоз у экспериментальных животныхвоспроизводят введением экстракта паращитовидных желез животных или очищенного паратирина. Под влиянием больших доз гормона уровень кальция в крови достигает 5 ммоль/л, концентрация неорганического фосфора снижается, усиливается выделение фосфора с мочой. Хотя паратирин и усиливает несколько канальцевую реабсорбцию ионов кальция, выведение их с мочой повышается за счет значительной гиперкальциемии. Возникают обезвоживание организма, рвота, лихорадка, острая почечная недостаточность, ведущие животного к гибели. Экспериментальный хронический гиперпаратиреоз отличается от острой интоксикации паратирином. При этом наблюдается прогрессирующее разрежение костной ткани (остеопороз), отложение солей кальция в почках, легких, сердце и других внутренних органах вплоть до полного их обызвествления. Стенки сосудов становится плотными и ломкими, давление крови повышается. Животные погибают, как правило, от уремии. Происхождение гиперпаратиреоза у людей связывают с аденомой или гиперплазией околощитовидных желез. Развивающаяся при этом генерализованная фиброзная остеодистрофия характеризуется болью в мышцах, костях и суставах, размягчением костей, резкой деформацией скелета. Минеральные компоненты "вымываются" из костной ткани и откладываются в мышцах и внутренних органах (это явление образно называют перемещением скелета в мягкие ткани). Развиваются нефрокальциноз, сужение просвета канальцев нефронов и закупорка их камнями (нефролитиаз) и в итоге – тяжелейшая почечная недостаточность. Вследствие известковых отложений в стенках магистральных сосудов нарушаются гемодинамика и кровоснабжение тканей. Нарушения функции надпочечных желез Гипофункция коркового вещества надпочечных желез. Броун-Секар установил, что удаление обеих надпочечных желез (адреналэктомия) вызывает в организме ряд патологических изменений,несовместимых с жизнью. При этом решающее значение имеет выпадение функции коркового вещества, в то, время как недостаточность мозгового вещества компенсируется выработкой катехоламинов хромаффинными клетками симпатической части вегетативной нервной системы. Острая недостаточность коркового вещества надпочечных желез развивается у собак, кошек и морских свинок, т. е. у тех животных, которые не имеют дополнительной адренокортикальной ткани. Через 1 – 2 дня после адреналэктомии появляются мышечная слабость, анорексия, рвота, понос. Животные апатичны, слабо реагируют на внешние раздражители. Температура тела снижается. Адреналэктомиро-ванные животные весьма чувствительны к инфекции, интоксикации, переохлаждению и т. д. Симптомы острой недостаточности надпочечных желез прогрессируют с течением времени. После адреналэктомии истощается депо гликогена в печени и мышцах. Благодаря уменьшению активности глюкозо-6-фосфатазы снижается скорость гликогенолиза в клетках печени. Одновременно замедляется образование глюкозы из аминокислот (гликонеогенез). Все это ведет к гипогликемии, уменьшает чувствительность к инсулину, повышает толерантность к глюкозе. Нарушение обмена белков и нуклеиновых кислот характеризуется преобладанием процессов диссимиляции, гиперазотемией. На поздней стадии недостаточности надпочечных желез снижается артериальное давление. Гипотензия обусловлена уменьшением объема циркулирующей крови, брадикардией и ослаблением вазоконстрикторного действия катехоламинов, для которых кортикостероиды являются пермиссивными факторами. В генезе острой недостаточности надпочечных желез важнейшую роль играют нарушения водно-электролитного обмена. В физиологических условиях альдостерон поддерживает работу натриевого "насоса", обеспечивает реабсорбцию ионов натрия в дистальных частях канальцев нефронов, а гликокортикоиды повышают клубочковую фильтрацию. После удаления надпочечных желез в результате потери ионов натрия с мочой понижается его содержание в плазме крови. Вначале отмечается полиурия, а затем олигурия и анурия. Одновременно развивается "водное отравление", т. е. усиленная гидратация клеток. Это объясняется тем, что вследствие нарушения работы натриевого "насоса" увеличивается внутриклеточная концентрация ионов натрия и повышается осмотическое давление. Резкое повышение концентрации ионов калия в плазме крови является причиной нарушения биоэлектрических процессов, силы и ритма сердечных сокращений (вплоть до мерцательной аритмии), ослабления сократительной способности исчерченной мышечной ткани. В терминальной стадии острой недостаточности надпочечных желез полностью прекращается мочеотделение, замедляется пульс, дыхание. Животно; впадает в коматозное состояние и погабает. Срок жизни адреналэктомированных собак и кошек колеблется от 2 – 3 до 9 – 11 сут. Отсутствие мозгового вещества надпочечных желез и отрицательные последствия операционной травмы затрудняют патофизиологический анализ изменений, вызванных у адреналэктомированных животных выпадением функции коркового вещества. Новый метод экспериментального моделирования гипофункции коркового вещества надпочечных желез основан на применении химических веществ (ингибиторов), которые при введении в организм избирательно выключают секрецию кортикостероидов. Наиболее эффективным является введение собакам хлодитана. Острая адренокортикальная недостаточность у человека может возникнуть в результате кровоизлияния в надпочечные железы. Хроническая недостаточность коркового вещества надпочечных желез у человека известна под названиемболезни Аддисона, или бронзовой болезни. Она возникает чаще всего при туберкулезе надпочечных желез, а также атрофии коркового вещества после перенесенных тяжелых инфекционных заболеваний или продолжительного лечения кортикостероидными препаратами. Для хронического гипоадренокортицизма характерны исхудание, быстрая физическая и психическая утомляемость, плохой аппетит, дисфункция пищевого канала, артериальная гипотензия, прогрессирующая гиперпигментация кожи. Механизм гиперпигментации связан с усилением мелано-цитстимулирующей активности гипофиза, которая сопутствует возникающему при гипоадренокортицизме увеличению секреции кортикотропина. Разнообразные патогенные воздействия – травма, инфекция, кровопотеря и даже экстракция зуба – у больного аддисоновой болезнью могут привести к острой недостаточности коркового вещества надпочечных желез. Гиперфункция и дисфункция коркового вещества надпочечных желез. Ведущими патогенетическими звеньями, определяющими клиническую картину гиперфункции и дисфункции коркового вещества надпочечных желез, являются избыточная секреция кортизола (болезнь и синдром Иценко – Кушинга), альдостерона (гиперальдостеронизм), андрогенов (адреногенитальный синдром, андростерома) или эстрогенов (кортикоэстрома). Этиология болезни и синдрома Иценко–Кушинга различна, но клинические симптомы и патогенез нарушений весьма сходны. Болезнь возникает вследствие чрезмерной секреции кортикотропина при опухоли аденогипофиза или нарушении диэнцефальной регуляции, синдром – в результате первичного поражения коркового вещества надпочечных желез опухолью. Под влиянием избыточного количества гликокортикоидов возникают тяжелые эндокринно-обменные нарушения. Развивается ожирение с преимущественным отложением жира на туловище, лицо становится лунообразным, гиперемированным, на коже живота появляются сине-багровые полосы растяжения. Отрицательный азотистый баланс свидетельствует о преобладании катаболических процессов. Повышение распада белков приводит к дистрофическим изменениям в мышцах, костях и суставах. Остеопороз может достигать такой степени, при которой возникают спонтанные компрессионные переломы позвонков. Под действием гликокортикоидов в печени повышается содержание гликогена, развивается стойкая гипергликемия (стероидный диабет). Последняя является результатом интенсификации гликонеогенеза и повышения активности глюкозо-6-фосфатазы в печени. Вследствие увеличения объема крови и повышения чувствительности сосудистой стенки к действию катехоламинов повышается артериальное давление. В лимфоидной ткани происходит усиленный распад нуклеопротеидов. Избыток гликокортикоидов вызывает лимфоцитопению и эозинопению, угнетает продукцию антител и реакции клеточного иммунитета. Нередко возникают язвенные поражения слизистой оболочки желудка и кишок, множественные кровоизлияния. Аденома, происходящая из клеток клубочковой зоны коркового вещества надпочечных желез, может стать источником образования избыточного количества альдостерона. В результате развивается первичный гиперальдостеронизм, или болезнь Конна. Секреция гликокортикоидов при болезни Конна не нарушена. Под влиянием избытка альдостерона в организме задерживаются ионы натрия и вода. Повышенная концентрация ионов натрия в клетках, в частности сосудистой стенки, повышает их чувствительность к симпатическим медиаторам. В результате развивается артериальная гипертензия. Потеря значительного количества ионов калия и хлора является причиной миастении и парезов, приступов судорог скелетных мышц, нарушения сократительной функции миокарда, негазового алкалоза. Канальцы нефро-нов подвергаются дистрофическим изменениям и теряют способность реагировать на вазопрессин. Так возникает полиурия, объясняющая отсутствие отеков при первичном гиперальдостеронизме. При многих патологических состояниях (сердечная недостаточность, цирроз печени, заболевания почек, сопровождающиеся нарушением почечного кровотока и др.) наблюдается избыточная продукция альдостерона -вторичный гиперальдостеронизм. В механизме его развития ведущую роль могут играть снижение артериального давления, гиповолемия, недостаточность депрессорных систем почек и повышение секреции ренина юкстагломерулярными клетками с последующим образованием ангиотензина II и III (рис. 24.6). Известно, что клетки клубочковой зоны коры надпочечников усиливают продукцию альдостерона под влиянием ангиотензина II и III, АКТГ (пермиссивное действие), избытка К и дефицита Na- в плазме крови. Подавляют секрецию альдостерона предсердный натрийуретический гормон (антагонист ангиотензина II), дофамин, высокая внеклеточная концентрация Na-. 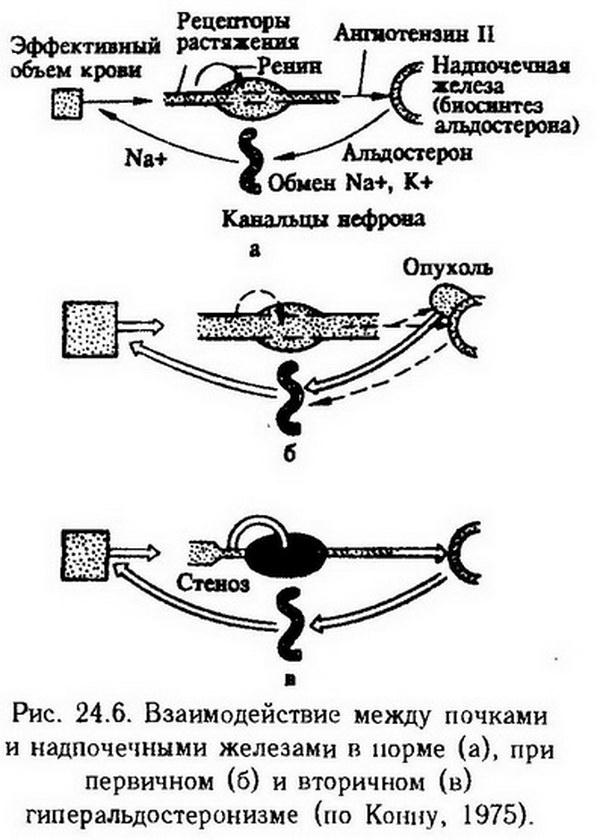 Вторичный гиперальдостеронизм способствует задержке натрия и воды в организме, потере калия и хлора, развитию отеков, повышению артериального давления. Адреногенитальный синдром у детей является клиническим проявлением врожденной гиперплазии коркового вещества надпочечных желез. Возникновение синдрома связывают с генетически обусловленной блокадой синтеза кортизола. При этом растормаживается секреция кортикотропина, который в свою очередь стимулирует выработку андрогенов надпочечных желез. Последние оказывают вирилизирующее действие (появление и усиление признаков мужского пола) уже во внутриутробном периоде. Последствия гормональных нарушений бывают различными – от легкой маскулинизации до грубых анатомических аномалий физического и полового развития. У мальчиков данная патология обусловливает преждевременное развитие вторичных половых признаков, девочки часто рождаются с явлениями псевдогермафродитизма. Один из вариантов адреногенитального синдрома у детей характеризуется более глубоким повреждением ферментов биосинтеза стероидных гормонов и сопровождается тяжелыми нарушениями водно электролитного обмена (синдром потери соли). Без заместительной терапии кортикостероидами дети погибают в раннем возрасте. Если синтез гормонов блокирован на завершающей стадии. катализируемой 11-гидроксилазой, образуется избыток дезоксикортикостерона – стероида с минералокортикоидными свойствами. В результате развивается тяжелая артериальная гипертензия. Гиперандрогенизация и гиперэстрогенизация организма могут наблюдаться у детей и взрослых при опухолевом перерождении сетчатой (внутренней) зоны коркового вещества надпочечных желез. В зависимости от соответствия характера гормональной секреции полу больного развиваютсявирилизация у женщин, феминизация у мужчин (гетеросексуальный синдром) или преждевременное половое развитие у лиц обоего пола (изосексуальный синдром). Нарушение функций мозгового вещества надпочечных желез. Чрезмерная секреция катехоламинов наблюдается прифеохромоцитоме – опухоли, происходящей из мозгового вещества надпочечных желез. Она сопровождается пароксизмальной или стойкой артериальной гипертензией или приступами, во время которых возникает тахикардия, повышается артериальное давление, появляется резкая боль в надчревной области, обильное потоотделение. Приступы объясняются массивным выбросом в кровь адреналина и норадреналина под влиянием психической или физической нагрузки и других провоцирующих воздействий. Нарушения функций половых желез Гипофункция половых желез. Недостаточность эндокринной функции половых желез может быть обусловлена удалением их хирургическим путем (кастрация), разрушением воспалительным процессом, токсинами,. ионизирующей радиацией, расстройствами гипоталамо-гипофизарной регуляции. Отдельную группу составляют врожденные нарушения полового развития, вызванные хромосомными аномалиями или мутацией генов. Неопущение яичек в мошонку (крипторхизм), гипоплазия яичек и яичников, врожденное отсутствие половых желез, псевдогермафродитизм – все эти аномалии развития сопровождаются гипогонадизмом. Последствия кастрации наиболее демонстративны у тех видов животных, у которых отчетливо выражен половой диморфизм. Кастрация растущих животных приводит к удлинению и истончению костей, уменьшению массы мышечной ткани, избыточному отложению жира. У самцов отмечается недоразвитие полового члена, семенных пузырьков и предстательной железы; у самок – недоразвитие матки и ее придатков, отсутствие циклических изменений. Описанные изменения обусловлены выпадением морфогенетического, анаболического и специфического (андрогенного и эстрогенного) действия половых стероидов. Кастрация после полового созревания отражается главным образом на обмене веществ и функции половых желез, вызывая их атрофию, исчезновение половых инстинктов, прекращение циклических процессов в матке, влагалище и маточных трубах, инволюцию вторичных половых признаков. Рано появляются признаки атеросклероза, изменяется соотношение возбудительного и тормозного процессов в коре большого мозга. Изменения, вызываемые кастрацией или гипогонадизмом у людей до наступления половой зрелости, очень сходны с наблюдаемыми в эксперименте. Соответствующий клинический синдром называется евнухоидизмом. У 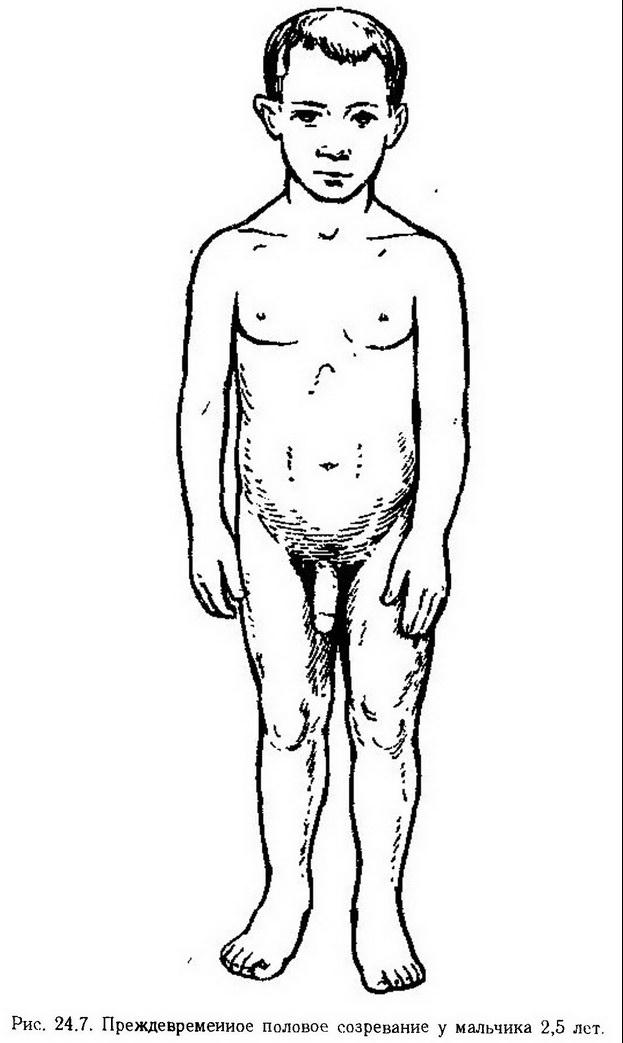 меньшение выработки прогестерона вследствие гормональной недостаточности желтого тела может быть причиной спонтанных абортов, поскольку прогестерон необходим для осуществления секреторных процессов в эндометрии и расслабления миометрия. Введение в этих случаях препаратов прогестерона позволяет сохранить беременность. меньшение выработки прогестерона вследствие гормональной недостаточности желтого тела может быть причиной спонтанных абортов, поскольку прогестерон необходим для осуществления секреторных процессов в эндометрии и расслабления миометрия. Введение в этих случаях препаратов прогестерона позволяет сохранить беременность.Возрастное угасание гормональной активности половых желез лежит в основе климакса у женщин и мужчин. Климактерический синдром иногда принимает патологическое течение и требует лечения. Гиперфункция половых желез. Усиление гонадотропной функции гипофиза или гормонально-активная опухоль семенников и яичников в раннем возрасте обусловливают преждевременное половое созревание. Под влиянием избыточного количества андрогенов мальчики превращаются в "маленьких геркулесов" с короткими конечностями и сильными мышцами (рис. 24.7). При увеличенной секреции гонадотропинов в семенных канальцах яичка находят зрелые сперматозоиды. Наружные половые органы гипертрофированы, в том числе яички, что позволяет отличить эту патологию от адреногенитального синдрома. Гиперандрогенизация вызывает раннее появление вторичных половых признаков – низкий голос, оволосение лобка, лица, подмышечных впадин и др. У девочек под влиянием избытка эстрогенов очень рано появляются менструации, наблюдаются рост молочных желез, оволосение лобка, отложение жира в области таза и бедер. Повышенная секреция гормонов яичника у взрослых женщин вызывает нарушения менструального цикла и другие сдвиги. Так, например, чрезмерное поступление в кровь эстрогенов при персистенции фолликула (состояние, при котором фолликул не достигает полного созревания и не наступает овуляция) служит частой причиной маточных кровотечений. Повышенная секреция прогестерона сопровождается аменореей, увеличением объема матки и молочных желез. Стресс и общий адаптационный синдром Одним из достижений современной медицины является раскрытие важной роли эндокринных желез, в частности системы гипофиз – корковое вещество надпочечных желез, в адаптации организма к действию патогенных факторов. Широкую известность приобрела теория канадского ученого Ганса Селье о стрессе. Термином "стресс" (от англ. stress – напряжение) обозначают неспецифическую реакцию организма, возникающую под влиянием любых сильных воздействий (стрессоров) и сопровождающуюся перестройкой защитных систем организма. Селье обратил внимание на то, что, несмотря на разнообразие стрессоров (травма, инфекция, переохлаждение, интоксикация, наркоз, мышечная нагрузка, сильные эмоции и т. д.), все они приводят к однотипным изменениям в вилочковой, надпочечных железах, в лимфатических узлах, составе крови и обмене веществ. В опытах на крысах он наблюдал типичную триаду, которая включает гипертрофию коркового вещества надпочечных желез, инволюцию вилочково-лимфатического аппарата и геморрагические язвы на слизистой оболочке желудка и двенадцатиперстной кишки. Стресс проявляется в виде общего адаптационного синдрома, который состоит из трех последовательных стадий: реакции тревоги, стадии резистентности и стадии истощения. Реакция тревоги означает немедленную мобилизацию защитных сил организма. Она состоит из фазы шока и противошока. В фазе шока наблюдаются гипотония мышц и артериальная гипотензия, гипотермия, гипогликемия, сгущение крови, эозинопения, повышение проницаемости капиллярных сосудов. Инволюция лимфоидной ткани, отрицательный азотистый баланс, язвенные поражения желудка свидетельствуют о преобладании процессов катаболизма.Фаза противошока характеризуется изменениями в обратном направлении (повышение артериального давления, мышечного тонуса, содержания глюкозы в крови), ведущими к развитию следующей стадии – стадии резистентности. Основное патогенетическое звено фазы противошока – это стойкое усиление секреции кортикотропина и кортикостероидов. В стадии резистентностигипертрофируется корковое вещество надпочечных желез и секретируется большое количество гормонов, активизируются анаболические процессы, усиливается гликонеогенез. Защитные реакции организма, обусловливающие возможность жизни при стрессе, Селье назвал синтоксическими. При длительном действии повреждающего агента адаптация нарушается. Истощение функциональных резервов и атрофия коркового вещества надпочечных желез, снижение артериального давления, распад белковых веществ характеризуют переход стадии резистентности в стадию истощения (дистресс). Исход стресса зависит от соотношения силы и длительности действия стрессора и потенциальных возможностей защитных сил организма. Биологическое значение адаптационного синдрома заключается не только в том, что во второй, наиболее длительной его стадии повышается резистентность организмапо отношению к фактору, вызвавшему состояние стресса, но и в том, что при не очень сильном и длительном стрессе может создаваться или повышаться неспецифическая резистентность" организма к различным другим факторам. Она проявляется в повышенной выживаемости после воздействия летальных агентов или же в уменьшении воспаления, предупреждении гиперэргических реакций, поражении сердца, почек и других органов, возникающих под влиянием патогенных факторов. Например, кровопусканием (стрессор) можно ослабить воспаление, вызванное внутрикожным введением формалина. Мышечное напряжение или травма защищает животное от некроза в миокарде, вызываемого внутривенной инъекцией протеолитических ферментов. Кортикотропин и кортикостероиды играют в формировании неспецифической резистентности ведущую роль, поэтому их называют адаптивными гормонами (рис. 24.8). Систематическое воздействие на организм слабых и умеренных раздражителей (например, холодный душ, физические упражнения) поддерживает готовность эндокринной системы к адаптивным реакциям. 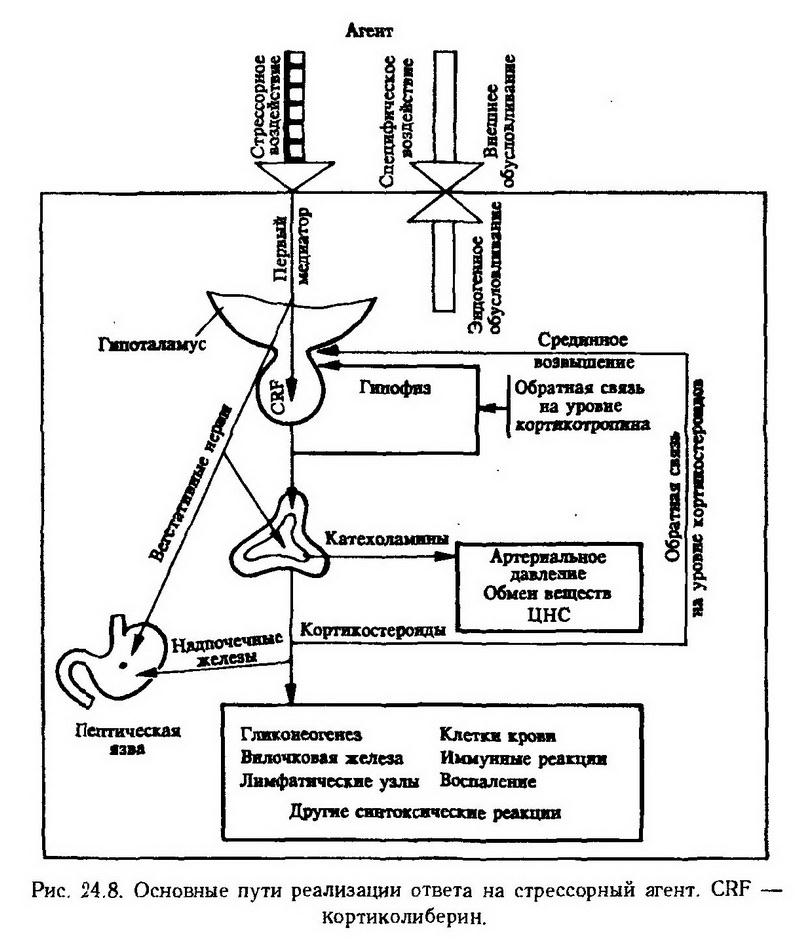 Недостаточность адаптации или ее отклонения в противоположную сторону являются, по Селье, причиной развития болезней адаптации. Экспериментальное подтверждение этого положения состоит в возникновении гипертензии, нефросклероза, гиалиноза органов, усилении воспалительных реакций после введения больших доз дезоксикортикостерона, который обладает провоспалительными свойствами. Введение животным гликокортикоидов (противовоспалительные гормоны) тормозит воспаление, но в то же время подавляет иммунные реакции, вызывает язвенное поражение желудка и двенадцатиперстной кишки, создает условия для возникновения некроза миокарда. Недостаточность секреции гликокортикоидов способствует гиперэргическому течению иммунных процессов, снижает устойчивость к болезнетворным воздействиям. К болезням адаптации Селье относит ревматизм, бронхиальную астму, некоторые болезни почек, сердца и сосудов, ряд кожных и других заболеваний. В их возникновении большое значение придается кондициональным (обусловливающим) факторам. Этими факторами могут быть переохлаждение, перегревание, физическое переутомление, отягощенная наследственность, избыточное потребление поваренной соли. Совместное введение кортикостероидов и натрия хлорида создает фон, на котором различные раздражители вызывают некротические изменения в сердечной мышце. Теория Г. Селье возникла на основе изучения эндокринных механизмов приспособительных реакций организма. Между тем еще раньше трудами У. Кеннона, Л. А. Орбели и их учеников было создано учение об адаптационно-трофической роли симпатической части вегетативной нервной системы в защитно-компенсаторных реакциях. Некоторые проявления стресса (появление язв) наблюдаются у гипофизэктомированных животных. Следовательно, невозможно сводить все разнообразие этих проявлений к одной только гормональной перестройке. Стресс является сложной нервно-гуморальной реакцией, в развитии которой принимают участие нервная система и эндокринные железы. Вместе с тем следует подчеркнуть, что теория Г. Селье оказала и продолжает оказывать большое влияние на развитие медицины. Она дала теоретическое обоснование кортикостероидной терапии. На основе этой теории разработан новый подход к проблеме старения, получила объяснение неспецифическая терапия (кровопускание, аутогемотерапия, иглоукалывание). Основные положения этой теории успешно разрабатываются и в настоящее время. | ||||||||||||||||||||||||||
