зайко. Н. Н. Зайко Патологическая физиология Введение Предмет и задачи патологической физиологии Патологическая физиология есть наука, изучающая жизнедеятельность больного организма. Программа
 Скачать 7.32 Mb. Скачать 7.32 Mb.
|
|
Глава 26. Патологическая физиология соединительной ткани Соединительная ткань как единая система Соединительная ткань – это комплекс клеток, волокон и основного вещества, которые объединяются общностью происхождения и выполняемых функций (рис. 26.1) и представляют собой единое целое. В 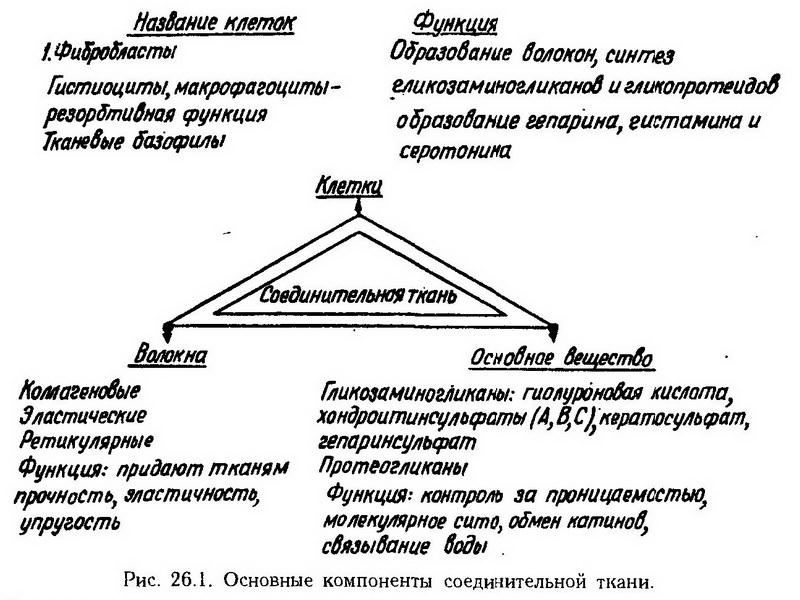 изучение функций и структуры соединительной ткани большой вклад внесли И. И. Мечников, А. А. Максимов, А. А. Заварзин, Л. Ашоф. Особая заслуга в этом отношении принадлежит А. А. Богомольцу, который первым предложил называть соединительную ткань "физиологической системой соединительной ткани". Наиболее характерными признаками этой системы являются универсальность, гетерогенность и высокая приспособляемость (А. В. Шехтер). изучение функций и структуры соединительной ткани большой вклад внесли И. И. Мечников, А. А. Максимов, А. А. Заварзин, Л. Ашоф. Особая заслуга в этом отношении принадлежит А. А. Богомольцу, который первым предложил называть соединительную ткань "физиологической системой соединительной ткани". Наиболее характерными признаками этой системы являются универсальность, гетерогенность и высокая приспособляемость (А. В. Шехтер).Универсальность определяется широким распространением соединительной ткани в организме: она образует строму внутренних органов, основу кожи, серозной и синовиальной оболочек, связки, сухожилия, апоневрозы, оболочки мышц и нервов, участвуете образовании сосудистой стенки. Гетерогенность обусловлена разнообразными проявлениями особенностей клеток и межклеточных компонентов соединительной ткани. Три типа клеток и волокнистых структур, несколько типов гликозаминогликанов – все это делает бесконечным количество комбинаций, которые могут возникнуть при патологии соединительной ткани. Кроме того, все клетки соединительной ткани способны к размножению и дифференцировке, что обусловливает наличие в тканях клеток различной степени зрелости и функциональной активности (например, моноцитарный ряд: стволовые, монобласты, моноциты). Все это создает огромный резерв, который может быть мобилизован для пластических и других целей, например при заживлении ран. С гетерогенностью соединительной ткани сочетается необычайное разнообразие ее функций. А. А. Богомолец различал пластическую, защитную, трофическую и опорную функции. К ним прибавилась еще одна – морфогенетическая, смысл которой заключается в том, что соединительная ткань служит не только субстратом для прикрепления клеток ("пространственный ориентир"), но влияет на дифференцировку клеток и их морфогенез (коллаген). Допускают, что в коллагеновых волокнах имеются полипептидные участки, которые передают контактирующим с ним клеткам сигналы, специфически влияющие на их метаболизм и двигательную активность. Регуляция функций соединительной тканиосуществляется на всех уровнях организации – на уровне клетки, органа, организма. На клеточном уровне имеют значение межклеточные контакты посредством эффекторного вещества, тесно связанного с мембраной клетки, и медиаторов, выделяемых в межклеточное пространство: лимфокины, монокины, фиброкины, лаброкины (соответственно медиаторы лимфоцитов, моноцитов, фибробластов, тканевых базофилов). Кроме специфических медиаторов, для которых на клеточных мембранах имеются соответствующие рецепторы, различают еще неспецифические – простагландины, мурамидаза, фибронектин, протеазы. Взаимоотношение между элементами соединительной ткани осуществляется по принципу обратной связи, что в нормальных условиях обеспечивает адекватность ответов, а при патологиивысокую приспособляемость и надежность. Ауторегуляция "внизу", основанная на кооперативных взаимодействиях между клетками, дополняется эндокринной и нервной регуляцией, построенной по иерархическому принципу "сверху вниз". В этом отношении важная роль принадлежит гормону передней доли гипофиза – соматотропину. Он стимулирует размножение клеток соединительной ткани и синтетические процессы в них. В то же время кортикотропин и гликокортикоиды угнетают пролиферацию, вызывают преждевременную дифференцировку и созревание фибробластов, что сопровождается нарушением коллагеногенеза. Роль инсулина в регуляции структуры и функции соединительной ткани состоит в том, что он ускоряет обмен гиалуроновой кислоты и хондроитинсульфата. По-видимому, этим объясняются серьезные нарушения со стороны соединительной ткани вообще и сосудистой стенки, в частности, при сахарном диабете (диабетические ангиопатии). Нарушение регуляции системы соединительной ткани также может происходить на любом уровне. Внутри соединительной ткани могут нарушаться сложившиеся ауторегуляторные отношения и ее связи с клетками паренхимы. Нарушение может проявляться преимущественно в том или ином органе (суставы при ревматизме, кожа при системной красной волчанке). Наконец, дисрегуляция соединительной ткани может проявиться во всех органах и в организме в целом (разрастание костей при акромегалии, карликовость и слизистый отек при гипофункции щитовидной железы). Состояние соединительной ткани играет важную роль при старении. В свое время А. А. Богомолец отмечал, что "старение начинается именно с соединительной ткани". Причину старения он видел в том, что происходят физико-химические изменения ее макромолекулярных компонентов – "созревание клеточных коллоидов и мицеллоидов, превращение их в преципитаты и флокуляты, образующие биологически инертные включения, тормозящие жизнедеятельность клеток". Современные исследования показали, что с возрастом в соединительной ткани действительно происходят изменения, которые нарушают ее трофическую, защитную и другие функции. В коже, сухожилиях, хрящевой ткани, аорте уменьшается количество клеток, их величина, а также размер ядер. Размножение фибробластов, например, при воспалении у стариков замедлено. В волокнистых структурах возрастные изменения выражаются увеличением количества поперечных связей между волокнами коллагена. Коллаген с избыточным количеством макромолекулярных "сшивок" приобретает новые свойства. Он становится более устойчивым к температурным воздействиям, понижается его растворимость, способность связывать воду. Метаболически стабильный в норме, коллаген становится все более инертным. Замедляется его самообновление, что неизбежно приводит к накоплению в молекулах новых ошибок. В основном веществе уменьшается количество гиалуроновой кислоты, что, вероятно, снижает способность организма с возрастом связывать воду. В то же время количество хондроитинсульфата в сосудистой стенке увеличивается. Последнее способствует кальцификации сосудов, так как сульфатированные гликозаминогликаны обладают сродством к ионам кальция. Защитная функция соединительной ткани выражается тем, что участвуя в строении кожи, слизистой оболочки, фиброзных капсул, а также в структурах специализированных барьеров (глия в гематоэнцефалическом барьере), она способствует созданию механических барьеров. Клетками соединительной ткани определяется такая форма защиты, как фагоцитоз (макрофагоциты), а также способность отграничивать поврежденную ткань от нормальной (грануляционный вал). Наконец, клетки соединительной ткани, вступая во взаимодействие с лимфоцитами, участвуют в иммунном ответе. А. А. Богомолец был первым, кто в полной мере оценил защитную роль соединительной ткани. Он и его ученики показали, что низкая реактивность соединительной ткани, как правило, сочетается с более тяжелым течением болезней: медленнее заживают раны, хуже срастаются переломы. Все это позволило предположить, что воздействием на соединительную ткань можно ухудшать или улучшать течение болезни, делать ее менее тяжелой. Необходимо было только найти способ, чтобы стимулировать ее функции. Определенных результатов можно было бы достичь такими методами, как лечебная физкультура, массаж, инсоляция, диета, но А. А. Богомолец имел в виду специфическую избирательную стимуляцию всех элементов соединительной ткани, где бы они в организме ни находились. В итоге это было достигнуто иммунологическим путем, т. е. введением людям сыворотки, полученной в результате иммунизации животных (лошадей) органами, богатыми соединительной тканью (костный мозг, селезенка). Эта сыворотка получила сокращенное название АЦС(антиретикулярная цитотоксическая сыворотка) и была детально изучена А. А. Богомольцем и его учениками, а затем применена в клинике. Было установлено, что эффект антиретикулярной цитотоксической сыворотки зависит от ее дозы. Большие дозы сыворотки оказывали цитотоксическое действие, т. е. разрушающее клетки соединительной ткани, малые – стимулирующее. Это выражалось повышением обмена веществ в макрофагоцитарных элементах ткани и активизацией фагоцитоза, увеличением титра противомикробных антител, нормализацией водно-электролитного и жирового обмена. Активизация энзиматических процессов позволяет соединительной ткани освободиться от балластных веществ, накапливающихся в ней при различных заболеваниях обмена веществ, а также при старении. При этом могут образовываться вещества, которые оказывают неспецифическое действие на клетки организма, составляя общий стимулирующий эффект. Нарушения структуры и функций соединительной ткани Клетки соединительной ткани К клеткам соединительной ткани относятся фибробласты, макрофагоциты (гистиоциты), тканевые базофилы (тучные клетки). Фибробласты Фибробласты являются основными клетками соединительной ткани. С их жизнедеятельностью связано образование и выделение в среду основного межклеточного вещества (гликозаминогликаны), а также синтез и секреция волокнистых структур (коллаген, эластин). Наследственные и приобретенные нарушения синтетической функции фибробластов лежат в основе мукополисахаридозов и других диффузных заболеваний соединительной ткани (см. ниже). Макрофагоциты. Главной функцией этих клеток является фагоцитоз, что и определяет их название. Все макрофагоциты происходят из стволовой кроветворной клетки костного мозга, затем в виде моноцитов они заносятся с током крови в разные органы и здесь, в зависимости от клеточного окружения, приобретают некоторые фенотипические особенности. В печени эти клетки называются звездчатыми ретикулоэндотелиоцитами, в легких- альвеолярными фагоцитами, в серозных полостях – плевральными и перитонеальными макрофагоцитами, в костной ткани – остеокластами. При некоторых структурных и функциональных особенностях этих клеток всем им присуща высокая фагоцитарная и метаболическая активность. В цитоплазме макрофагоцитов содержится большое количество вакуолей и фагосом с большим содержанием ферментов. На поверхностных мембранах этих клеток находятся рецепторы, контакт с которыми разных веществ, в том числе антигенов, приводит клетки в возбужденное состояние. При этом они способны выбрасывать в среду различные ферменты (коллагеназа, эластаза), а также антибактериальные вещества (лизоцим). Макрофагоциты вырабатывают специальные вещества, которые по аналогии с лимфокинами называют монокинами.Монокины оказывают влияние на другие, находящиеся поблизости клетки (микроокружение): одни стимулируют, другие подавляют (колонийстимулирующий, лимфостимулирующий фактор, ингибитор роста клеток и др.) их активность. В этом заключается важная роль макрофагоцитов при воспалении. Установлено, что все макрофагоциты, где бы они ни находились, выполняют единую функцию – очищение организма от вредных и чуждых веществ. Ими могут быть мертвые или живые клетки, в том числе опухолевые, бактерии, вирусы., продукты отработанной аутологичной ткани, антигены, лекарственные препараты, гормоны, микроагрегаты фибрина и т. д. Все, что попадает в клетку, подвергается здесь биотрансформации, а затем выводится, в том числе с секретами (желчью, слюной, потом). Изотопное исследование фагоцитарного клиренса, т. е. скорости очищения организма от какого-нибудь вещества (например, двуокиси тория в виде коллоида), показало, что в норме очищение происходит за определенное время. Фагоцитарный индекс используется для изучения мощности системы мононуклеарных фагоцитов при различных заболеваниях (травма, ожог, хирургическое вмешательство). Например, при гипоксии печени (в норме ее фагоцитарная активность составляет около 80% от общей) скорость клиренса резко понижается. Известно, что блокада этой системы каким-нибудь индифферентным коллоидом, например тушью, снижает резистентность организма к травме, при стимуляции же ее (эстрогенами, холином, зимозаном, сывороткой Богомольца) устойчивость организма повышается. Болезни макрофагоцитарной системы заключаются в том, что нарушается главная ее функция – способность захватывать и переваривать чуждые и вредные организму вещества. В клинике известна группа болезней, которые называются болезнями накопления. Тканевые базофилы Тканевые базофилы содержат в цитоплазме гранулы, метахроматически окрашивающиеся анилиновыми красками. В них находятся высокоактивные вещества – гистамин, гепарин, серотонин (у крыс). Гистамин в клетках представляет собой неактивную форму, так как связан с белково-гепариновым комплексом. Большая часть гистамина находится в тканевых базофилах соединительной ткани и в базофильных гранулоцитах крови: на 106 клеток крови приходится 20–30 мкг гистамина. Освобождение гистамина из гранул (дегрануляция) происходит под влиянием либераторов – веществ низкомолекулярной (моноамины, замещенные ароматические амины, тубокурарин, морфин) и высокомолекулярной (декстраны, пептоны, протеолитические ферменты, яды, комплексы антиген – антитело) природы. Процесс дегрануляции происходит активно с потреблением энергии АТФ. Гистамин, освободившийся из гранул тканевых базофилов, вызывает в тканях характерные изменения – бронхоспазм, расширение сосудов и увеличение их проницаемости (см. "Аллергия"). Основное вещество соединительной ткани Важнейшим компонентом соединительной ткани является основное межклеточное вещество, или матрикс, состоящее в основном из гликозаминогликанов (мукополисахаридов). Последние представляют собой высокомолекулярные полисахариды, в состав которых входят амнносахара, остатки глюкуроновой, сиаловых, серной и уксусной кислот. В соединительной ткани человека имеется 9 различных типов гликозаминогликанов, которые отличаются друг от друга по набору аминосахаров (галактозамин, глюкозамин), по наличию или отсутствию сульфатных групп (сульфатированные и несульфатированные гликозаминогликаны), по типу замещения в аминной группе и т. д. Общим же является то, что полисахаридные цепи со сходной молекулярной массой прикрепляются к одному белковому стержню, формируя таким образом большие полимерные молекулы – протеогликаны. Структура гликозаминогликанов меняется в зависимости от вида ткани: кожа, хрящ; роговица, стекловидное тело и т. д. Биологическое значение гликозаминогликанов не ограничивается тем, что они являются "смазывающими", "склеивающими", "опорными" материалами. Эти биополимеры, легко образующие комплексы с другими молекулами, способны задерживать и освобождать различные вещества., в том числе чуждые и токсичные. Структурная и химическая организация гликозаминогликанов такова, что они могут образовывать упорядоченные сети с порами определенной величины, обеспечивающими селективную проницаемость для различных веществ (молекулярное сито). Именно в этом состоит их барьерная роль. Гликозаминогликаны способны связывать огромное количество воды (до 500 молекул на одну макромолекулу). Нарушение этого свойства может привести к обезвоживанию или, наоборот, к избыточному накоплению воды (микседема). Местом синтеза гликозаминогликанов являются фибробласты. Процесс этот катализируется специфическими ферментами – гликозилтрансферазами, от активности которых зависит скорость сборки полисахаридных цепей и чередование в них гликозильных остатков. Гликозаминогликаны характеризуются интенсивным метаболизмом. Например, период полужизни гиалуроновой кислоты (одного из гликозаминогликанов) составляет 2–4 дня. Деградация гликозаминогликанов осуществляется главным образом в клетках (макрофагоцитах). В этом отношении главную роль играют лизосомальные ферменты – экзо- и эндогликозидазы, сульфогидролазы, и, по-видимому, протеазы. Патология гликозаминогликанов состоит в нарушении их синтеза, распада или того и другого. Описан ряд болезней или синдромов, которые объединены под названием болезней накопления гликозаминогликанов или мукополисахаридозы. Самым характерным для этих болезней является накопление гликозаминогликанов в клетках и в то же время увеличенное выделение их с экскретами. Мезенхимные и паренхиматозные клетки оказываются переполненными некатаболизирующимися гликозаминогликанами, что может закончиться их гибелью. Причиной этих болезней является дефицит ферментов, необходимых для деградации гликозаминогликанов. Исследование in vitro фибробластов людей, страдающих мукополисахаридозами, показало, что меченные изотопами предшественники гликозаминогликанов усваиваются клетками, но медленно выводятся из них. Даже после трехдневного пребывания в культуральной жидкости 70% радиоактивной метки остается внутри клеток. Местом накопления гликозаминогликанов в клетках являются лизосомы. Если в среду, где культивируются эти фибробласты, внести нормальные клетки, то скорость катаболизма гликозаминогликанов увеличивается. Очевидно, нормальные клетки секретируют какие-то вещества, способные проникать в дефектную клетку и исправлять данный дефект. Такими корригирующими веществами являются лизосомальные ферменты. Дефицит этих ферментов носит наследственный характер. В связи с тем, что в тканях человека имеется несколько типов гликозаминогликанов (хондроитинсульфаты, гепарин и гепаринсульфат, кератан-сульфаты, гиалуроновая кислота) и катаболизм каждого из них определяется специфическим ферментом, то болезни накопления дифференцируют на несколько нозологических единиц. Так, например, при накоплении в клетках и гиперэкскреции дерматансульфата и гепаринсульфата (низкая или нулевая активность глюкуронидазы и гиалуронидазы) возникает синдром Гурлер; при накоплении хондроитинсульфата и кератансульфата (дефект фермента галактозамин-6-сульфат-сульфатазы) -синдром Маркио. Оба синдрома и им подобные характеризуются генерализованным поражением соединительной ткани. Гурлер-подобный фенотип характеризуется грубыми изменениями черт лица, тяжелой деформацией скелета, множественным дизостозом, гепатоспленомегалией. При синдроме Маркио наблюдается тяжелое поражение скелета, карликовость, тугоподвижность суставов, недостаточность аортального клапана, помутнение роговицы. Вторым нефибриллярным компонентом основного вещества являются гликопротеиды. Гликопротеиды – это полимеры, состоящие из белкового стержня и ковалентно связанных с ним углеводных компонентов. Моносахаридными составными частями гликопротеидов являются гексозы, пентозы и аминосахара. Количество углеводных цепей может быть различным – от единиц до сотен. Важным компонентом гликопротеидов являются сиаловые кислоты. При ферментативном отщеплении этих кислот свойства гликопротеидов меняются, время полураспада их резко сокращается. Значение гликопротеидов очень велико. Их делят на три группы: функциональные (ферменты, гормоны), интегрированные (в мембранах) и структурные. В данном случае речь идет о последних, т. е. о структурных. Установлено, что структурные гликопротеиды образуются в фибробластах, откуда поступают в окружающую среду. Туда же выходят эластические и коллагеновые волокна (проэластин, проколлаген). Дальнейшее созревание этих волокон в значительной мере определяется присутствием в среде гликопротеидов. Такие специфические морфологические особенности, как диаметр фибрилл, их расположение, ориентировка в пространстве; отношение между эластиновыми и коллагеновыми нитями,- все это связано с количеством и качеством структурных гликопротеидов. Изложенное важно для понимания тех нарушений, которые наблюдаются при патологии соединительной ткани. Изменение синтеза структурных гликопротеидов сказывается на регенерации и, в частности, на заживлении ран, имеет значение при атеросклерозе, нефрите и других заболеваниях. Структурные гликопротеиды представляют интерес и в отношении их иммуногенности. Это важно при решении вопроса о том, какие компоненты соединительной ткани могут дать антигенный стимул при аутоиммунных заболеваниях, в том числе диффузных болезнях соединительной ткани. Установлено, что при парентеральном введении кроликам очищенных структурных гликопротеидов в крови появляются специфические антитела. Этими веществами можно индуцировать аллергические реакции замедленного типа у крыс и у морских свинок. Иногда антитела против структурных гликопротеидов обнаруживаются и у человека. При этом следует иметь в виду то обстоятельство, что гликопротеиды широко распространены в природе и, в частности, содержатся в мембранах микроорганизмов. Поэтому антитела у человека могут появляться в результате микробной инфекции, а уже потом взаимодействовать с гликопротеидами его собственной соединительной ткани. Нарушения волокнистых структур соединительной ткани. Коллаген Структурным компонентом соединительной ткани являются коллагеновые волокна, состоящие в основном из коллагена. Основная функция коллагена заключается в том, чтобы поддерживать специфическую структуру органов и тканей в процессе развития организма. Способность коллагена упорядочивать и стабилизировать клеточные ансамбли, с которыми он контактирует, определяется тем, что он сам строго упорядочен и стабилен. Биосинтез коллагена осуществляется в фибробластах и клетках неисчерченной мышечной ткани в соответствии с генетическим кодом. Информация, передаваемая через мРНК, реализуется в рибосомах в виде полипептидных цепей, которые затем уже внеклеточно претерпевают ряд превращений, ведущих к образованию зрелого нерастворимого коллагена (рис. 26.2). Знание этих этапов важно потому, что нарушение каждого из них может проявиться в виде различных заболеваний соединительной ткани наследственного и ненаследственного характера. Мутация гена, кодирующего синтез коллагена, может изменить аминокислотный профиль первичной полипептидной цепи, а это, в свою очередь, может отразиться на прочности всей фибриллы. При этом следует отметить, что коллагену свойственно особенное соотношение аминокислот и их расположение в цепи. Из всех аминокислот треть приходится на глицин, который занимает каждое третье место в полипептидной цепи. Естественно, что нарушение генетического кода, дефицит материала (глицина) или соответствующего фермента могут привести к нарушению синтеза всей молекулы коллагена. 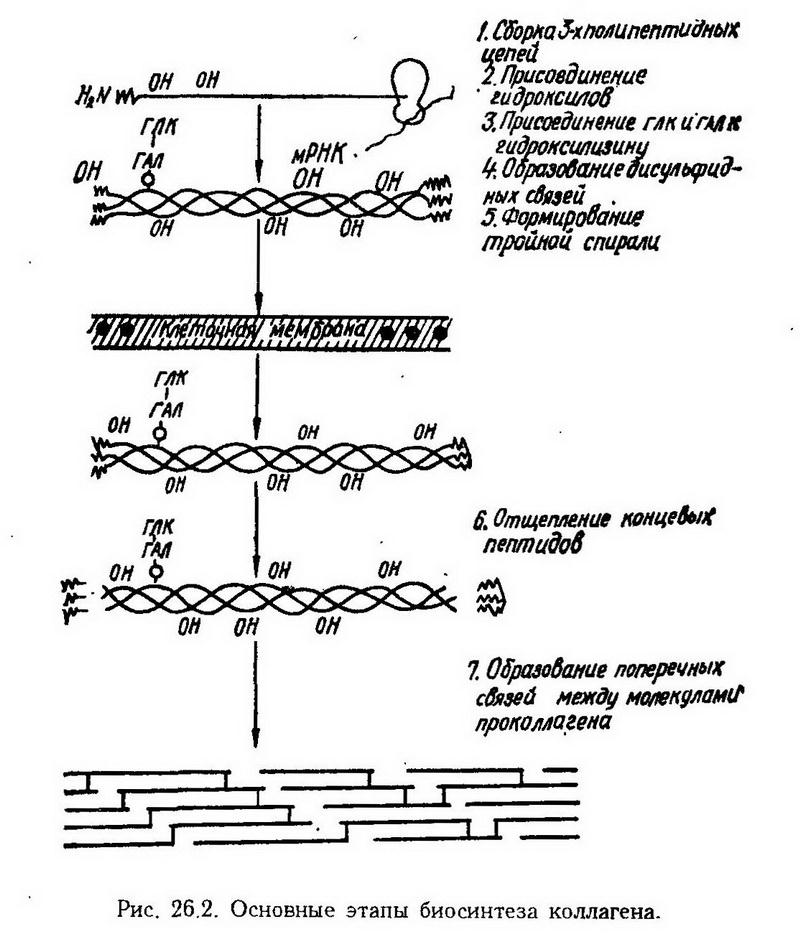 Образовавшиеся в рибосомах первичные полипептидные цепи (?-цепи) далее проходят еще несколько этапов, четыре из которых можно назвать критическими, потому что нарушение именно их чаще всего приводит к патологическим последствиям. I этап – гидроксилирование лизина и пролина. Присоединение к названным аминокислотным остаткам ОН-групп, необходимое для того, чтобы между тремя первичными аминокислотными цепями, объединенными между собой, возникли ковалентные связи и началась спирализация тройной молекулы. Для осуществления этого этапа необходимо наличие активных лизин- или пролингидроксилазы и кофактора аскорбиновой кислоты. II этап – образование альдегидных группировок в результате дезаминирования лизина и оксилизина. Альдегидные группировки двух соседних а-цепей, взаимодействуя между собой, образуют поперечные ковалентные связи, необходимые для дальнейшей стабилизации молекул коллагена. Поперечные связи особенно нужны там, где одна фибрилла заканчивается и начинается другая и где они примерно на протяжении 1/4 длины накладываются одна на другую. Для осуществления второго этапа синтеза коллагена необходимо присутствие лизиноксидазы и меди в качестве кофактора. III этап – гликозилирование коллагена. Молекула коллагена всегда содержит некоторое количество углеводов в виде глюкозы или гликозилгалактозы. Эти углеводы присоединены к гидроксилизину. Реакция катализируется двумя ферментами – галактозилтрансферазой и гликозилтрансферазой. Значение присоединения углеводов еще не выяснено. Вероятно, оно играет роль в транспорте готовых молекул коллагена из фибробластов в межклеточное пространство, для их укладки и для дальнейших конформационных изменений. IV этап – секреция коллагена в интерцеллюлярный матрикс. После того как коллаген прошел первые этапы синтеза и образовались тройные спирали, последние покидают клетку. Этот процесс затрудняется, если нарушено гидроксилирование пролина и лизина. Контроль за синтезом коллагена осуществляется на всех его этапах. В рибосомах этот процесс ограничивается количеством свободного оксипролина. На последующих этапах он зависит от специфических ферментов, обеспечивающих гидроксилирование и гликозилирование. На масштабы внутриклеточного синтеза коллагена влияет также его количество, находящееся вне клеток. В этом отношении определенное значение имеют теплопептиды, т. е. неспирализованные концы проколлагена, отщепляемые при созревании. В их действии на синтез коллагена в клетке наблюдается обратная зависимость, т. е. чем больше полипептидов вне клетки, тем меньше синтез. Из неспецифических факторов, влияющих на синтез коллагена, следует назвать ионы кальция, железа, ?-кетоглутарат, аскорбиновую кислоту. Цинга всегда ассоциируется с нарушением коллагенового метаболизма. В клеточных культурах скорбутных животных накапливается незрелый коллаген. Тот факт, что для реакции гидроксилирования требуется а-кетоглутарат, говорит о связи между синтезом коллагена и энергетикой клетки. Коллаген после его секреции становится неотъемлемой частью межклеточного вещества. Хотя его взаимосвязь с другими, находящимися здесь веществами еще полностью не изучена, известно, что структурно-функциональная роль коллагена, его участие в метаболизме зависят от среды, в которой он находится, т. е. от взаимосвязи с гликозаминогликанами и гликопротеидами. В регуляции синтеза коллагена принимают участие также гормоны. В экспериментах с применением радиоактивных изотопов показано, что у гипофизэктомированных животных синтез коллагена снижается. Кроме того, снижается сопротивление сухожилий к растяжению. В табл. 9 приводятся данные о некоторых заболеваниях соединительной ткани, в основе которых лежат нарушения биосинтеза коллагена. Одни из этих болезней передаются по наследству, другие развиваются в результате недостатка кофакторов ферментов, участвующих в модификации коллагена (аскорбиновая кислота). Таблица 9. Нарушения основных этапов синтеза коллагена и болезни, развивающиеся при них
| |||||||||||||||||||||||||||||||||||||
