зайко. Н. Н. Зайко Патологическая физиология Введение Предмет и задачи патологической физиологии Патологическая физиология есть наука, изучающая жизнедеятельность больного организма. Программа
 Скачать 7.32 Mb. Скачать 7.32 Mb.
|
|
Глава 25. Патологическая физиология нервной системы Общая этиология и патогенез нарушений деятельности нервной системы Расстройство деятельности нервной системы может возникать в результате воздействия на организм разнообразных экзогенных и эндогенных факторов, влияющих на метаболизм, структуру и функцию нервных клеток. Прежде всего необходимо отметить, что нервная система и особенно ее центральные отделы очень чувствительны к гипоксии. Мозг потребляет около 20% всего кислорода, поступающего в организм. При внезапном прекращении подачи кислорода мозгу (вдыхание бескислородных газовых смесей, нарушение мозгового кровообращения) у человека через 6 – 7 с наступает потеря сознания, а через 15 с прекращается нормальная биоэлектрическая активность мозга. Полное восстановление функций мозга возможно в тех случаях, когда остановка кровообращения не превышает 5 – 6 мин. Если ишемия мозга продолжается дольше, память и интеллект необратимо нарушаются. Следует отметить, что различные отделы центральной нервной системы обладают неодинаковой чувствительностью к кислородному голоданию. Филогенетически старые структуры являются более устойчивыми к гипоксии. Так, нейроны мозгового ствола, входящие в состав дыхательного и сосудодвигательного центров, способны переносить аноксию длительностью до 30 мин. Патогенное воздействие на нервную систему могут оказать такие физические факторы, как ионизирующая радиация, электрический ток, шум, вибрация, электромагнитное поле, механическая травма, высокая и низкая температура. При повышении температуры тела (перегревание, лихорадка) повышается обмен веществ, усиливаются процессы возбуждения в нервной системе с последующим развитием запредельного торможения и истощением энергетических ресурсов в нервных клетках. При охлаждении (общем или местном) снижается скорость обменных процессов в нейронах, их способность генерировать потенциал действия и проводить его по нервным отросткам. Функция нервной системы может нарушаться при действии различных токсических веществ естественного или искусственного происхождения. Выделяют большую группу так называемых нейротропных ядов, которые могут избирательно нарушать биоэнергетические процессы в нервных клетках, образование, транспорт, выделение и метаболизм нейромедиаторов, влиять на проницаемость ионных каналов в нейронах. Расстройством деятельности нервной системы, прежде всего ее центрального отдела, могут сопровождаться нарушения обмена веществ в организме. Головной мозг очень чувствителен к гипогликемии. Практически весь кислород, потребляемый головным мозгом, идет на окисление глюкозы. При резком снижении уровня глюкозы в крови происходит нарушение биотоков мозга и может наступить потеря сознания. Длительная гипогликемия вызывает необратимые повреждения коры большого мозга. При сильно выраженной гипогликемии нарушаются и функции, регулируемые стволовыми механизмами. Расстройства деятельности нервной системы наблюдаются при изменении содержания в крови электролитов и ионов водорода. Голодание, в частности витаминное, нередко приводит к нарушению нервной деятельности. Особенно важны в этом отношении витамины группы В. К глубоким нарушениям функций нервной системы, особенно ее высших отделов, может привести патология эндокринных желез. Несомненно влияние старения на строение и функции нервной системы. Механизм этого влияния еще не совсем изучен, но результатом его является обеднение клетками всех узлов периферической нервной системы и головного мозга, включая кору. Существует общепринятая точка зрения, что, начиная примерно с 25 лет, у человека ежедневно отмирает определенное количество нейронов, причем по мере старения темп гибели нервных клеток возрастает. Однако в последние годы появились данные о том, что с возрастом имеет место не гибель нейронов, а лишь их атрофия, что ведет к уменьшению массы мозга. При этом в разных зонах мозга уменьшение массы нейронов идет с различной скоростью и начинается в разное время. Функции нервной системы могут нарушаться рефлекторно под влиянием сильных или необычных воздействий на наружные и внутренние рецепторы. Среди причин, вызывающих нарушение функции нервной системы, важное место занимают социальные факторы. Человек обладает второй сигнальной системой. С помощью образов, символов и понятий в его воображении строится модель окружающего его мира. Вторая сигнальная система тесно связана с социальной жизнью человека, является результатом взаимоотношений индивидуума с общественной средой. Влияние этой среды, которое осуществляется главным образом путем словесной сигнализации, на человеческую психику, интеллект, эмоциональное состояние, огромно. Человек постоянно оценивает свое положение в обществе, степень своей свободы в нем, возможности удовлетворения своих потребностей, отношение к нему других людей и т. д. Все это, а также интенсивная трудовая деятельность требуют от человека высокого эмоционального и умственного напряжения. Длительно существующие или часто возникающие конфликтные ситуации, которые связаны как с особенностями личности индивидуума, так и с характером его социального окружения и с устройством общества в целом, с условиями труда, быта, могут приводить к чрезмерному возбуждению эмоциональных центров и нарушению высшей нервной деятельности человека, развитию невротических состояний, психических заболеваний и связанных с ними разнообразных психосоматических расстройств. Особенно велика в этом отношении роль слова, внушения (в том числе самовнушения), которые существенно влияют на течение физиологических процессов в нервной системе и которые могут оказывать как патогенное, так и благотворное, лечебное действие. Патология нервной системы может быть наследственной. Это выражается недоразвитием отдельных структур нервной системы и нарушением метаболизма в различных группах нейронов. Иногда поражения нервной системы при наследственных болезнях могут иметь вторичный характер. Примером является фенилкетонурия, при которой первичным является нарушение обмена фенилаланина, а нервная система поражается вследствие интоксикации продуктами нарушенного обмена этой аминокислоты. Нарушения деятельности нервной системы возможны в результате развития типических патологических процессов – воспаления, опухоли, местных нарушений кровообращения. Опухоль оказывает раздражающее действие на тот или иной нервный центр, вызывая его чрезмерное возбуждение. По мере же роста опухоли развивается атрофия нервных клеток и волокон, что приводит к выключению их функций. Кроме того, увеличение массы опухоли сопровождается повышением внутричерепного давления,- уменьшением кровенаполнения головного мозга и его ишемией. Воспаление довольно часто является причиной нарушения функций нервной системы. Воспаление периферических нервных проводников сопровождается нарушениями чувствительности, движения или деятельности внутренних органов. Воспаление, возникшее в центральной нервной системе, чаще всего локализуется в мозговых оболочках и приводит к нарушению продукции и оттока спинномозговой жидкости, повышению внутричерепного давления, нарушению мозгового кровообращения. Воспаление может захватывать и вещество мозга (энцефалит). В патогенезе энцефалита существенную роль играет аутоаллергическая реакция, поскольку у организма отсутствует иммунологическая толерантность к собственной нервной ткани. Что касается патогенеза нарушений деятельности нервной системы, то надо отметить, что достаточно хорошо изучены лишь механизмы нарушений функций нейронов. Такими универсальными механизмами являются утрата нервной клеткой способности поддерживать определенную величину мембранного потенциала, генерировать потенциалы действия и проводить их по отросткам, передавать возбуждение с одной нервной клетки на другую. Более подробно эти механизмы будут рассмотрены ниже. Интегративные и аналитические способности нервной системы во многом определяются множественными контактами нервных клеток друг с другом. Известно, что в некоторых отделах мозга на одном нейроне может формироваться до 2•105 контактов с другими нервными клетками. Уменьшение количества межнейрональных контактов в процессе развития ряда патологических процессов, вероятно, также является одним из существенных механизмов нарушения функции нервной системы. Важным звеном в патогенезе многих расстройств деятельности нервной системы может быть нарушение образования, выделения и распада медиаторов. Кроме того, в настоящее время имеются многочисленные данные о том, что деятельность нервной системы и особенно ее высших отделов во многом определяется веществами пептидной природы (нейропептидами), которые вырабатываются как нервными, так и другими клетками и могут выполнять медиаторные и немедиаторные функции. Наиболее изучены опиатные системы мозга, работа которых регулируется эндорфинами и энкефалинами. Однако в мозге человека и животных обнаружены десятки других олигопептидов, введение которых в желудочки мозга или непосредственно в нервные центры может вызвать различные эмоциональные состояния и поведенческие реакции, влиять на выработку условных рефлексов, способность к запоминанию, обучению и т. д. Вероятно, в патогенезе нарушений функций нервной системы может иметь значение недостаточное или избыточное образование нейропептидов, изменение чувствительности к ним нервных клеток. В частности, на модели эпилепсии было показано, что в головном мозге больных животных вырабатываются пептиды, которые могут оказывать эпилептогенное влияние на других животных. С другой стороны, были выделены вещества, способные подавлять эпилептическую активность мозга. Говоря об общих закономерностях нарушений деятельности нервной системы, следует сказать, что в патогенезе функциональных нарушений ее центральных отделов может иметь значение появление в нервных центрах группы нейронов, которые работают с той или иной степенью автономности и продуцируют избыточное возбуждение. Такие нейроны обозначают как генератор патологически усиленного возбуждения (Г. Н. Крыжановский). В норме активность нейронов или нервных центров контролируется и ограничивается соответствующими механизмами торможения. При повреждении этих механизмов и возникает генератор патологически усиленного возбуждения, который в зависимости от его локализации может быть причиной чувствительных, двигательных и вегетативных расстройств, а также нарушений высшей нервной деятельности. Нарушение функций нервных клеток и проводников Важнейшими функциями нервной клетки являются генерирование потенциала действия, проведение возбуждения по нервным волокнам и передача его на другую клетку (нервную, мышечную, железистую). Функция нейрона обеспечивается протекающими в нем обменными процессами. Одним из назначений метаболизма в нейроне является создание асимметричного распределения ионов на поверхности и внутри клетки, что определяет потенциал покоя и потенциал действия. Обменные процессы поставляют энергию натриевому насосу, активно преодолевающему электрохимический градиент Na+ на мембране. Из этого следует, что все вещества и процессы, которые нарушают метаболизм и ведут к уменьшению выработки энергии в нервной клетке (гипоксемия, отравление цианидами, динитрофенолом, азидами и др.), резко угнетают возбудимость нейронов. Функция нейрона нарушается и при изменении содержания одно- и двухвалентных ионов в окружающей среде. В частности, нервная клетка полностью утрачивает способность к возбуждению, если поместить ее в среду, лишенную Na+. Большое влияние на величину мембранного потенциала нейрона оказывает также К+ и Са2+. Мембранный потенциал, определяемый степенью проницаемости для Na+, К+ и Cl- и их концентрацией, может поддерживаться только в том случае, если мембрана стабилизирована кальцием. Как правило, повышение Са2+ в среде, где находятся нервные клетки, ведет к их гиперполяризации, а его частичное или полное удаление – к деполяризации. Нарушение функции нервных волокон, т. е. способности проводить возбуждение, может наблюдаться при развитии дистрофических изменений в миелиновой оболочке (например, при дефиците тиамина или цианокобаламина), при сдавлении нерва, его охлаждении, при развитии воспаления, гипоксии, действии некоторых ядов и токсинов микроорганизмов. Как известно, возбудимость нервной ткани характеризуется кривой сила – длительность, отражающей зависимость пороговой силы раздражающего тока от его длительности. В случае повреждения нервной клетки или дегенерации нерва кривая сила – длительность значительно изменяется, в частности увеличивается хронаксия (рис. 25.1). Под влиянием различных патогенных факторов в нерве может развиться особое состояние, которое Н. Е. Введенский назвал парабиозом. В зависимости от степени повреждения нервных волокон различают несколько фаз парабиоза. При изучении явлений парабиоза в двигательном нерве на нервно-мышечном препарате видно, что при небольшой степени повреждения нерва наступает такой момент, когда на сильное или слабое раздражение мышца отвечает одинаковыми по силе тетаническими сокращениями. Это уравнительная фаза. По мере углубления альтерации нерва возникаетпарадоксальная фаза, т. е. в ответ на сильное раздражение нерва мышца отвечает слабыми сокращениями, в то время как умеренные по силе раздражения вызывают более энергичный ответ со стороны мышцы. Наконец, в последней фазе парабиоза – фазе торможения, никакие раздражения нерва не способны вызвать мышечное сокращение. Если нерв поврежден настолько, что утрачивается его связь с телом нейрона, он подвергается дегенерации. Основным механизмом, ведущим к дегенерации нервного волокна, является прекращение аксоплазматического тока и транспорта веществ аксоплазмой. Процесс дегенерации, подробно описанный Уоллером, заключается в том, что уже через сутки после травмы нерва миелин начинает отходить от узлов нервного волокна (перехватов Ранвье). Затем он собирается в крупные капли, которые постепенно рассасываются. Нейрофибриллы подвергаются фрагментации. От нерва остаются узкие трубочки, образованные нейролеммоцитами. Через несколько дней после начала дегенерации нерв утрачивает возбудимость. В разных группах волокон потеря возбудимости наступает в различные сроки, что, по-видимому, зависит от запаса веществ в аксоне. В нервных окончаниях дегенерирующего нерва изменения наступают тем быстрее, чем ближе к окончанию перерезан нерв. Вскоре после перерезки нейро-леммоциты начинают проявлять фагоцитарную активность по отношению к нервным окончаниям: их отростки проникают в синаптическую щель, постепенно отделяя терминали от постсинаптической мембраны и фагоцитируя их. После травмы нерва наступают изменения и в проксимальном отделе нейрона (первичное раздражение), степень и выраженность которых зависят от вида и интенсивности повреждения, его отдаленности от тела нейроцита, типа и возраста нейрона. При ранении периферического нерва изменения в проксимальном отделе нейрона, как правило, минимальны, и в дальнейшем нерв регенерирует. Наоборот, в центральной нервной системе нервное волокно дегенерирует ретроградно на значительном протяжении и нередко нейрон погибает. Нарушения функций синапсов Синапсы – это специализированные контакты, через которые осуществляется передача возбуждающих или тормозящих влияний с нейрона на нейрон или другую клетку (например, мышечную). У млекопитающих существуют главным образом синапсы с химическим типом передачи, при котором активность от одной клетки к другой передается с помощью медиаторов. Все синапсы делятся на возбуждающие и тормозящие. Основные структурные компоненты синапса и процессы, происходящие в нем, показаны на рис. 25.2, где схематично представлен холинэргический синапс. 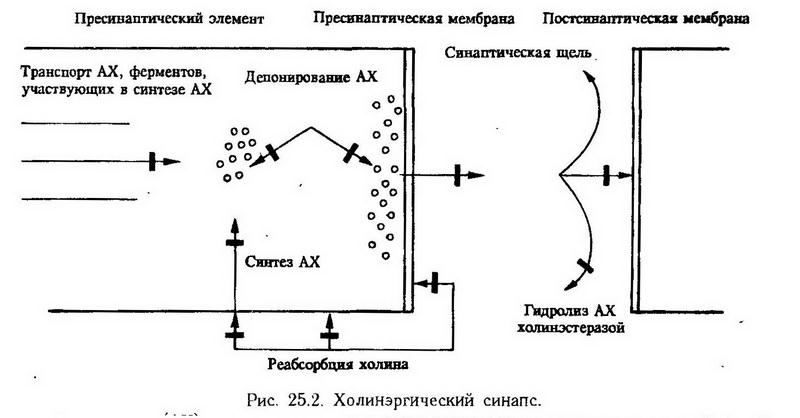 Нарушение синтеза медиатора. Синтез медиатора может быть нарушен в результате снижения активности ферментов, участвующих в его образовании. Например, синтез одного из медиаторов торможения – ?-аминомасляной кислоты (ГАМК) – может быть угнетен при действии семикарбазида, блокирующего фермент, катализирующий превращение глутаминовой кислоты в ГАМК. Нарушается синтез ГАМК и при недостатке в пище пиридоксина, являющегося кофактором этого фермента. В этих случаях в центральной нервной системе страдают процессы торможения. Процесс образования медиаторов связан с затратой энергии, которая поставляется митохондриями, присутствующими в большом количестве в нейроне и нервных окончаниях. Поэтому нарушение этого процесса может быть вызвано блокадой метаболических процессов в митохондриях и снижением содержания макроэргов в нейроне вследствие гипоксии, действия ядов и др. Нарушение транспорта медиатора. Медиатор может синтезироваться как в теле нервной клетки, так и непосредственно в нервном окончании. Образующийся в нервной клетке медиатор транспортируется по аксону в пресинаптическую часть. В механизме транспорта большую роль играют цитоплазматические микротрубочки, построенные из особого белка тубулина, близкого по своим свойствам к сократительному белку актину. По микротрубочкам к нервному окончанию проходят медиаторы, ферменты, участвующие в обмене медиаторов, и т. д. Микротрубочки легко распадаются под воздействием анестетиков, повышенной температуры, протеолитических ферментов, веществ типа колхицина и др., что может приводить к уменьшению количества медиатора в пресинаптических элементах. Например, гемохолин блокирует транспорт ацетилхолина в нервные окончания и тем самым нарушает передачу нервных влияний в холинэргических синапсах. Нарушение депонирования медиатора в нервных окончаниях. Медиаторы хранятся в пресинаптических пузырьках, в которых находится смесь молекул медиатора, АТФ и специфических белков. Предполагают, что пузырьки формируются в цитоплазме нейроцита, а затем транспортируются по аксону к синапсу. Некоторые вещества могут нарушать процесс депонирования медиатора. Так, например, резерпин препятствует накоплению в пресинаптических пузырьках норадреналина и серотонина. Нарушение секреции медиатора в синаптическую щель. Процесс выхода медиатора в синаптическую щель может нарушаться под действием некоторых фармакологических препаратов и токсинов, в частности столбнячного токсина, препятствующего выходу медиатора торможения глицина. Ботулинический токсин блокирует выброс ацетилхолина. По-видимому, в механизме секреции медиатора имеет значение сократительный белок тубулин, входящий в состав пресинаптической мембраны. Блокада этого белка колхицином угнетает выделение ацетилхолина. Кроме того, на секрецию медиатора нервным окончанием оказывают влияние ионы кальция и магния, простагландины. Нарушение взаимодействия медиатора с рецептором. Имеется большое количество веществ, влияющих на связь медиаторов со специфическими рецепторными белками, расположенными на постсинаптической мембране. Главным образом это вещества, обладающие конкурентным типом действия, т. е. легко вступающие в связь с рецептором. В их числе можно назвать тубокурарин, блокирующий Н-холинорецепторы, стрихнин, блокирующий рецепторы, чувствительные к глицину, и др. Эти вещества блокируют действие медиатора на эффекторную клетку. Нарушение удаления медиатора из синаптической щели. Для того чтобы синапс функционировал нормально, медиатор после его взаимодействия с рецептором должен удаляться из синаптической щели. |
