Биофизика. Биофизика мембран. Навчальнометодичний посібник для викладачів для проведення занять студентів зі спеціальностей 12010001 Лікувальна справа
 Скачать 6.62 Mb. Скачать 6.62 Mb.
|
|
Структура змістового модуля 2
Теми лекцій: 1. Основи біологічної термодинаміки 2. Основи молекулярної біофізики. Структура і фізичні властивості біомембран. Транспорт речовин у біомембранах 3. Біопотенціал спокою. Генерація та поширення біопотенціалу дії 4. Біофізика м’язового скорочення 5. Біофізичні основи електрокардіографії Теми практичних занять: 1. Біологічна термодинаміка 2. Основи молекулярної біофізики. Будова та властивості біомембран 3. Активний та пасивний транспорт речовин у біомембранах 4. Електричне поле клітини. Мембранний потенціал спокою 5. Виникнення та розповсюдження потенціалу дії 6. Біофізика м’язового скорочення 7. Фізичні та біофізичні основи електрокардіографії ТЕМА ЗАНЯТТЯ 1: ОСНОВИ БІОЛОГІЧНОЇ ТЕРМОДИНАМІКИ АКТУАЛЬНІСТЬ ТЕМИ: Для здійснення процесів життєдіяльності необхідна енергія. Вивченням різних форм енергії і їх перетворення друг у друга займається термодинаміка, в якій не розглядають механізми або природу того чи іншого явища, але досліджують можливість його здійснення з точки зору енергетики. У біології та медицині є важливим вивчення живих організмів в якості відкритих термодинамічних систем, які здатні підтримувати стаціонарний стан за рахунок обміну з навколишнім середовищем речовиною та енергією. Розуміння питань, які вивчає біологічна термодинаміка, необхідно для визначення енергетичних витрат організму шляхом біокалоріметріі, розрахунку у відповідність з ними харчового раціону, вивчення процесів теплообміну організму з навколишнім середовищем. ЦІЛІ ЗАНЯТТЯ: 1. Трактувати основні поняття термодинаміки; 2. Пояснювати перший закон термодинаміки, його застосовність до живим об'єктам, характеризувати джерела енергії для організму; 3. Трактувати застосування принципу Гесса для обчислення теплового ефекту хімічних процесів і визначення калорійності продуктів харчування; 4. Характеризувати суть другого закону термодинаміки, Пояснити фізичний і статистичний зміст ентропії; 5. Трактувати на основі другого закону термодинаміки принцип здійснення прямої калориметрії живих об'єктів; 6. Характеризувати стаціонарний стан живих систем, пояснювати рівняння і теорему Пригожина. МАТЕРІАЛИ МЕТОДИЧНОГО ЗАБЕЗПЕЧЕННЯ: 1. Матеріали для основної частини заняття: таблиці, схеми, малюнки, проблемні теоретичні питання зі збірника «Робочий зошит для самостійної роботи на практичних заняттях для студентів медичного факультету» 2. Матеріали для контролю знань:тестовіпитання для стандартизованого контролю знань студентів. 3. Матеріали для самопідготовки студентів:рекомендовані навчальніпосібники, методичні вказівки для самостійної роботи студентів. ТЕОРЕТИЧНІ ВІДОМОСТІ Термодинаміка - розділ фізики, що вивчає енергію, її перенесення з одного місця в інше і її трансформацію з одного виду в інший. Існують три типи термодинамічних систем, в залежності від типу взаємодії системи з навколишнім середовищем: ізольована (не обмінюється енергією або ре-ством з зовнішнім середовищем), закрита (може обмінюватися з зовнішнім середовищем енергією, але не речовиною), відкрита (обмінюється з зовнішнім середовищем і енергією і речовиною). Параметри стану термодинамічних систем – фізичні величини, які описують стан термодинамічних систем (інтенсивні:температура, об'єм, тиск, хімічний склад, концентрація; екстенсивні: маса, об’єм, щільність). Стан ізольованої системи, за умови, що параметри системи не змінюються, називається термодинамічним рівновагою. Цей стан є абсолютно стабільним і може існувати протягом необмеженого періоду часу. Якщо ізольована система виходить зі стану термодинамічної рівноваги, вона мимовільно повертається в нього. Енергія визначає ступінь здатності термодинамічної системи здійснювати будь-яку роботу. Існують різні види енергії: механічна, електрична, хімічна і т.д. Внутрішня енергія системи - це загальна кінетична і потенціальна енергія всіх молекул системи. Кількість внутрішньої енергії залежить від параметрів стану системи. Енергія може зберігатися або передаватися системою. Вона також може бути переведена з однієї форми в іншу. Теплота - енергія, що передається від однієї системи до іншої за рахунок різниці температур. Існує кілька способів передачі енергії: теплопровідність (відбувається між об'єктами при їх безпосередньому контакті), конвекція (перенесення теплоти від одного об'єкта до іншого за допомогою руху газу або рідини) і радіація (теплота переноситься в вакуумі за рахунок електромагнітних хвиль різної довжини). Робота, що здійснюється системою або здійснюються над системою - ще одна форма передачі енергії між термодинамічними системами. Існує багато способів здійснення роботи: м'язи здійснюють механічну роботу, осмотична робота полягає в транспорті речовин за рахунок різниці їх концентрації, електрична робота полягає в перенесенні заряджених частинок (іонів) електричним полем. Перший закон термодинаміки - це закон збереження енергії: загальна енергія в ізольованій системі постійна і не змінюється в часі, її кількість зберігається при переході з однієї форми в іншу. Перший закон також виключає існування вічного двигуна першого роду. Перший закон термодинаміки встановлює, що кількість теплоти ΔQ передана системі переходить в різницю внутрішньої енергії системи dUі роботу ΔA, яку здійснюють системою над іншими системами: 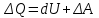 Принцип Гесса (наслідок першого закону термодинаміки) тепловий ефект багатоступеневих реакцій залежить не від проміжних ступенів, а від початкового і кінцевого стану системи. Якщо людина або тварина не здійснюють будь-якої зовнішньої роботи, всі енергетичні витрати тіла можна визначити, вимірявши кількість теплоти, що випромінюється тілом. Такий вид вимірювань називають прямою калориметрією. Експерименти, проведені даним методом, показали, що кількість енергії, що надходить в організм, дорівнює кількості енергії, яку випромінюється їм. Непряма калориметрія – метод, який дозволяє визначити кількість вихідної енергії на підставі вимірювання об'єму кисню, який засвоюється організмом. Другий закон термодинаміки- теплота в ізольованій системі не може мимоволі передаватися від менш нагрітих тіл до більш нагрітих (формулювання Клаузіуса). Другий закон термодинаміки також говорить про те, що всі реальні процеси (фізичні, біологічні тощо) проходять з розсіюванням частини енергії у вигляді тепла. Всі види енергії (механічна, хімічна, електрична, тощо) можуть бути переведені в тепло без залишку, але теплота не може перейти в інші форми енергії повністю. Будь-який реальний процес, який може відбуватися в термодинамічної системи, є незворотнім і може проходити тільки в одному напрямку. Напрямок спонтанних термодинамічних процесів в кожній ізольованій системі характеризується параметром стану, який називається ентропія: 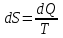 dS дорівнює відношенню кількості теплоти dQ входить або залишає систему до абсолютної температурі Т. Ентропія тісно пов'язана з рівнем невпорядкованості або безладу компонентів системи. Відповідно до принципу Больцмана, ентропія системи S пропорційна її термодинамічної ймовірності W: 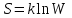 , ,тут k- постійна Больцмана, W - термодинамічна ймовірність - число мікростанів, які можливі в макроскопічному стані системи. Чим більше мікроскопічних станів (конфігурацій), тим більше безладної є сама система і тим більше значення W і S. Кожна система мимовільно прагне до стану максимального безпорядку або хаосу Термодинаміка незворотних процесів. При наближенні до стану рівноваги, а також при протіканні кожного реального процесу, ентропія термодинамічної ізольованої системи збільшується і досягає свого максимуму. Реальні фізичні та біофізичні об'єкти відносяться до відкритого типу термодинамічних систем і процеси, які відбуваються в таких системах, є незворотніми. Зміна ентропії dS в відкритих системах визначається двома компонентами. dSi - продукція ентропії всередині системи, як результат деяких незворотних процесів. dSe - результат взаємодії системи і навколишнього середовища: 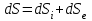 Термодинаміка нерівноважних процесів розглядає також швидкість продукції ентропії у відкритих системах: 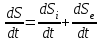 Значення швидкості залежить від двох компонентів: швидкості продукції ентропії всередині системи і швидкості її зміни внаслідок обміну енергією з навколишнім середовищем. Згідно з другим законом термодинаміки, перший показник буде завжди позитивний, другий - може бути як позитивним, так і негативним, в залежності від напрямку потоку енергії через кордони системи. На відміну від ізольованої системи, відкрита система може перебувати в стаціонарному стані. Стан термодинамічної системи називається стаціонарним, якщо величина продукції ентропії в ній не змінюється з часом, тобто якщо dS = 0. Це можливо, якщо продукція ентропії всередині системи повністю компенсується вихідної ентропією системи (dSi=- dSe). Стаціонарний стан відкритої системи має схожість з термодинамічної рівновагою, тому що для обох характерна стабільність їх параметрів стану. Але стаціонарний стан відрізняється від термодинамічної рівноваги тим, що вимагає обміну енергією з навколишнім середовищем. Стаціонарний стан є типовим для біологічних систем. Велика кількість фізіологічних і біохімічних показників організму досить стабільні, незважаючи на різні зміни в навколишньому середовищі. Спеціальні фізіологічні механізми підтримують їх сталість. Температура тіла теплокровних тварин може бути ілюстрацією стаціонарного стану. Температура тіла підтримується завдяки балансу між продукцією і віддачою тепла. В результаті, вона залишається незмінною, незважаючи на зміни температури навколишнього середовища. Фізіологія вивчає механізми, завдяки яким людський організм зберігає гомеостаз - постійність внутрішнього середовища організму. Основна характеристика стаціонарного стану приведена в теоремі Пригожина. Відповідно до цієї теореми, продукція ентропії в стаціонарному стані мінімальна. Це означає, що система розсіює мінімум енергії в навколишнє середовище і вимагає мінімум вільної енергії для підтримки її стану. Теорема Пригожіна пояснює стабільність стаціонарного стану відкритих систем. Якщо система спонтанно виходить з цього стану, рівень продукції ентропії підвищується. В результаті, деякі внутрішні процеси системи активізуються, і система прагне повернутися в начальний стаціонарний стан. ПЛАН ТА ОРГАНІЗАЦІЙНА СТРУКТУРА ЗАНЯТТЯ: І. Визначення актуальності, цілей заняття 5 хв. ІІ. Письмова самостійна робота студентів з «Робочим зошитом для студентів медичного факультету» 30 хв.: На рис. 1 схематично зображено термодинамічні системи. 1.1. Як Ви розумієте термін «Термодинамічна система»? Будь-яке об'єднання об'єктів може вважатися термодинамічною системою. Приклади систем: жива клітина, серце, організм, біосфера і т.д. 1.2. Перерахуйте системи, зображені на малюнку. Вкажіть характеристики кожної системи і приведіть приклади. 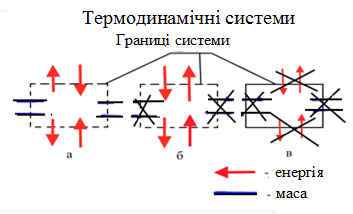 Рис.1 А) Відкрита система обмінюється з зовнішнім середовищем і енергією і речовиною. Приклад: живий організм, відкрита посудина з рідиною. Б) Закрита система може обмінюватися з зовнішнім середовищем енергіїй, але не речовиною. Приклад: закритий посудину з рідиною, закрита банка варення, батарея опалення і т.д. В) Ізольована система - не обмінюється енергією або речовиною з зовнішнім середовищем. Такі системи не існують в реальних умовах. Зіставте рівноважний стан ізольованої системи і стаціонарний стан відкритої системи. Що спільного між ними і чим вони відрізняються один від одного? Стан ізольованої системи, за умови, що параметри системи не змінюються, називається термодинамічним рівновагою. Стаціонарний стан відкритої системи має схожість з термодинамічним рівновагою, тому для обох характерна стабільність їх параметрів стану. Але стаціонарний стан відрізняється від термодинамічної рівноваги тим, що вимагає обміну енергією з навколишнім середовищем. На рис. 2 представлені приклади процесів, що викликають зміни внутрішньої енергії системи. Розгляньте малюнок і дайте відповідь на питання. 2.1. Що таке внутрішня енергія системи? Які форми енергії складають внутрішню енергію тіла? Внутрішня енергія системи - це загальна кінетична і потенціальна енергія всіх молекул системи. 2.2. Які процеси можуть приводити до зміни внутрішньої енергії тіла? До способів зміни внутрішньої енергії відносять: роботу(деформація, третя) та теплопередачу (конвекцію, випромінювання, теплопровідність). 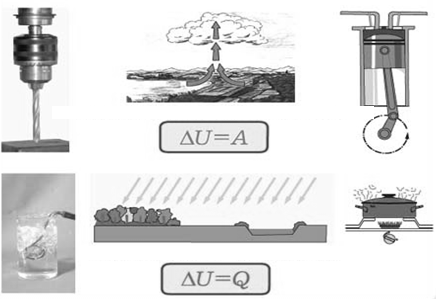 Рис.2 Наведіть рівняння першого закону термодинаміки. Дайте визначення входять до нього величин, вкажіть одиниці їх виміру. 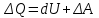 DQ- кількість теплоти (Дж), dU – внутрішня енергія(Дж), DA - робота (Дж). Что таке тепломісткість (ентальпія) термодинамічної системи? Ентальпія, також теплова функція і тепловміст- термодинамічний потенціал, що характеризує стан системи в термодинамічній рівновазі при виборі в якості незалежних змінних тиску, ентропії і кількості частинок. Ентальпія - це та енергія, яка доступна для перетворення в теплоту при певних температурі і тиску. 3. На рис. 3 показані приклади різних типів теплопередачі. Розгляньте їх і дайте відповідь на питання: 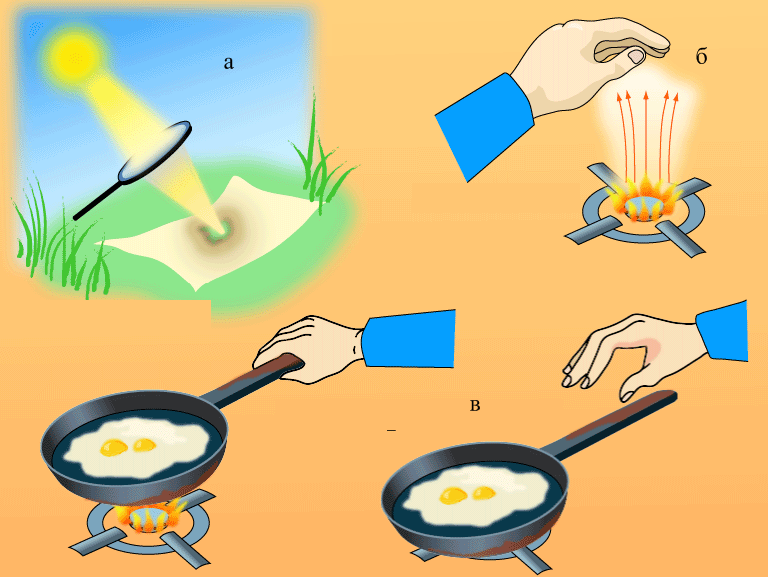 Рис.3 3.1.Что собою являє теплота? Теплота - енергія, передана від однієї системи до іншої за рахунок різниці температур. 3.2. Вкажіть, які види теплопередачі зображені на малюнку. Охарактеризуйте кожен з них. Випромінювання(а) перенесення теплоти і через вакуум і через речовину між об’єктами. У цьому випадку теплота переноситься за рахунок електромагнітних хвиль різної довжини. Конвекція (б) - перенесення теплоти від одного об'єкта до іншого за допомогою руху газу або рідини. Теплопровідність (в) відбувається між об'єктами при їх контакті. Він має місце при зіткненні молекул, під час якого вони передають надлишок енергії один одному. 3.3. Що таке температура тіла? Як Ви розумієте вислів абсолютна (термодинамічна) температура? Обчисліть термодинамічну температуру повітря при 250. Абсолютна шкала температури називається так, тому що міра основного стану нижньої межі температури - абсолютний нуль, тобто найбільш низька можлива температура, при якій в принципі неможливо витягнути з речовини теплову енергію. Абсолютний нуль визначений як 0K, що дорівнює -273.15°C.Термодинамічну температуру повітря при 250складає 298 К. В результаті хімічних реакцій речовина А перетворюється в речовину B (рис. 4). Перетворення може йти трьома шляхами: безпосередньо або через різні проміжні продукти. В ході відповідних реакцій відбувається виділення або поглинання теплоти в кількості Q1, Q2, Q3 і т.д. Яке співвідношення між величинами Q1, (Q2 + Q3), (Q4 + Q5 + Q6)? Відповідь обґрунтуйте, використовуючи принцип Гесса. Принцип Гесса: тепловий ефект багатоступеневих реакцій залежить не від проміжних ступенів, а від початкового і кінцевого стану системи. Q1 = (Q2 + Q3) = (Q4 + Q5 + Q6) 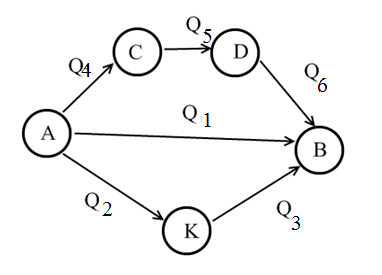 Рис.4 На рис. 5 представлена установка для визначення витрати енергії живим організмом. 5.1. У чому принцип визначення витрати енергії живим організмом? Як називається даний метод? Яка величина безпосередньо вимірюється при проведенні методу? 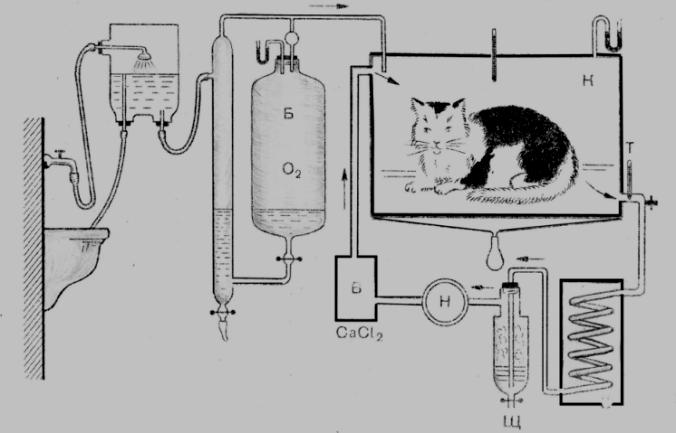 Рис.5 Якщо людина або тварина не здійснюють будь-якої зовнішньої роботи, всі енергетичні витрати тіла можна визначити, вимірявши загальну кількість теплоти, що випромінюється тілом. Такий вид вимірювань називається прямою калориметрією і проводиться за допомогою великих, спеціально обладнаних калориметрів. Об'єкт дослідження розміщують у спеціальну камеру, добре теплоізольовану від зовнішнього середовища, де і проводиться вимірювання теплоти, яка виробляється тілом. 5.2. Як зіставити кількість енергії, що надходить в організм і витрачається їм? Експерименти, проведені даним методом, показали, що кількість енергії, що надходить в організм, дорівнює кількості енергії, випромінюваної їм. III. Обговорення основних питань теми за наступними питаннями 30 хв. 1. Термодинамiчнi системи. Параметри стану термодинамiчних систем. 2. Перший закон термодинамiки. Принцип Гесса. Біокалориметрія. 3. Другий закон термодинамiки. Поняття ентропiї. 4. Термодинамiчнi потенцiали. Електрохiмiчний потенцiал. 5.Teрмодинамiчнi особливостi вiдкритих систем. Рiвняння Пригожина. 6. Особливостi стацiонарного стану вiдкритих систем. Теорема Пригожина. 7. Закон лiнiйного спiввiдношення рушійних сил та потокiв у вiдкритих системах. IV. Тестовий контроль знань 15 хв. 1. Зміна ентропії в стані термодинамічної рівноваги: А. негативне В. нескінченне Д. позитивне Б. максимальне Г. дорівнює нулю 2. Теорема Пригожина: А. в рівноважному стані ентропія максимальна Б. в стаціонарному стані ентропія мінімальна В. в рівноважному стані приріст ентропії позитивно Г. в стаціонарному стані зміна ентропії мінімально Д. в рівноважному стані підтримуються градієнти параметрів 3. Перший закон термодинаміки вказує на: А. напрямок протікання процесів Б. збереження енергії В. нееквівалентність різних форм енергії Г. розсіювання енергії у вигляді теплоти Д. утворення енергії в ході процесів 4. Вкажіть одиниці вимірювання роботи: А. Кельвін В. Пуаз Д. Джоуль Б. Паскаль Г. Ньютон 5. Згідно з другим законом термодинаміки: А. енергія не з'являється нізвідки і не зникає в нікуди Б. теплота мимовільно не передається від тіла до тіла В. теплота є універсальною мірою праці Г.теплота переходить від більш нагрітого тіла до менше нагрітого тіла Д. теплота може бути перетворена без залишку в інші форми енергії 6. Біокалоріметрія заснована на вимірюванні: А. температури організму Б. теплоти, що виділяється тілом В. калорій продуктів харчування Г. співвідношення маси тіла до його поверхні Д. калориметричних співвідношень 7. До шляхів теплообміну не відносять: А. теплову радіацію В. тепломісткість Д. конвекцію Б. теплопровідність Г. теплове випромінювання 8. Мимовільний процес супроводжується: А. зменшенням ентропії В. збільшенням вільної енергії Б. збільшенням ентропії Г. зменшенням безладу в системі Д. зменшенням часток в системі 9. Закон Гесса свідчить, що тепловий ефект хімічної реакції: А. визначається числом проміжних стадій у реакції Б. залежить від вихідних речовин та шляхів їх переходу в продукти реакції В. залежить від продуктів реакції і стадій їх отримання з вихідних речовин Г. залежить тільки від вихідних речовин і продуктів реакції Д. завжди постійний, не залежить від речовин і числа стадій реакції 10. Температура повітря становить 27 градусів за Цельсієм. Знайдіть термодинамічну температуру повітря: А. 27 Кельвін Б. 273 Кельвін В. 300 Кельвін Г. 297 Кельвін Д. 227 Кельвін 11.У рівноважному стані приріст ентропії: А. максимальний Б. мінімальний В. дорівнює нулю Г. позитивний Д. негативний 12. Основною реакцією, яка дозволяє отримувати енергію живим організмам є реакція: А. етерифікації Б. нейтралізації Д. окислення В. обміну Г. розкладу 13. Сума кінетичної і потенційної енергії всіх часток, що складають систему, називається: А. її ТД потенціалом Б. повною енергією системи В. внутрішньою енергією системи Д. ентропією системи Г. тепловміст системи 14. Згідно з другим законом термодинаміки мимовільні процеси: А. рівноважного Б. рівнозначні Д. оборотні В. циклічні Г. незворотні 15. Ентропія вимірюється в: А. Джоуль / Кельвін Б. Джоуль / м2 В. Кельвін / моль Г. Джоуль / моль Д. Джоуль 16. Внутрішня енергія тіла може бути збільшена: А. шляхом збільшення швидкості його руху Б. при виконанні тілом роботи В. шляхом зниження маси тіла Г. при охолодженні тіла Д. шляхом нагрівання тіла 17. Перший закон термодинаміки пов'язує між собою зміни: А. внутрішньої енергії, теплоти та роботи Б. ентропії і кількості наведеної теплоти В. різних термодинамічних потенціалів Г. маси, об'єму і температури тіла Д. об'єму і тиску термодинамічної системи 18. Згідно рівнянню Пригожина мінімальне приріст ентропії відкритої системи в стаціонарному стані обумовлено: А. негативним приростом ентропії усередині системи Б. відсутністю прирощення ентропії усередині системи В. обміном ентропією з навколишнім середовищем Г. надходженням ентропії з навколишнього середовища Д. відсутністю ентропії у відкритих системах 19. Вкажіть відміну стаціонарного стану системи від стану термодинамічної рівноваги: А. в стаціонарному стані ентропія максимальна Б. в стаціонарному стані ентропія дорівнює нулю В. в стаціонарному стані існують градієнти Г. стаціонарний стан не змінюється в часі Д. в стаціонарному стані термодинамічні потенціали мінімальні 20. У стані термодинамічної рівноваги величина вільної енергії в системі: А. мінімальна Б. нескінченна Д. змінюється В. максимальна Г. дорівнює нулю V. Підведення підсумків заняття, домашнє завдання 10 хв.: | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
