Биофизика. Биофизика мембран. Навчальнометодичний посібник для викладачів для проведення занять студентів зі спеціальностей 12010001 Лікувальна справа
 Скачать 6.62 Mb. Скачать 6.62 Mb.
|
|
Тема наступного заняття: «Основи молекулярної біофізики. Структура біологічних мембран» Питання для підготовки до заняття: 1. Поняття про біологічні мембрани та їх функції. 2. Хімічний склад біомембран. Особливості структури молекул фосфоліпідів і білків мембрани. 3. Особливості взаємодії фосфоліпідів і білків мембрани з водою. 4. Сили міжмолекулярної взаємодії в біологічних мембранах. 5. Рідинно-мозаїчна модель плазматичної мембрани. 6. Рухливість молекул фосфоліпідів і білків в мембрані. 7. Залежність біофізичного стану біомембран від їх хімічного складу і температури. ЛІТЕРАТУРА: 1. Основи біофізики // Навчальний посібник для студентів медичного факультету - Запоріжжя, ЗДМУ, 2011. 2. Ємчик Л.Ф., Кміт Я.М. Медична і біологічна фізика- Львів: Світ, 2003.-с.91-124. ТЕМА ЗАНЯТТЯ 2: ОСНОВИ МОЛЕКУЛЯРНОЇ БІОФІЗИКИ. СТРУКТУРА БІОЛОГІЧНИХ МЕМБРАН АКТУАЛЬНІСТЬ ТЕМИ: Біологічна мембрана – це частина клітини, яка відіграє важливійшу роль в усіх її функціях. Мембрана має рідкокристалічну структуру, тому фізичні та хімічні закономірності рідких кристалів дають змогу зрозуміти механізмїї функціонування. Транспорт речовин із середовища, і навпаки, генерація біопотенціалів, поширення нервового імпульсу забезпечується клітинною мембраною. Відома роль рідких кристалів у винекненні деяких захворювань в організмі людини. Засвоєння теми «Основи молекулярної біофізики. «Структура біологічних мембран» сприятиме вивченню наступних тем мембраннології. ЦІЛІ ЗАНЯТТЯ: Трактувати поняття «біологічна мембрана», функції мембрани і її будову; Встановити хімічну структуру основних речовин мембрани (гліцерофосфолипідів та білків); Пояснювати взаємозв'язок між хімічною будовою основних речовин мембрани, їх властивостями та структурою мембрани; Обгрунтувати вплив температури та хімічної структури липідів на фазове становище мембрани, а також на її проникливість. МАТЕРІАЛИ МЕТОДИЧНОГО ЗАБЕЗПЕЧЕННЯ: 1. Матеріали для основної частини заняття: таблиці, схеми, малюнки, проблемні теоретичні питання зі збірника «Робочий зошит для самостійної роботи на практичних заняттях для студентів медичного факультету» 2. Матеріали для контролю знань: тестові питання для стандартизованого контролю знань студентів. 3. Матеріали для самопідготовки студентів: рекомендовані навчальні посібники, методичні вказівки для самостійної роботи студентів. ТЕОРЕТИЧНІ ВІДОМОСТІ: Біологічні мембрани одні з найважливіших структурних компонентів клітин. Розрізняють плазматичну (поверхневу) мембрану, яка відділяє вміст клітини від зовнішнього середовища, і внутрішні мембрани, які формують різні клітинні органели (мітохондрії, ЕПР, апарат Гольджі, лізосоми та ін.) Плазматична мембрана є барьером, необхідним для підтримання сталості хімічного складу іфізичних властивостей клітини по відношенню до зовнішнього середовища, а також явлє собою високовибірковий фільтр, який здійснює транспорт речовин між клітиною і зовнішнім середовищем. Спеціалізована плазматична мембрана збудливих клітин відіграє основну роль в поширенні електричних імпульсів (потенціалів дії). Плазматичні мембрани епітеліальних клітин шлунково-кишкового тракту і нирок беруть участь в процесах всмоктування і секреції. Властивості мембран багато в чому визначають проникнення лікарських речовин і характер їх дії в організмі. Хімічний склад біологічних мембран. Всі біологічні мембрани складаються з ліпідних і білкових молекул. Ліпідні молекули утворюють безперервний подвійний шар, який являє собою відносно непроникний бар'єр для більшості молекул, розчинних у воді. Білкові молекули необхідні для виконання різних функцій мембран: здійсння транспорту речовин, каталізу біохімічних реакцій та ін. Найбільш поширенним типом липидів в мембрані є фосфоліпіди (є також холестерол і гліколіпіди). У гліцерофосфоліпідах одна з гідроксильних груп гліцерину пов'язана із залишком фосфорної кислоти,за допомогою якої до молекули гліцерофосфоліпіда приєднується одна з азотистих основ, а дві інші - з залишками жирних кислот (як насиченими жирними кислотами (стеаринової, пальмітинової та ін.), так і ненасиченими (олеїнової, лінолевої, ліноленової, арахідонової та ін.)). Ненасичені жирні кислоти містять одну або більше подвійних зв'язків, в місці яких є вигин молекули. Таким чином, молекули гліцерофосфоліпідів складаються з двох частин. Перша з них - "головка": до її складу входить одназ азотистих основ, а також залишки фосфорної кислоти і гліцерину. Інша частина - два "хвоста", що складаються зостатків молекул жирних кислот. Головки і хвости, будучи двома складовими частинами молекул фос-фоліпідів, характеризуються різними фізико-хімічними особливостями. Головки мають виражені полярні властивості (гідрофільні). Хвости неполярні (гідрофобні). Наявність в молекулі фосфоліпідів гідрофільноїі гідрофобноїчастин, називається амфіфільністю. У воді такі молекули об'єднуються і утворюють упорядкувані структури, які відрізняються відносно високою стабільностью. У таких структурах гідрофільні головки знаходяться в контакті з молекулами води, а гідрофобні хвости віддаляються від неї. Структури, утворені фосфоліпідами у водному середовищі, поєднують властивості рідин і кристалів. Вони зберігають впорядкованість в розташуванні і орієнтації молекул, як кристали, і в той же час володіють плинністю подібно рідин (рідкі кристали). Фізичний стан фосфоліпідів у водному середовищі залежить від температури. При зменшенні температури нижче деякого критичного значення відбувається перехід фосфолипідів з рідкокристалічного стану в гель - структуру, до близьку твердокрісталліческой. Білки мембрани різноманітні за своєю структурою і функціями. Всі білки складаються з амінокислот, які завдяки ковалентним пептидним зв'язкам утворюють довгі цепі. Більшість мембранних білків містить ділянки молекули, стабілізовані водневими зв'язками в формі альфа-спіралі, і ділянки у вигляді безладно звернутого клубка. Це надає молекулам білка певну гнучкість і здатність змінювати свою форму. Окремі амінокислоти відрізняються хімічної природою своїх бічних груп які надають їх молекулам полярний або неполярний характер. Залишки кислих амінокислот більш полярні в порівнянні з нейтральними. Тому деякі ділянки білкових молекул можуть бути гідрофільними, а другі - гідрофобними. Білки відіграють першорядну роль в структурній організації і функціонування клітини: 1. Закодована генетичноа інформація; 2. Структурні елементи клітини; 3. Ферментативна функція; 4. Транспортна функція; 5. Захісна функція і т.ін. Білки являють собою полімери, які утворені із залишків аминокислот. Розрізняють декілька рівнів організації структури молекул білків. Властивості білків визначаються особливостями їх просторової структури. Первинна структура - це послідовність амінокислотних залишків, пов'язаних один з одним ковалентними пептидними зв'язками, які утворюються між атомом вуглецю карбоксильної групи однієї амінокислоти і атомом азоту аміно-групи іншої амінокислоти (N-C - зв'язок). Пептидні зв'язкі є жорсткими і не допускають можливість обертання ланцюга навколо себе. Але інші типи зв'язків в складі поліпептидного ланцюга до певної міри рухливі і допускають можливість її обертання. Вони позволяють поліпептидного ланцюга згинатися і міняти форму, що призводить до утворення вторинної і третинної структури білкової молекули, а також їх конформацій. Вторинна структура являє собою впорядковану укладання поліпептидного ланцюга того чи іншого типу, стабілізовану водневими зв'язками між пептидними групами. В одній і тій же молекулі білка можуть зустрічатися ділянки з різними типами вторинної структури, а також невпорядковані ділянки, позбавлені певної вторинної структури. Найбільш часто зустрічаються два типи вторинної структури білкових молекул: альфа-спіраль ( більш енергетично вигідна) і бета-структура Третинна структура утворюється в результаті виникнення всіх видів слабких взаємодій між радикалами амінокислот. Найбільш важливу роль у формуванні третинної структури білка у водному середовищі грають гідрофобні взаємодії. Білкова молекула приймає таку третинну структуру, при которій гідрофільні амінокислотні залишки знаходяться зовні в контакті з водою, а гідрофобні опиняються всередині глобули. При цьому утворюється така третинна структура білкової молекули, яка є термодинамічно найбільш стійкою. Білкові молекули, які можуть перебувати в третинної структурі, саме завдяки її особливостям набувають певної функціональну активність і здатність брати участь в тих чи інших біологічних процесах. Зокрема, при формуванні третинної структури в білкової молекулі з'являються активні центри, що складаються з декількох амінокислотних радикалів. Третинна структура білкової молекули нe є жорсткою і має певну рухливістю. На її конформацію можуть впливати теплові флуктуації, спеціальні біологічно активні регулятори, а також виконання білкової молекулою її функцій. Зміна третинної структури білків різко змінює їх біологічну активність. Четвертична структура властива білкам, які складаються з декількох субодиниць, тобто білкових молекул меншого розміру. Окремі субодиниці зв'язуються за рахунок взаємодії аминокислотних радикалів (наприклад, гемоглобін, натрій-калієвий насос мембран клітин). Найбільш сталою є первинна структура білка, менш стійкими є більш високі структурні рівні білкової молекули, які стабілізовані слабкими взаємодіями. При зміні тимператури, кислотності, іонного складу середовища сила таких взаємодій змінюється, відбувається денатураці, що призводить до порушення вторинної та третинної структури білкової молекули. При зниженні температури до початкового значення білки можуть швидко (протягом декількох секунд) самовільно відновлюватися. У клітинних мембранах виявляються також вуглеводи у вигляді комплексіз з ліпідами (гліколіпіди) і білками (глікопротеїни). Будова біологічних мембран В даний час загальноприйнятою є теорія будови мембрани С.Сінгера і Г.Ніколсона (1972р), що отримала найменування рідинно-мозаїчної моделі. Основний сенс її полягає в тому, що подвійний шар молекул фосфоліпідів є основною безперервної частиною мембрани і знаходиться в рідкому стані. Головки молекул фосфолипідів завдяки своїм гідрофільним властивостями звернені назовні і контактують з водним середовищем. Хвости звернені всередину бішару і звʼязани гідрофобною взаємодією. При звичайній для клітини температурі ліпідний бішар знаходиться в рідкокристалічному стані. Молекули фосфоліпідів в мембрані здатні здійснювати різні види рухів: 1. швидке обертання молекули фосфолипіда навколо своєї поздовжньої осі; 2. коливання залишків молекул жирних кислот.; 3. латеральна дифузія: молекули- фосфоліпідів легко міняються місцями зі своїми сусідами в межах одного моношару. 4. переміщаються з одного моношару мембрани в інший шар («фліп-флоп»). Термотропний поліморфізм – залежність фізичного стану фосфоліпідів мембрани від температури, яка впливає на конфігурацію вуглеводневих ланцюгів залишків молекул жирних кислот, які входять до їх складу. Ці ланцюги здатні здійснювати повороти (ротації) навколо своїх -С-С- зв'язків, в результаті чого вони утворюють різні конфігурації (ротамер). Найбільш сталою є транс-конфігурація, яка обладає найменшою енергією. Вуглеводневі ланцюги в транс-конфігурації повністю витягнуті, найбільш щільно упаковані в мембрані і характеризуються малої рухливістю. Перебування в транс-конфігурації характерно для стану мембрани при температурі нижче критичної, коли вона набуває властивостей гелю. Підвищення температури збільшує ймовірність переходу транс-конфігурації в гош-конфігурацію, якої відповідає більш високий рівень енергії. Такий перехід означає поворот навколо -С-С- зв'язку на 120°. В результаті утворюється вигин вуглеводневого ланцюга. Поява таких вигинів призводить до збільшення відстані між молекулами, збільшенню рухливості. Розташування молекул в мембрані стає менш впорядкованим що відповідає переходу мембрани в рідкий стан. У вуглеводневого ланцюга при переході в гош-конфігурацію утворюється петля, яка називається кінок (kink- петля, англ.). Кінкі здатні переміщатися уздовж вуглеводневих ланцюгів, що може грати роль в перенесенні речовин через мембрану. Ліотропний поліморфізм- це залежність фізичного стану мембранних фосфоліпідів від складу їх жирних кислот. У ненасичених жирних кіслот в області подвійних зв'язків С = С - існує цис-конфігурація, яка також призводить до вигину вуглеводневих ланцюгів. Тому в мембранах, що містять значну кількість ненасичених жирних кислот, вуглеводневі ланцюги упаковані більш пухко, проміжки між ними більше, вище ступінь разупорядкування молекул Все це збільшує плинність мембран і сприяє збереженню ними рідкого стану. Важливу роль в регуляції фізичних властивостей біомембран грає холестерин. Його молекули легко вбудовуються в подвійній фосфолипідний шар. При температурі нижче критичної холестерин порушує кристалічну упаковку ланцюгів, збільшуючи їх рухливість. При температурі вище критичної його присутність викликає зростання впорядкованості вуглеводневих ланцюгів і зменшення їх рухливості, Але надлишок холестерину в мембранах призводить до зростання їх в'язкості і впливає несприятливо на ряд біохімічних процесів. Структурні особливості біомембран визначаються властивостями фосфолипидного бішару, а їх функції здійснюються головним чином білками. Рідинно-мозаїчна модель мембрани враховує, що білки як би вбудовані в неї. За характером розташування в мембрані, білки поділяються на периферичні та інтегральні. Периферичні білки розташовані на поверхні бішару і прилягають до голівок молекул мембранних фосфолипідів. На поверхні молекул таких білків є в основному гідрофільние групи, які зв'язуються з фосфоліпідами за допомогою електростатичної взаємодії і водневих зв'язків. Такі білки можуть бути легко відділені від мембрани з допомогою розчинів солей високої іонної сили або зміни рН. Молекули інтегральних білків мають поряд з гідрофільними також великі гідрофобні ділянки. Ці ділянки білкових молекул занурені в фосфоліпідний бішар мембрани на більш-менш значну глибину. Багато з інтегральних білків пронизують мембрану наскрізь і контактують сво-ними гідрофільними групами з водним середовищем по обидва боки мембрани. Інтегральні білки пов'язані з мембраною гідрофобними взаємодіями, тобто більш міцно, ніж периферичні білки. Вони можуть бути виділені з мембрани тільки за допомогою органічних розчинників або детергентів. Молекули білків в мембрані рухливі. Вони здатні до обертального руху і латеральної дифузії. Однак через великі розмірів молекул їх рухливість значно поступається рухливості фосфоліпідів. Рухливість деяких мембранних білків ограниче-на і завдяки тому, що вони пов'язані з розташованими в цитоплазмі специфічними білковими молекулами, які утворюють цитоскелет клітини. На поверхні мембран є також вуглеводи. Вони приєднени у вигляді бічних ланцюгів до мембранних білків (глікопротеїни) і ліпідів (гліколіпіди). Вуглеводні бічні ланцюга в плазматичній мембрані розташовуються лише на її зовнішній поверхні. Передбачається, що вони грають роль в процесах взаємодії між клітинами. ПЛАН ТА ОРГАНІЗАЦІЙНА СТРУКТУРА ЗАНЯТТЯ: І. Визначення актуальності, цілей заняття 5 хв. ІІ. Письмова самостійна робота студентів з «Робочим зошитом для студентів медичного факультету» 30 хв.: 1.На рис. 1а показано хімічну будову гліцерофосфоліпідів. До складу "головки" входить залишок одної з азотистих основ (холін, серин, етаноламін, інозит), а також залишки фосфорної кислоти і гліцерину. Два "хвоста", що складаються із залишків молекул жирних кислот (насичені жирні кислоти (стеаринова, пальмітинова та ін) і ненасичені (олеїнова, лінолева, ліноленова, арахідонова та ін.). залишок гліцерину,2- хвости, 3- залишок фосфорної кислоти, 4- залишок азотистої основи, 5- головка 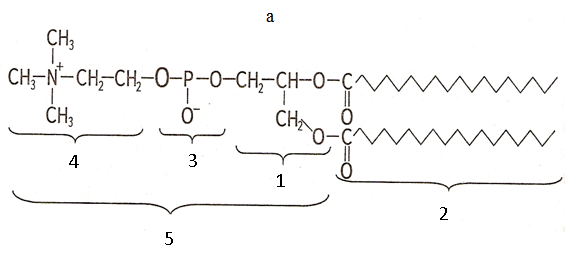 Рис.1а 1.1. Із залишків, яких хімічних речовин складаються «головки» і «хвости» фосфоліпідів? Назвіть частини фосфоліпіду позначені цифрами 1-5. 1.2. Які частини молекул фосфоліпідів володіють спорідненістю до води, які відштовхуються від неї? Головка - споріднена до води, хвости - відштовхуються від неї 1.3. Як називаються молекули, що мають гідрофільну і гідрофобну частини? Чи має значення це властивість у формуванні структури мембрани? Молекули, що мають гідрофільну і гідрофобну частини називаються амфифільними.При формуванні структури мембрани амфифільність відіграє основну роль. 1.4. Як впливає наявність подвійного зв'язку в вуглеводневій ланцюжку «хвоста» на його конфігурацію (рис.1б)? Ненасичені жирні кислоти містять одну або більше подвійних зв'язків, у місці яких є вигин молекули. 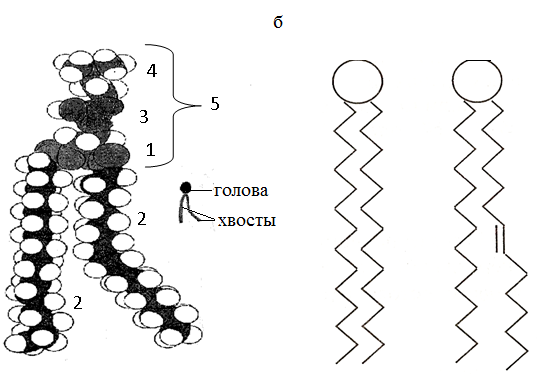 Рис.1б 2. На рис. 2 схематично представлені структури, утворені молекулами фосфоліпідів у воді. 2.1. Як називаються структури, позначені цифрами 1 і 2? 1- біліпідний шар 2- біліпідна міцела 2.2. Як розташовані фосфоліпіди в представлених структурах? Чим пояснюється саме таке їх розташування? Гідрофобні хвости розташовуються між двома шарами гідрофільних головок. Бішарова структура стабілізована з одного боку взаємодією полярних головок з молекулами води, з іншого - гідрофобними взаємодіями неполярних хвостів один з одним. 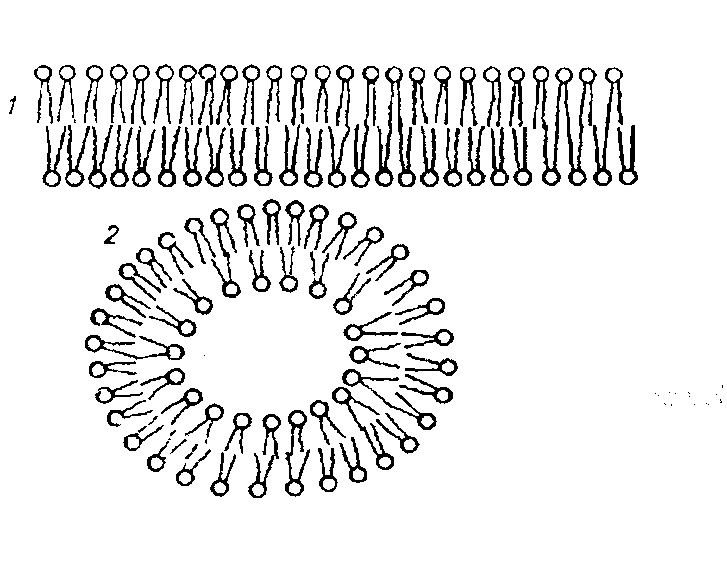 Рис.2 3. На рис. 3 схематично представлені різні рівні організації білкової молекули. Розгляньте запропоновані Вам схеми і дайте відповідь на питання: 3.1. Яка структура білка представлена на малюнку 3а? Вкажіть, який хімічним зв'язком ця структура стабілізована? Первинна. Стабілізована ковалентним полярним зв’язком (пептидним) між карбоксильною групою однієї амінокислоти і аміногрупою другої амінокислоти. 3.2. Яка структура білка показана на рис. 3б? Який тип хімічного зв'язку її формує? Вторинна. Стабілізована водневим зв’язком. 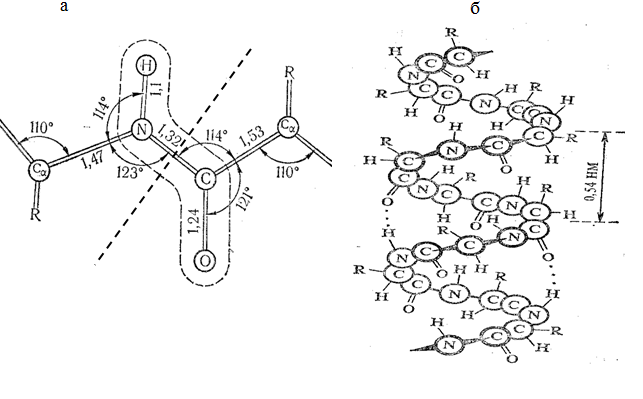 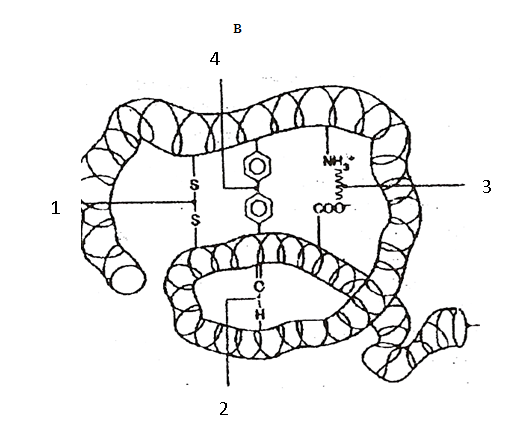 Рис.3 3.3. Яка структура білка показана на ріс.3в? Перелічіть види хімічних зв'язків формують цей рівень організації білкової молекули (1-4)? Який вид хімічної взаємодії є вирішальним у формуванні даної структури білкової молекули? Третинна. Стабілізована іонним, водневим, ковалентним (дісульфідний місток), силами Ван–дер–Ваальса. Вирішальним у формуванні даної структури білкової молекули є гідрофобна взаємодія. 3.4. Чи можлива ще якась структура для організації білкової молекули? Можлива четвертинна структура. В її формуванні найважливішу роль відіграє гідрофобна взаємодія. На рис. 4 схематично показані фосфоліпідні мембрани, до складу яких входять насичені і ненасичені жирні кислоти. 4.1. Які відмінності в хімічному будову насичених і ненасичених жирних кислот Вам відомі? У яких із них можливі зміни конфігурації? Залишки ненасичених жирних кислот мають подвійний зв'язок. Зміни конфігурації можливі у насичених жирних кислот (транс- (найбільш стійка) і гош - конфігурація.) 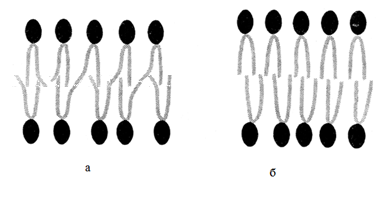 Рис.4 4.2. Проаналізуйте відмінності розташування у мембрані ліпідів, до складу яких входять насичені і ненасичені жирні кислоти (їх віддаленість один від одного в моношарі, товщину ліпідного бішару). Рис.4 а – до складу мембрани входять залишки ненасичених жирних кислот, віддаленість від один від одного в моношарі більша, ніж у тої мембрани до складу якої входять насичені жирні кислоти (рис.4б). Товщина мембрани в випадку 4а менша. 4.3. Яка з мембран є більш текучої? Чому? Більш текучою є мембрана,в який ненасичених жирних кислот більше ніж насичених. Це пов’язано з фізичними властивостями ВЖК. 4.4. Яка з представлених на малюнку мембран буде більш проникна для різних речовин? Чому? Найбільш проникна для різних речовин мембрана. Яка складається з ненасичених залишків ВЖК. Тому, що така мембрана більш тонка, віддаленість ліпідів моно шарі у такої мембрани є більшою. 4.5. Як називається залежність біофізичних властивостей мембрани від їх хімічної будови? Ліотропний поліморфізм. На рис. 5 схематично показано вплив змін температури на стан молекул фосфоліпідів у мембрані. 5.1. Поясніть, як на конфігурацію молекул і на їх взаємодію один з одним впливає підвищення і пониження температури? Підвищення температури збільшує ймовірність переходу транс-конфігурації в гош-конфігурацію, якої відповідає більш високий рівень енергії. Такий перехід означає поворот навколо-С-С-зв'язку на 120 °. В результаті утворюється вигин вуглеводневої ланцюга.Поява таких вигинів призводить до збільшення розміру проміжків між молекулами, їх більш пухкої упаковці в мембрані, збільшення рухливості. Розташування молекул в мембрані стає менш впорядкованим (рис.5а). Все це відповідає переходу мембрани в рідкий стан. Найбільш стійкою є транс-конфігурація, яка володіє найменшою енергією. Вуглеводневі ланцюги в транс-конфігурації повністю витягнуті, найбільш щільно упаковані в мембрані і характеризуються малою рухливістю (рис.5б). Перебування в транс-конфігурації характерно для стану мембрани при температурі нижче критичної, коли вона набуває властивостей гелю. 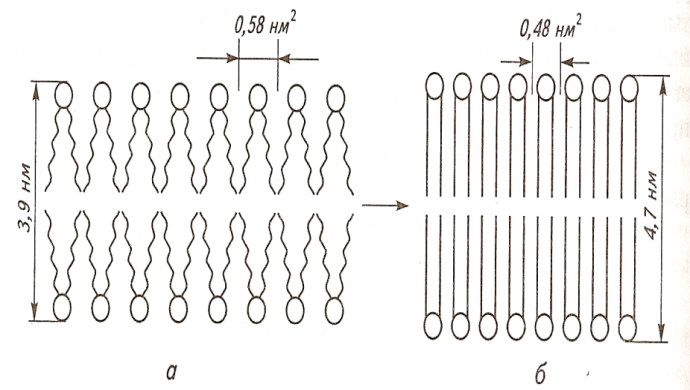 Рис.5 5.2. Чи може при цьому мінятися проникність мембрани? Чому? Проникність мембрани буде більше при більш високої температурі. Тому що відстань міжліпідами у моношарі у такої мембрани є більшою. Як називається залежність біофізичних властивостей мембрани від температури? Термотропний поліморфізм. На рис. 6 схематично показані різні види рухів молекул фосфоліпідів у мембрані 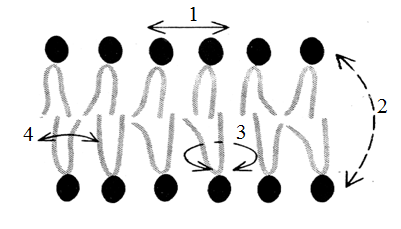 Рис.6 6.1. Назвіть ці рухи і дайте їм характеристику. 1- латеральна дифузія. У процесі цього руху молекули фосфоліпідів легко міняються місцями зі своїми сусідами в межах одного моношару. 2 - «фліп-флоп», молекули фосфоліпідів з працею переміщаються з одного моношару мембрани в інший шар. 3 - швидке обертання молекули фосфоліпіду навколо своєї поздовжньої осі. Вони здатні здійснювати приблизно 108 обертів за секунду. коливання залишків молекул жирних кислот, які володіють гнучкістю. 4- коливання залишків молекул жирних кислот, які володіють гнучкістю. 6.2. З однаковою частотою здійснюються руху фосфоліпідів 1 і 2 в мембрані? Чому? Латеральна дифузія відбувається приблизно 107 разів в одну секунду.«Фліп-флоп» дуже рідко. 6.3.Як відрізняється рух білків в плазматичній мембрані від руху ліпідів? Чому? Молекули білків в мембрані рухливі. Вони здатні до обертального руху і латеральної дифузії. Однак через великі розміри молекул їх рухливість значно поступається рухливості фосфоліпідів. Рухливість деяких мембранних білків обмежена і завдяки тому, що вони пов'язані з розташованими в цитоплазмі специфічними білковими молекулами, які утворюють цитоскелет клітини. 7. Розгляньте рис. 7, на якому зображено будову мембрани і дайте відповідь на питання: 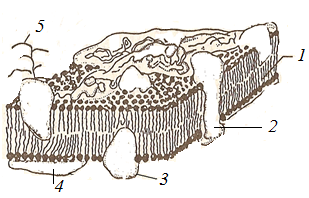 Рис.7 7.1. З яких хімічних речовин складається мембрана? Мембрана складається з фосфоліпідів, білків, вуглеводів. 7.2. Як молекули фосфоліпідів розташовані в мембрані? Згідно рідинно-мозаїчної моделі головки молекул фосфоліпідів завдяки своїм гідрофільним властивостям звернені назовні і контактують з водним середовищем. Хвости звернені всередину бішару та пов'язані гідрофобною взаємодією. 7.3. Чому молекули фосфоліпідів розташовані у два шари? Завдяки їх амфіфльності. 7.4. Які сили пов'язують молекули фосфоліпідів один з одним? Гідрофобні взаємодії. 7.5. Як білки діляться на групи по їх розташуванню в мембрані? Які з них більш міцно пов'язані з мембраною? Чому? За характером розташування у мембрані, білки поділяються на периферичні та інтегральні. Периферичні білки розташовані на поверхні бішару і прилягають до голівок молекул мембранних фосфоліпідів. На поверхні молекул таких білків є в основному гідрофільні групи, які зв'язуються з фосфоліпідами допомогою електростатичної взаємодії і водневих зв'язків. Такі білки можуть бути порівнянно легко відділені від мембрани за допомогою розчинів солей високої іонної сили або зміни рН. Молекули інтегральних білків, на відміну від периферичних, мають поряд з гідрофільними також великі гідрофобні ділянки. Ці ділянки білкових молекул занурені в фосфоліпідний бішар мембрани на більш-менш значну глибину. Багато хто з інтегральних білків пронизують мембрану наскрізь і контактують своїми гідрофільними групами з водним середовищем по обидва боки мембрани. Інтегральні білки пов'язані з мембраною гідрофобними взаємодіями, тобто більш міцно, ніж периферичні білки. Вони можуть бути виділені з мембрани тільки за допомогою органічних розчинників або детергентів. 7.6. Якими властивостями повинна володіти молекула інтегрального білка, щоб міцно утримуватися в мембрані? Вони повинні бути амфіфільними. 7.7. Чому плазматичну мембрану називають «рідким кристалом»? При звичайній для клітини температурі ліпідний бішар знаходиться в рідкокристалічному стані. За своїми фізичними властивостями (в'язкості, текучості) він приблизно відповідає оливковій олії. |
