Общая характеристика растворов. Межмолекулярные взаимодействия вандерваальсовские и специфические. Уравнение ЛеннардДжонса Здравствуйте. Меня зовут Юрий Федорович Опруненко
 Скачать 1.21 Mb. Скачать 1.21 Mb.
|
|
pA = NA pA0 Различные способы выражения закона Рауля: Отношение давления пара растворителя над раствором нелетучего неэлектролита (вещества) В к давлению пара над чистым растворителем равно мольной доле растворителя. pA/pA0 = NA Можно по-другому переписать уравнение: pA/pA0 =1 - NB или (p0 -pA)/pA0 = NB Относительное понижение давления растворителя в растворе нелетучего неэлектролита (вещества) В к давлению пара чистого растворителя равно мольной доле вещества В. Закон Рауля применим к идеальным и сильно разбавленным растворам. Однако, снижение давления довольно невелико (например, менее 1% для разбавленного (10-3 М) раствора сахарозы). Для идеальных и разбавленных растворов, когда оба компонента являются летучими, общее давление пара над раствором p будет равно сумме парциальных давлений его компонентов: p = pA+pB = NApA0+NBpB0 = (1-NB)pA0 + NBpB0 = pA + NB(pBo-pA0) Уравнение характеризует линейную зависимость давления от мольной доли компонента В. Такая зависимость характерна для идеальных и разбавленных растворов. Законы Рауля могут быть выведены на основе 2-го закона термодинамики из условия термодинамического равновесия в изобарно-изотермических условиях, когда G=0 с использованием химических потенциалов (следствие 2-го закона термодинамики). Например, практически идеальными свойствами обладает раствор бензола в толуоле. В идеальном растворе силы взаимодействия и соответствено энергия взаимодействия между молекулами (частицами) растворителя А ЕАА (сила взаимодействия (св) А-А), между частицами растворенного вещества ЕВВ (св В-В) и между частицами растворителя и частицами растворенного вещества ЕАВ (св А-В) одинаковы. Именно это условие очень хорошо выполняется для раствора толуола в бензоле. Поэтому изменение концентрации любого компонента в растворе приводит к пропорциональному изменению его парциального давления в паре над раствором. Для неидельных растворов линейная зависимость общего давления от состава раствора нарушается: наблюдается положительное – давление пара больше предсказуемого (кривая 1) - (такая ситуация характерна для растворов, которые образуются с поглощением теплоты при растворении, т.е. Нраст 0 – эндотермический процесс) и отрицательное отклонение – давление пара меньше предсказуемого(кривая 2)(Н 0, выделение теплоты, экзотермический процесс). При этом, как правило, эти отклонения одного знака, как для общего давления р, так и для парциальных давлений компонентов рА и рВ. Причина положительного отклонения: силы взаимодействия А-В слабее, чем А-А и В-В (например, при растворении разрываются водородные связи) – т.е. большая возможность для А и В переходить в паровую фазу. Отрицательного отклонения – А-В-связь сильнее А-А и В-В. Ж 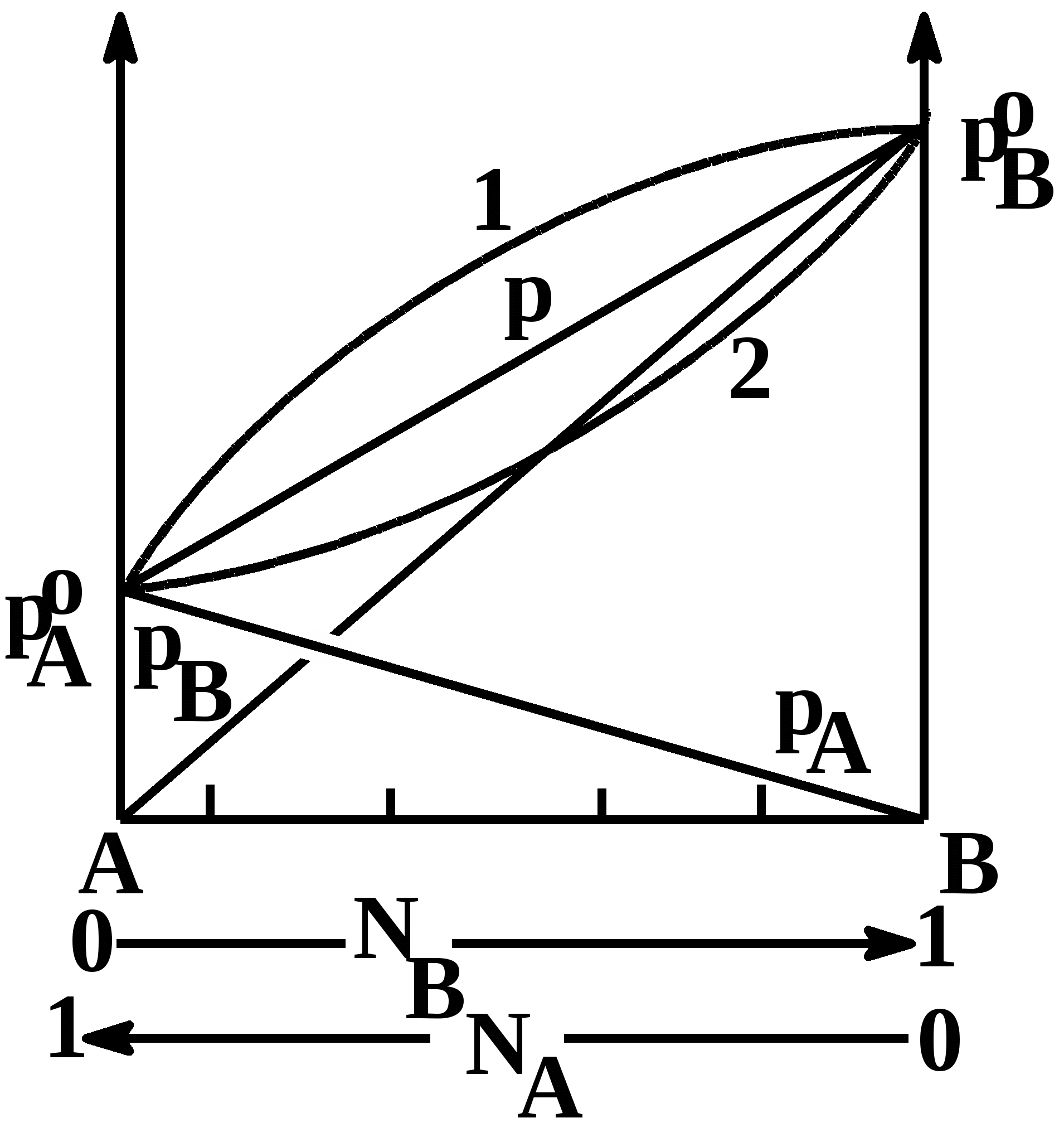 идкие смеси, свойства которых сильно отличаются от идеальных называются азеотропными (в отличие, от идеальных – зеотропных). Жидкие растворы, не подчиняющиеся закону Рауля С положительным отклонением С отрицательным отклонением Бензол/этанол метанол/вода Вода/этанол азотная к-та/вода Этанол/дисульфид углерода трихлорметан/этанол Важной и полезной информацией при этом является состав паровой фазы, который можно узнать по составу жидкой фазы и по давлениям паров над чистыми компонентами. В общем случае ясно, что паровая фаза будет обогащена более легколетучим компонентом. Содержание компонента в паровой фазе расчитывается для бинарного раствора:по формуле:  где x1 и x2 состав жидкой фазы, а y1 и y2 состав пара. Это уравнение получают из комбинации закона Рауля (давления пара компонента бинарной жидкой системы равно давлению пара чистого компонента, умноженного на мольную долю компонента в жидкости) и закона Дальтона – частный случай закона Генри (первый описал болезнь, которой страдал сам – дальтонизм – отсутствие способности различать цвета) (общее давление пара (газа) равно сумме парциальных давлений паров (газов), которые пропорциональны мольным долям компонентов). Даже для идеальных растворов состав пара отличен от состава исходного раствора. Осмос. Осмотическое давление растворов неэлектролитов (коллективные свойства растворов). Осмотическое давление развивают растворы, которые отделены от чистого растворителя полупроницаемой (проницаемой для растворителя, но не для растворенного вещества) перегородкой (мембрана – по-латыни - перепонка: бычий (свиной мочевой) пузырь, кожи, искусственные – керамика, целлофан и пр.). Впервые в качестве таких перегородок применил животные пленки физик и ботаник аббат Жан Антуан Ноле (1748 г) (бычий пузырь) и он впервые с помощью таких мембран изменял концентрацию водно-спиртовых растворов, т.е. наблюдал явление осмоса. Парижский аббат и придворный «электрик» короля Людовика XV (1715-1774), учивший затем физике внука последнего, казненного французкой революцией Людовика XVI, и специально ведавший различными электрическими увеселениями, Жан Антуан Нолле прославился тем, что ставил свои эксперименты и научные опыты в присутствии знатных особ, пытаясь добыть деньги – гранты - на научные исследования. Так он заставил содрогнуться от электрического разряда целую цепь из взявшихся за руки любопытствующих монахов картезианского монастыря, а через некоторое время в присутствии короля в Версале повторить этот довольно опасный, но зато впечатляющий эксперимент в значительно большем масштабе: на сей раз "содрогнулась" от электричества из лейденской банки – простейшего конденсатора - цепь из 180 стойких королевских мушкетеров! Даже гвардейская дисциплина оказалась бессильной перед ударом тока: «Первый держал в свободной руке банку, а последний извлекал искру; удар почувствовался всеми в один момент. Было очень курьезно видеть разнообразие жестов и слышать мгновенный вскрик, исторгаемый неожиданностью у большей части получающих удар». Эти эксперименты Нолле докладывал в Парижской академии наук. Осмос – это самопроизвольный односторонний переход растворителя (диффузия) через полупроницаемую мембрану из разбавленного раствора или чистого растворителя в концентрированный раствор. С  хема осмоса: 1 - растворитель (или менее концентрированный раствор), 2 - раствор (более концентрированный, чем в части 1), 3 – полупроницаемая перегородка или мембрана, 4 – поток растворителя Осмос отражает коллигативные свойства растворов, т.к. определяется только концентрацией растворенного вещества, а не его природой. С одной стороны мембраны молекул растворителя в единице объема больше, чем по другую сторону, поэтому растворитель переходит в более концентрированный раствор. Растительные клетки содержат солевые растворы, их оболочки – мембраны, поэтому они вытягивают воду из земли. Есть обратный осмос – переход растворителя под давлением через мембрану из раствора для получения чистого растворителя. Этот процесс используется в промышленности, для получения чистой воды из морской. Давление, которое надо приложить к концентрированному раствору, чтобы прекратить перенос растворителя через полупроницаемую мембрану называется осмотическим давлением (). Немецкий ботаник Пфеффер количественно измерил величину осмотического давления растворов сахара (сахарозы) разной концентрации с использованием полупроницаемой оболочки из ферроцианида меди. Законы осмотического давления для разбавленных растворов (у концентрированных растворов начинаются отклонения) были сформулированы Вант-Гоффом на основе экспериментов Пфеффера (уравнение Вант-Гоффа – приближенное уравнение и справедливо только для очень разбавленных растворов): V = nRT = n/V*RT=cRT n – число молей растворенного вещества, с – молярная концентрация (или разница молярных концентраций), моль/л, R – газовая постоянная, 8.31 кПа л/(моль К), V – объем раствора, л, n – число молей растворенного вещества, - осмотическое давление, кПа. Формула имеет сходство с уравнением состояния идеального газа. Подобное сходство неслучайно и отражает сходство систем на молекулярном уровне. Раствор, содержащий 1 моль растворенного вещества в 22.4 л раствора имеет при 0оС давление 1 атм (1.013 105 Па). С точки зрения термодинамики движущейся силой осмоса является стремление системы к выравниванию концентраций, так как при этом энтропия системы возрастает (S0). Энергия Гиббса ситемы G уменьшается и химические потенциалы выравниваются. Измерение осмотического давления применяется для определения молекулярной массы многих веществ, в частности, полимеров. В живых системах осмотическое давление является основной причиной пополнения воды, в частности, растениями. Осмотическое давление у растений в пустынной местности 17 Мпа (М = 106), что позволяет им высасывать воду даже из очень сухой почвы. Явление осмоса очень важно в медицине, в частности, в гематологии. Осмотическое давление крови у человека около 8 атм при 37оС. Клетки нормально функционируют в изотонических растворах, которые применяются для введения различных лекарств (изотонический раствор NaCl 0.9%), в гипотонических растворах происходит разрыв клеточных оболочек и вытекание содержимого. Такое разрушение называется лизисом. Он необходим, когда нужно выделить какие-то интересные внутриклеточные биологически-активные молекулы: ДНК, РНК, белки, ферменты и т.д. Сморшивание и высушивание клеток крови в гипертоническом растворе называется плазмолизом. Интересна связь механизма осмоса с изменением давления пара над раствором. Иллюстрацией может служить простой эксперимент. Если в закрытый стеклянный сосуд-колокол поместить стакан 1 с чистым растворителе и стакан 2 (уровни в стаканах одинаковы) с раствором какого-либо нелетучего вещества, то через какое-то время уровень 1 понизится, а уровень 2 повысится. Это объясняется более низким давлением пара над раствором, чем над чистым растворителем. Воздушное пространство выполняет роль полупроницаемой мембраны.  1. стакан с чистым растворителем, 2. раствор нелетучего вещества Теоретически расчитанные по формуле значения осмотического давления совпадают с экспериментальными лишь при малых концентрациях, т.е. справедливо только для разбавленных растворов неэлектролитов. Зависимость осмотического давления раствора сахарозы от концентрации:
|
