аллергология зачет. Опосредованные заболевания. Принципы диагностики заболеваний. Особенности сбора анамнеза. Наследственные аспекты аллергический заболеваний
 Скачать 7.01 Mb. Скачать 7.01 Mb.
|
|
1вопрос LgE-опосредованные заболевания. Принципы диагностики заболеваний. Особенности сбора анамнеза. Наследственные аспекты аллергический заболеваний Тип I (анафилактический, IgE-зависимый).Обусловлен образованием особого типа антител, имеющих высокое сродство к определённым клеткам (например, тучным клеткам, базофилам). Эти антитела называют гомоцитотропными [к ним относят реагины (IgE и IgG4) человека], поскольку у них выражена тропность к клеткам (тканям) того же вида животного, от которого они получены. Попадая в организм, аллерген фрагментируется в АПК до пептидов, презентируемых затем этими клетками Th2-лимфоцитам. Тh2-клетки, в свою очередь, активизируясь, продуцируют ряд лимфокинов, в частности ИЛ-4 (и/или альтернативную молекулу - ИЛ-13), ИЛ-5, ИЛ-6, ИЛ-10, а также экспрессируют на своей поверхности лиганд для CD40 (CD40L или CD154), что обеспечивает необходимый сигнал для В-клеток к индукции синтеза IgE. Образовавшийся аллергенспецифический IgE взаимодействует с имеющими к ним очень высокое сродство специализированными рецепторами FcεRI (расположены на тучных клетках слизистых оболочек и соединительной ткани, базофилах), а также низкоаффинных FcεRII (CD23; экспрессированы на поверхности В-лимфоцитов, моноцитов, эозинофилов и, возможно, Т-лимфоцитов). CD23 может отделяться с клеточных мембран и попадать в циркуляцию, стимулируя продукцию IgE В-лимфоцитами. При повторном поступлении аллерген связывается IgE-антителами, что вызывает цепь биохимических превращений мембранных липидов (патохимическую фазу), следствием которых является секреция медиаторов, таких как гистамин, метаболиты арахидоновой кислоты (простагландин D2, сульфидопептидные лейкотриены: C4, D4, E4), ФАТ и происходит активация плазменных кининов. Медиаторы, взаимодействуя с рецепторами органов-мишеней, индуцируют патофизиологическую фазу атопической реакции: повышение сосудистой проницаемости и отёк ткани, сокращение гладкой мускулатуры, гиперсекрецию слизистых желёз, раздражение периферических нервных окончаний. Эти изменения составляют основу быстрой (ранней) фазы аллергической реакции,развивающейся в течение первых минут после контакта с аллергеном. Подготовка миграции клеток из сосудов в ткань обеспечивается изменением кровотока в микрососудах и экспрессией молекул клеточной адгезии на эндотелии и лейкоцитах. Последовательное вовлечение в процесс молекул адгезии и хемокинов приводит к инфильтрации тканей базофилами, эозинофилами, Т-лимфоцитами, тучными клетками, клетками Лангерганса. После активации они тоже секретируют проаллергические (провоспалительные) медиаторы, что формирует позднюю (или отсроченную) фазу аллергической реакции.Типичные примеры этого вида реакций - атопическая БА, АР, аллергический конъюнктивит (АК), аллергическая крапивница, АШ и др. ПРИНЦИПЫ ДИАГНОСТИКИ АЛЛЕРГИЧЕСКИХ ЗАБОЛЕВАНИЙ Диагностика направлена на выявление причин и факторов, способствующих формированию и манифестации аллергических заболеваний. Для этого применяют специфическиеи неспецифическиеметоды обследования. Начинают диагностику всегда с выяснения жалоб и сбора аллергологического анамнеза, особенности которых нередко позволяют предположить предварительный диагноз, изучения истории жизни и болезни, которые осуществляет врач во время осмотра пациента. Клинические методы обследования включают врачебный осмотр, клинико-лабораторные, рентгенологические, инструментальные, функциональные и другие методы исследования (по показаниям). Основной принцип специфическойдиагностики аллергических заболеваний - выявление причинно-значимого аллергена, для чего определяют аллергические антитела (специфические IgE) или сенсибилизированные лимфоциты и продукты специфического взаимодействия антигенов и антител. Специфическоеаллергологическое обследование включает: • сбор аллергологического анамнеза; • проведение кожных тестов; • проведение провокационных тестов; • лабораторную диагностику. Сбор аллергологического анамнеза При опросе больного особое внимание обращают на особенности развития первых симптомов заболевания, их интенсивность, динамику развития, длительность и чувствительность к назначаемым фармакотерапевтическим средствам. Выясняют семейный анамнез аллергии, поскольку известно, что у 30-70% больных с аллергическими заболеваниями близкие родственники страдают аллергией. При сборе анамнеза отмечают наличие или отсутствие сезонности заболевания, его связь с простудой, изменением климатических, жилищных или рабочих условий. Например, указание на ежегодное развитие респираторных проявлений (ринорея, заложенность носа, приступы удушья и др.) и/или зуда век, слезотечения в одни и те же периоды времени (весенние или летние месяцы, в сезон цветения определённых растений) характерно для поллиноза, и в план обследования таких больных включают методы тестирования с пыльцевыми аллергенами. Для больных с инфекционно-аллергической формой БА характерно обострение аллергического заболевания на фоне острых респираторных вирусных или бактериальных инфекционных заболеваний, особенно в холодное время года. Необходимо выяснить жилищно-бытовые условия больного, наличие в квартире мягкой мебели, ковров, книг, домашних животных, рыб, птиц, а также вызывает ли контакт больного с домашней пылью, животными и другими аллергенами обострение заболевания. Отдельно собирают пищевой анамнез (связь симптомов с употреблением каких-либо пищевых продуктов) и фармакологический анамнез (связь развития реакции с приёмом препаратов, её длительность, объём лечения и его эффективность). Анализ пищевого дневника.Для диагностики пищевой аллергии больного просят вести пищевой дневник, в котором указывается дата, время приёма пищи, название продукта с учётом объёма и способа приготовления, характер симптомов с указанием времени их появления и динамикой состояния в течение дня, характер стула, а также применяемые медикаменты и их эффективность. Правильно собранный анамнез позволяет не только выяснить характер заболевания, но и предположить его этиологию, т.е. виновный аллерген или группу аллергенов. Эти предположения должны быть подтверждены специфическими методами обследования - кожными, провокационными и другими тестами. 2 вопрос Тесты in vivo для диагностики LgE-опосредованных заболеваний . Кожное тестирование. Виды кожных проб. Провокационные пробы. Кожные тесты Существуют разные методы кожного тестирования с аллергенами in vivo: prick-тесты(тесты уколом), скарификационные тесты, аппликационные тесты, внутрикожные тесты. Кожное тестирование с ингаляционными и пищевыми аллергенами проводят для диагностики только IgE-зависимых аллергических заболеваний. Для кожного тестирования используют стандартные серийные, содержащие 10 тыс. единиц белкового азота (PNU - Protein Nitrogen Unit)в 1 мл, водно-солевые экстракты аллергенов. Эти экстракты приготавливают из пыльцы растений, домашней пыли, клещей домашней пыли, шерсти, пуха, эпидермиса животных и птиц, пищевых и других продуктов. Противопоказаниядля проведения кожных тестов. • Обострение основного заболевания. • Острые интеркуррентные инфекционные заболевания. • Туберкулёз и ревматизм в период обострения. • Нервные и психические заболевания в период обострения. • Болезни сердца, печени, почек и системы крови в стадии декомпенсации. • АШ в анамнезе. • Беременность и период лактации. Не рекомендуется проведение аллергологического обследования в полном объёме детям до 3-летнего возраста, больным в период лечения глюкокортикоидами и блокаторами Н1-рецепторов гистамина (снижают кожную чувствительность), а также после острой аллергической реакции, поскольку в этот период пробы могут оказаться отрицательными из-за истощения в коже сенсибилизирующих антител. Наиболее часто применяют prick-тесты или скарификационные тесты, которые ставят на внутренней поверхности предплечий на расстоянии 3-5 см друг от друга. Обязательны тесты на отрицательный (с тест-контрольной жидкостью) и положительный контроль (с гистамином). Оценку проб проводят через 20 мин, учитывая при этом наличие/отсутствие гиперемии и размер волдыря. Внутрикожные пробы более чувствительны, но отличаются меньшей специфичностью, их используют главным образом для выявления сенсибилизации к аллергенам бактериального и грибкового происхождения. Аппликационные пробы (patch-тесты)проводят с помощью стандартных наборов химических аллергенов для тестирования для диагностики аллергического контактного дерматита (определение ГЗТ - IV тип реакций). Провокационные тесты Провокационные тесты используют при расхождении данных анамнеза и результатов кожного тестирования. Противопоказания для проведения провокационных тестов те же, что и для кожного тестирования. В зависимости от вида аллергена и способа его введения в организм выделяют провокационные тесты:конъюнктивальный, назальный, ингаляционный, подъязычныйи пероральный.Для диагностики ЛА применяют тест торможения естественной эмиграции лейкоцитов in vivo(ТТЕЭЛ), разработанный А.Д. Адо. Методы лабораторной диагностики Основные показания для назначения лабораторных методов специфической аллергодиагностики, проводимых in vitro: • ранний детский возраст; • высокая степень сенсибилизации пациента; • наличие противопоказаний к проведению кожного тестирования; • непрерывно рецидивирующее течение заболевания без периодов ремиссии; • невозможность отмены антигистаминных и других препаратов, влияющих на кожную чувствительность; • поливалентная сенсибилизация, когда невозможно провести тестирование in vivoсразу со всеми предполагаемыми аллергенами в ограниченные сроки обследования; • резко изменённая реактивность кожи; • ложноположительный или ложноотрицательный результат при кожном тестировании; • уртикарный дермографизм. В клинической практике наиболее широко применяют следующие методы специфической диагностики аллергии, проводимые in vitro: • иммуноферментные методы анализа для выявления специфических IgE с колориметрическим, флюориметрическим и хемилюминесцентным способом регистрации результатов; • радиоаллергосорбентный тест (PACT) для выявления специфических IgE; • непрямой базофильный тест (тест Шелли); • прямой базофильный тест (тест Шелли); • реакция специфического высвобождения гистамина из базофилов периферической крови пациента. Данные методы лабораторной диагностики позволяют выявить только состояние сенсибилизации (наличие или отсутствие специфических IgE-антител к аллергенам без учёта клинических проявлений). Методы лабораторной диагностики рассматривают в качестве дополнительных мер, позволяющих уточнить сомнительные результаты тестирования in vivo. При постановке диагноза нужно опираться главным образом на жалобы пациента, данные аллергоанамнеза, осмотра больного, кожного тестирования, а также на результаты общеклинического обследования пациента. 3 вопрос Исследование функции внешнего дыхания. Пикфлоуметрия. Спирометрия. Бронхопровокационные пробы. Методики. Показания. Противопоказания Пикфлоуметрия - метод определения с какой скоростью может выдохнуть человек, другими словами это способ оценки степени сужения воздухоносных путей (бронхов). Данный метод обследования важен людям, страдающими затрудненным выдохом, в первую очередь людям с диагнозом бронхиальная астма, и позволяет оценивать эффективность проводимого лечения. Как проводится пикфлоуметрия? В сидячем положении, после нескольких спокойных вдохов и выдохов необходимо сделать глубоких вдох, плотно обхватить губами мундштук пикфлоуметра, который следует держать параллельно поверхности пола, и сделать максимально быстрый выдох. Через 2-3 минуты следует повторить вышеописанные действия и записать максимальное из двух значений Как часто следует проводить пикфлоуметрию? Исследование проводится, как правило, утром и вечером, при начальном подборе терапии желательно проводить пикфлоуметрию и днем, т.е. три раза в день. Все показатели необходимо записывать в дневник астматика, удобнее всего отмечать показатели пикфлоуметрии на специальных графиках, которые часто прилагаются вместе с пикфлоуметрами в комплекте. Как следует оценивать результаты пикфлоуметрии? Норма показателей выдоха рассчитывается индивидуально с учетом пола, возраста, роста. При достижении самых лучших показателей скорости выдоха, приближающихся к нормальным и при отсутствие симптомов астмы, необходимо рассчитать три цветных зоны для удобство оценки данных пикфлоуметрии. Ваш самый лучший показатель пикфлоуметрии нужно умножить на 0,8. Например, если у Вас лучшее значение пикфлоуметрии = 500 л/мин, Вам необходимо 500 умножить на 0,8, результат 400 л/мин. Любое значение выше 400 л/мин будет относиться к так называемой зеленой зоне, что означает - нормальный уровень проходимости бронхов. Для определения границ желтой зоны Вам необходимо умножить Ваш лучший показатель (например 500 л/мин) на 0,5, полученный результат (250 л/мин) будет нижней границей желтой зоны, а верхнюю границу мы уже знаем (ранее подсчитанное значение), т.е. желтая зона в нашем примере будет находится между 250 и 400 л/мин. Красная зона находится ниже уровня нижней границы желтой зоны, (т.е. в нашем случае ниже 250 л/мин), любой показатель пикфлоуметрии - должен требовать незамедлительных мер по улучшению проходимости бронхов Спирометрией называется клинический метод исследования адекватности внешнего дыхания, который основывается на измерении жизненной емкости легких и показателей скорости выдоха и вдоха. Данное исследование незаменимо для выяснения:
Это исследование можно назначать с шестилетнего возраста. Спирометрию проводят в первой половине дня, спустя несколько часов после завтрака. Непосредственно перед процедурой пациент должен отдыхать не меньше 15 мин в сидячем положении. Персонал, который будет следить за процедурой, обязательно проводит инструктаж пациента, где подробно рассказывает об этапах спирографии и о действиях самого исследуемого. Если больной принимает препараты теофиллина, их нужно отменить за сутки до исследования, а если ингаляционные препараты, то за 12 часов. Процедура не займет много времени и не принесет пациенту болезненных или неприятных ощущений. На нос человеку одевают зажим, чтобы предотвратить утечку воздуха, с помощью загубника соединяют исследуемого со спирографом. В течение 5 минут пациент дышит спокойно и размеренно. Потом делает максимально глубокий выдох, а за ним – такой же по глубине вдох и снова – выдох, и опять – вдох. Для получения достоверных результатов вышеописанные циклы проводятся 3 раза. Основные показатели спирометрии и их значения Для определения степени нарушения функции дыхания необходимо много показателей, но самыми главными считаются:
Показатели спирографии зависят от возраста, состояния здоровья и конституции пациента. Нормой считаются следующие цифровые значения показателей: ДО – 500-800 мл, ОФВ1 – 75%, индекс Тиффно – 70% и выше. Остальные показатели рассчитываются по специальным формулам и не имеют определенных цифровых значений. Спирометрия нужна, чтобы определить вид нарушений дыхательной системы у конкретного пациента. Патофизиологи выделяют 2 вида нарушений дыхательной функции:
Выявить наличие и оценить степень выраженности бронхообструкции в клинической практике позволяет исследование функции внешнего дыхания (ФВД), а провести первичную диагностику БА, дифференциальную диагностику БА и ХОБЛ – выполнение бронхомоторых тестов. В качестве алгоритма диагностики бронхообструктивных заболеваний с использованием бронхомоторных тестов может быть предложен следующий подход: 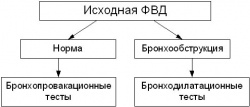 Бронхопровокационные тесты. Для установления наличия гиперреактивности (восприимчивости) дыхательных путей у пациентов с респираторными жалобами (эпизоды затрудненного дыхания, чувство нехватки воздуха, кашель, хрипы в легких, отделение мокроты и др.) при исходно нормальной ФВДиспользуются фармакологические тесты (ингаляции растворов гистамина, метахолина, карбахола) или тесты с неспецифическими провокаторами (например, с физической нагрузкой). Ингаляции осуществляются через небулайзер в последовательно возрастающих концентрациях раствора (от 0,0001 до 0,1%). Длительность ингаляции -3 мин при спокойном дыхании с произвольной частотой с использованием носового зажима. Повторная регистрация ФВД в режиме записи кривой «поток-объем» (пневмотахометрия) производится через 30 и 90 с после каждой ингаляции. Для анализа применяются наименьшие значения, отражающие максимальную бронхоконстрикцию при определенной дозе гистамина. Значимым является снижение объема форсированного выдоха за 1-ю секунду (ОФВ1) на 20% и более от исходного значения или клинические эквиваленты положительного теста - развитие типичного приступа затрудненного дыхания и рассеянные сухие хрипы в легких [3-5, 8]. При этом тест считается положительным независимо от того, ингаляция раствора какой концентрации привела к подобным изменениям. протокол пробы:
Кроме того, экспертная система спирометра «МАС-1» обеспечивает хронометраж, вследствие чего повторные исследования могут выполняться через требуемые временные промежутки, что является гарантией корректного исследования. Бронходилатационные тесты используются для оценки обратимости обструкции дыхательных путей. Тест на обратимость обструкции обычно проводится в момент установления диагноза:
К проведению теста предъявляются следующие требования:
Ответ на бронхолитик зависит от используемой дозы препарата; времени, прошедшего после ингаляции; бронхиальной лабильности и состояния легочной функции; воспроизводимости показателей, используемых для сравнения; вероятности повторения незначительных погрешностей исследования. В клинической практике обратимость обструкции, как правило, измеряется приростом показателя ОФВ1, выраженного в процентах к должному значению этого показателя [2], и рассчитывается экспертной системой спирометра «МАС-1» автоматически. Вариабельность ОФВ1, у одного и того же человека в разные дни составляет примерно 178 мл, поэтому увеличение ОФВ1, во время проведения теста на 12% и более по отношению к должному значению этого показателя при одновременном абсолютном увеличении ОФВ1 не менее чем на 200 мл не может быт случайностью и является диагностически значимым [6,10]. Дополнительными критериями положительного ответа на бронходилатационный тест являются увеличение СОС25-75 на 25% и более, а также увеличение ПОС на 1 л/с иболее по отношению к исходным значениям [2]. Заключение по бронходилатационному тесту включает должные объемы и должные нормативы исходные данные, значения показателей после использования бронхолитика, препарат, дозу, метод применения и временной интервал от момента тестирования до записи ответа. Протокол бронходилатационного теста, формируемый «МАС-1», представлен на рис.2. Таким образом, использование бронхомоторных тестов в клинической практике позволяет установитьналичие гиперреактивности дыхательных путей, степень обратимости бронхообструкции. Кроме того, применение разных бронхолитиков дает индивидуально подобрать прогностически наиболее эффективный препарат. 4 вопрос Тесты in vitro для диагностики lgЕ-опосредованных заболеваний ЛАБОРАТОРНЫЕ ТЕСТЫ ПРИСТ - прямой радиоиммуносорбентный тест Тест для определения общего IgE в сыворотке крови. Используют технику, при которой нерастворимые иммуносорбенты с "пришитыми" антиIgЕ-антителами в течение 16 часов инкубируют либо со стандартом, либо с исследуемой сывороткой. Затем несвязанные IgE-антитела сыворотки удаляют отмыванием, после чего в течение 2-4 часов инкубируют с меченными 125J aнтиIgE-антителами. Несвязанные 125J антиIgЕ антитела снова удаляют отмыванием. По связанной радиоактивности определяют количество общего Ig E. Радиоактивное мечение изотопом 131J, а в последнее время все чаще 125J - это многократно проверенный и надежный метод. Однако из-за того, что необходимые в этом случае реагенты опасны для здоровья и нестабильны в результате радиоактивного распада, были предложены и другие типы меток. Успешно применяют ферменты, в частности пероксидазу и фосфотазу, которые при добавлении к реагирующим компонентам соответствующего бесцветного субстрата, называемого хромогеном, воздействуют на последний с образованием окрашенных продуктов реакции. На использовании ферментов основан, в частности, метод определения антител, а иногда и антигенов, называемый ELISA (от англ. enzyme linked immunosorbent assay) - твердофазный иммуноферментный анализ - ИФА. Прямой метод выявления специфических Ig Е-антител: Радиоаллергосорбентный тест (PACT) Используют для количественной оценки антигенспецифических Ig Е-антител. Принцип метода: содержание специфических Ig Е антител в сыворотке можно установить, используя их способность связываться с антигеном (аллергеном), находящимся на нерастворимом сорбенте-носителе. Если в используемой сыворотке содержатся соответствующие антитела, то после инкубации они взаимодействуют с аллергенами. Несвязанные антитела сыворотки удаляют путем отмывания и оставшийся комплекс инкубируют с Ig Е-антителами, меченными 125J. В том случае, если ранее (на 1 этапе реакции) произошло связывание реагинов с аллергенами, то молекулы 125J aнтиIgE взаимодействуют с этими реагинами. Несвязанные 125J aнтиIg E удаляют отмыванием. Количество антигенспецифических антител определяют по связанной радиоактивности, используя соответствующие стандарты. Преимущества PACT по сравнению с кожными пробами: больной тратит меньше времени на исследование; на результаты не влияют принимаемые лекарственные препараты; выполнение теста не связано с риском развития у больного анафилаксии; есть возможность количественной оценки. Недостатки PACT: не выявляет иных антител-реагинов, кроме IgE. Примечание: PACT хорошо коррелирует с другими пробами, особенно провокационными. По сравнению с внутрикожными пробами PACT является менее чувствительным, но более специфичным, то есть практически не дает ложноположительных результатов PACT предпочтителен у детей до 5 лет, у которых кожные пробы непрактичны, у больных экземой, которым они противопоказаны и при патологическом дермографизме, когда результаты проб ложноположительные. Иммуноферментный анализ (ИФА) ИФА может быть использован для количественной оценки общего Ig E в сыворотке крови. Метод основан на принципе "сандвича". К сорбированным на твердой фазе антиIgE-антителам добавляют испытуемую пробу сыворотки, инкубируют, отмывают. Затем сюда же вносят конъюгат антиIgЕ-антител с ферментом в расчете на то, что этот конъюгат может связаться со вторым свободным активным центром IgE-антител, находящихся в составе иммунных комплексов на твердой фазе. Затем стадии инкубации и отмывки, после чего вносят субстрат (хромоген), соответствующий использованному ферменту. О превращении субстрата свидетельствует изменение цвета в лунке или в пробирке с твердой фазой, причем окрашивание происходит только при наличии в составе сендвич-комплексов на твердой фазе, а соответственно и в исследуемой сыворотке крови иммуноглобулина E. Интенсивность цветной реакции оценивают спектрофотометрически относительно положительной и отрицательной контрольных проб. 5 вопрос Возрастные особенности формирования аллергических заболеваний.Атопический марш. Во все периоды жизни, даже в момент предсуществования, на организм ребенка влияют различные факторы риска развития аллергии: -неблагоприятное состояние здоровья родителей перед зачатием, -отягощенная наследственность. -неблагоприятное течение беременности и родов, - воздействие пищевых, инфекционных антигенов и АГ окружающей среды. Процесс сенсибилизации развивается эволюционно, начинаясь с внутриутробного этапа, когда закладывается потенциальная сенсибилизация. А после рождения имеет место прогрессирующее расширение ее «плацдарма» в виде манифестации «аллергического марша» уже в раннем детском возрасте Первично, с первых месяцев жизни, развивается пищеваяаллергия, которая является основной и нередко единственной причиной аллергических заболеваний у детей первых трех лет жизни. (из-за раннего перевода на искусственное вскармливание.)При адекватной терапии она клинически угасает, хотя латентная сенсибилизация может сохраняться многие годы, и часто остается невыявленной. Таким образом, пищевая аллергия в грудном возрасте – это первое клиническое проявление «атопического марша». Продолжение же употребления аллергенных продуктов повышает степень пищевой полисенсибилизации и нередко способствует развитию на ее фоне других видов аллергии в определенной последовательности: -бытовой и эпидермальной со 2 — 3 года жизни, -пыльцевой и бактериальной — с 5—7 лет; они не сменяют друг друга, а наслаиваются. При этом вначале данные виды сенсибилизации имеют субклинический характер, реализуясь в манифестные формы через 6—12 месяцев при продолжении контакта со специфическим аллергеном. Это способствует, с одной стороны, формированию сочетанной сенсибилизации, частота и степень которой прогрессивно увеличивается с продолжительностью заболевания. С другой стороны, обусловливает возрастные особенности структуры сенсибилизации, а именно: ведущими видами сенсибилизации являются у детей до трех лет — пищевая, в возрасте 4—6 лет — пищевая и бытовая, более чем у половины в сочетании, и после 7 лет дополнительно к двум предыдущим также пыльцевая и бактериальная с преобладанием полисочетанных вариантов. Во всех возрастных периодах может развиваться лекарственная аллергия. Следует подчеркнуть, что развитие основных видов сенсибилизации завершается к 6—7 годам, а в последующем происходит трансформация субклинической стадии в манифестную, что обусловливает формирование полиаллергии и полиэтиологичности заболеваний, увеличивающих тяжесть их течения. Выявленные закономерности формирования аллергии у детей обусловлены возрастными анатомо-физиологическими особенностями органов и систем, степенью их зрелости в период антигенной нагрузки, особенно избыточной. Атопический марш-это хронологическая последовательность формирования сенсибилизации и клинической трансформации симптомов аллергии в зависимости от возраста ребенка с атопической конституцией: атопического дерматита (АД), бронхиальной астмы (БА), аллергического ринита (АР) и др. Атопический марш является естественным ходом развития проявлений атопии. Он характеризуется типичной последовательностью развития клинических симптомов атопической болезни, когда одни симптомы становятся более выраженными, тогда как другие идут на убыль «Атопический марш» формируется еще в период внутриутробного развития, а клинически проявляется в период раннего детства и часто сопровождает больного в течение всей жизни. Клинические симптомы «аллергического марша» Манифестация заболевания начинается с симптомов пищевой аллергии, часто проявляющейся атопическим дерматитом. Он дебютирует преимущественно на 1-м году жизни и является первым проявлением атопических заболеваний. У детей раннего возраста одними из ведущих провокаторов аллергических заболеваний являются пищевые АГ: коровье молоко, яйца, злаки, рыба, соя. С возрастом спектр пищевых АГ изменяется и по качеству и по частоте выявления, возрастает значение клещевых и инфекционных АГ (Staphylococcus aureus и Сandida albicans). Большое значение в возникновении пищевой аллергии принадлежит нарушению морфофункционального состояния пищеварительного тракта. Становление биоценоза пищеварительного тракта в значительной мере зависит от грудного вскармливания. Заселение кишечника патогенными микроорганизмами находится в обратной зависимости от наличия секреторных иммуноглобулинов и других факторов защиты, поступающих с молоком матери. Взрослый тип микробиоценоза формируется к 18-му месяцу жизни. Более раннее становление «микробного пейзажа» кишечника по взрослому типу содействует развитию гастроинтестинальной аллергии. Первые проявления атопического дерматита – эритематозные элементы, везикулы, мокнутие – у большинства детей возникают на 3-4-м месяце жизни. На 2-м году жизни преобладают процессы инфильтрации и лихенификации с локализацией на разгибательных и сгибательных поверхностях конечностей, но к концу 2-го года жизни процесс охватывает преимущественно сгибательные поверхности, а на лице стихает. Во втором возрастном периоде – от 2 до 12-13 лет – АД приобретает хронический характер. В третьем возрастном периоде (подростки и взрослые) превалируют экскориации, папулы, очаги лихенификации и инфильтрации кожи. Типичной является локализация процесса на локтевых и коленных сгибах, на задней поверхности шеи, коже век, тыльной поверхности кистей и суставов. Пик развития БА приходится на 5-летний возраст, аллергический ринит – на подростковый. Первые проявления wheezing-синдрома у половины детей имеют место в возрасте до 2 лет. Пик интермиттирующего (сезонного) АР отмечается у подростков. Относительно персистирующего (хронического) АР следует сказать: сложности диагностики инфекционного и АР в раннем возрасте, а также стереотип врачебного мышления о преимущественно инфекционной этиологии ринита способствуют тому, что обострение назальной аллергической реакции часто воспринимается как очередная инфекция, поэтому диагноз АР устанавливается поздно.Трудности возникают также при диагностике обострений АР, триггером которых часто выступает вирусная инфекция. Поскольку этапность развития «аллергического марша» рассматривается, прежде всего, как последовательная трансформация клинических проявлений атопии в БА, следует помнить о тех детях, у которых БА начинается с бронхообструктивного синдрома в раннем возрасте (47% случаев). Бронхообструкция или псевдокруп (острый стенозирующий ларинготрахеит), независимо от причин их возникновения (80% – ОРВИ), в дальнейшем рецидивируют у 53% детей. С течением времени у 2/3 детей рецидивирование БОС прекращается, а у 23,3% больных формируется БА. Факторы риска рецидивов БОС: • семейный анамнез атопии; • повышение уровня сывороточного IgE; • ингаляционная сенсибилизация; • пассивное курение; • мужской пол. Выводы: 1)Атопические заболевания чаще возникают у детей, имеющих генетическую предрасположенность к аллергическим болезням, особенно по материнской линии. Их формированию способствует сенсибилизация пищевыми продуктами матерей в период беременности, ранний перевод детей на искусственное вскармливание и рано (на первом году жизни) проявляющаяся пищевая сенсибилизация у детей. 2)Клинические проявления атопических болезней у детей характеризуются последовательностью развития симптомов аллергии и сенсибилизации с дебютом АтД на первом году жизни. С возрастом ребенка расширяется спектр аллергенов и у детей старше 6 лет уже преобладает поливалентная сенсибилизация, формируется респираторный синдром, что по мере прогрессирования приводит кразвитию сочетанных форм атопических болезней (дерматит, астма, ринит). 3)Для детей, страдающих атопическими болезнями, причем независимо от вариантов их сочетания, характерны значительные нарушения со стороны показателей иммунитета: клеточного, гуморального и местного, которые в целом характеризуются повышением CD3+- (Р<0,05), иммунорегуляторного индекса (Р<0,01), содержания эозинофилов в периферической крови, снижением количества CD8+, CD20+-клеток (Р<0,01) и фагоцитарного числа (Р<0,01), а также повышением концентрации IgE в сыворотке крови и снижением концентрации IgA (Р<0,05) в крови и в слюне. 6 вопрос Ингалируемые аллергены.Классификация.Характеристика.Понятие «мажорных» и «минорных» аллергенов. Ингаляционные аллергены-аллергены,вдыхаемые в организм вместе с воздухом. Делятся на два класса: 1)Внешние (пыльца и плесневые грибы).Представляют высокий риск для развития АР сезонного 2)Внутренние (клещи домашней пыли,насекомые,грибы) .высокий риск развития круглогодичного ринита. 3)Профессиональные(сенсибилизаторы) Характеристика. Маленький размер позволяет частицам аллергенов переноситься с ветром,проникать глубоко в респираторный тракт,оседать на слизистых оболочках.Каждый аэроаллерген содержит несколько аллергенных белков,которые могут вызвать алл.им.ответ у сенсибилизированных пациентов,проявляющийся в виде респираторной(астмы),кожной(крапивница),и конъюктивальной аллергии. Внутренние аллергены      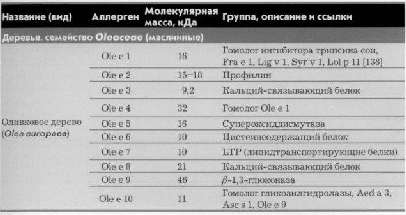 Аллергены латекса.   Мажорные(главные) аллергены(белки)-это видоспецифичные белки(т.е по ним можно определить к какой группе принадлежит данный белок).обычно устойчивы к нагреванию и более крупные по размеру,а также содержатся в данном аллергене в большом количестве. Минорные(второстепенные)белки-аллергены-часто меньше по размеру и по количеству.Они часто встречаются одновременно в нескольких аллергенах и именно из-за них развиваются перекрестные реакции(аллергии).Например белок клещей пыли-тропомиозин,входит в состав белков не только клещей,но и ракообразных,тараканов,аскарид. 7 вопрос Перекрестная реактивность. Под перекрёстной реакцией понимают тот факт, что человек болезненно реагирует не только на одно вещество, аллерген из одного источника. Причина заключается в том, что и в других источниках встречаются аналогичные по своему составу очень похожие аллергены. Они могут поразить одну и ту же систему органов, с которой контактировал аллерген или другую. Перекрёстные реакции между аэроаллергенами и пищевыми аллергенами возникают по трём основным механизмам: - полная идентичность между вдыхаемым и пищевым аллергеном; - аллергенная идентичность, виновный протеин присутствует, но скрыт в пище; - общие эпитопы в пище и вдыхаемых частицах разного происхождения.
Перекрёстные реакции ингаляционных аллергенов с пищевыми.
Перекрестные реакции между пыльцевыми аллергенами сорных трав. 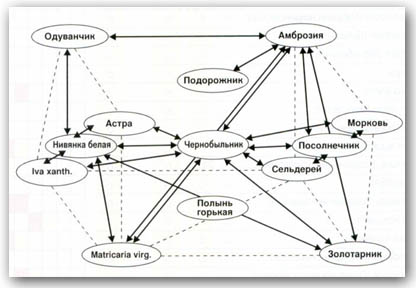 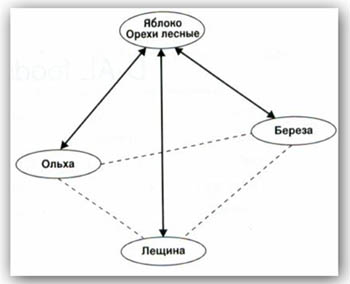 8Й ВОПРОС.Пищевые аллергены.  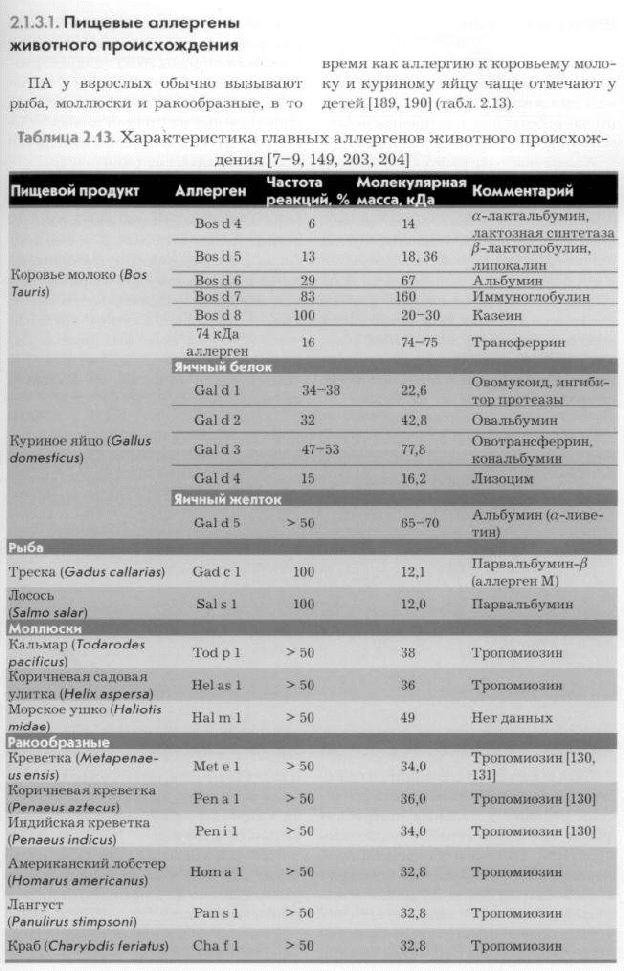     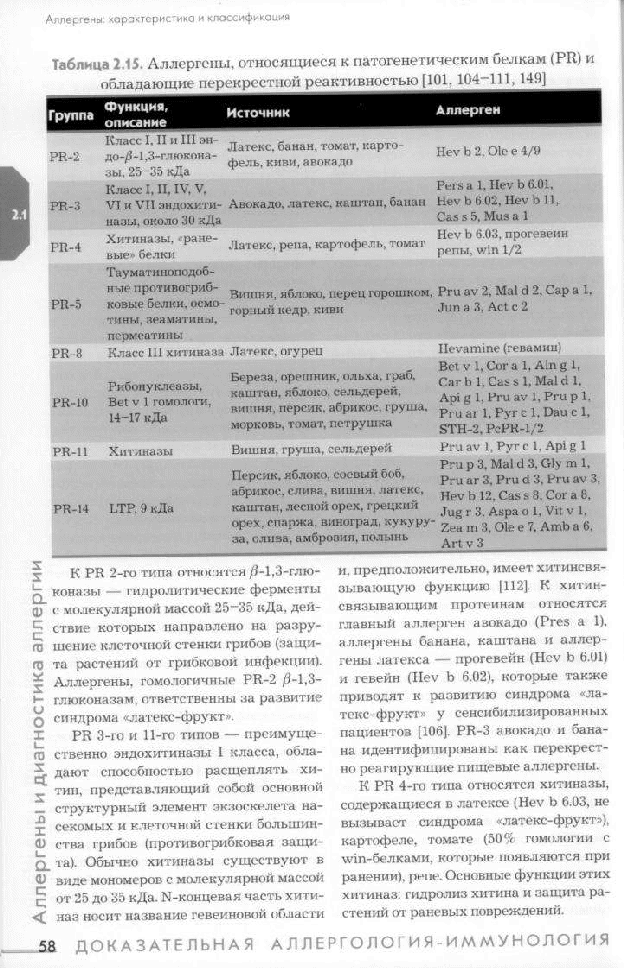 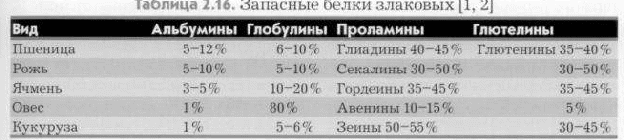 Классификация пищевых аллергенов
9. см. 7 вопрос =) 10 вопрос Принципы элиминации причинно-значимого аллергена Элиминация — удаление факторов, вызывающих болезнь. Обсуждая лечение аллергии, под элиминацией подразумевают удаление причинно-значимых аллергенов. Элиминация аллергенов относится к этиопатогенетическим методам лечения при пищевой, лекарственной и ингаляционной аллергии. Если речь идет об ингаляционных аллергенах, осуществлять контроль чистоты вдыхаемого воздуха и устранять причинно-значимые аллергены очень трудно. В период цветения ветроопыляемых растений искусственно свободный от пыльцы воздух может быть обеспечен лишь в закрытых помещениях специальной очисткой с помощью электростатических фильтров или кондиционирования. В случае повышенной чувствительности к пыльце березы рекомендуют переселяться в южные области, хотя бы на время цветения деревьев, к пыльце амброзии — рекомендуют переезд на север. Дабы уменьшить контакт с пыльцой растений, присутствующей в воздухе, рекомендуют не выезжать в загородную зону в течение всего периода цветения растений, к пыльце которых имеется повышенная чувствительность, закрывать окна на ночь, не выходить из дома в утренние часы, на которые приходится максимальная концентрация пыльцы в воздухе. Если тщательно проведенные элиминационные мероприятия не оказали эффекта, врач предлагает пациенту, страдающему поллинозом, аллерген-специфическое лечение и медикаментозную терапию. | ||||||||||||||||||||||||||||||||||||||||||||||||
