Аналитическая химия. Аналит. 3. Oсадительное титрование.. Суть и классификация методов
 Скачать 1.45 Mb. Скачать 1.45 Mb.
|
Индикаторы метода окислительно-восстановительного титрованияВ окислительно-восстановительном титровании вблизи точки эквивалентности происходит резкое изменение потенциала системы. Конечную точку титрования можно определить либо потенциометрически (по резкому излому кривой титрования, построенной в координатах V - E), либо визуально. Окислительно-восстановительное титрование можно проводить для систем, у которых разность потенциалов между определяемым веществом и титрантом больше 0,20 В, причем, если разность между реальными потенциалами лежит в пределах 0,20-0,40 В, можно использовать лишь потенциометрический способ фиксирования точки эквивалентности; если же разность потенциалов больше 0,40 В, довольно надежные результаты можно получить и при визуальной индикации конечной точки титрования. Если титрант является интенсивно окрашенным веществом, то от использования индикатора можно отказаться. Например, при титровании восстановителей раствором перманганата калия в кислой среде малиновая окраска перманганата будет обесцвечиваться до тех пор, пока в системе будет находиться даже небольшое количество определяемого вещества. Как только реакция будет закончена и в реакционной системе появится избыток титранта, раствор окрасится в розовый цвет. Если же раствор бесцветный или окраска его мало интенсивна, то для визуальной индикации конечной точки титрования необходимо использовать индикаторы. По механизму действия все индикаторы в методе окисления - восстановления можно разделить на четыре основные группы. 1. Специфические индикаторы - вещества, вступающие в специфическую реакцию с окисленной или восстановленной формой окислительно-восстановительной пары, участвующей в титровании. Например, раствор крахмала окрашивается в синий цвет при появлении в системе йода, роданид-ионы реагируют на появление в реакционной системе ионов Fe3+. 2. Редокс-индикаторы - окислительно-восстановительные пары, имеющие разную окраску в окисленной и восстановленной форме. Окраска этой группы индикаторов изменяется при достижении определенного значения потенциала системы. В растворах таких индикаторов существует равновесие: InOx + ze <=> InRed. Уравнение Нернста для этой полуреакции имеет вид: 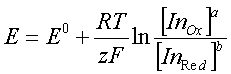 Так как окисленная и восстановленная формы имеют разную окраску, то цвет индикатора в растворе будет зависеть от соотношения: 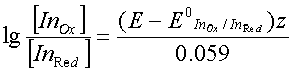 Как и в случае кислотно-основных индикаторов, при сравнении интенсивности окраски обеих форм можно различить окраску окисленной формы, если 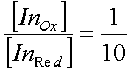 и наоборот, окраска восстановленной формы становится различимой, если 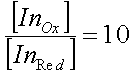 Интервал перехода окраски находится между двумя окислительно-восстановительными потенциалами и определяется величиной Изменение окраски у некоторых редокс-индикаторов зависит от рН раствора, поэтому, выбирая индикатор, необходимо учитывать среду, в которой проводится титрование и для которой известны реальные потенциалы. 3. Комплексные соединения некоторых металлов, способных к реакциям окисления - восстановления. Наиболее часто для аналитических целей используют комплексные соединения железа с некоторыми органическими веществами, содержащими группировку атомов. 4. Органические красители, которые окисляются необратимо. Переход окраски у данных индикаторов связан с глубоким изменением строения их молекул. Наиболее часто для данной цели используют метиловый оранжевый, индигокармин. Окислительно-восстановительный индикатор, как и в методе нейтрализации, выбирают на основании кривой титрования. Для титрования следует брать такой индикатор, изменение окраски которого будет включать в себя значение потенциала в точке эквивалентности. При титровании необходимо учитывать, что процесс перехода электронов между окисленной и восстановленной формами происходит довольно медленно, поэтому скорость титрования, особенно вблизи точки эквивалентности, должна быть невысокой. |
