Аналитическая химия. Аналит. 3. Oсадительное титрование.. Суть и классификация методов
 Скачать 1.45 Mb. Скачать 1.45 Mb.
|
Факторы, влияющие на устойчивость комплекса:Внешние факторы: температура, природа растворителя, ионная сила и состав раствора. Фундаментальные факторы: Природа комплексообразователя, например, устойчивость комплекса [Cu(NH3)2]+ выше, чем устойчивость комплекса [Ag(NH3)2]+, т.е. β2([Cu(NH3)2]+) = 7,2 ·1010 > β2([Ag(NH3)2]+ ) = 1,7· 107. По результатам многих исследований составлен ряд комплексообразователей, в котором устойчивостькомплексных соединений, содержащих эти металлы, растет: Mn(II) – Fe(II) – Co(II) – Ni(II) – Cu(II). Природа лиганда и координационное число здесь никакого влияния не оказывают. Данный ряд называют “естественный порядок устойчивости”. Природа лигандов, например, устойчивость комплекса [Ag(CN)2]+ выше, чем устойчивость комплекса [Ag(NH3)2]+, т.е. > β2([Ag(NH3)2]+) = 7,1·1019 > β2([Ag(NH3)2]+ ) = 1,7·107. Cтерические факторы: хелатный эффект – за счет образования хелатных циклов, полидентантные лиганды образуют более устойчивые комплексы, нежели их монодентантные аналоги. Стерический эффект — пространственное окружение донорных атомов лиганда, также влияет на устойчивость комплекса. Структура лиганда Равновесие в растворах кординационных соединений. Для растворов комплексных соединений характерно четыре вида равновесий: а) диссоциация на комплексный и внешнесферный ноны, б) диссоциация комплексного нона (или замещение лигандов молекулами растворителя), в) диссоциация лигандов г) окислительно- восстановительное равновесие (в случае, когда атом комплексообразователь проявляет переменную -валентность). Ниже приводятся схемы этих видов равновесий: 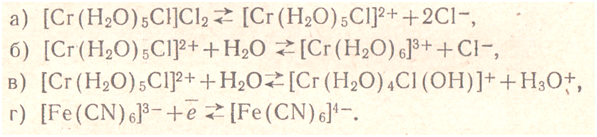 Комплексоны и их особенностиКомплексонометрическое титрование основано на реакциях образования комплексов. Среди реакций с участием неорганических лигандов в титриметрии применяют реакции образования галогенидов Hg(II), фторидов, Al, циркония, тория и цианидов некоторых металлов (Ni, Co, Zn). На образовании этих комплексов основаны методы меркуриметрии, фторидометрии и цианидометрии. Известно много монодентантных неорганических и органических лигандов, однако их применению в комплексонометрии препятствует то, что ступенчатые константы устойчивости соответствующих комплексов мало различаются между собой. Поэтому при увеличении количества добавленного лиганда концентрация ионов Ме изменяется постепенно, и кривая титрования не имеет скачка. Многие же полидентантные лиганды реагируют с ионами Ме в простом стехиометрическом соотношении (чаще всего 1:1). Титрование с использованием полидентантных органических реагентов называется комплексонометрией. Широкое применение получили аналитические органические реагенты, предложенные в 1944 г. Г. Шварценбахом. Шварценбах отнес к ним группу аминополиуксусных кислот, содержащих иминодиацетатные фрагменты – N(CH2COOH)2, связанные с определенными алифатическими и ароматическими радикалами. Сейчас известно большое число сходных соединений, в которых вместо алкилкарбоксильных групп введены другие кислотные группы – алкилфосфоновые, алкиларсоновые, алкилсульфоновые и др. Все они объединяются под общим названием – комплексоны. Применяют следующие комплексоны: 1) комплексон I – нитрилотриуксусная кислота (H3Y), где Y‾3 – анион 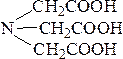 2) комплексон II – этилендиаминтетрауксусная кислота (ЭДТУК) (H4Y) 3) комплексон III – динатриевая соль ЭДТУК – ЭДТА (Трилон Б) (Na2H2Y) 4) комплексон IV – диаминциклогексантетрауксусная кислота (H4Y) С катионами Ме ЭДТА образует комплексные соединения в соотношении 1:1: Ме2+ + [Y]4‾ ↔ [MeY]2‾ В комплексах ЭДТА часть связей носит ионный характер, часть донорно-акцепторный. Комплексы многих Ме с ЭДТА образуются легко, обладают достаточной устойчивостью и в большинстве растворимы в воде. Все это позволяет использовать ЭДТА для титриметрического определения солей Ме. ЭДТУК (H4Y) – белое кристаллическое вещество мало растворимое в воде, так при 20оС растворимость ее всего лишь 28,3 мг в 100 мл. Растворимость H4Y минимальна при рН 1,6-1,8. При повышении и понижении концентрации ионов водорода растворимость растет. Высокая растворимость H4Y в минеральных кислотах объясняется образованием протонированных форм H5Y+ и H6Y2+. ЭДТУК – четырехпротонная кислота, которая ионизирует по 4-м ступеням, причем по первым двум в значительной степени (рК1 = 2,07; рК2 = 2,75) по третьей и четвертой – гораздо меньше (рК3 = 6,24; рК4 = 10,34). Поэтому и ЭДТА в кислой среде (рН = 4,5) частично протонируется и находится в виде [H2Y]2‾, в слабо щелочной (рН = 8-9) под действием ОН‾ частично депротонируется и переходит в [HY]3‾, в сильно щелочной (рН > 12) полностью депротонируется и находится в виде Y4‾. Реакция комплексообразования проходит между полностью ионизированной формой Y4‾ и ионами Ме и характеризуется общей константой образования (или устойчивости): Y4‾ + Ме2+ → [MeY]2‾; Чтобы реакция комплексообразования прошла с достаточной полнотой (на 99,99%) и могла быть использована в количественном анализе, константа образования должна быть > 108. Устойчивость комплексов Ме с ЭДТА зависит от заряда иона Ме, электронной конфигурации и меняется в зависимости от рН среды. Наиболее устойчивые комплексы ЭДТА с многозарядными ионами р- и d-элементов могут образовываться в кислой среде. К ним относятся комплексы с Bi3+, Fe3+,Cr3+ и т.д. Менее устойчивые комплексы с ЭДТА образуют ионы s-элементов: Ba2+, Mg2+, Ca2+ и т.д. Их определение комплексонометрическим титрованием проводят в щелочной среде. |
