Аналитическая химия. Аналит. 3. Oсадительное титрование.. Суть и классификация методов
 Скачать 1.45 Mb. Скачать 1.45 Mb.
|
Стандартные растворыВ титриметрическом методе анализа используют растворы с точно известной концентрацией. Такие растворы называют стандартными. Различают первичные и вторичные стандарты. Первичные стандарты получают растворением точной навески реагента в мерной колбе и разбавлением полученного раствора до метки. Зная массу растворенного вещества и объем раствора, вычисляют его концентрацию. Для приготовления первичных стандартов можно использовать соли, оксиды, имеющие постоянную массу, а также фиксоналы - запаянные трубки, содержание веществ в которых точно известно. Некоторые вещества, например, щелочи, нельзя приготовить по точной навеске, так как они могут содержать неопределенное количество воды. Поэтому при приготовлении вторичных стандартов навеску вещества берут на технических весах, растворяют ее и разбавляют до определенного объема. Точную концентрацию вторичных стандартов устанавливают путем титрования с помощью подходящего первичного стандарта. Требования к реакциям, используемым в титриметрических методахРеакции, применяемые в титриметрических методах анализа, должны удовлетворять следующим требованиям: Реакция должна быть стехиометрической. Это означает, что в процессе реакции между взаимодействующими веществами должно сохраняться строго определенное соотношение. Концентрация стандартного раствора должна быть точно известна. При титровании не должны протекать побочные реакции, делающие точное вычисление результатов анализа невозможным. Реакция должна протекать количественно. Для получения правильных результатов анализа полнота реакции в момент добавления эквивалентного количества титранта должна составлять не менее 99,9 %. Реакция должна протекать с достаточной скоростью, чтобы титрование можно было провести быстро. Автопротолиз растворителя. Константа автопротолиза Автопротолизом называют процесс кислотно-основного взаимодействия между двумя молекулами вещества, при котором одна молекула ведёт себя как кислота, а вторая - как основание. 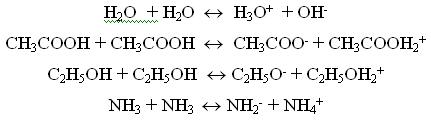 Автопротолизу в той или иной степени подвергается большинство растворителей. Однако у одних веществ он идёт более интенсивно, у других - менее интенсивно. Рассмотрим реакцию кислотно-основного взаимодействия между двумя молекулами растворителя 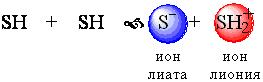 Для чистого растворителя , поэтому aSH=1 Показатель константы автопротолиза является мерой протяжённости шкалы кислотности (от aSH2+=1 до aS-=1) для данного растворителя. Величина, равная половине pKSH, соответствует нейтральной среде для данного растворителя. В нейтральной среде  Константа автопротолиза растворителя связывает между собой константы кислотности и основности частиц, образующих сопряжённую кислотно-основную пару. Например, для водных растворов: Константа автопротолиза растворителя связывает между собой константы кислотности и основности частиц, образующих сопряжённую кислотно-основную пару. Например, для водных растворов: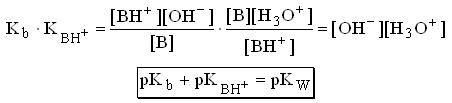 Расчет рН слабых одноосновных кислот и однокислотных основанийСлабые кислоты и основания в водных растворах диссоциируют лишь частично, поэтому расчеты равновесных концентраций проводят, опираясь на закон действия масс. Расчет равновесных концентраций, рН, степени диссоциации для раствора слабой кислоты можно проводить, опираясь на формулы: 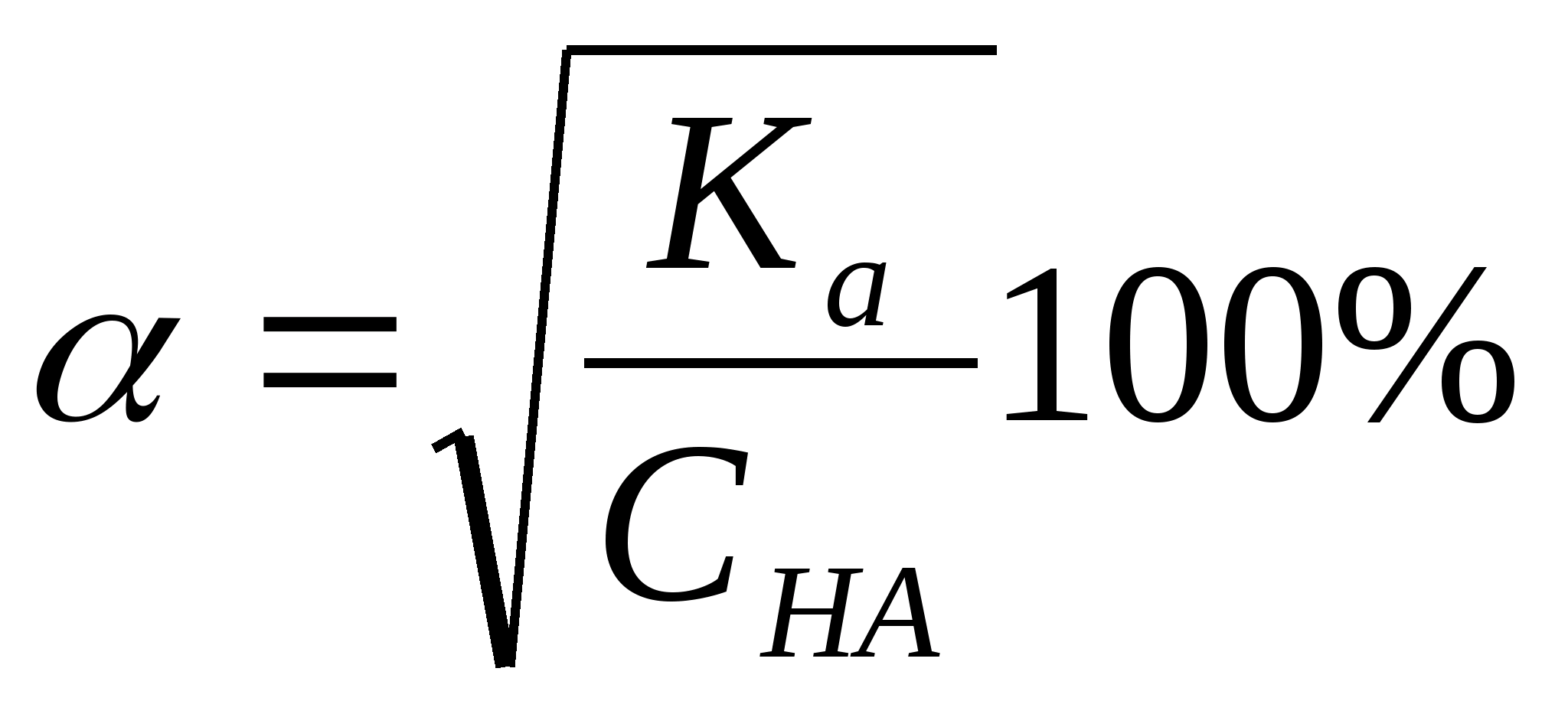 , ,а для растворов слабых однокислотных оснований: 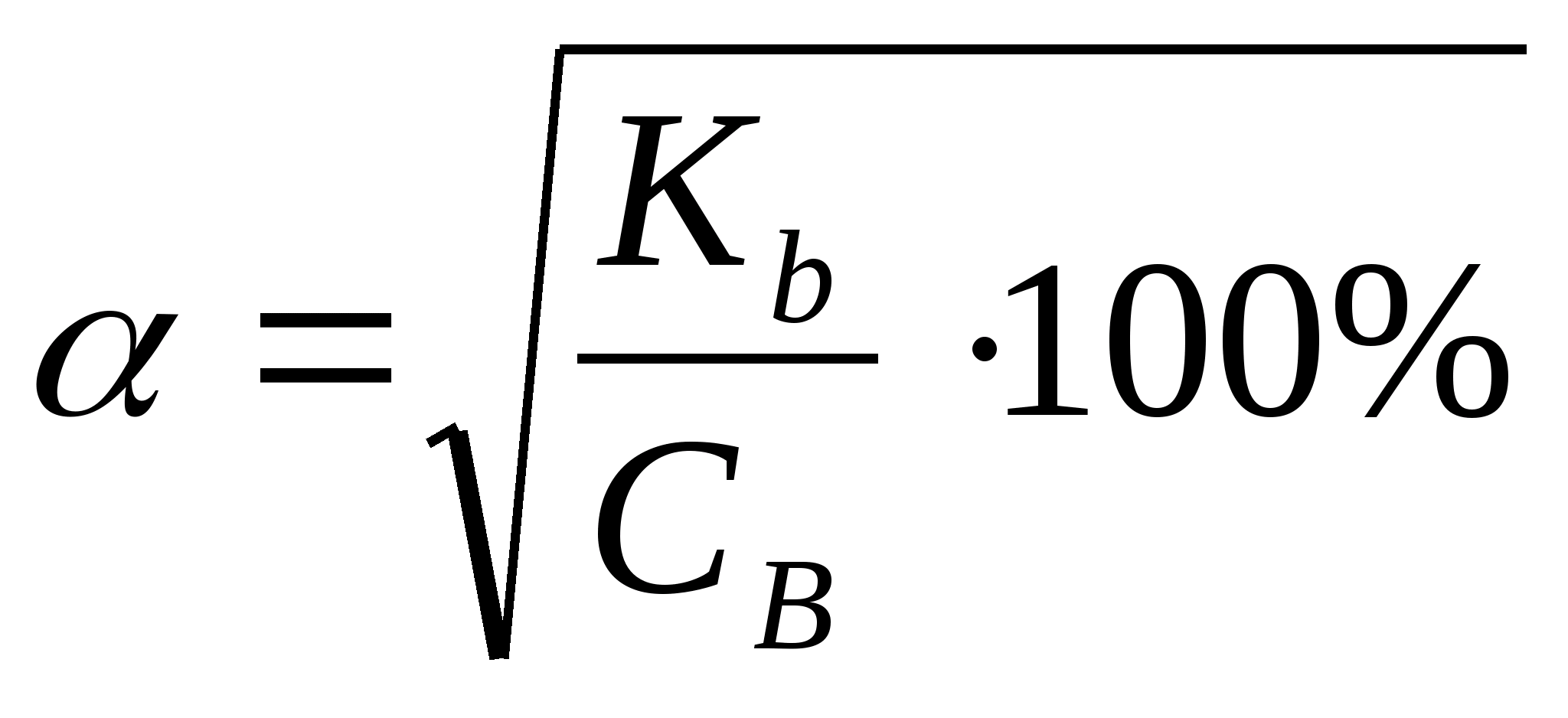 , ,однако при решении задач лучше каждый раз выводить данные выражения, опираясь на закон действия масс. Особенно это важно при расчете ионных равновесий в многокомпонентных системах. В растворах слабых электролитов концентрация ионов мала, межионные взаимодействия проявляются в незначительной степени, коэффициенты активности ионов стремятся к единице, поэтому расчеты можно проводить без учета влияния ионной силы раствора |
