Аналитическая химия. Аналит. 3. Oсадительное титрование.. Суть и классификация методов
 Скачать 1.45 Mb. Скачать 1.45 Mb.
|
Расчет рН буферных растворовБуферный раствор используют для поддержания постоянного значения рН. Он состоит из смеси слабой кислоты НА и сопряженного основания А-. В буферном растворе сосуществуют равновесия: НА + Н2О ↔ Н3О+ + А- А- + Н2О ↔ НА + ОН- подавляющие друг друга при достаточно высоких С(НА) и С(А-); поэтому можно считать, что [НА] = С(НА) и [А-] = С(А-). Используя выражение для КаНАи пренебрегая вкладом [Н3О+] за счет диссоциации воды, получаем То же выражение можно получить, используя константу второго равновесия Растворы амфолитов Рассмотрим поведение амфолита HA- (например, HCO3-) в водном растворе. 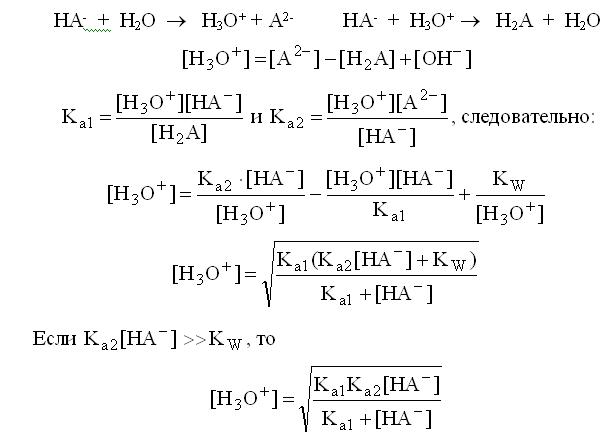 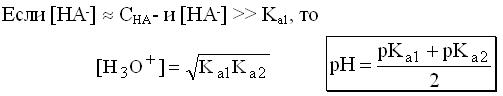 Такие же формулы используются и для амфолитов типа BH+A- Пример 4.4. Рассчитать рН 0,10 М NaHCO3 и 0,10 М HCOONH4 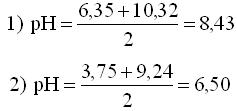 Кислотно-основные буферные растворы Буферными растворами, в широком смысле слова, называют системы, поддерживающие определённое значение какого-либо параметра (рН, потенциала системы, концентрации катионов металла), при изменении состава системы. Кислотно-основным называется буферный раствор, сохраняющий примерно постоянным значение рН при добавлении к нему не слишком больших количеств сильной кислоты или сильного основания, а также при разбавлении или концентрировании. Кислотно-основные буферные растворы содержат (в не слишком малых количествах) слабые кислоты и сопряжённые с ними основания. 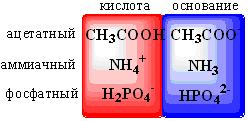 Причина буферного действия таких растворов заключается в следующем. 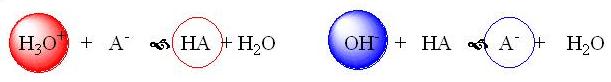 Сильная кислота при добавлении к буферному раствору «превращается» в слабую кислоту, а сильное основание - в слабое основание. Следовательно, заметного изменения рН раствора при этом не происходит. Формулу для расчёта рН буферного раствора можно получить следующим образом. 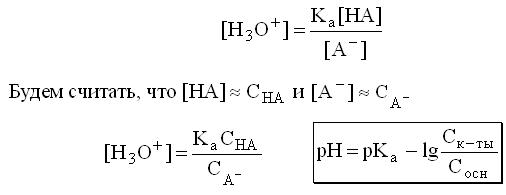 Будем считать, что и Полученное уравнение называется уравнением Гендерсона - Хассельбаха. Из этого уравнения следует что, что рН буферного раствора зависит от отношения концентраций слабой кислоты и сопряжённого с ней основания и поэтому незначительно изменяется при разбавлении (или концентрировании). Разбавление, само собой, не может быть безграничным. При значительном разбавлении рН раствора изменится, так как, во-первых, концентрации компонентов станут такими малыми, что нельзя будет пренебречь автопротолизом воды, во-вторых, коэффициенты активности незаряженных и заряженных частиц по-разному зависят от ионной силы. Пример 4.6. Рассчитать рН растворов, полученных 1) при смешивании 100 мл 0,10 М HCOOH и 200 мл 0,10 М HCOONа; 2) 200 мл 0,10 М NH3 и 100 мл 0,10 М HCl. Вместо концентрации в уравнение Гендерсона-Хассельбаха могут быть подставлены количества кислоты и основания или объёмы их растворов (если концентрация растворённых веществ в последних одинакова) 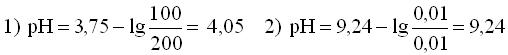 Способность буферного раствора сопротивляться изменению рН зависит от соотношения концентраций слабой кислоты и сопряжённого с ней основания, а также от их суммарной концентрации в растворе и характеризуется буферной ёмкостью. Способность буферного раствора сопротивляться изменению рН зависит от соотношения концентраций слабой кислоты и сопряжённого с ней основания, а также от их суммарной концентрации в растворе и характеризуется буферной ёмкостью.Буферной ёмкостью (β или π) называют отношение бесконечно малого увеличения концентрации сильной кислоты или сильного основания в растворе (без изменения его объёма) к вызванному этим увеличением изменению рН. 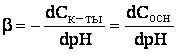 Буферную ёмкость раствора можно рассчитать по следующим уравнениям: Буферную ёмкость раствора можно рассчитать по следующим уравнениям: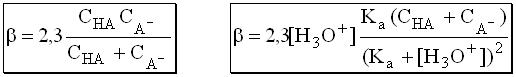 На рис. 4.4. приведён пример зависимости β от рН. В сильнокислой и сильнощелочной среде буферная ёмкость значительно увеличивается. Растворы, в которых достаточно высока концентрация сильной кислоты или сильного основания, также обладают буферными свойствами, причём даже в большей степени, чем растворы, традиционно рассматриваемые в качестве «буферных». Для растворов сильных кислот β = 2,3[H3O+], для растворов сильных оснований β= 2,3[OH-]. 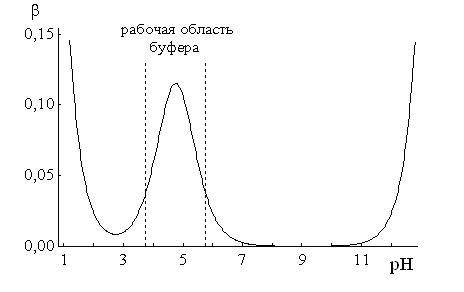 Рис. 4.4. Зависимость буферной ёмкости 0,2 М ацетатного буферного раствора от рН Рис. 4.4. Зависимость буферной ёмкости 0,2 М ацетатного буферного раствора от рНБуферная ёмкость максимальна при рН = рКa и составляет 2,3•0,5•0,5 Cбуф = 0,575Cбуф. Для поддержания некоторого значения рН следует использовать такой буферный раствор, у которого величина рКa входящей в его состав слабой кислоты находится как можно ближе к этому рН. Буферный раствор имеет смысл использовать для поддержания рН, находящегося в интервале рКa ± 1. Такой интервал называется рабочей областью буфера. Например, рабочая область рН для ацетатного буферного раствора составляет примерно 3,8 - 4,8. Совершенно бессмысленно использовать такой буферный раствор для рН, например, 9. Пример 4.7. Рассчитать буферную ёмкость формиатного буферного раствора, упомянутого в примере 4.6. Каким станет рН этого раствора, если к 1 л его добавить 5,0·10-3 моль сильной кислоты? моль/л моль/л моль/л , рН раствора станет равным 3,95 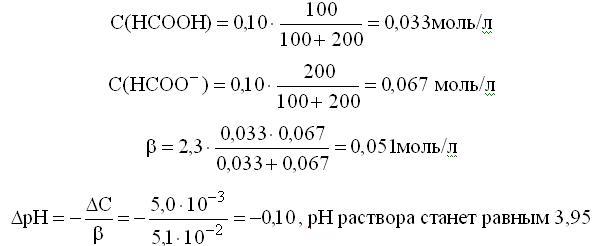 |
