Аналитическая химия. Аналит. 3. Oсадительное титрование.. Суть и классификация методов
 Скачать 1.45 Mb. Скачать 1.45 Mb.
|
ПРОТОЛИТИЧЕСКАЯ ТЕОРИЯ БРЕНСТЕДА — ЛОУРИСогласно теории электролитической диссоциации Аррениуса, кислотаминазываются вещества, при диссоциации которыхобразуется ион гидроксония ианион кислотного остатка, а основаниями называются соединения. при диссоциации которых образуются гидроксид-ионы и катионы металла. Теория Аррениуса объясняет поведение и свойства электролитов в водных растворах, а также дает возможность сравнивать силу электролитов по степени электролитической диссоциации. Однако с помощью теории Аррениуса нельзя объяснить изменение свойств многих веществ в неводных растворителях. В зависимости от растворителя одно и то же вещество может быть сильным и слабым электролитом, кислотой или основанием или вообще не проявлять кислотно-основных свойств. В настоящее время существует несколько обобщенных теорий кислот и оснований. Наиболее широкое применение имеютпротонная теория кислот и оснований,предложенная в 1923 г. датским ученым Бренстедом и английским ученым Лоури, и электронная теория Льюиса. Согласно теории Бренстеда—Лоури, кислотами называют вещества, отдающие протоны, а основаниями — вещества, принимающие протоны. Протон не может существовать в растворе самостоятельно, он должен быть принят основанием, поэтому, чтобы кислота могла отдать протон, необходимо присутствие основания, к которому протон переходит. Таким образом, возникают кислотно – основные пары, которые называют сопряженными. Следовательно, каждая кислота имеет сопряженное с ней основание и каждое основание – сопряженную с ним кислоту. Реакция отдачи Протона выражается схемой: Кислота1 ↔ основание1 + Н+. Реакция принятия протона выражается схемой: Основание2 + Н + ↔ Кислота2. Суммарно: Кислота1 + основание2 ↔ Кислота2 + основание1 Например, в уравнениях: HCl + NH3 ↔ Cl- + NH4+ кислота1 основание2 основание1 кислота2 HCl ↔ Cl- + H+ кислота1 основание1 NH3 + H+ ↔ NH4+ основание2 кислота2 В приведенном равновесии участвуют 2 пары кислот и оснований: сопряженными кислотой и основанием являются НС1 и С1-, NH4- и NНз. К кислотам и основаниям по теории Бренстеда – Лоури относятся не только молекулы, но и ионы. Например, ионы аммония и гидросульфат ион являются кислотами, так как они способны отщеплять протоны: NH4+ ↔ NH3 + H+ HSO4- ↔ SO42- + H+. Ацетат-ион является основанием так как он принимает протон. СНзСОО-+ Н+ ↔ СНзСООН. Одно и то же вещество при растворении в разных растворителях может проявлять амфотерные свойства, т. е. Быть кислотой и основанием. Например, в жидком аммиаке гидросульфид-ион HS- проявляет свойства кислоты: HS- + NH3 ↔ NH4+ + S2- кислота основание кислота основание находясь же в бромоводороде НS-, будет основанием НS- + НВг ↔ Н2S + Вг-. Основание Кислота Кислота Основание Во всех этих реакциях протон играет особую роль при взаимодействии кислот и оснований, поэтому, согласно теории Бренстеда—Лоури, кислоты и основания носят общее название протолиты, а реакции между ними называют протолитическими. К протолитическим реакциям относят реакции нейтрализации, гидролиза, диссоциации кислот и оснований. Гравиметрический метод анализа11.1. Общая характеристика Гравиметрией (от лат. gravis – тяжёлый и греч. metreo – измеряю) называется совокупность методов количественного анализа, основанных на измерении массы определяемого вещества или его составных частей, выделенных в чистом виде или в виде соединений точно известного состава. Устаревшее название гравиметрии – «весовой метод анализа». Такое название не совсем верно, поскольку аналитическим сигналом в гравиметрии является масса, а не вес. Гравиметрия является одним из немногих представителей безэталонных методов анализа. Её используют в качестве метода сравнения при проверке правильности определений, выполненных другими методами; в качестве арбитражного метода анализа; для проверки стандартных образцов и т.п. Неопределённость результатов гравиметрических определений зависит, главным образом, от неопределённости измерения массы и составляет, в среднем, 0,1%. 11.2. Виды гравиметрических определений В методе осаждения навеску определяемого вещества растворяют в воде, к полученному раствору добавляют необходимое количество реагента, реакция которого с определяемым веществом сопровождается выпадением осадка. Образовавшийся осадок отделяют от раствора, отмывают от посторонних веществ, высушивают, если необходимо прокаливают и затем измеряют его массу. Соединение, в виде которого определяемый компонент осаждают из раствора, называется осаждаемой формой. Соединение, масса которого является аналитическим сигналом, называют гравиметрической формой. 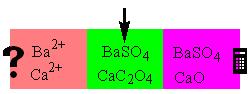 Вещества, претендующие на роль осаждаемой и гравиметрической формы, должны обладать определёнными свойствами.  В методе отгонки часть анализируемого объекта является летучей, либо летучее соединение получается из определяемого вещества в процессе химической реакции. 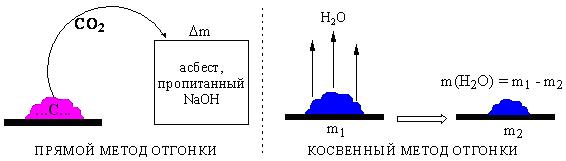 Реже встречается вариант гравиметрического определения, называемый методом выделения, в котором определяемое вещество отделяют от других компонентов смеси фильтрованием, центрифугированием, экстракцией. К такого рода гравиметрическим определениям можно отнести также процесс определения зольности органических материалов. Органическое вещество разрушают с образованием летучих продуктов, и затем измеряют массу оставшейся золы Наряду с перечисленными известны такие гравиметрические методы как термогравиметрия и электрогравиметрия, которые обычно относят к инструментальным методам анализа. При термогравиметрических определениях с помощью специальных термовесов измеряют изменение массы вещества при его нагревании. В электрогравиметрии в результате протекания процесса электролиза определяемое вещество осаждается на электроде (например, Ag+ в виде Ag на катоде или свинец в виде PbO2 на аноде). Аналитическим сигналом является увеличение массы электрода. 11.3. Понятие о механизме образования осадка Необходимым условием для образования осадка является превышение произведением концентраций ионов, входяших в его состав, произведения растворимости. Образование осадка является сложным процессом, протекающим во времени и включающим в себя несколько стадий. Момент смешивания реактивов и визуально заметное появление осадка разделяет некоторый промежуток времени, называемый индукционным периодом. Его величина зависит от химической природы образующегося осадка, концентрации реагентов, методики проведения эксперимента, чистоты реактивов и т.д. Образованию осадка предшествует образование пересыщенного раствора. Максимальная концентрация вещества в пересыщенном растворе, при которой последний ещё остаётся устойчивым, называется сверхрастворимостью. Возможная зависимость растворимости и сверхрастворимости от температуры приведена на рис. 11.1. 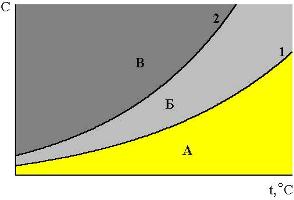 Рис. 11.1. Возможная зависимость растворимости (1) и сверхрастворимости (2) от температуры А – ненасыщенный раствор, Б – устойчивый (метастабильный) пересыщенный раствор, В – неустойчивый пересыщенный раствор Разность между сверхрастворимостью и растворимостью зависит от природы вещества. Например, у BaSO4 сверхрастворимость превышает растворимость примерно в тысячу раз, т.е. о данном веществе можно сказать то, что оно склонно образовывать пересыщенные растворы, у AgCl сверхрастворимость больше растворимости всего лишь в 5 раз. Процесс образования осадка начинается с образования первичных центров кристаллизации (первичных зародышей). 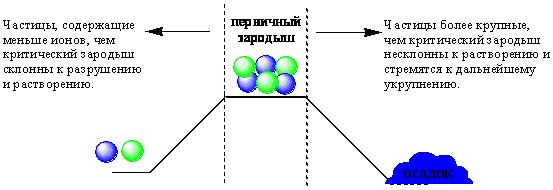 Размер критического зародыша зависит от природы образующих его ионов и составляет по одним данным 2-9 ионов, по другим – до 100 ионов. Размер критического зародыша зависит от природы образующих его ионов и составляет по одним данным 2-9 ионов, по другим – до 100 ионов.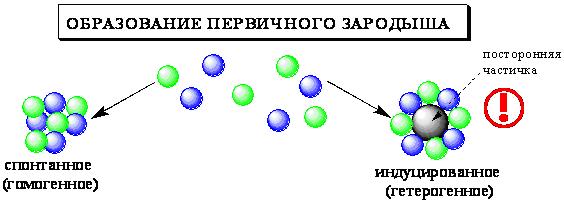 Образующиеся осадки могут быть: Образующиеся осадки могут быть: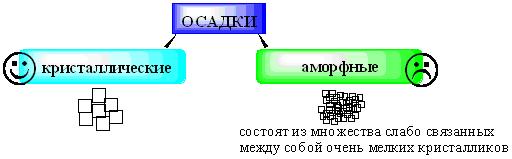 Характер образующегося осадка зависит от соотношения скоростей двух процессов: образования зародышей и роста первичных центров кристаллизации, которые зависят от относительного пересыщения раствора, возникающего при добавлении осадителя. где Q - концентрация осаждаемого компонента в какой-то момент времени в пересыщенном растворе; S - концентрация осаждаемого компонента в насыщенном растворе («растворимость»). 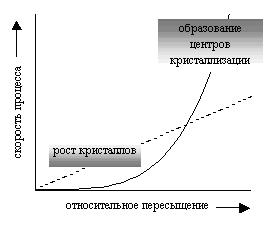 Рис. 11.2. Зависимость скоростей процессов образования первичных центров кристаллизации и роста кристаллов от величины ОП Скорости процессов образования первичных зародышей и роста кристаллов связаны с ОП уравнением: Примерная зависимость скорости процесса образования первичных зародышей и роста образовавшихся кристаллов от относительного пересыщения приведена на рис. 11.2. При малых значениях относительного пересыщения преобладает рост кристаллов, вследствие чего образуется немного крупных кристаллов, при больших - образование новых первичных центров кристаллизации, поэтому образуется множество мелких кристалликов. Для образования крупнокристаллического осадка необходимо, чтобы величина относительного пересыщения при добавлении осадителя была незначительной. 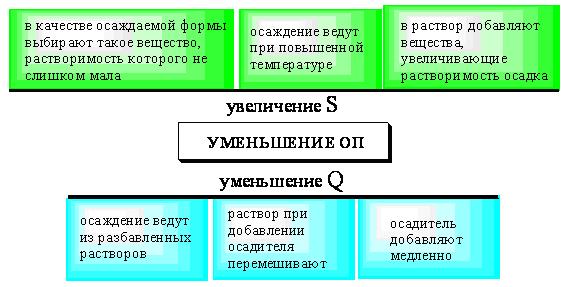 Очень медленного поступления осадителя можно добиться с помощью приёма, называемого методом возникающих реагентов или осаждением из гомогенного раствора. К раствору добавляют вещество, образующее осадитель в процессе медленно протекающей реакции. 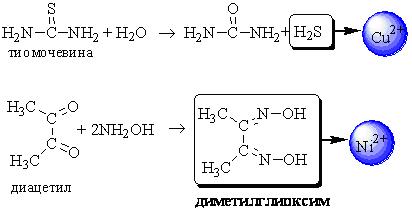 Метод «возникающих реагентов» позволяет получать кристаллические осадки таких веществ, которые при обычном осаждении образуют лишь аморфные осадки. После охлаждения кристаллические осадки оставляют на 2 - 24 часа для «старения». При этом происходит растворение мелких кристаллов, укрупнение и самоочищение кристаллов. Созревший осадок является более чистым и легко отделяется от маточного раствора при фильтровании. 11.4. Коллоидная стадия образования осадка По мере адсорбции на первичных зародышах всё большего и большего количества ионов размер частиц осадка увеличивается. Коллоидной степени дисперсности соответствует размер частиц дисперсной фазы в среднем 1-100 нм. Образование коллоидных частиц неблагоприятно отражается на результатах гравиметрического анализа, поскольку такие частицы вследствие достаточно малого размера не задерживаются обычными фильтрами. Это ведёт к потере осаждаемого вещества. Коллоидные системы являются устойчивыми. Частицы дисперсной фазы в них могут сколь угодно долго находиться во взвешенном состоянии. Главной причиной устойчивости является наличие у коллоидных частиц электрического заряда, который не позволяет им объединяться друг с другом, превращаясь в более крупные образования, оседающие под действием силы тяжести. Возможное строение коллоидной частицы показано на рис. 11.3. Потенциалопределяющие ионы и соответствующие им противоионы, остающиеся в растворе, образуют двойной электрический слой (ДЭС) – тонкий электрический слой, образующийся из пространственно разделённых зарядов противоположного знака на границе раздела агрегата и раствора. Благодаря наличию двойного электрического слоя коллоидные системы не слипаются друг с другом. 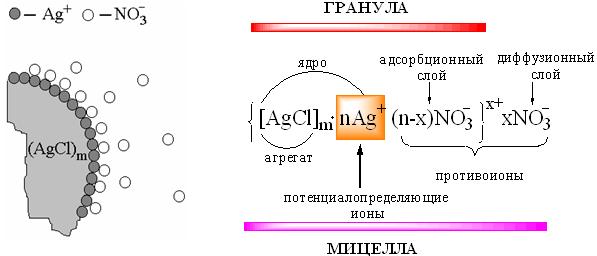 Рис. 11.3. Строение коллоидной частицы хлорида серебра, образованной при добавлении к раствору NaCl избытка AgNO3 (показаны потенциалопределяющие ионы и соответствующие им противоионы) Процесс объединения частиц дисперсной фазы в более крупные частицы называется коагуляцией. Коагуляцию можно вызвать нагреванием или добавлением к коллоидной системе сильного электролита. Процесс обратный коагуляции называется пептизацией. В результате протекания данного процесса скоагулированный осадок возвращается в исходное коллоидно-дисперсное состояние. Пептизация может происходить при промывании осадка водой. По этой причине осадок вещества, склонного к образованию коллоидных растворов, следует отмывать от адсорбированных на нём примесей не чистой водой, а раствором сильного электролита. 11.5. Причины загрязнения осадка и способы их устранения Осадок, образующийся в процессе гравиметрического определения, всегда содержит то или иное количество посторонних примесей. Примеси могут попадать в осадок по различным причинам. Вид примесей, загрязняющих осадок, и их количество зависят от условий выполнения анализа и характера образующегося осадка. Загрязнение осадка может быть вызвано соосаждением примесей либо, реже, совместным или последующим их осаждением. При соосаждении образование осадка приводит к выпадению в осадок соединений, которые в данных условиях либо хорошо растворимы, либо находятся в таких малых концентрациях, что не достигается величина их произведения растворимости. Различают следующие виды соосаждения: 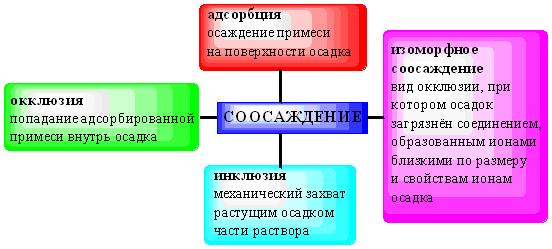 Адсорбция примесей на осадке приводит к увеличению его массы по сравнению с ожидаемой и, следовательно, к завышению результатов анализа. Процесс адсорбции ионов на осадках подчиняется правилу Фаянса-Панета-Хана. На осадке адсорбируются ионы, образующие с противоположным по заряду ионом осадка малорастворимое соединение. Например, на осадке AgCl будут адсорбироваться ионы серебра и хлорид-ионы, на осадке BaSO4 – Ba2+ и SO42- и т.д. Адсорбирующиеся ионы могут отличаться от собственных ионов осадка. Например, на осадке AgCl могут адсорбироваться ионы Br- или I- Такая адсорбция называется специфической. Степень адсорбции иона на осадке зависит от его концентрации в растворе и заряда. При прочих равных условиях адсорбируются те ионы, концентрация которых больше. При увеличении заряда иона его адсорбционная способность повышается. Адсорбция является экзотермическим процессом. При увеличении температуры она уменьшается. Количество адсорбированных примесей прямо пропорционально площади поверхности осадка, поэтому такой вид загрязнения особенно характерен для аморфных осадков с большой удельной поверхностью. Все действия, ведущие к увеличению размера частиц осадка, приводят и к уменьшению количества адсорбированных примесей. Для уменьшения количества адсорбированных ионов используют нагревание раствора. Адсорбированные примеси можно удалить путём замещения их другими ионами, от которых можно затем легко избавиться при прокаливании осадка. Для этого осадок промывают разбавленным раствором летучего электролита (например, NH4NO3). Окклюзия подчиняется тем же закономерностям, что и адсорбция. Окклюдированные примеси в той или иной степени удаляются в процессе «старения» осадка и при его переосаждении. На процесс изоморфного соосаждения влияет размер частиц осадка и скорость установления равновесия между осадком и раствором. Изоморфное соосаждение это самый трудный с точки зрения устранения последствий вид соосаждения. Предотвратить его можно лишь путём предварительного удаления мешающих ионов из раствора. |
