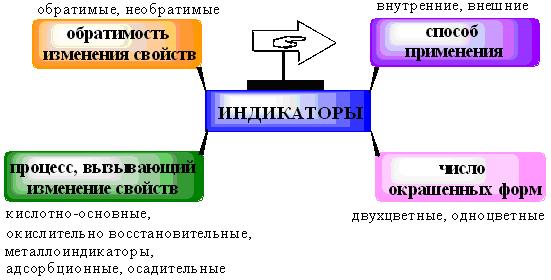
Индикаторы в комплексонометрии
В качестве индикаторов в комплексонометрии используют металлохромные индикаторы. Это органические красители, образующие окрашенные комплексные соединения с ионами металла, менее прочные, чем комплекс металла с комплексоном. При титровании раствором комплексона III происходит разрушение менее прочного комплекса металла с индикатором и выделение свободного индикатора, имеющего другую окраску. При определении многих ионов методом комплексонометрии в качестве индикатора используют эриохром черный Т. Анион этого индикатора в щелочной среде имеет синюю окраску, а с катионами металлов он образует комплекс винно-красного цвета:
M2+ + Hind2- → MInd- + H+.
синий винно-красный
Когда будут оттитрованы все ионы металла, комплекс MInd- полностью разрушится, и окраска раствора перейдет из винно-красной в синюю:
MInd- + H2Y2- → MY2- + HInd2- + H+.
винно-красный синий
Взаимодействие большинста катионов с комплексоном III протекает в молярном отношении 1:1, поэтому факторы эквивалентности (fэкв) равны 1.
Требования, предъявляемые к металлоиндикаторам
5. Металлоиндикаторы должны в выбранной области рН образовывать с ионами металлов достаточно устойчивые комплексы с соотношением компонентов 1:1.
6. Условные константы устойчивости комплексов катионов металлов с индикаторами должны быть меньше констант устойчивости металлов с ЭДТА
7. Комплекс иона металла с индикатором должен быть кинетически лабильным и быстро разрушаться при действии ЭДТА.
8. Изменение окраски раствора в конечной точке титрования должно быть контрастным
Интервал перехода окраски индикатора
Образование комплекса определяемого катиона с индикатором происходит по схеме:
M+ Ind = MInd
Условная константа устойчивости комплекса равна
Из этого выражения следует, что
-lgM= pM , где рМ –показатель концентрации катионов М. Так как человеческий глаз ощущает переход цвета в интервале
тогда для границ интервала перехода окраски индикатора получаем
pM= lgβ ±1.
Наиболее резкий переход окраски наблюдается при pM= lgβ.
Индикаторные ошибки комплексонометрического титрования.
Индикаторные ошибки комплексонометрического титрования обусловлены несовпадением величины рМ в ТЭ и в КТТ — в момент изменения окраски индикатора. В КТТ в растворе остается небольшое количество неоттитрованных катионов определяемого металла. Относительная индикаторная ошибка комплексонометрического титрования Х рассчитывается (в процентах) по формуле:
Х = 10-рМ[V(X) + V(T)]100%/c(X)V(X),
где с(Х),V(X) – концентрация и объем определяемого Ме
с(Т),V(T) – концентрация и объем титранта.
Определение жесткости воды
Жесткость воды обусловлена наличием в ней растворимых солей кальция и магния. Различают общую и временную жесткость воды.
Общая жесткость воды включает карбонатную жесткость, которая обусловлена наличием в воде гидрокарбонатов, и некарбонатную, обусловленную солями кальция и магния с анионами сильных кислот – в основном хлоридами и сульфатами.
Карбонатную жесткость воды можно устранить кипячением, поэтому её также называют временной, а некарбонатную – постоянной. Учитывая то, что кальций и магний имеют разные атомные массы и их соотношение в природных водах не является постоянным, жёсткость воды выражают в ммоль-экв/л. Иногда жёсткость воды выражают также в немецких (10 мг СаО в 1 л воды), английских (1г СаСО3 в 1 галлоне) или французских (1 г СаСО3 в 100 000 г воды) градусах (1ммоль-экв/л соответствует 2,8о жесткости). Вода, содержащая до 4 ммоль-экв/л, считается мягкой, свыше 12 ммоль-экв/л - очень жесткой, с промежуточным содержанием Са2+ и Mg2+ - cредней жесткости.
Определение общей жёсткости воды методом комплексонометрии
Метод основан на титровании воды раствором двунатриевой соли этилендиаминтетрауксусной кислоты (комплексон ІІІ, сокращенная формула Na2H2Y) в щелочной среде при рН+10 с использованием эриохром чёрного в качестве металлохромного индикатора (сокращенная формула Na2H2Ind). Металлоиндикатором называют индикатор, изменение окраски которого зависит от концентрации иона металла. Металлохромные индикаторы содержат в своих молекулах хромовые группы (окрашенные), образующие с ионами металла внутрикомплексные соединения, по цвету отличающиеся от самих индикаторов.
Металлоиндикаторы в выбранной области рН образуют с ионами металлов достаточно устойчивые комплексы с соотношением М:Ind + 1:1. Условные константы устойчивости комплексов М:Ind должны быть меньше условных констант устойчивости комплексов, анализируемых металлов с комплексоном ІІІ. Комплекс металла с индикатором быстро разрушается при действии комплексона ІІІ.
Изменение окраски раствора в конечной точке титрования должно быть контрастным.
Комплексон ІІІ образует с ионами кальция и магния в щелочной среде бесцветные комплексные соединения.
Комплексонат кальция более прочный, чем магния, поэтому при титровании образуется в первую очередь. Эриохром черный образует с ионами магния окрашенный комплекс красно-фиолетового цвета, который при добавлении раствора комплексона ІІІ изменяет окраску на зелено-синюю, вследствие образования более прочного комплексоната магния состава MgY2- и появление свободного индикатора H2Ind.
Титрование раствором комплексона ІІІ определяют суммарное содержание солей кальция и магния.
В присутствии ионов металлов, комплексы которых с эриохром черным более прочные, чем с комплексоном ІІІ, наблюдается недостаточно четкий переход цвета индикатора. Определению жесткости воды не мешают ионы железа (не более 10 мг/л), кобальта, никеля, меди (не более 0,1 мг/л каждого) и некоторые другие элементы. Для маскирования различных катионов металлов, которые реагируют с комплексоном ІІІ, используют цианид калия, солянокислый гидроксиламин или сульфид натрия. Такая потребность возникает в основном при анализе сточных вод.
Кривые титрования
Для того чтобы наглядно представить себе, что происходит при титровании, можно воспользоваться кривой титрования. С помощью кривых титрования можно, например, объяснить, почему для титрования данного вещества подходит один, но не подходит другой индикатор, оценить индикаторную погрешность титрования.
Кривая титрования - график зависимости параметра системы, связанного с концентрацией титруемого вещества, титранта или продукта реакции, от степени протекания процесса титрования (например, от количества добавленного титранта).
По оси абсцисс при построении кривых титрования обычно откладывают объём добавленного стандартного раствора титранта или степень оттитрованности (f).
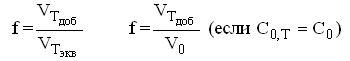
На оси ординат, в случае кривых титрования для кислотно-основного титрования, откладывают значение рН раствора.
В зависимости от определяемого вещества и титранта различают 4 основных случая кислотно-основного титрования и, соответственно, 4 типа кривых титрования:
титрование сильной кислоты сильным основанием,
титрование сильного основания сильной кислотой,
титрование слабой кислоты сильным основанием,
титрование слабого основания сильной кислотой.
Теоретически можно представить себе и титрование слабой кислоты слабым основанием или титрование слабого основания слабой кислотой. Однако, на практике (во всяком случае, в химических методах анализа) такое титрование не используется.
Титрование сильной кислоты сильным основанием и сильного основания слабой кислотой
Рассмотрим кривую титрования 0,10 М HCl при использовании в качестве титранта 0,10 М NaOH.
В любой кривой титрования можно условно выделить 4 участка:
исходная точка;
участок до скачка титрования;
скачок титрования, включая точку эквивалентности;
участок после скачка титрования.
Скачком титрования называется участок кривой титрования, соответствующий резкому изменению свойств системы (в случае кислотно-основного титрования - резкому изменению рН) вблизи точки эквивалентности (обычно в интервале значений степени оттитрованности 0,999 - 1,001).
Расчёты, необходимые для построения кривой титрования, удобно представить в виде таблицы (табл. 13.1). Исходный объём раствора титруемого вещества составляет 100,0 мл. Полученная кривая титрования представлена на рис. 13.1. На этом же рисунке представлена кривая титрования 0,10 М NaOH 0,10 M раствором HCl. Кривые титрования сильной кислоты сильным основанием и сильного основания сильной кислотой симметричны друг другу. Точка эквивалентности совпадает с точкой нейтральности.
Табл. 13.1
Расчёты для построения кривой титрования

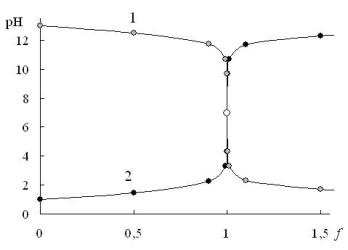
Рис. 13.1. Кривые титрования 0,10 М NaOH 0,10 M раствором HCl (1) и 0,10 M HCl 0,10 M раствором NaOH (2)
Титрование слабой кислоты сильным основанием и слабого основания сильной кислотой
Рассмотрим кривую титрования 0,10 М HCOOH при использовании в качестве титранта 0,10 М NaOH. Расчёты, необходимые для построения кривой титрования, представлены в табл. 13.2, а сама кривая - на рис. 13.2. На этом же рисунке приведена кривая титрования слабого основания (NH3 pKBH+ = 9,24) сильной кислотой. Кривые титрования слабой кислоты сильным основанием и слабого основания сильной кислотой несимметричны относительно точки эквивалентности, которая не совпадает с точкой нейтральности. Величина скачка титрования меньше, чем для, соответственно, кривой титрования сильной кислоты и сильного основания.
На рис. 13.2. показаны также области перехода окраски метилового оранжевого и фенолфталеина. Метиловый оранжевый не подходит для обнаружения конечной точки титровании HCOOH, но подходит для NH3, в то время как фенолфталеин можно использовать в качестве индикатора при титрования HCOOH, но нельзя при титровании NH3. Таким образом, индикаторы, переход окраски у которых происходит в слабокислой среде, нельзя использовать для обнаружения конечной точки при титровании слабых кислот, а индикаторы, у которых интервал перехода окраски находится в слабощелочной среде - при титровании слабых оснований.
Табл. 13.2
Расчёты для построения кривой титрования 0,10 М HСООН (рКа = 3,75) 0,10 М раствором NaOH
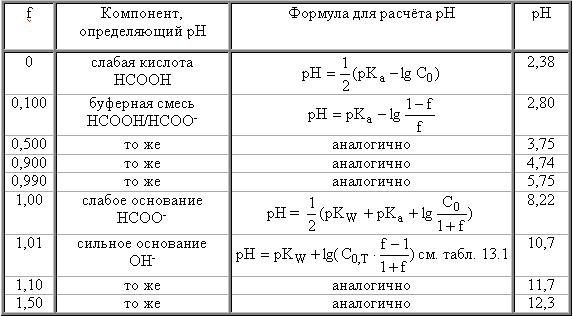
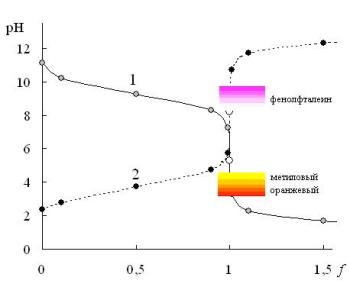
Рис. 13.2. Кривые титрования слабого основания (0,10 M NH3 pKBH+=9,24) сильной кислотой (1) и слабой кислоты (0,10 M HCOOH pKa=3,75) сильным основанием (2)
Титрование многоосновных кислот и многокислотных оснований, а также смесей кислот или смесей оснований
Представим себе, что мы титруем двухосновную кислоту H2A, превращение которой в НА- характеризуется константой Ka1, а превращение НА- в A2- - константой Ka2
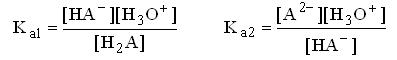
Определим, при каком соотношении данных констант, H2A можно оттитровать вначале до HA-, а затем до A2-, т.е. можно получить кривую титрования с двумя отчётливыми скачками титрования. Допустим, что нас удовлетворяет погрешность титрования H2A по первой ступени менее 1%, иначе говоря, к концу титрования степень превращения H2A в НА- составит более 99%, а НА- в A2- менее 1%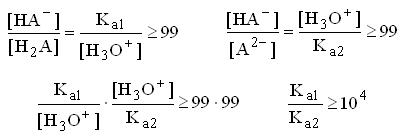
Таким образом, чтобы оттитровать двухосновную кислоту по первой ступени с погрешностью менее 1%, необходимо, чтобы константы кислотности по первой и второй ступени отличались на 4 порядка и более. При допустимой погрешности 0,1% константы должны отличаться на 6 порядков и т.д.
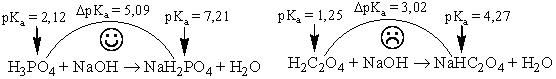
Закономерности, характерные для многоосновных кислот, остаются справедливыми для многокислотных оснований, а также для смесей кислот или смесей оснований. В качестве примера рассмотрим титрование раствора, содержащего карбонат-ион (например, 0,10 М Na2CO3). Расчёт рН для основных точек кривой титрования приведен в табл. 13.3. Кривая титрования показана на рис. 13.3. На кривой имеются 2 скачка титрования; первый скачок можно обнаружить при использовании фенолфталеина, а второй - метилового оранжевого.
Табл. 13.3
Расчёты для построения кривой титрования 0,10 М Na2CO3 0,10 М раствором HCl
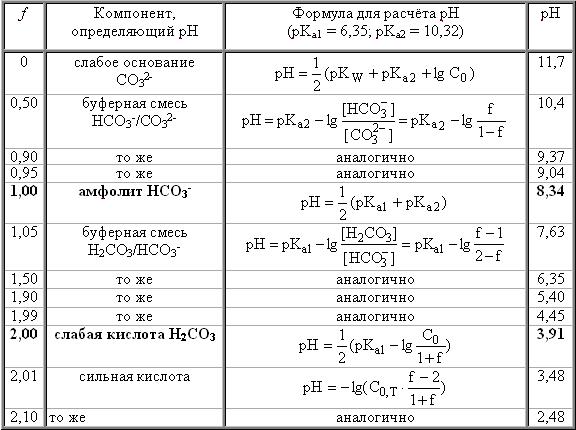
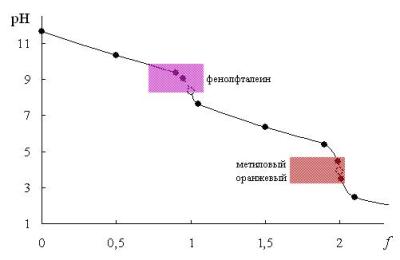 Рис. 13.3 Кривая титрования 0,10 М Na2CO3 0,10 М раствором HCl Рис. 13.3 Кривая титрования 0,10 М Na2CO3 0,10 М раствором HCl
13.4. Факторы, влияющие на величину скачка титрования
На величину скачка титрования в кислотно-основном титровании влияют:
концентрация титруемого вещества и титранта,
сила титруемой кислоты или основания,
температура,
ионная сила раствора.
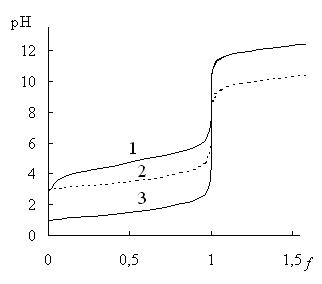
Рис. 13.4. Кривые титрования 0,1М CH3COOH 0,1М NaOH (1), 0,001М HCl 0,001М NaOH (2) и 0,1М HCl 0,1М NaOH (3)
При уменьшении концентрации титруемого вещества и титранта величина скачка титрования уменьшается (рис. 13.4), поэтому кислотно-основное титрование нельзя использовать для определения веществ в сильно разбавленных растворах. Величина скачка титрования также становится меньше при уменьшении силы титруемой кислоты или основания (рис. 13.4). Прямое титрование таких слабых кислот как H3BO3 (pKa = 9,2) или NH4+ (pKa = 9,24) в водных растворах с удовлетворительной погрешностью невозможно и поэтому для их определения используют специальные приёмы.
Температура и ионная сила влияют на величину скачка титрования менее заметно, чем концентрация или сила титруемой кислоты или основания. При повышении температуры константа автопротолиза воды увеличивается, поэтому величина скачка кислотно-основного титрования в водном растворе уменьшается. Аналогичным образом влияет на величину скачка титрования ионная сила раствора.
13.5. Погрешности титрования
Индикаторные погрешности в кислотно-основном титровании удобно разделить на 4 вида:
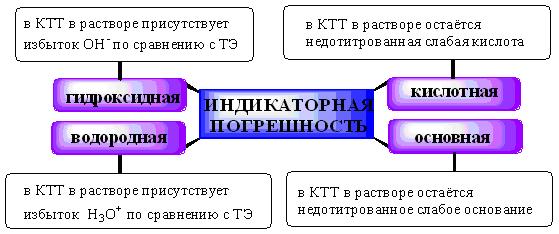
Водородная индикаторная погрешность может возникнуть при недотитровании сильной кислоты (в таком случае погрешность отрицательная) либо когда сильная кислота используется в качестве титранта и добавлена в избытке (положительная погрешность).
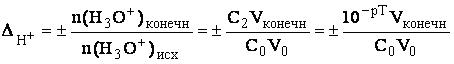
Если концентрации титруемого вещества и титранта одинаковы, то Vконечн = 2V0, тогда
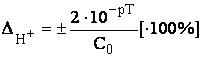
Гидроксидная погрешность может возникнуть при недотитровании сильного основания (отрицательная погрешность) либо в том случае, когда сильное основание используется в качестве титранта и добавлено в избытке (положительная погрешность).
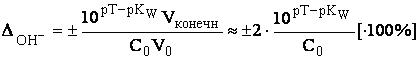 Кислотная и основная индикаторные погрешности могут быть только отрицательными (если, конечно, исключить гипотетический случай использования слабой кислоты или основания в качестве титранта). Кислотная и основная индикаторные погрешности могут быть только отрицательными (если, конечно, исключить гипотетический случай использования слабой кислоты или основания в качестве титранта).
Величина кислотной погрешности представляет собой молярную долю неоттитрованной кислоты.
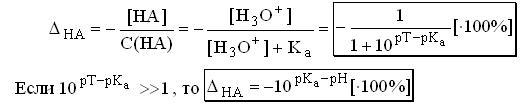
Формула для расчёта основной погрешности выводится аналогичным образом и выглядит следующим образом:
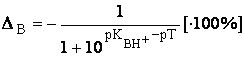
или в упрощённом виде
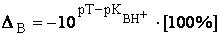
Пример 13.1. Рассчитать систематическую индикаторную погрешность титрования 0,1 М HCl и 0,1 М HCOOH при использовании в качестве титранта 0,1 М NaOH и индикатора метилового оранжевого (рТ = 4).
В случае HCl титрование заканчивается при рН меньшем (4), чем рН в точке эквивалентности (7), поэтому имеет место водородная индикаторная погрешность. Поскольку в конечной точке титрования определяемое вещество будет недотитровано, величина систематической индикаторной погрешности будет отрицательной
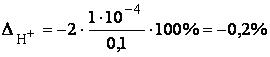
При титровании HCOOH в конечной точке титрования будет оставаться неоттитрованная слабая кислота, поэтому в данном случае будет кислотная индикаторная погрешность.
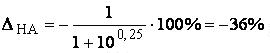
Совершенно очевидно, что метиловый оранжевый не может быть использован для обнаружения конечной точки титрования раствора HCOOH раствором NaOH.
Обнаружение конечной точки титрования. Кислотно-основные индикаторы
Индикатором (лат. indicator - указатель) называется вещество, видимо изменяющее свои свойства (окраску, люминесценцию, растворимость) при изменении концентрации какого-либо компонента в растворе. У правильно выбранного индикатора изменение окраски должно происходить в точке эквивалентности или вблизи неё.
Кислотно-основные индикаторы - слабые органические кислоты или основания, кислотная (протонированная) и основная формы которых отличаются по окраске или флуоресценции, т.е. вещества, окраска или флуоресценция которых зависят от рН.
В качестве кислотно-основных индикаторов при титровании в водных растворах наиболее широко используются:
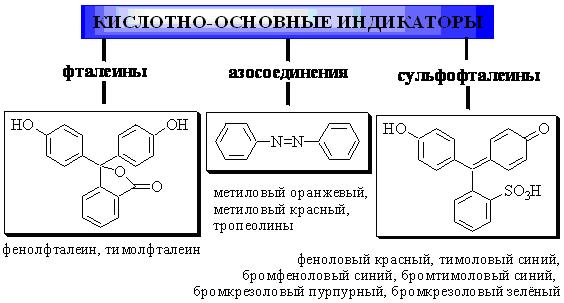
Метиловый оранжевый представляет собой двухцветный индикатор. Его основная форма окрашена в жёлтый цвет, а кислотная (протонированная) - в красный.
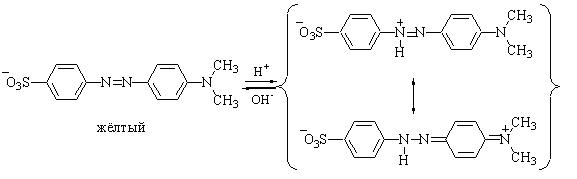
У протонированной формы степень делокализации электронной плотности выше и поэтому меньше разность энергий основного и возбуждённого состояния. Вследствие этого кислотная форма поглощает электромагнитное излучение видимого диапазона с большей длиной волны (меньшей энергией), чем основная.
Изменение окраски метилового оранжевого и любых других кислотно-основных индикаторов происходит в определённом интервале рН, называемом интервалом перехода окраски индикатора.
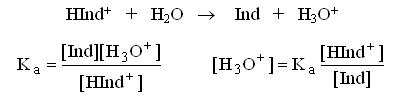
В среднем, человеческий глаз замечает изменение окраски, когда концентрация одной окрашенной формы становится в 10 раз больше, чем другой.
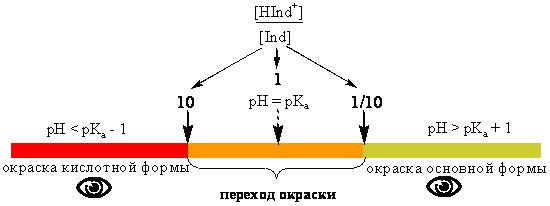
pHперехода = pKa ± 1
Границы интервала pKa ± 1 соблюдаются лишь в том случае, если интенсивность окраски обеих форм одинакова. В действительности это обычно не так. У метилового оранжевого pKa = 3,36, а интервал перехода окраски - 3,1-4,6. Это объясняется тем, что протонированная форма имеет больший молярный коэффициент светопоглощения и для того, чтобы окраска раствора индикатора соответствовала окраске кислотной формы, достаточно, чтобы её концентрация не в 10, а всего лишь в
2 раза превышала концентрацию основной формы.
Значение рН, при котором заканчивают титрование с данным индикатором, называется показателем титрования (для данного индикатора) - рТ.
Величина показателя титрования находится примерно в середине интервала перехода окраски индикатора, например, у метилового оранжевого рТ ≈ 4.
Интервал перехода окраски индикаторов зависит от:
температуры;
ионной силы;
присутствия в растворе посторонних веществ (например, этанола), влияющих на кислотно-основные свойства индикатора.
У метилового оранжевого и других двухцветных индикаторов интервал перехода не зависит от концентрации индикатора в растворе.
Метиловый красный
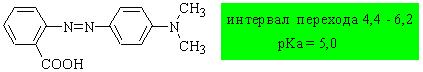
Фенолфталеин относится к одноцветным индикаторам.
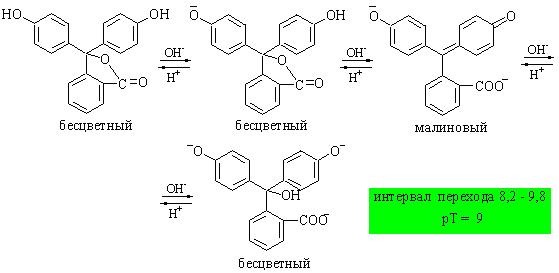
Лактонная форма фенолфталеина не имеет окраски, дианион - окрашен в малиновый цвет, что связано со значительной степенью делокализации электронов в последнем. В сильнощелочной среде образуется трианион фенолфталеина (карбинольная форма), и его раствор вновь становится бесцветным. При ионной силе 0,2: рKa1 = 8,83; рKa2 = 9,32; рKa3 = 11,73.
Интервал перехода окраски фенолфталеина и других одноцветных индикаторов зависит от их концентрации в растворе, что является недостатком таких индикаторов. Пусть общая концентрация фенолфталеина в растворе равна C. Человеческий глаз начинает замечать появление окраски индикатора при некоторой минимальной концентрации его окрашенной формы, которую мы обозначим как [HInd2-]мин. Значение рН, при котором станет заметным появление окраски, будет равно:
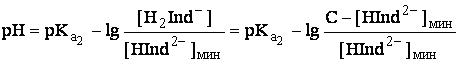
Так как C>>[HInd2-], то 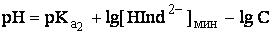
|
 Скачать 1.45 Mb.
Скачать 1.45 Mb.