ыва. Практикум по ОХТ[155]. Основы химической технологии
 Скачать 5.15 Mb. Скачать 5.15 Mb.
|
102 или больше, а равновесный выход целевого продукта был близок к 100% или к 1 (в долях) (см. ниже), то процесс называют обратимым смещенным. Если константа равновесия и равновесный выход не достигают указанных значений в выбранных условиях проведения, то ХТП считают обратимым несмещенным.При организации ХТП необходимо учитывать тепловой эффект протекающих реакций. Тепловой эффект реакции (Q) и изменение энтальпии (ΔН) одинаковы по абсолютной величине, но противоположны по знаку. Реакции, протекающие с выделением тепла, называют экзотермическими (Q>0, ΔН<0), реакции, приводящие к поглощению тепла – эндотермическими (Q<0, ΔН>0). Тепловой эффект ХТП складывается из тепловых эффектов основной и побочных реакций. Если сумма тепловых эффектов положительна, т.е. преобладают реакции, протекающие с выделением тепла, то ХТП является экзотермическим. Если основной вклад в суммарный тепловой эффект вносят реакции, протекающие с поглощением тепла, то ХТП – эндотермический. Часто под тепловым эффектом ХТП имеют ввиду тепловой эффект целевой реакции. Очевидно, что для экзотермических ХТП необходимо обеспечить теплоотвод при соблюдении оптимального температурного режима в реакционной зоне (или организовать автотермический режим), а для эндотермических процессов – решить проблему теплоподвода. Константа равновесия связана с изменением стандартного изобарно-изотермического потенциала реакции уравнением (1.2.) ΔG° = ΔН° - ТΔS° = - RT lnK (1.2.) Отсюда следует связь константы равновесия реакции и температуры (изобара Вант-Гоффа) (1.3). lnK = ΔS°/R - ΔН°/RT (1.3) Это уравнение позволяет проводить термодинамический анализ реакционных систем при известных или рассчитанных по справочным данным изменениям энтальпии (ΔН°) и энтропии (ΔS°) реакции. Равновесный выход или равновесная степень превращения – это доля исходного реагента, превратившегося в продукты реакции к моменту достижения равновесия. Равновесный выход - величина более информативная в практическом плане, чем величина константы равновесия, поскольку это максимально достижимый выход в данных условиях. Связь равновесного выхода и константы равновесия определяется видом уравнения реакции. Покажем алгоритм нахождения этой связи на примере реакции синтеза метанола из синтез-газа (1.4). СО + 2Н2 = СН3ОН (1.4) Предположим, что исходная смесь газов содержит 1 моль СО и 2 моля водорода (стехиометрическое соотношение). Метанол в исходной смеси отсутствует. Обозначим равновесный выход метанола буквой x. Тогда к моменту установления равновесия в равновесной газовой смеси содержится (1-x) молей СО, (2-2x) молей Н2 и x молей СН3ОН. СО Н2 СН3ОН Исходная смесь, моль 1 2 0 Равновесная смесь, моль 1-x 2-2xx Для того чтобы связать константу равновесия (1.5) с равновесным выходом, выразим парциальные давления веществ, присутствующих в равновесной системе, через равновесный выход. Для этого воспользуемся выражением (1.6.). 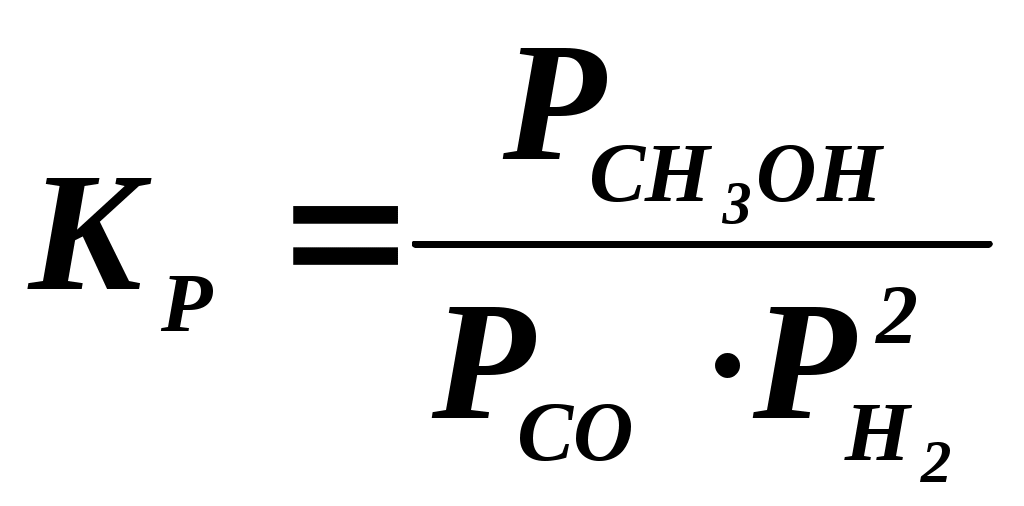 (1.5) (1.5)где Рi –парциальное давление i-ого вещества, P – общее давление в системе, Ni – мольная доля i-ого вещества (Ni = ni / ni - отношение количества молей данного вещества к сумме молей всех веществ, присутствующих в данной фазе системы). Тогда для рассматриваемого примера выражение для константы равновесия (1.5) перепишем с учетом выражений для парциальных давлений веществ (1.7). После сокращений и преобразований получим (1.8). Уравнения типа (1.8) позволяют не только исследовать взаимосвязь температуры и равновесного выхода (совместно с уравнением 1.3), но и определить чувствительность равновесного выхода к изменению давления (при постоянной температуре и константе равновесия). Так, легко показать, что для вышеприведенного примера величина константы равновесия и равновесный выход будут уменьшаться с увеличением температуры (ΔН < 0), и равновесный выход будет увеличиваться при увеличении давления (реакция протекает в газовой фазе с уменьшением количества молей). Причем, при малых х (х<<1) равновесный выход будет увеличиваться пропорционально Р2. В первом приближении можно считать, что константа равновесия не зависит от давления и является функцией только температуры. Это совершенно верно при относительно низких давлениях и высоких температурах. При высоких давлениях законы для идеальных газов перестают описывать наблюдаемые зависимости. Для сохранения возможности пользоваться простыми законами были введены понятия активности и коэффициента активности. Взаимосвязь активности и давления выражается уравнением (1.9). А константа равновесия реакции, протекающей под давлением, должна выражаться через активности компонентов. Например, для реакции синтеза метанола из синтез-газа выражение для константы равновесия с использованием равновесных активностей и коэффициентов активностей выглядит следующим образом (1.10). 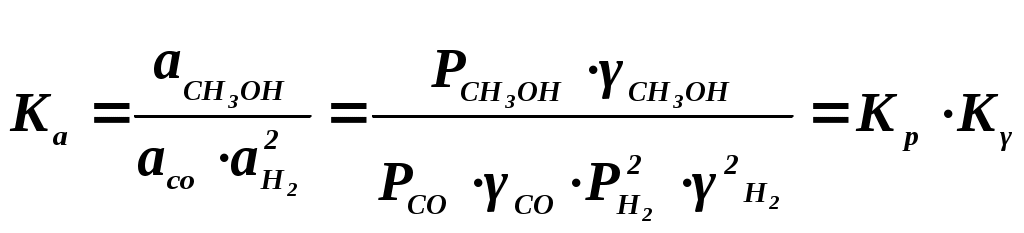 (1.10) (1.10)Поскольку при расчете по формулам (1.2) и (1.3) получают значение Ка, а для расчета равновесного выхода необходимо значение Кр, то необходимо для процессов, протекающих под давлением, рассчитывать Кγ. Для этого используют различные подходы, описанные в литературе по химической термодинамике. Таким образом, на величину константы равновесия реакции влияет температура в зависимости от знака теплового эффекта. Давление может влиять на величину Кр только через изменение Кγ. На величину равновесного выхода влияет температура (через значение Кр), общее давление и соотношение концентраций (парциальных давлений веществ). Избыток одного реагента приводит к увеличению степени превращения другого(их) реагента(ов) и к уменьшению степени превращения реагента, находящегося в избытке. Большая величина константы равновесия и отсутствие термодинамических ограничений (Хравн.=1) необходимое, но не достаточное условие возможности практической реализации ХТП. Очень важное значение для выбора условий проведения ХТП имеют кинетические закономерности целевой и побочных реакций (т.е. закономерности протекания процесса во времени или зависимость скорости от концентрации веществ, температуры, наличия катализатора и его характеристик). 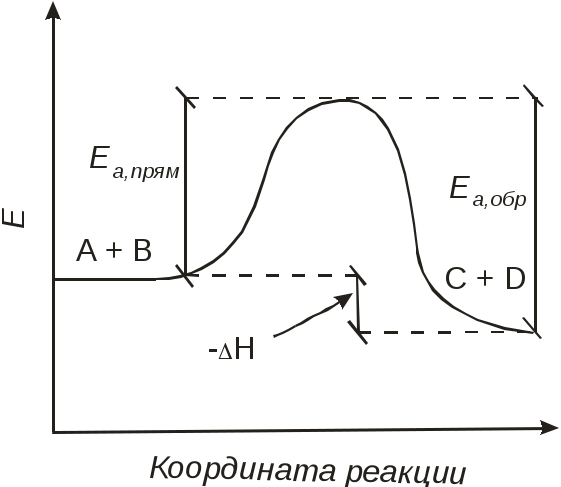 Рис. 1.1 Энергетическая диаграмма элементарной реакции Столкновение двух молекул исходных реагентов, обладающих достаточной энергией для преодоления энергетического барьера, приводит к получению продуктов (промежуточных или конечных) реакции и называется элементарным актом химического взаимодействия (рис.1.1). Точку на вершине энергетического барьера называют переходным состоянием или активированным комплексом (это термины из соответствующих теорий элементарных реакций, см. курс «Физическая химия»). Совокупность одинаковых элементарных актов – элементарная реакция (1.13). аА + вВ → сС + dD (1.13) Элементарную реакцию от сложной (по у) отличает отсутствие промежуточных продуктов. Скорость элементарной реакции может быть описана законом действия масс. Для реакции (1.13) уравнение (1.14). Скорость элементарной реакции пропорциональна концентрациям реагентов в степенях, равных их стехиометрическим коэффициентам в уравнении реакции. Для газофазных реакций вместо концентраций используют парциальные давления веществ. Коэффициент пропорциональности – константа скорости элементарной реакции. Зависимость константы скорости от температуры описывают уравнением Аррениуса (1.15). где А – предэкспоненциальный член, Е – энергия активации, R – газовая постоянная, Т – абсолютная температура Показатель степени концентрации (или парциального давления) в кинетическом уравнении называют порядком по данному реагенту. Для элементарной реакции порядок совпадает со стехиометрическим коэффициентом данного вещества (и должен быть положительным и целочисленным). Сумма показателей степени для концентраций реагентов – суммарный порядок. Для элементарной реакции суммарный порядок совпадает с молекулярностью (числом молекул реагентов, участвующих в элементарной реакции) и не превышает двух. Одновременное столкновение более двух молекул – маловероятно. Сложные по механизму реакции включают несколько элементарных реакций. На энергетической диаграмме сложной по механизму реакции 1.16, 1.17 будет соответствовать кривая потенциальной энергии с несколькими минимумами и максимумами (рис. 1.2) 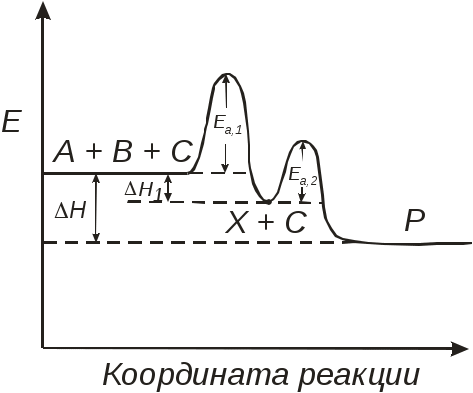 Рис. 1.2. Энергетическая диаграмма сложной по механизму реакции. Х – промежуточный продукт. Скорость сложной по механизму реакции часто можно описать эмпирическим уравнением, по форме совпадающим с уравнением закона действия масс (например, 1.14). Но в случае сложной по механизму реакции порядки по реагентам могут быть нецелочисленными, переменными, отрицательными, большими по абсолютной величине. С точки зрения организации ХТП кинетические порядки основной и побочных реакций по реагентам важны, так как они отражают степень чувствительности скоростей образования целевых и побочных продуктов (а, следовательно, и показателей процесса, см. ниже) к концентрациям веществ – участников ХТП. Чем выше порядок по данному веществу, тем сильнее влияет изменение его концентрации на скорость. Зависимость наблюдаемой константы скорости (kэфф) может описываться уравнением, по форме совпадающим с уравнением Аррениуса, но значения предэкспоненты и энергии активации могут быть любыми (в отличие от определенных значений этих параметров для элементарных реакций). Например, наблюдаемая энергия активации сложной реакции может быть отрицательна, т.е. скорость сложной реакции может уменьшаться с увеличением температуры из-за того, что в kэфф входят константы равновесия экзотермических стадий (реакций), значения которых уменьшаются с увеличением температуры. С технологической точки зрения знак и величина наблюдаемой энергии активации отражает чувствительность скоростей реакций ХТП к изменению температуры. Чем больше наблюдаемая энергия активации данной реакции, тем сильнее влияет изменение температуры на скорость этой реакции. Скорость реакции, имеющей более высокую энергию активации, растет быстрее при увеличении температуры, чем скорость реакции с меньшей величиной Еа. При понижении температуры быстрее уменьшается скорость реакции, имеющая большую энергию активации. В подавляющем большинстве промышленных ХТП используют катализаторы. Тип катализатора и его характеристики определяют, как правило, выбор условий и показатели ХТП. В связи с этим ХТП делят на каталитические и некаталитические. А каталитические ХТП подразделяют в зависимости от типа используемого катализатора на гомогенно-каталитические (катализатор находится в той же газовой или чаще жидкой фазе, в которой находятся реагенты) и гетерогенно-каталитические. В последних используют твердые (гетерогенные) катализаторы, а реагенты находятся в газообразном или жидком состоянии. Для способа организации ХТП важна фазовая характеристика. С этой точки зрения ХТП делят на гомофазные (все вещества находятся в одной фазе, отсутствуют границы раздела фаз) и гетерофазные (система, в которой протекает ХТП, включает хотя бы одну границу раздела фаз). Границей раздела фаз может быть поверхность твердого катализатора в газофазном или жидкофазном процессе. Поэтому все гетерогенно-каталитические процессы всегда гетерофазны, а гомогенно-каталитические могут быть как гомофазны, так и гетерофазны. 1.2. Основные технологические критерии эффективности Для оценки качества ХТП используют количественные технологические показатели: степень превращения сырья, селективность образования и выход продукта, производительность реактора или установки, интенсивность работы реактора или катализатора, расходные коэффициенты по реагентам, другим веществам (в ходе ХТП расходуются катализаторы, инерты и т.д.) и энергии. Эти показатели характеризуют степень совершенства ХТП. Рассмотрим основные показатели на примере реакции (1.18), которую будем считать основной реакцией ХТП. aA +bB = pP (1.18) 1.2.1. Степень превращения (степень конверсии) реагента (Х) – это отношение количества превращенного реагента к введенному в реакционную систему количеству этого реагента. Количества реагента могут быть выражены в единицах массы, молях, в мольных потоках (количество молей вещества, поступающее в реактор или выходящее из реактора в единицу времени) и, даже, в единицах объема, взятых при одинаковых условиях (температуре и давлении). 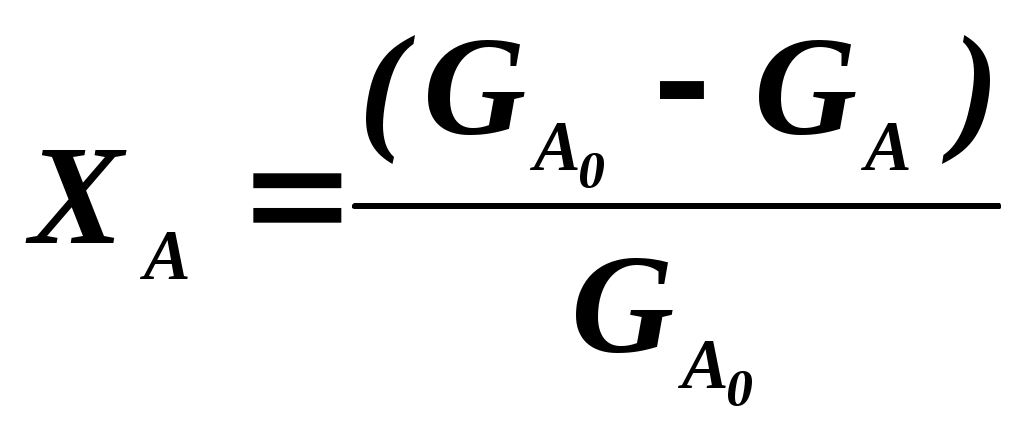 ; ; 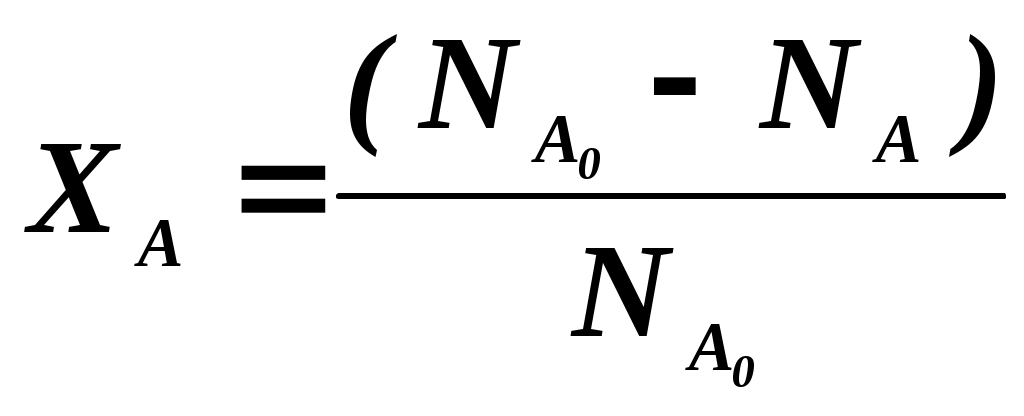 (1.19), где (1.19), где Если объем реакционной системы остается постоянным в ходе ХТП, то во всех расчетах количества веществ могут быть заменены их молярными концентрациями. При использовании формул (1.19) степень превращения получают в долях единицы. Умножив полученное значение на сто процентов, получим величину Х в процентах. 1.2.2. Выходом продукта по данному реагенту называют отношение количества реагента, превратившегося в данный продукт, к количеству этого реагента, введенного в систему. Эквивалентная формулировка: выход продукта по данному реагенту – это отношение количества продукта, полученного практически, к количеству этого продукта, которое должно быть получено из введенного количества данного реагента в соответствии с уравнением реакции. Обе формулировки выражаются одной формулой. Для уравнения (1.18) выходы продукта Р на реагенты А и В выражаются формулами (1.20). (1.20), где Для уточнения связи формулы (1.20) с двумя формулировками определения выхода перепишем ее для реагента А в двух видах: (1.21) – для первой формулировки, (1.22) – для второй. 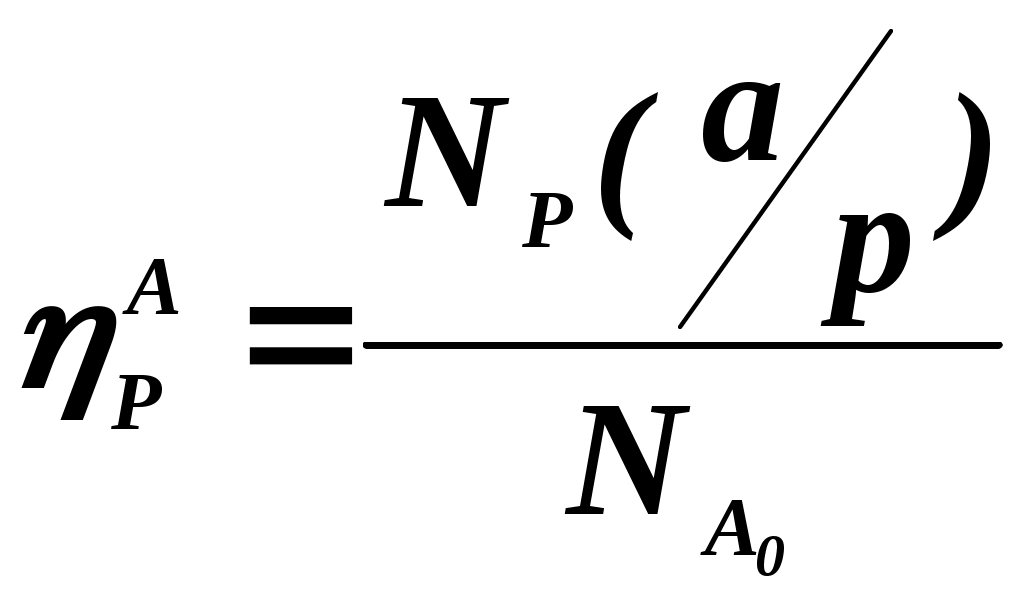 (1.21); (1.21); 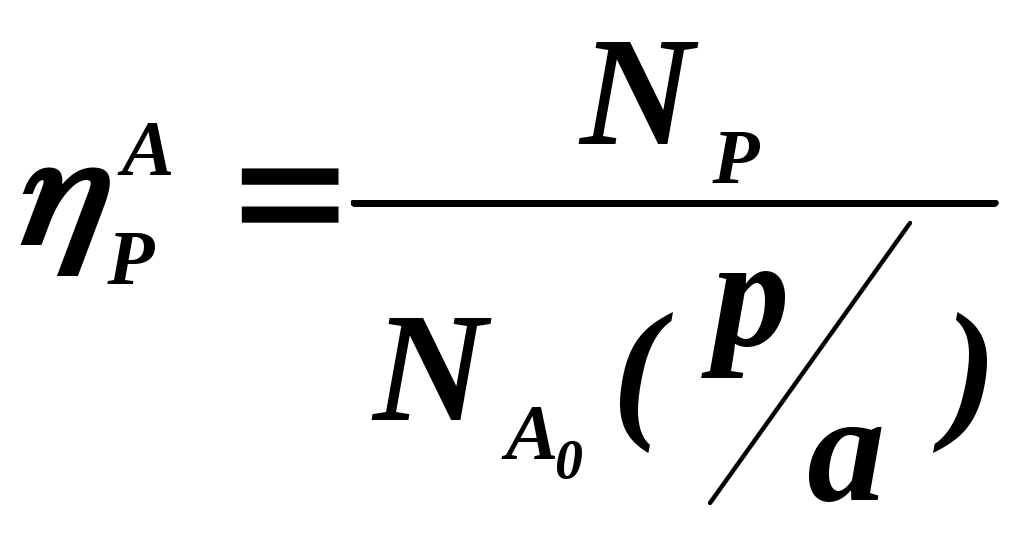 (1.22) (1.22)Выражение Выход можно рассчитывать для каждого из продуктов по любому из реагентов (а если необходимо, то и по всем реагентам основной реакции). Чаще выход рассчитывают для наиболее ценного (целевого) продукта на наиболее дорогой из реагентов. Например, в синтезе метанола из синтез-газа наряду с основной (1.23) идут побочные реакции (1.24 - 1.26). СО + 2Н2 = СН3ОН 1.23) 2СО + 2Н2 = СН4 + СО2 (1.24) СО + 3Н2 = СН4 + Н2О (1.25) 2СН3ОН = СН3ОСН3 + Н2О (1.26) Выход метанола (ηCH3OH) в соответствии со стехиометрией уравнения (1.23) по оксиду углерода(II) рассчитывают по формуле (1.27), а по водороду – по формуле (1.28). 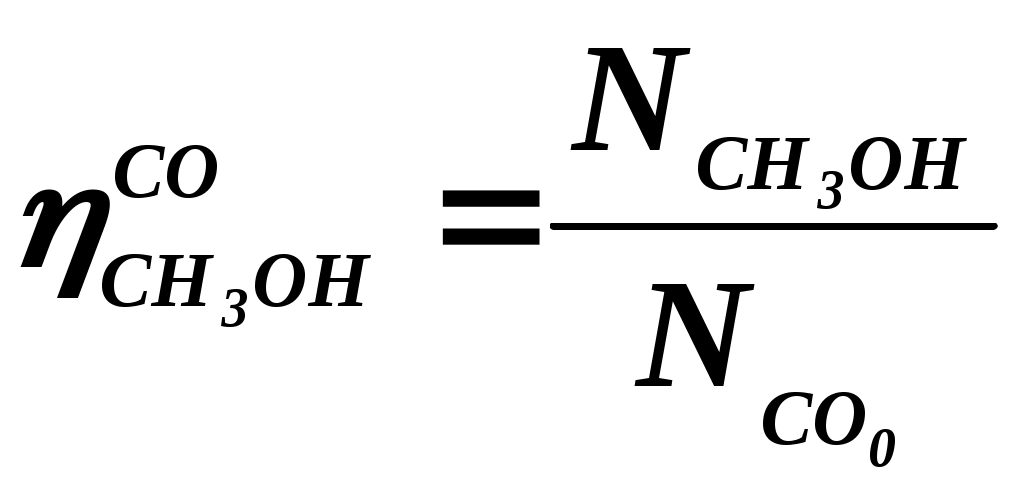 (1.27); (1.27); 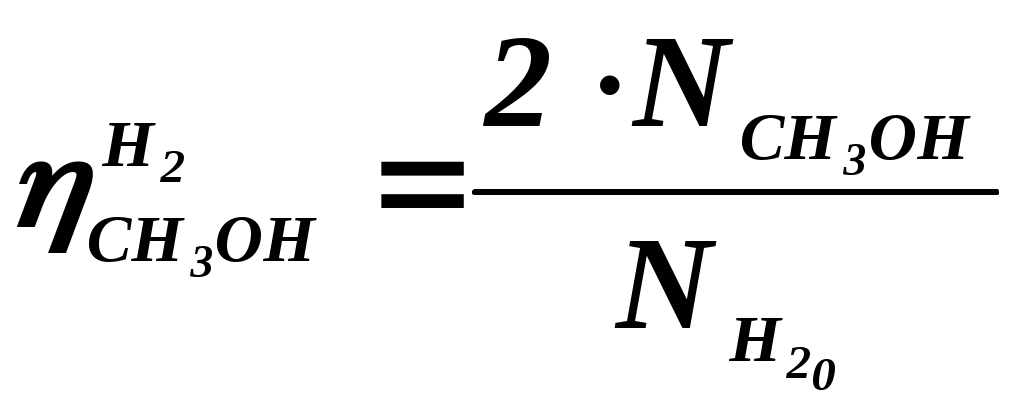 (1.28), (1.28),где Аналогичным образом может быть рассчитан выход по каждому из побочных продуктов. Очевидно, что практический выход не может превышать равновесный выход при условиях проведения процесса. Для процессов, в которых трудно выделить одну стехиометрическую реакцию образования целевого продукта, и поэтому нельзя рассчитать выход описанным способом, рассчитывают показатель, который также называют выходом или массовым выходом и который представляет собой отношение массы полученного продукта к массе затраченного сырья. Например, выход этилена для процесса пиролиза фракций нефти находят как отношение массы этилена к массе поступившей в реактор фракции нефти. 1.2.3. Селективность – важнейший показатель сложного ХТП, характеризующий эффективность превращения сырья в целевой продукт. Селективность образования продукта по реагенту (φ) – это отношение количества этого реагента, превратившегося в продукт, к общему количеству превратившегося реагента. В отличие от выхода, селективность не учитывает не превратившийся реагент, поэтому этот показатель более чувствителен к соотношению различных направлений химического превращения. Для реакции (1.18) селективность образования продукта Р по реагентам А и В выразится формулами (1.29) и (1.30), в знаменателе которых, в отличие от формул для выхода (1.21) и (1.22), количество превращенного реагента. Символом N обозначены мольные количества веществ или мольные потоки (для открытых систем, работающих в стационарном режиме). Для селективности, также как для выхода, есть второе определение: селективность – это отношение количества полученного практически продукта, к количеству этого продукта, которое должно было быть получено из прореагировавшего количества реагента в соответствии со стехиометрией реакции, по которой образуется этот продукт. Если продукт образуется по нескольким реакциям, то селективность, как правило, рассчитать нельзя. Селективность, рассчитанную по формулам (1.29,1.30) называют интегральной в отличие от дифференциальной селективности. Дифференциальной селективностью ( Например, для реакции синтеза метанола (1.23) интегральную селективность образования метанола по СО и по Н2 рассчитывают по формулам (1.32) и (1.33), соответственно. 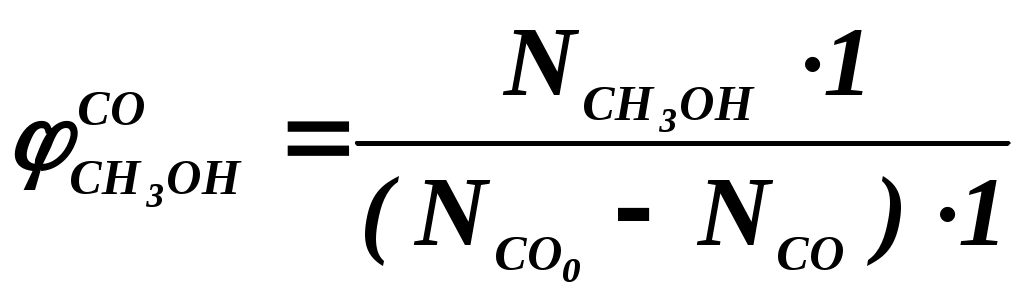 (1.32); (1.32); 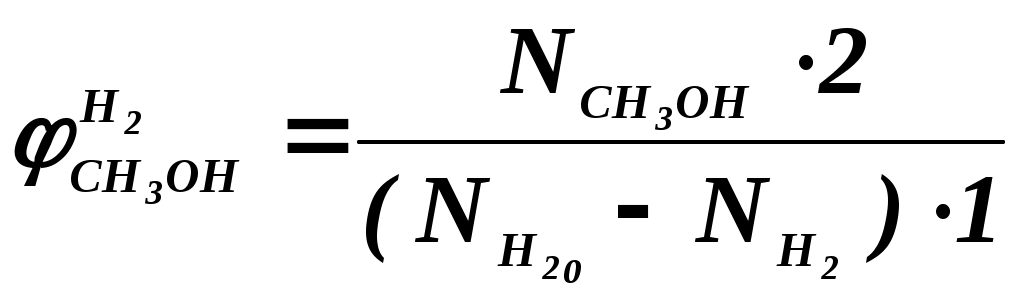 (1.33) (1.33)1.2.4. Взаимосвязь степени превращения реагента, выхода и интегральной селективности образования продукта по этому реагенту легко получить, перемножив выражения для степени превращения (1.19) и селективности (1.29). Сократив одинаковые члены в числителе и знаменателе, получим (1.34) (сравнить с (1.21)). 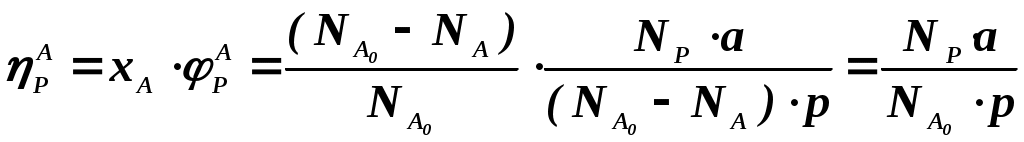 (1.34) (1.34)Очевидно, что для простых ХТП селективность равна единице (100%) для всех продуктов единственной реакции (стехиометрического уравнения). В этом случае выход каждого из продуктов реакции по любому из реагентов равен степени превращения этого реагента ( В случае сложных ХТП для получения высокого выхода необходимо иметь высокие значения и степени превращения, и селективности. Если процесс протекает с полным превращением реагента, то выход продуктов по этому реагенту равен селективности образования каждого из продуктов по данному реагенту. Например, в контактном окислении аммиака весь поступающий в процесс аммиак реагирует, превращаясь в оксид азота и побочные продукты. Выход оксида азота в этом случае равен селективности образования NO по аммиаку. 1.2.5. Производительность аппарата. Производительность аппарата (П) - это масса (или объем) выработанного целевого продукта за единицу времени: где G – масса (или объем) продукта, полученная за времяt 1.2.6. Интенсивность работы аппарата. Интенсивностью работы аппарата (I) называют его производительность, отнесенную к какой-либо величине, характеризующей размеры данного аппарата. Обычно производительность относят к объему аппарата V или к площади его сечения S: В каталитических процессах рассчитывают интенсивность работы катализатора, для чего массу полученного за единицу времени целевого продукта относят к объему катализатора Vk: 1.2.7. Материальный баланс ХТП. Материальный баланс ХТП является следствием закона сохранения массы вещества. Это означает, что масса веществ, поступивших на технологическую операцию - приход, равна массе полученных веществ - расходу. Материальный баланс должен соблюдаться для ХТП всех типов, синтеза, разделения, очистки целевых продуктов. Данные о материальном балансе позволяют дать оценку целесообразности осуществления процесса в заданных условиях. Эти данные нужны как при проектировании новых, так и при анализе работы существующих производств. По данным материального баланса рассчитывают технологические показатели процесса: выход целевого продукта, степень превращения сырья, селективность процесса, расходные коэффициенты по сырью и т.д. Материальный баланс является необходимым элементом при расчете энергетического и эксергетического балансов. Материальный баланс сводят, пользуясь уравнениями основной и побочных реакций. Когда учитывают не все происходящие побочные реакции и полученные побочные продукты, а лишь наиболее важные из них, материальный баланс имеет приблизительный характер. Существуют три основные формы составления материального баланса. В виде системы уравнений, таблицы и поточной диаграммы. Уравнение материального баланса в общем виде: GAO + GBO + ... = GR + ...+ GD +...+ GA + GB + G, где GAO, GBO - массы исходных реагентов (сырья). GR - масса целевого продукта, GD - масса побочного продукта, GА, GВ - массы не прореагировавших веществ, G - невязка баланса. Невязка баланса является следствием потерь сырья и продуктов при проведении процесса, неточности эксперимента и расчета, а также принятых допущений. Чаще всего материальный баланс процесса представляют в виде таблицы:
В таблицу материального баланса, кроме обязательных масс и массовых процентов введенных и получающихся веществ, включают еще и объемы веществ, находящихся в газовой фазе, приведенные к нормальным условиям. Массовые проценты в столбце “Расход” рассчитывают по отношению к сумме масс введенных реагентов в столбце “Приход”, т.е. массу всех введенных реагентов принимают за 100%. Может случиться, что из-за погрешностей эксперимента и допущений, принятых при расчете, масса полученных веществ окажется больше массы введенных. Тогда невязка баланса будет иметь отрицательное значение. Материальный баланс составляют на заданный базис. Обычно базисом является масса сырья или целевого продукта (кг, т) или продолжительность процесса (ч, сутки). В лабораторных исследованиях составляют баланс за время проведения опыта. В дальнейшем производят пересчет на заданный базис, пользуясь коэффициентом пересчета. Коэффициент пересчета показывает, во сколько раз нужно изменить массы веществ, входящих в материальный баланс, при переходе на другой базис. Так, если в материальном балансе, составленном за время проведения опыта, получили GR грамм целевого продукта, а заданный базис расчета - 1000 г целевого продукта, коэффициент пересчета равен 1000 / GR. В названии таблицы материального баланса указывают, для какого процесса и реактора произведен расчет, а также принятый базис расчета. Поточная диаграмма это блок-схема (рис.1.3). Материальные потоки изображают в виде полос, ширина которых пропорциональна массе в выбранном масштабе. Основным преимуществом данного способа изображения является его наглядность.  Рис.1.3. Поточная диаграмма колонны синтеза аммиака: 1 - свежий газ; 2 - циркулирующий газ; 3 - жидкий аммиак и растворенные в нем газы; 4 - отдувочные газы 1.2.8. Расходные коэффициенты по сырью. К основным показателям ХТП относятся расходные коэффициенты, характеризующие затраты сырья, воды, топлива, электроэнергии, пара на единицу массы целевого продукта. В связи с большим вкладом затрат на реагенты (сырье) в себестоимость продуктов в химической технологии особое значение имеют расходные коэффициенты по реагентам. Различают теоретические и практические расходные коэффициенты. Теоретический расходный коэффициент стех рассчитывают, пользуясь стехиометрическим уравнением, описывающим химическое превращение (1.18):     где MA и MP - молекулярные массы реагента и продукта а и р - стехиометрические коэффициенты. Теоретический расходный коэффициент характеризует минимальный расход сырья на единицу массы продукта. Практический расходный коэффициент отражает реальный расход поступившего в процесс сырья на единицу массы продукта, т.е. его рассчитывают как отношение массы поступившего в процесс сырья Расходные коэффициенты рассчитывают по всем реагентам. Практические расходные коэффициенты всегда больше стехиометрических из-за неполноты превращения сырья, а также из-за расходования сырья на побочные реакции. Данные для расчета практических расходных коэффициентов берут из материального баланса процесса. Практический расходный коэффициент по реагенту можно найти, зная теоретический расходный коэффициент и выход целевого продукта по этому реагенту: 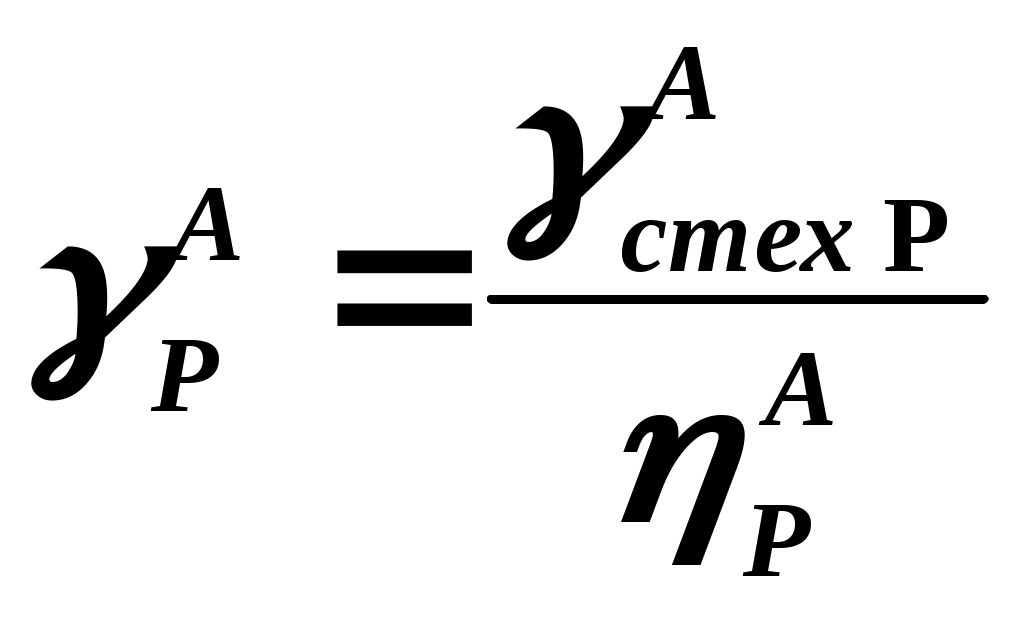 где 1.3. Технологические параметры ХТП 1.3.1. Время пребывания исходных веществ в реакционной зоне. На выход целевого продукта и интенсивность работы аппарата влияют не только температура, давление, концентрации исходных веществ, но и длительность пребывания этих веществ в зоне реакции. В аппаратах периодического действия время пребывания реагентов - это интервал времени между загрузкой и выгрузкой аппарата. В аппаратах непрерывного действия время пребывания исходных веществ в реакционной зоне определяют следующим образом: где V- реакционный объем, м3 (полезный объем аппарата), Vt,p - расход исходных веществ, поступающих в реакционный аппарат при температуре и давлении в аппарате, м3/с. Э  то уравнение позволяет получить истинное время пребывания только в идеальном случае, когда все частицы в потоке имеют одинаковую скорость и, следовательно, одинаковое время пребывания в реакционной зоне. В общем случае рассчитанное таким образом время пребывания является средней величиной ср. то уравнение позволяет получить истинное время пребывания только в идеальном случае, когда все частицы в потоке имеют одинаковую скорость и, следовательно, одинаковое время пребывания в реакционной зоне. В общем случае рассчитанное таким образом время пребывания является средней величиной ср.Для каталитических процессов рассчитывают время соприкосновения исходных веществ с катализатором. Его называют временем контактирования. Время контактирования находят из отношения свободного объема катализатора Vсв к расходу исходных веществ Vt,p, проходящих через катализатор при условиях процесса. Свободный объем катализатора - это объем пустот между зернами и в сетках катализатора. Свободный объем Vсв рассчитывают как произведение объема катализатора Vk на долю свободного объема : Долю свободного объема катализатора называют также порозностью. При расчете времени контактирования во взвешенном слое катализатора свободный объем находят как разность между объемом, занимаемым катализатором во взвешенном состоянии, Vвзв, и объемом твердых частиц катализатора Vk(1-): Если катализатор выполняется в виде сетки, его свободный объем рассчитывают по формуле: где - доля свободного объема катализатора, m - число сеток, S - рабочая площадь сетки, м2, d - диаметр нити сетки, м, 3 - числовой коэффициент, учитывающий увеличение толщины сетки при переплетении нитей. где d - диаметр нити сетки, см; n - число плетений сетки на 1 см2. В качестве примера рассмотрим расчет времени контактирования реагентов для синтеза дивинила. Исходные данные: В реактор поступает 40 г/ч 95%-го (масс.) этанола. Температура в реакторе 400ОС, давление - 740 мм рт.ст. Объем катализатора 60 мл, доля свободного объема катализатора - 0,6. где V1,t,p и V2,t,p - расходы паров этанола и воды, поступающих в реактор при условиях процесса, м3/с. Таким образом, Окончательно, 1.3.2. Объемная скорость. Кроме времени пребывания исходных веществ в реакционной зоне для оценки условий проведения процесса рассчитывают объемную скорость. Объемная скорость W - это объем исходных веществ, поступающих в реакционный аппарат в единицу времени в фазовом состоянии, соответствующем условиям проведения процесса (для газофазных процессов – в газообразном состоянии), отнесенный к единице реакционного объема. Для нахождения объемной скорости расход исходных веществ берут как при условиях проведения процесса (температуре и давлении в реакторе), так и при нормальных условиях (условная объемная скорость): или где V- объем реактора. Объемная скорость и время пребывания исходных веществ в реакционной зоне связаны соотношением В каталитических процессах вместо реакционного объема в расчете объемной скорости используют объем катализатора Vk: или с учетом 1.35 где - доля свободного объема катализатора, - время контактирования Аналогично рассчитывают условную объемную скорость | ||||||||||||||||||||||||||||||||||||||||||||||||

