ыва. Практикум по ОХТ[155]. Основы химической технологии
 Скачать 5.15 Mb. Скачать 5.15 Mb.
|
|
Раздел 2 Технология неорганических веществ 2.1. Каталитическое окисление аммиака 2.1.1. Цель работы. Знакомство с основными закономерностями и обоснованием выбора условий реализации сложного, необратимого, каталитического, гетерогенного процесса и расчет основных технологических показателей. 2.1.2. Введение В настоящее время практически единственным промышленным способом получения азотной кислоты является контактное окисление аммиака кислородом воздуха с последующим поглощением полученных оксидов водой. Стадия окисления аммиака во многом, определяет показатели всего производства азотной кислоты: от условий и качества ее проведения зависят расходные коэффициенты по аммиаку, платиновым металлам, энергии, т.е. основные показатели, влияющие на экономику процесса. Процесс окисления аммиака - сложный и может с одинаковой вероятностью протекать как с образованием оксида азота (II), так и молекулярного азота и оксида азота (I). В этом случае определяющими факторами являются активность и селективность используемого катализатора и оптимизация технологических условий процесса. 2.1.3. Теоретические основы процесса Химия процесса и равновесие. Окисление аммиака кислородом воздуха до оксида азота (II) является первой стадией процесса получения азотной кислоты. Наряду с основной реакцией окисления аммиака до оксида азота (II) (2.1.1)(здесь и далее приведены тепловые эффекты реакции): 4NH3 + 5O2 = 4NO + 6H2O 946 кДж/моль (2.1.1) происходит окисление аммиака до элементарного азота и оксида азота (I): 4NH3 + 3O2 = 2N2 + 6H2O 1328 кДж/моль (2.1.2) 4NH3 + 4O2 = 2N2O + 6H2O 1156 кДж/моль (2.1.3) При определенных условиях возможна диссоциация аммиака 2NH3 = N2 + 3H2 – 91 кДж/моль (2.1.4) а также последовательные реакции, приводящие к образованию элементарного азота (2.1.5 и 2.1.6): 2NO = N2 + O2 180 кДж/моль (2.1.5) 4NH3 + 6NO = 5N2 + 6H2O 1810 кДж/моль (2.1.6) Таким образом, окисление аммиака - процесс сложный Константы равновесия реакций (2.1.1-2.1.3) характеризуются очень большими величинами (значительно больше 102) и, следовательно, все эти реакции необратимы. При этом наиболее вероятной с термодинамической точки зрения является реакция (2.1.2). При повышении температуры на 100С значения констант равновесия реакций (2.1.1 – 2.1.3) уменьшаются на несколько порядков, но, несмотря на это, даже при температуре 1000С эти экзотермические реакции остаются практически полностью смещёнными в сторону образования продуктов окисления. Реакция диссоциации аммиака (2.1.4) в интервале температур от -86 до 500°С обратима, при температурах выше 500°С она почти нацело смещена в сторону продуктов разложения аммиака. Например, при 800°С и 0.1 МПа равновесная концентрация аммиака составляет 0.011%, а при 1 МПа - 0.12 % объем. Таким образом, в широком диапазоне изменения температуры исходное вещество (аммиак) нацело превращается в конечные продукты. Поскольку окисление аммиака - процесс сложный, и кроме оксида азота (II) получаются побочные продукты: азот и оксид азота (I), то выбор условий проведения процесса определяется необходимостью направить взаимодействие исходных веществ по пути образования оксида азота (II). С учетом практической необратимости рассматриваемых реакций, этого можно достичь только путем создания условий, при которых скорость основной реакции будет значительно превышать скорости побочных реакций. И чем значительней будет эта разность скоростей, тем выше будет практический выход оксида азота (II). Кинетика процесса. Некаталитическое окисление аммиака до оксида азота (II) в газовой фазе не происходит даже при высоких температурах. Для реализации этой реакции необходим катализатор, активно адсорбирующий кислород. В промышленности чаше всего применяют платино-родиевые сплавы (кроме платины до 10% родия, палладия, рутения, осмия и др.) в виде сеток. Окисление аммиака на этом катализаторе протекает очень быстро, при времени контактирования порядка 10-4 с, а выход NO составляет примерно 98%. Неплатиновые катализаторы, состоящие из оксидов железа и хрома, дают выход оксида азота (II) около 96%, но скорость реакции примерно в 100 раз меньше. В промышленности часто используют комбинированный катализ с окислением вначале на платиновых сетках, а потом - на оксидном катализаторе. Скорость гетерогенного каталитического процесса зависит от величины поверхности катализатора. Для увеличения поверхности и сокращения диффузионного пути молекул платиновый катализатор изготавливают в виде сеток из тончайших нитей диаметром 0,09 мм. с числом ячеек 1024 на см2 (ГОСТ-31930-74). Окисление аммиака на платиновом катализаторе протекает в несколько стадий: 1) диффузия реагирующих веществ из газового объема к поверхности катализатора; 2) активированная адсорбция кислорода на активных центрах катализатора с образованием поверхностного комплекса (катализатор-кислород), из которого затем образуется новый комплекс (катализатор - кислород - аммиак); 3) стадии превращения последнего комплекса с образованием оксида азота (II) и воды; 4) десорбция продуктов реакции с поверхности катализатора (NO и H2O обладают небольшой адсорбционной способностью при температурах процесса и легко удаляются с поверхности); 5) диффузия продуктов реакции в газовый объем. Химические превращения на поверхности платинового катализатора протекают в течение миллионных долей секунды, между тем как необходимое время контактирования равно десятитысячной доле секунды. Очевидно, что наблюдаемая скорость каталитического окисления аммиака определяется скоростью диффузии реагирующих веществ из объема к поверхности катализатора. При отношении O2:NH3 ниже стехиометрического скорость процесса окисления аммиака определяется диффузией кислорода к поверхности платинового катализатора, а при избытке кислорода – скоростью диффузии аммиака. Механизм процесса окисления аммиака на поверхности катализатора схематично представлен на рис. 2.1.1. Оксид азота (II) образуется при взаимодействии молекул аммиака с кислородом, адсорбированным на активных центрах катализатора. Реакция окисления аммиака до азота по реакции (2.1.2) в отсутствие катализатора (окисление в объеме) протекает со скоростью значительно меньшей, чем каталитическое окисление NH3 до NO на платиновом катализаторе. Разложение аммиака на N2 и H2 (2.1.4) на том же катализаторе в отсутствие кислорода протекает со скоростью, сравнимой со скоростью окисления аммиака до NO. Но в присутствии избытка кислорода скорость разложения аммиака на азот и водород мала даже при температурах около 1000°С. Реакции (2.1.2) и (2.1.4) ускоряются на активных центров катализатора, свободных от кислорода, а также при соприкосновении аммиачно-воздушной смеси с разогретыми трубопроводами и стенками аппаратов. Каталитическое воздействие стенок трубопроводов и аппаратов начинается при температурах около 200оС и с повышением температуры возрастает. Поэтому для предотвращения образования азота в предкатализаторной зоне контактные аппараты, теплообменники и трубопроводы изготавливают из сплавов алюминия, никеля, хромоникелевых сплавов. Скорость диссоциации NO при температурах ниже 1000°С в отсутствие катализатора очень мала: в условиях окисления аммиака диссоциация N0 ускоряется, но все же константа скорости диссоциации NO в 180 раз меньше константы скорости окисления NH3 в NO, так как вероятность адсорбции NO в присутствии избытка кислорода очень мала. Скорость образования N2O в условиях получения оксида азота (II) незначительна, так как выход оксида азота (I) составляет всего 0,005 - 0,009% на аммиак. Из рассмотрения кинетики реакций ясно, что доля поверхности катализатора, занятая химически адсорбированным кислородом, определяет соотношение количеств NO и N2, получаемых на катализаторе. Для повышения селективности катализатора необходимо обеспечивать наибольшее насыщение катализатора кислородом. Степень занятости активных центров катализатора кислородом в значительной степени зависит от температуры и концентрации кислорода в поступающей газовой смеси. Связывание кислорода с поверхностью катализатора в зависимости от температуры может происходить как за счет физической адсорбции, так и за счет хемосорбционных процессов. Физическая адсорбция и хемосорбция - процессы экзотермические, а значит, равновесное содержание сорбированного на катализаторе кислорода уменьшается с повышением температуры (рис.2.1.2). Физическая адсорбция даже при низких температурах протекает достаточно быстро и поэтому до значения t1 кривая представляет собой фактически равновесную кривую физической адсорбции газа. При t1 одновременно с физической адсорбцией протекает с небольшой скоростью и хемосорбция. С повышением температуры скорость хемосорбции возрастает, и при температуре t2 количество адсорбированного газа приближается к равновесному. При дальнейшем повышении температуры происходит разрыв связей между адсорбированным газом и активными центрами катализатора, что приводит к резкому снижению количества адсорбированного вещества. Это снижение обусловлено тем, что наряду с возрастанием константы скорости сорбции с повышением температуры начинает сказываться смещение равновесия в сторону десорбции. Скорость десорбции растет быстрее, чем скорость сорбции. Таким образом, практическая кривая адсорбции имеет минимум и максимум. 2.1.4. Выбор оптимального технологического режима. Выбор оптимальных условий для сложного необратимого каталитического процесса сводится к созданию такого технологического режима, который обеспечивал бы высокую скорость основной реакции. 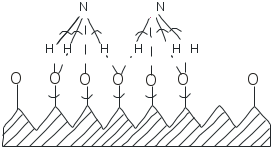 Рис.2.1.1. Схема окисления аммиака кислородом на поверхности платинового катализатора: 1 – старые связи, 2 – вновь образовавшиеся связи, 3 – место разрыва связей. 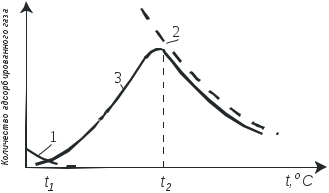 Рис.2.1.2. Зависимость количества адсорбированного газа от температуры. 1 – равновесная кривая физической адсорбции, 2 и 3 – равновесная и практическая кривые хемосорбции Это в первую очередь определяется правильным подбором катализатора и условий, обеспечивающих его высокую селективность и активность. Температура. На платиновом катализаторе с изменением температуры практический выход оксида азота (II) изменяется по кривой с максимумом (рис.2.1.3). Такой характер кривой определяется влиянием температуры на возможность протекания побочных реакций и на их скорость. При низких температурах, примерно до 500°С, когда количество адсорбированного кислорода сравнительно невелико, окисление аммиака протекает в основном с образованием элементарного азота (2.1.2), некоторого количества оксида азота (II) и, возможно, оксида азота (I). 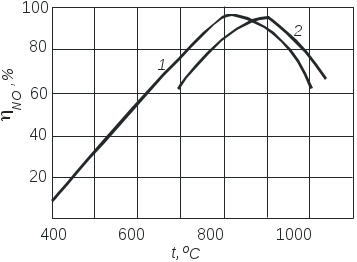 Рис.2.1.3. Зависимость практического выхода оксида азота (II) от температуры при разных давлениях : 1 – 0,1 МПа, 2 – 0,8 МПа С повышением температуры до 700-800°С выход NO возрастает, так как увеличивается доля активных центров катализатора, занятых кислородом (кривая 3, рис.2.1.2) и растет скорость диффузии исходных веществ к поверхности катализатора. При дальнейшем повышении температуры происходит десорбция кислорода, и резко возрастают скорости побочных каталитических реакций и реакций, протекающих в объеме. В результате снижается выход оксида азота (II) и возрастает выход элементарного азота. При выборе температуры окисления аммиака необходимо учитывать другой фактор, влияющий на экономические показатели процесса - потери дорогостоящей платины, которые возрастают с повышением температуры. Температура должна быть тем выше, чем больше примесей содержится в аммиачно-воздушной смеси. Необходимый температурный режим в реакторе может быть обеспечен теплом, выделяющимся при реакциях окисления аммиака. Состав исходной смеси. Для обеспечения высокого выхода оксида азота (II) необходимо проводить процесс при избытке кислорода (рис 2.1.4). При стехиометрическом отношении кислорода к аммиаку (см. реакцию (2.1.1)), равном 1,25, часть активных центров катализатора не заполняется кислородом, что способствует реакциям разложения аммиака, окисления его до N2 и, возможно, до N2O. В промышленности объемное отношение поддерживается в пределах 1,7-1,9 Повышение отношения кислорода к аммиаку свыше двух незначительно сказывается на выходе оксида азота (II), но приводит к снижению концентрации оксида азота (II) в нитрозных газах за счет введения воздуха, что отрицательно сказывается на работе абсорбционного отделения. При использовании неплатиновых катализаторов отношение кислорода к аммиаку должно быть более двух. Аммиачно-воздушные смеси способны взрываться, причем с повышением температуры газовой смеси границы взрываемости аммиачно-воздушных смесей расширяются и взрыв происходит при более низкой концентрации аммиака. Например, при температуре 250°С предел взрываемости аммиачно-воздушной смеси находится при содержании аммиака в смеси от 14 до 30% объем., а при температуре 450оС - от 12,3 до 33,9% объем. Практически применяемые аммиачно-воздушные смеси при концентрации в них аммиака 9.5-11,8% объем. не взрывоопасны. 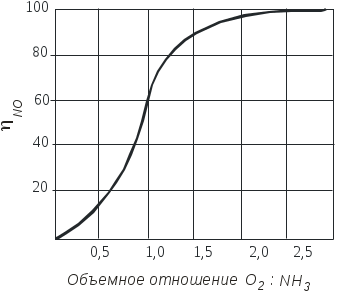 Рис.2.1.4. Зависимость практического выхода оксида азота (II) от объемного отношения кислорода к аммиаку Давление. Давление в процессе окисления аммиака связано с температурой. Чем выше давление, тем требуется более высокая температура для достижения одного и того же выхода оксида азота (II) (рис.2.1.3). С повышением давления затрудняется процесс десорбции продуктов каталитического окисления с поверхности катализатора в объём. Для компенсации этого необходимо повышать температуру процесса. Рекомендуются следующие сочетания температуры и давления:
Проведение процесса окисления аммиака под давлением имеет ряд преимуществ: повышается скорость процесса, увеличивается интенсивность катализатора, значительно возрастает скорость последующих стадий в производстве азотной кислоты: реакции 2NO+O2=2N02 и абсорбции нитрозных газов водой. Повышение давления имеет большое значение для работы агрегатов большой единичной мощности. Однако с повышением давления увеличиваются потери платины. Потери платины из-за летучести образующихся на ее поверхности оксидов и ее эрозии составляют при 900-950С и 0,8 МПа 250-400 мг на 1 т 100 % HNO3 . Часть платины осаждается на стенках коммуникаций и может быть собрана и регенерирована (до 50-70 % Pt). Потери платины могут быть уменьшены за счет добавок других металлов 8-ой группы (Pd, Rh, Ru). Время контактирования(рис.2.1.5). Реакция окисления аммиака происходит во внешнедиффузионной области, и поэтому увеличение объемной скорости оказывает положительное влияние на интенсивность процесса. С повышением, до определенного предела, объемной скорости поток газовой смеси становится более турбулентным, что увеличивает скорость диффузии исходных веществ к поверхности катализатора. Наряду с этим уменьшается время соприкосновения газовой смеси с горячими стенками аппаратов, что снижает возможность окисления аммиака до азота. При дальнейшем росте объемной скорости (уменьшении времени контактирования В заводских условиях в зависимости от качества катализатора и точности соблюдения заданного технологического режима достигается значительная селективность процесса, и выход оксида азота (II) составляет 92- 98%. При оптимальных условиях проведения процесса и правильном подборе конструкционных материалов побочные реакции (2.1.3), (2.1.5), (2.1.6) не имеют существенного значения. 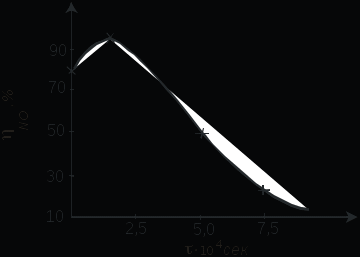 Рис.2.1.5. Зависимость практического выхода оксида азота(II) от времени контактирования 2.1.5. Схема лабораторной установки Схема представлена на рис 2.1.6. Газообразный аммиак из баллона 1 через ротаметр 2 поступает в смеситель 3. Ротаметр 2 не калиброван и является лишь индикаторным прибором, регистрирующим заданный расход аммиака (h мм). Расход аммиака регулируется вентилем А. Воздух подается с помощью воздуходувки 4, очищается от масла в фильтре 5, заполненном стеклянной ватой, затем поступает в смеситель 3. Расход воздуха замеряется ротаметром 6 и регулируется вентилем Б. Аммиачно-воздушная смесь поступает в верхнюю часть контактного аппарата 7 и проходит через комбинированный катализатор (одну платиновую сетку и слой оксидного катализатора). Полученные нитрозные газы по нижней трубке направляют на нейтрализацию. Контактный аппарат состоит из трех частей: верхнего стального конуса, футерованного алюминием; средней цилиндрической части и нижнего конуса, изготовленного из хромоникелевой стали. С целью снижения потерь тепла аппарат снаружи покрыт теплоизоляцией. Между фланцами верхнего конуса и цилиндрической частью зажат фланец катализаторной корзины 8 для таблеток неплатинового катализатора. Над корзиной укреплена платиновая сетка. Для измерения температуры в зоне катализатора в качестве датчика используют термопару 9. В верхний конус контактного аппарата вмонтирована платиновая спираль 10, которая разогревается электрическим током от сети через ЛАТР: сила тока контролируется амперметром. Аппарат имеет смотровое стекло 11 для наблюдения за разогреванием катализатора. Трубка с краном В служит для отбора аммиачно-воздушной смеси, поступающей в контактный аппарат, трубка с краном Г - для отбора нитрозных газов. Трубка с краном Д необходима для слива слабой азотной кислоты, образующейся при частичной конденсации влажных нитрозных газов. 2.1.6. Порядок проведения опыта 1. Подготовка колб для отбора газовых проб. 1.1 Круглодонные колбы с пришлифованными пробками должны быть вымыты. Горловины колб и шлифы очищают от остатков смазки фильтровальной бумагой, наносят на шлиф пробки и горловину вакуумную смазку и тщательно притирают (шлифы после смазки и притирания должны быть совершенно прозрачными). 1.2. В колбу, предназначенную для анализа аммиачно-воздушной смеси, наливают из бюретки 25 мл 0.1 н раствора серной кислоты и 3 капли индикатора метилового красного. В другую колбу, предназначенную для анализа нитрозных газов, наливают 25 мл 0,1 н раствора гидроксида натрия и добавляют три капли того же индикатора. Затем пробки на колбах вновь притирают. 1.3. Колбы помещают поочередно в защитное устройство из металлической сетки и откачивают воздух вакуумным насосом до момента закипания жидкости. После этого поворачивают пробку так, чтобы отверстие в ней не совпадало с отверстием в горлышке колбы. 1.4. Взвешивают колбы на электронных весах. 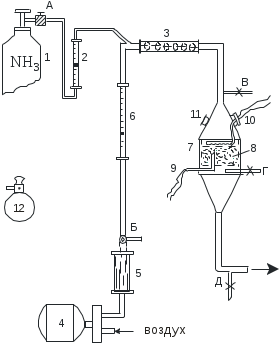 Рис.2.1.6. Схема лабораторной установки для окисления аммиака. 1 – баллон; 2,6 – ротаметры; 3 – смеситель; 4 – воздуходувка; 5 – фильтр; 7 – контактный аппарат: 8 – катализаторная корзина; 9 – термопара; 10 – спираль; 11 – смотровое окно; 12 – колба для отбора пробы газа 2. Техника проведения эксперимента. 2.1. Включают воздуходувку 4 и устанавливают вентилем Б заданный расход воздуха. 2.2. Осторожно поворачивая вентиль А, устанавливают заданный расход аммиака. Во избежание получения взрывчатой смеси содержание аммиака в аммиачно-воздушной смеси не должно превышать 11% объем. (не более 40 дел.) 2.3. Для начала реакции необходимо разогреть катализатор, для чего включают платиновую спираль 10. 2.4. При достижении в контактном аппарате температуры 300°С выключают ток, проходящий через спираль. В дальнейшем температура в контактном аппарате будет поддерживаться за счет тепла выделяющегося при реакции. После установления постоянной температуры в контактном аппарате отбирают пробы аммиачно-воздушной смеси и смеси нитрозных газов. Эта операция выполняется двумя студентами следующим образом: 1. Проводят отдувку нитрозных газов для чего открывают кран Г и в течение нескольких секунд выпускают газ в выхлопную линию. 2. Присоединяют подготовленную колбу с кислотой к газоотборной трубке с краном В, а со щелочью к газоотборной трубке с краном Г. 3. Открывают краны В и Г. 4. Осторожно поворачивают пробки так, чтобы отверстия на них близко подошли к отросткам на горловинах колб. 5. Одновременно по счету «раз» дополнительным поворотом пробок обеспечивают поступление газа в колбы. 6. Через 3-4 с поворачивают пробки в первоначальное положение, прекращая, таким образом, доступ газа в колбы, перекрывают краны В и Г и отсоединяют колбы. 7. Прекращают подачу аммиака, затем после полного охлаждения контактного аппарата выключают воздуходувку. 8. Определяют концентрации аммиака в аммиачно-воздушной смеси и оксида азота (II) в нитрозных газах (см. 6. Контроль процесса). Если нужно провести опыт при других условиях, то изменяют расход воздуха или аммиака и вновь отбирают пробы газовых смесей на анализ после установления постоянной температуры в реакторе. Экспериментальные и расчетные данные записывают по прилагаемой форме. |
