ыва. Практикум по ОХТ[155]. Основы химической технологии
 Скачать 5.15 Mb. Скачать 5.15 Mb.
|
Состав электролитаВ качестве электролита при электрохимическом получении гидроксида натрия используют раствор, содержащий 300-310 г/л хлорида натрия (близкий к насыщению), что позволяет поддерживать высокую электропроводность раствора, низкое напряжение на электролизной ванне и тем самым уменьшать расход электроэнергии. Кроме того, при высокой концентрации хлорид-ионов снижается перенапряжение выделения хлора и возрастает скорость его выделения на аноде, а вероятность выделения кислорода (табл. 2.2.1) существенно уменьшается. Высокая концентрация хлорида натрия в электролите способствует понижению растворимости хлора в анолите. Концентрация гидроксида натрия в католите определяет затраты энергии на стадии упаривания при получении товарного продукта. Поэтому при электролизе стремятся получить раствор католита с высокой концентрацией щелочи. Однако при увеличении ее концентрации в католите возрастает вероятность попадания гидроксид-ионов в анодное пространство за счет диффузии, их превращения и снижения выхода по току. Оптимальная конечная концентрация гидроксида натрия в католите при диафрагменном процессе составляет 110-135 г/л. Температура В промышленных ваннах процесс электролиза проводят при температурах 80-90ОС. Это дает возможность снизить растворимость хлора в 5-8 раз, увеличить электропроводность электролита, снизить перенапряжение выделения водорода и хлора, тем самым увеличить скорость процесса электролиза и уменьшить расход электроэнергии. Плотность тока Плотность тока (i) в электрохимических процессах играет важнейшую роль, поскольку скорость процесса пропорциональна величине i. Так как, плотность тока (i) равна отношению силы тока (I) к площади электрода (S): а из уравнения (2.2.16) следует то : и, соответственно: Таким образом, если площадь электрода постоянна, то скорость процесса (Gпр /) пропорциональна плотности тока. В этой связи для достижения высокой производительности электролизеров стремятся работать при высоких плотностях тока. Кроме того, использование высокой анодной плотности тока (2000 А/м2 и более), уменьшает расход тока на побочный электродный процесс, связанный с выделением кислорода (табл. 2.2.1, реакция 2) и предотвращает разрушение графитового анода по реакции (2.2.12). При повышении плотности тока скорость выделения кислорода понижается, что связано с преимущественным ростом его перенапряжения по сравнению с ростом перенапряжения для хлора. Материал электродов Материал электродов должен обладать хорошей электропроводностью, химической стойкостью в агрессивных средах, доступностью и обеспечивать наименьшее перенапряжение при выделении хлора (анод) и водорода (катод). Минимальным перенапряжением при выделении водорода обладают платина и палладий, но эти металлы дороги и дефицитны. Из доступных металлов небольшим перенапряжением выделения водорода характеризуются железо, никель и титан. Поэтому при диафрагменном процессе получения гидроксида натрия катоды изготавливают из наиболее дешевой и достаточно устойчивой в щелочной среде стальной (сталь-3) сетки, укрепленной на каркасе. Катоды имеют сложную форму и большую поверхность. При этом сохраняется постоянное минимальное расстояние между катодом и анодом. Увеличение расстояния между электродами на 1 мм повышает напряжение на ванне на 0,1 В, существенно увеличивая расход электроэнергии. Аноды выполняют из специальных высокоплотных сортов графита в виде прямоугольных стержней толщиной 50 мм. Основным недостатком графитовых анодов является их относительно быстрое (10-16 месяцев) разрушение. При этом изменяется межэлектродное расстояние и растет напряжение на ванне. В последние годы графитовые аноды заменяют на малоизнашивающиеся (срок службы 4-6 лет), титановые аноды, покрытые смесью оксидов титана и рутения (электроды ОРТА). Аноды изготавливают из титановой проволоки или перфорированного листа. Толщина оксидного покрытия составляет около 0,1 мм. Такие аноды имеют перенапряжение выделения хлора в 8-10 раз меньше, чем графитовые. На них практически не происходит разряд гидроксид-ионов. Наличие перфорации способствует быстрому удалению хлора из межэлектродного пространства, что снижает электрическое сопротивление электролита за счет уменьшения газонаполнения. Кроме того, малая толщина анодов позволяет увеличить их число при тех же габаритах электролизера и тем самым повысить нагрузку, а значит и производительность в 2-3 раза. Применение электродов ОРТА существенно снижает общее напряжение на ванне и расход электроэнергии на 15-20%. Диафрагма Для уменьшения скорости побочных процессов необходимо, в частности, исключить возможность смешения анолита и католита, попадания ионов гидроксила в анодное пространство за счет конвекционных потоков и диффузии. Это достигается применением фильтрующей диафрагмы, разделяющей анодное и катодное пространство, и созданием гидравлического противотока, обеспечивающего непрерывное движение электролита через диафрагму от анода к катоду (навстречу движению ионов гидроксила ) со скоростью равной или несколько большей, чем скорость переноса указанных ионов. Диафрагма должна быть механически прочной, химически стойкой к действию кислот, щелочей и окислителей, иметь одинаковую и равномерную по всей площади толщину, плотность, протекаемость, быть достаточно дешевой и доступной и т.д. Материалом, удовлетворяющим всем этим требованиям, является асбестовое волокно определенных сортов. Диафрагму наносят на сетчатый железный катод путем просасывания через его поверхность пульпы (10-15 г/л асбестового волокна в растворе, содержащем 220-240 г/л хлорида натрия и 60-80 г/л гидроксида натрия) и сушат. Формирование структуры диафрагмы происходит в процессе работы электролизера. В последние годы асбестовые диафрагмы армируют термопластами для снижения набухаемости и увеличения прочности. Существенную роль в процессе электролиза играет протекаемость диафрагмы, т.е. количество электролита, протекающее в единицу времени через единицу поверхности диафрагмы. Принципиально возможны три режима работы диафрагмы: скорость движения анолита через диафрагму равна скорости движения гидроксид-ионов к аноду. При этом режиме получаются высокие выходы по току (98%) и достаточно концентрированная электролитическая щелочь (120-140 г/л). Этот режим используют в промышленности; скорость движения анолита больше скорости движения гидроксид-ионов. В этом случае содержание гидроксида натрия снижается. Кроме того, «кислый» анолит будет проникать в катодное пространство и при взаимодействии с гидроксидом натрия образовывать гипохлорит натрия, что уменьшает выход по току; скорость движения анолита меньше скорости движения гидроксид-ионов, щелочь будет получаться более высокой концентрации, чем при первом режиме, но выход по току будет меньше за счёт расхода гидроксида натрия на взаимодействие с соляной и хлорноватистой кислотами в анодном пространстве. При содержании гидроксида натрия свыше 150 г/л выход по току начинает резко падать, так как поток анолита не может сдерживать движущиеся в анодное пространство гидроксид-ионы. Для обеспечения постоянной протекаемости диафрагмы во времени необходимо применять растворы хлорида натрия, свободные от ионов кальция и магния, так как последние образуют карбонаты и гидроксиды, забивающие поры диафрагмы. Поэтому в производстве растворы хлорида натрия перед электролизом подвергаются тщательной очистке. 2.2.5. Экспериментальная часть Схема лабораторной установки Схема установки для электролиза водного раствора хлорида натрия представлена на рис. 2.2.1 и состоит из выпрямителя 8, электролизера 1, выполненного из органического стекла, имеющего в верхней крышке дозатор электролита 5 и патрубок для отвода анодных газов, а в нижней части патрубок для вывода католита и водорода. Католит собирают в мерный цилиндр 4. Электролизер состоит из трех частей: цилиндрического корпуса из оргстекла, в нижней части которого имеется фланец для крепления к днищу; объемного днища конической формы со спиральной кольцевой выемкой для крепления катода; крышки из оргстекла. Катод 3 изготовлен из железной сетки. Перед сборкой на железную сетку наносят диафрагму из асбестовой массы. Анод 2 изготовлен из графита в форме диска. Диск укреплен на графитовом стержне. Исходные данныеДата..................................………………………………………………………... Температура в лаборатории....................................................................ОС Барометрическое давление.........................................................мм рт. ст. Концентрация хлорида натрия в электролите.......310...г/л ( 26 масс. %) Плотность электролита..................................................................1,2 г/см3 Размеры анода: диаметр(d).....................................................................................8 см высота(h) ..................................................................................1,5 см Рабочая поверхность анода, SA.............................................................см2 Анодная плотность тока, iA....................................................................А/м2 Теоретическая масса гидроксида натрия(GT) (за 10 мин).....................г Нормальность (эквивалентная концентрация) серной кислоты для титрования ( 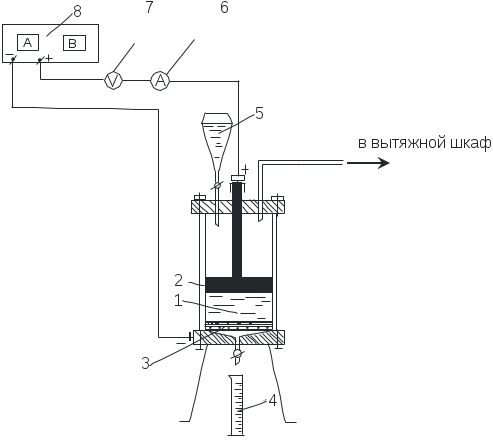 Рис. 2.2.1. Схема установки электролиза водного раствора хлорида натрия. Предварительные расчеты По заданной силе тока рассчитывают: 1) теоретическую массу гидроксида натрия, которая должна образоваться за 10 мин (время отбора пробы) по формуле (2.2.16); 2) анодную плотность тока: где SA – поверхность графитового анодного диска, соприкасающегося с электролитом, которую определяют как сумму поверхностей основания (S1 = ( d2)/4) и части боковой (S2 = d h*, где h* - глубина погружения анода в электролит, т.е. SA = S1 + S2 (м2). (2.2.31) Глубина погружения анодного диска в условиях лабораторной установки составляет примерно 1,5 см, если боковая сторона анодного диска полностью погружена в электролит. Порядок выполнения работы 1. Перед началом работы необходимо ознакомиться с инструкцией и правилами техники безопасности, вывешенными над установкой. 2. Заливают электролит (водный раствор, содержащий 310 г/л хлорида натрия) в дозатор (5) и через него заполняют электролизер (1) таким образом, чтобы уровень электролита покрывал расчетную поверхность анода. С помощью капельной воронки периодически во время опыта добавляют необходимый объем электролита в электролизер для поддержания постоянного уровня. 3. Подключают электролизер, устанавливают по амперметру (6) силу тока, которую необходимо поддерживать строго постоянной в течение всего опыта. Напряжение отмечают по вольтметру (7). 4. Открывают кран слива католита и собирают вытекающий католит в химический стакан. 5. В начале опыта определяют протекаемость диафрагмы. Для этого заменяют стакан мерным цилиндром и измеряют (c точностью 0,1 мл) объем католита, вытекающего за 10 мин (последовательно три пробы католита) (табл.2.2.2). При постоянстве расхода католита определяют выход по току по гидроксиду натрия, для чего через каждые последующие 10 мин отбирают еще 4 пробы католита, каждую из которых количественно переносят в колбу для титрования, определяют концентрацию щелочи титрометрическим методом и рассчитывают выход по току (см. Контроль процесса). Таблица 2.2.2 Экспериментальные данные
Контроль процесса Определение концентрации щелочи в католите. Пробу католита, количественно переносят из мерного цилиндра в коническую колбу для титрования, разбавляют в 2-3 раза дистиллированной водой и добавляют 2-3 мл. 3%-ного раствора пероксида водорода для разрушения гипохлорит- и хлорат ионов. Через 2-3 мин. в раствор вносят 2-4 капли индикатора – метилового оранжевого и титруют раствором серной кислоты до изменения окраски индикатора (от желтой до светло оранжевой). Практическую массу щелочи, полученной при электролизе(Gпр.NaOH .), рассчитывают по формуле: где Массовую концентрацию щелочи в католите (г/л) (СNaOH) рассчитывают по формуле: где Vкат – объем пробы католита, мл. Расчет материального баланса Материальный баланс процесса электролиза рассчитывают для времени электролиза, заданного преподавателем. 1. В связи с техническими сложностями измерения объема подаваемого электролита и анализа всех продуктов при расчёте материального баланса делаем следующие допущения: Учитываем две реакции – получения гидроксида натрия (2.2.1) и гипохлорита натрия (2.2.8). Процессами образования хлората натрия, кислорода и др. пренебрегаем. Объем вытекающего католита принимаем равным объему введенного электролита, плотность электролита принимаем равной =1,2 г/см3. При таких допущениях выход по току по водороду ( 2. Последовательность расчета материального баланса а) Объем католита Vкат в литрах определяют экспериментально б) Определяют массу введенного электролита, рассчитывают количество введенных хлорида натрия G0NaCl и воды G0 H2О, исходя из концентрации насыщенного раствора хлорида натрия при 20С – 26,3 масс.%. в) Зная силу тока и время электролиза, по уравнениям (2.2.16) и (2.2.18 – 2.2.20) рассчитывают теоретические массы продуктов электролиза: GTNaOH ,GTCl2 GTH2; г) Учитывая значения выходов по току, полученные по уравнению (2.2.15), рассчитываем практические массы полученных продуктов: GпрNaOH, GпрCl2 и Gпрн2; д) По основному уравнению материального баланса (2.2.1) с учетом теоретических масс продуктов рассчитываем массу хлорида натрия и воды, затраченные на образование всех продуктов электролиза (Gизр.NaCl и Gизр.H2О ); е) Масса гидроксида натрия, пошедшая на побочные реакции (2.2.10), является разностью между теоретической и практической массой гидроксида натрия; ж) По уравнению (2.2.10), учитывая массу гидроксида натрия, пошедшего на побочную реакцию, рассчитываем массу образовавшихся хлорида и гипохлорита натрия, а также воды: GпобNaCl, GпобNaClO и Gпоб H2О; з) Масса воды в католите (G H2О) определяется как разность между массой воды, введенной с электролитом, и массой воды, пошедшей на основную реакцию: Gост H2О = G0 H2О - Gизр.H2О Вода, унесенная с хлором и водородом, не учитывается Таблица 2.2.3 Материальный баланс процесса электролиза Базис ………..
Расчет технологических показателейНа основании экспериментальных данных (№№ проб указывает преподаватель) рассчитывают по формулам (2.2.15), (2.2.23), (2.2.25), (2.2.27) выход по току по гидроксиду натрия (Э), удельный расход электроэнергии (Wуд.), коэффициент использования энергии (N), степень превращения хлорида натрия (X) после расчета материального баланса. Результаты расчетов заносятся в табл. 2.2.4. Таблица 2.2.4 Технологические показатели процесса электролиза
2.2.6. Задание 1. Определить постоянство протекаемости электролита через диафрагму 2. Провести электролиз раствора хлорида натрия с заданной силой тока с записью всех экспериментальных данных по прилагаемой форме. 3. Провести анализ электролитической щелочи (3-4 пробы). 4. Составить приближенный материальный баланс процесса электролиза (табл. 2.2.3). 4. По полученным данным рассчитать технологические показатели электролиза для 2-3 проб (по указанию преподавателя) и результаты свести в табл. 2.2.4. 2.2.5.Техника безопасности 1. Не прикасаться руками к клеммам выпрямителя. 2. Включать ток только после заполнения электролизера необходимым объемом электролита. 3. Выполнять работу на установке, смонтированной в вытяжном шкафу с хорошей вытяжкой. 4. В случае появления признаков отравления хлором, вывести пострадавшего на свежий воздух, дать молоко и обеспечить медицинскую помощь. 5. Вблизи включенного электролизера запрещается работать с открытым огнем (на катоде выделяется водород). Библиографический список 1. Скорчеллетти В.В. Теоретическая электрохимия. – Л.:Химия, 1974, 568 с. 2. Якименко Л.М. Производство водорода, кислорода, хлора и щелочей. – М.: Химия, 1981. – 280 с. 3. Файнштейн С.Я. Производство хлора методом диафрагменного электролиза. – М.: Химия, 1984. – 304 с. 4. Кубасов В.Л., Банников В.В. Электрохимическая технология неорганических веществ. – М.: Химия, 1989. – 288 с. 2.3. Контактное окисление оксида серы (IV). 2.3.1. Цель работы. Ознакомить с закономерностями простого, обратимого, экзотермического, гетерогенно-каталитического процесса окисления SO2 в SO3 на ванадиевом катализаторе, который является основной стадией производства серной кислоты; провести характерные для этого процесса технологические расчеты. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

