ыва. Практикум по ОХТ[155]. Основы химической технологии
 Скачать 5.15 Mb. Скачать 5.15 Mb.
|
2.3.10. Задание1. Провести опыт при заданных преподавателем условиях и записать экспериментальные данные в соответствующие таблицы. 2. Рассчитать степень превращения оксида серы (IV) в оксид серы (VI). 3. Построить графические зависимости от температуры равновесной (табл. 2.3.1) и практической степени превращения оксида серы (IV). 4. Рассчитать материальный баланс и основные технологические показатели процесса. Приложение Определение степени превращения SO2 в SO3 (степени контактирования) При расчете точной степени превращения SO2 в SO3 необходимо учитывать изменение числа молей при протекании реакции. Если содержание SO2 в газовой смеси до и после контактирования в мольных долях равно соответственно а и b, а степень превращения х, то число молей SO3, образовавшегося из 1 моля газовой смеси, поступающей на контактирование, равно ах, а число молей непрореагировавшего SO2 а(1-х). При этом в соответствии со стехиометрией реакции число молей прореагировавшего кислорода составит Следовательно мольная доля SO2 в газовой смеси после контактирования 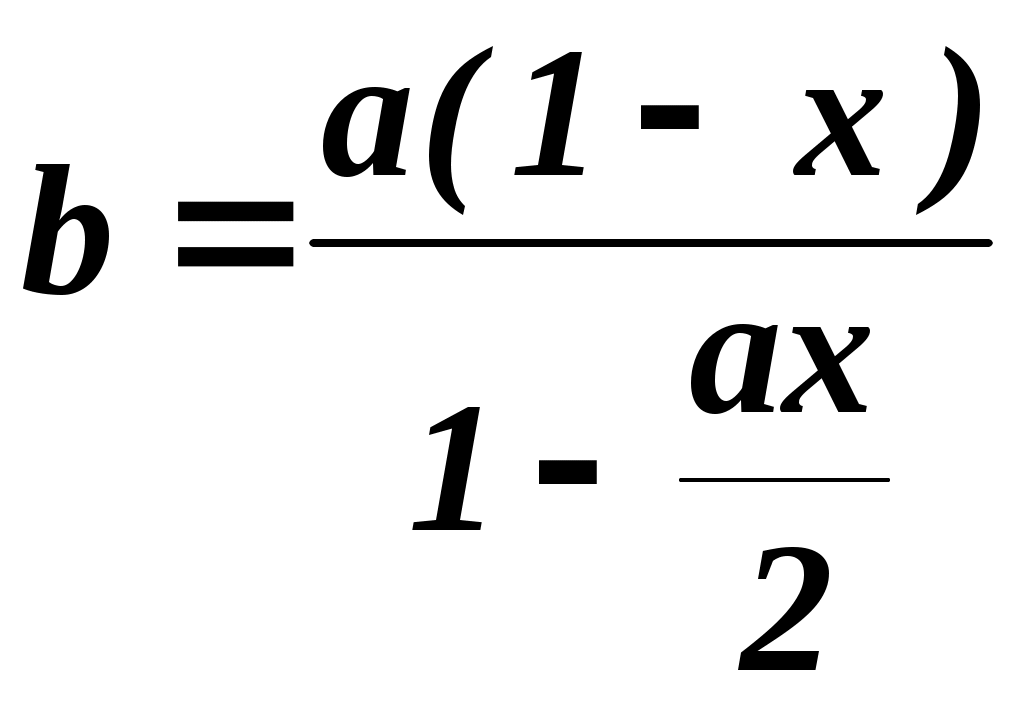 (2.3.7) (2.3.7)Из уравнения 2.3.7 выразим степень превращения SO2 (в долях единицы) 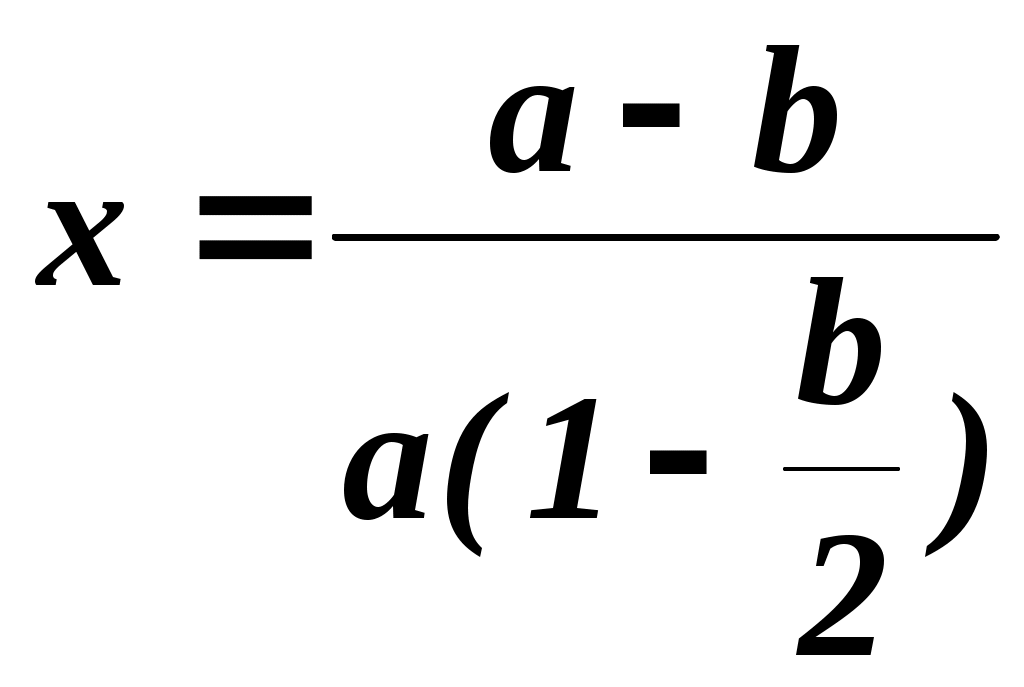 (2.3.8) (2.3.8) Поскольку в реальных условиях исходная концентрация SO2 не превышает 10%, величина изменения числа молей Выбор той или иной формулы для расчета определяется методом анализа: для хроматографического метода – удобнее уравнение 2.3.8, для йодометрического – уравнение 2.3.11. При расчете степени превращения на основе экспериментально полученных результатов по количеству вытекающей воды при анализе газовой смеси после контактирования процент SO2 определяется не по отношению ко всей газовой смеси, а к газовой смеси без SO3. Тогда условное содержание SO2 в газе после контактирования B΄: 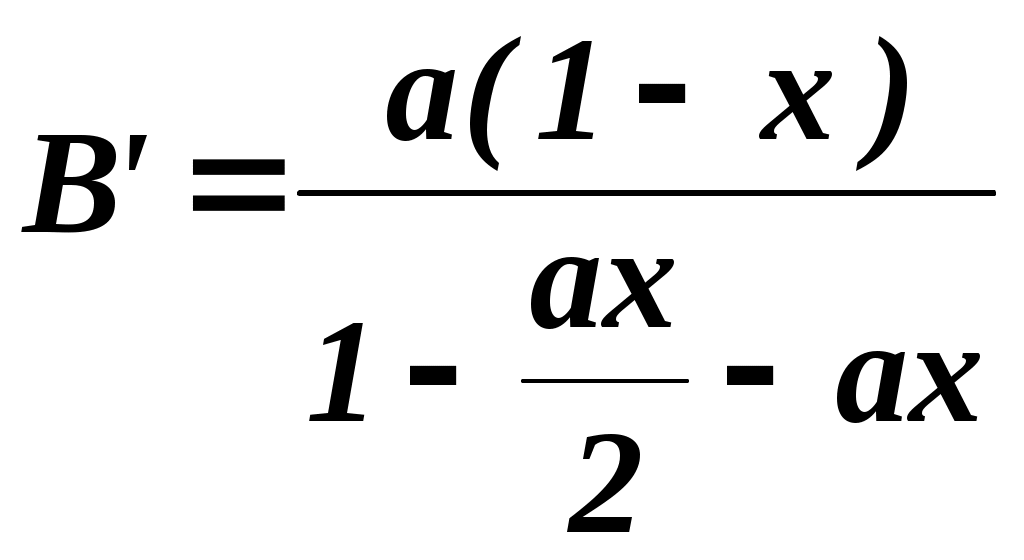 , (2.3.10) , (2.3.10)где ах- мольная доля SO3 в газе после контактирования. Тогда 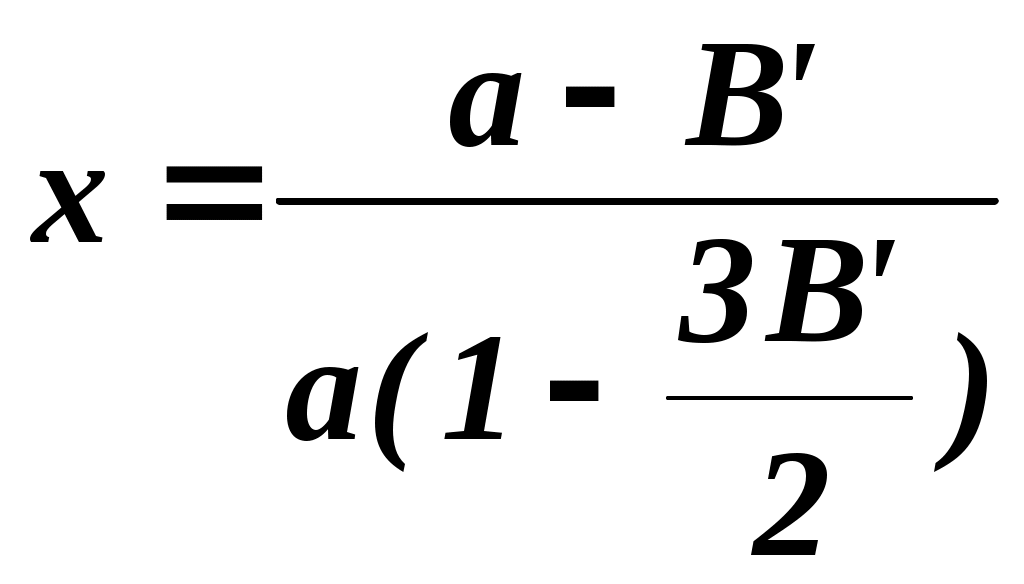 (2.3.11) (2.3.11)Библиографический список 1. Васильев В.Т., Отвагина М.И. Технология серной кислоты. М.: Химия. 1985.- 385 с. 2. Кутепов А.М. и др. Общая химическая технология. Учебник для вузов.3-е изд. – М.: ИКЦ «Академкнига», 2003.– 528 с. 3. Кутепов А.М. и др. Общая химическая технология. Учебник для технических вузов. 2-е изд. – М.: Высшая школа, 1990-520 с. Раздел 3 Технология органических веществ 3.1. Получение метаналя (формальдегида) окислительным дегидрированием метанола 3.1.1. Цель работы Ознакомить с основными закономерностями гетерогенного каталитического процесса, включающего параллельные и последовательные побочные реакции, с рациональным проведением высокотемпературного процесса. 3.1.2. Введение Формальдегид (метаналь) CH2O представляет собой бесцветный газ с острым раздражающим запахом (tконд=19ОС при атмосферном давлении). Формальдегид хорошо растворяется в воде, спирте, эфире, легко полимеризуется и конденсируется. Промышленность выпускает формальдегид в форме формалина - 37% масс. водного раствора. В нем формальдегид присутствует в виде гидрата CH2OH2O и низкомолекулярных полимеров (полиоксиметиленгликолей): nCH2O + H2O = H-(OCH2)n-OH, где n<8. Во избежание более глубокой полимеризации и выпадения осадка к формалину добавляют 7-12% масс. метанола в качестве стабилизатора. Формальдегид является одним из наиболее крупнотоннажных продуктов органического синтеза. Ежегодно в мире производится около 7 млн.т. Его применяют для производства пластических масс (феноло-, карбамидо-, и меламино-формальдегидных полимеров, полиформальдегидов), изопрена и на его основе полиизопренового каучука, лекарственных препаратов (уротропина), взрывчатых веществ (пентрита) и т.д. В промышленности формальдегид получают из метанола окислительным дегидрированием на металлических катализаторах (600 – 720о) или окислением избытком воздуха на молибдате железа при 250 – 400о. Первый способ преобладает. 3.1.3. Теоретические основы процесса. Химия процесса. Формальдегид при катализе металлами образуется по двум реакциям: мягким окислением и дегидрированием метанола (указаны величины тепловых эффектов): CH3OH + 0,5O2 CH2O + H2O 147,4 кДж/моль (3.1.1) CH3OH CH2O + H2 - 93,4 кДж/моль (3.1.2) Наряду с основными протекают побочные реакции: CH3OH + 1,5O2 CO2 + 2H2O 575 кДж/моль, (3.1.3) CH2O + 0,5O2 HCOOH 270,4 кДж/моль, (3.1.4) HCOOH + 0,5O2 CO2 + H2O 14,5 кДж/моль, (3.1.5) CH2О CO + H2 1,9 кДж/моль, (3.1.6) 2CO CO2 + C 172 кДж/моль (3.1.7) Следовательно, синтез формальдегида относится к сложным процессам. Равновесие основных реакций.На рис. 3.1.1 приведена зависимость равновесного выхода * формальдегида от температуры для реакции окисления и дегидрирования. Равновесие экзотермической реакции окисления (3.1.1) в широком диапазоне температур полностью смещено в правую сторону, * 100%, т.е. реакция (3.1..1) необратима. Равновесие эндотермической реакции дегидрирования (3.1.2), согласно принципу Ле Шателье, при повышении температуры смещается вправо, равновесный выход растет и достигает практически 100% при температуре > 700ОС (*627оС=96,5%; *727оС=98,9%). Кинетика процесса. Метанол может превращаться по различным направлениям: (3.1.1), (3.1.2), (3.1.3). Проведение процесса при высокой температуре приводит к значительному ускорению реакции глубокого окисления метанола до оксида углерода (IV) (3.1.3), так как энергия активации этой реакции больше энергии активации основных реакций превращения метанола в формальдегид. Для ускорения основных реакций (3.1.1), (3.1.2) необходимо проводить процесс с участием избирательно действующего катализатора. В качестве катализатора можно использовать металлы IБ подгруппы Периодической системы элементов: Ag, Au, Cu. Промышленным катализатором является серебро, ибо оно проявляет наиболее высокою селективность. 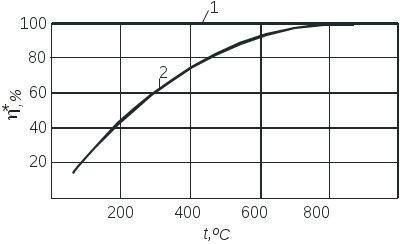 Рис. 3.1.1. Зависимость равновесных выходов формальдегида от температуры: 1 - по реакции окисления, 2 - по реакции дегидрирования. Механизм химических взаимодействий на серебряном катализаторе включает в себя ряд последовательных превращений. Метанол не адсорбируется на серебре в отсутствие кислорода. Кислород, адсорбируясь на серебряном катализаторе, образует с серебром различные поверхностные соединения. Эти соединения являются действительными катализаторами протекающих процессов. Считается, что реакции (3.1.1) и (3.1.2) катализируют соединения, в которых кислород связан относительно прочно, а побочные процессы глубокого окисления метанола связаны с наличием на поверхности соединений с непрочно связанным кислородом. Доля последних возрастает при избытке кислорода в системе. В результате изучения взаимодействия метанола и кислорода с медными и серебряными катализаторами был предложен следующий механизм реакции: СН3ОН(газ) + О(адс) СН3О(адс) + ОН(адс) СН3ОН(газ) + ОН(адс) СН3О(адс) + Н2О(адс) СН3О(адс) СНОН(адс) + Н(адс) 2Н(адс) Н2(газ) Н2О(адс) Н2О (газ) СНОН(адс) СН2О (газ) Из этого механизма следует, что реакции дегидрирования и окисления сопряжены между собой и протекают с участием одних и тех же кислородных центров на поверхности катализатора. В процессах, протекающих в гетерофазных системах, в частности, в гетерогенно-каталитических процессах, к которым относится синтез формальдегида, важную роль играют массообменные процессы. Эти процессы включают несколько последовательных стадий: 1) диффузия газообразных (или жидких) реагентов из потока через пограничный газовый (или жидкий) слой к внешней поверхности катализатора (внешняя диффузия); 2) внутренняя диффузия газообразных (или жидких) реагентов в порах твердого вещества катализатора к внутренней поверхности; 3) химическая реакция на поверхности; 4) внутренняя диффузия газообразных (или жидких) продуктов реакции в обратном направлении; 5) внешняя диффузия газообразных (или жидких) продуктов через пограничный слой в поток. В зависимости от соотношения скоростей этих стадий гетерогенные процессы могут протекать в диффузионной, переходной или кинетической области. В качестве примера рассмотрим некий гетерогенно-каталитический процесс с участием газообразного реагента. Выражения для скоростей внешней (через пограничный газовый слой толщиной у поверхности катализатора) и внутренней (в порах к внутренней поверхности катализатора) диффузии запишем по закону Фика уравнениями (3.1.8) и (3.1.9), соответственно. Внешняя диффузия Внутренняя диффузия Скорость химического превращения на поверхности катализатора пропорциональна концентрации реагента (3.1.10). где CU, CF, CS - концентрации газообразного реагента в объеме потока, у внешней поверхности и у внутренней поверхности катализатора, соответственно. - коэффициент массоотдачи (=D/, D - коэффициент диффузии, - толщина газового слоя); k - константа скорости химической реакции; ' - коэффициент массоотдачи в твердой фазе (' =Dэф/Rз , Dэф - эффективный коэффициент диффузии, Rз – радиус зерна катализатора). Поскольку концентрации у внешней и внутренней поверхности катализатора трудно измерить и они, как правило, неизвестны, выразим скорость реакции в стационарном режиме (скорости всех последовательных стадий, перечисленных выше, равны между собой) через известную концентрацию реагента в объеме. Приравняв скорости внешней, внутренней диффузии и химической реакции (r = rU = rF) и проведя простые преобразования для исключения неизвестных концентраций CF и CS, получим (3.1.11).  где r - скорость гетерогенного процесса; kнабл - эффективная константа скорости гетерогенного процесса; 1/k, 1/, 1' - сопротивления химической реакции, внешней и внутренней диффузии. Если сопротивление на одной из стадий значительно превышает сопротивление двух других стадий, то эффективная константа скорости с достаточно хорошим приближением будет равна константе скорости этой стадии. Эта стадия называется лимитирующей (или скорость определяющей) и характеризуется следующими особенностями: - обладает максимальным сопротивлением и, следовательно, минимальным коэффициентом интенсивности в уравнении скорости (k, или '); - на лимитирующей стадии происходит максимально возможное изменение концентрации газообразного реагента от CU до нуля (для необратимых реакций) или от CUдо CU* (для обратимых реакций); - скорость гетерогенного процесса может быть рассчитана как скорость лимитирующей стадии. Гетерогенные процессы протекают в кинетической области, если велика скорость массообмена и относительно мала скорость химической реакции. Для кинетической области характерно сильное влияние температуры на скорость процесса (энергия активации достаточно велика и составляет 40-280 кДж/моль). Это обычно бывает при низких температурах и давлениях, больших скоростях газового потока и при высокой пористости или отсутствии слоя “золы” (для процессов с участием твердых реагентов, например, различные виды обжига и выщелачивания). При этом >> k, ' >> k и r k CU(для реакций первого порядка). Для интенсификации процесса необходимо повышать температуру и концентрации (парциальные давления) реагентов. Если скорость процесса массопереноса из потока к поверхности значительно меньше скорости химической реакции и внутренней диффузии, то процесс протекает во внешней диффузионной области. Величина энергии активации составляет 8-20 кДж/моль. При этом << k, << '. Для интенсификации процессов, протекающих во внешнедиффузионной области, необходимо увеличивать скорость потока, концентрацию реагента в потоке CU, а также проводить процесс при интенсивном перемешивании. Если выполняются условия ’ << k, ' << , процесс лимитируется внутридиффузионным торможением. Увеличение скорости внутренней диффузии возможно, главным образом, за счет уменьшения размера зерна катализатора (или частиц твердого реагента, участвующего в процессе). В переходной области наблюдается примерно одинаковое влияние кинетики химической реакции и процессов массопереноса на скорость гетерогенного процесса, а коэффициенты интенсивности k, и ' и, соответственно, сопротивления на каждой стадии соизмеримы по величине. Как следует из экспериментальных данных, образование формальдегида на серебряном катализаторе при линейной скорости газового потока W 2 м/сек и температурах ниже 300ОС протекает в кинетической области, при 300-500ОС - в переходной и выше 500ОС - во внешнедиффузионной области. 3.1.4. Выбор оптимального технологического режима. Синтез формальдегида осложнен побочными реакциями, среди которых велика роль последовательных превращений формальдегида: (3.1.4), (3.1.6). Для получения высокого выхода формальдегида необходимо создать такие условия, которые обеспечивают большую скорость основных реакций (3.1.1), (3.1.2) и сводят к минимуму скорость побочных. Катализатор. В промышленности используют серебряные катализаторы, так как на золотых и медных катализаторах интенсивнее, чем на серебряных, идут реакции глубокого окисления метанола до муравьиной кислоты и оксида углерода (IV). Серебро применяют в виде сеток, гранул и, чаще всего, нанесенным на различные носители. Количество нанесенного серебра составляет обычно 20-40% от массы катализатора и зависит от природы носителя и способа приготовления катализатора. Носители должны обладать достаточной механической и термической прочностью, а также химической инертностью. Наличие мелких пор (большая удельная поверхность) затрудняет отвод формальдегида с поверхности катализатора и способствует последовательным превращениям СН2О. Поэтому наиболее эффективными являются носители с крупными порами (10-70 мкм) и малой удельной поверхностью (0,01- 4 м2/г). В настоящее время в качестве носителей используется природная пемза, корунд, алюмосиликаты (размер пор не менее 15 мкм, удельная поверхность не более 4 м2/г). Температура. Степень превращения метанола с повышением температуры увеличивается (рис. 3.1.2), так как растут скорости основных и побочных реакций. Как видно из рис.3.1.2, до температуры 600-650ОС выход целевого продукта растет. Происходит это вследствие того, что скорость реакций образования формальдегида увеличивается с повышением температуры значительней, чем скорость побочных реакций. При температуре 600-700ОС выход формальдегида достигает максимального значения. 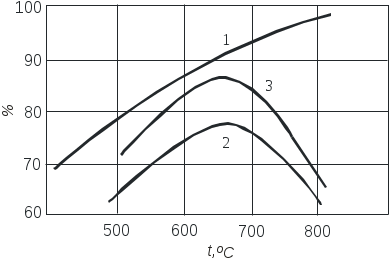 Рис.3.1.2 Зависимость степени превращения спирта Х, выхода формальдегида на метанол и селективности образования СН2О на метанол от температуры процесса: 1 - Х, 2 - , 3 - В этом температурном интервале серебряный катализатор избирательно ускоряет основные реакции. Причем в пределах температурного интервала работы катализатора с ростом температуры увеличивается доля формальдегида, образующегося по реакции дегидрирования (3.1.2). При дальнейшем повышении температуры выход формальдегида уменьшается. Объясняется это тем, что значительная часть поступающего кислорода начинает расходоваться на глубокое окисление метилового спирта до оксида углерода (IV) по реакции (3.1.3), с возрастающей скоростью идет окисление и распад образовавшегося формальдегида по реакциям (3.1.4), (3.1.6). Такое резкое снижение селективности процесса приводит к уменьшению выхода формальдегида. Следовательно, оптимальный температурный режим процесса - 600-700ОС. Окислительное дегидрирование метанола в формальдегид в промышленности осуществляют в адиабатических реакторах, где совмещается экзотермическая реакция окисления метанола с эндотермической реакцией дегидрирования. В этом состоит одно из основных преимуществ рассматриваемого процесса. Состав реакционной смеси. Превращение метанола в формальдегид проводят кислородом воздуха. При выборе соотношения между кислородом и метанолом учитывают, что часть формальдегида образуется по реакции дегидрирования без затраты кислорода. Поэтому количество кислорода, рассчитанное по реакции окисления на поступающий в процесс метанол, оказывается избыточным, что приводит к образованию продуктов глубокого окисления и чрезмерному увеличению температуры в реакционной зоне. Максимальный выход формальдегида достигается при соотношении O2:CH3OH 0,35:1. Следовательно, оптимальное соотношение кислорода и метанола составляет 70% от стехиометрического, рассчитанного по реакции (3.1.1). Для поддержания устойчивого температурного режима разбавляют спирто-воздушную смесь парами воды. Рекомендуется вводить 20-25% водяных паров от массы метанола. При таком соотношении содержание метанола в паро-воздушной смеси составляет 45% объем., что находится за верхним пределом взрываемости метанола в воздухе (34,7% объем.). При оптимальном соотношении кислорода и метанола (70% от стехиометрического) основное количество формальдегида образуется по реакции окисления, поэтому с некоторой долей приближения синтез формальдегида можно отнести к необратимым процессам. Время контактирования. Зависимость выхода формальдегида от времени контактирования представляет собой кривую с максимумом, что характерно для сложных процессов с последовательными побочными реакциями. Оптимальное время контактирования - 0,01 - 0,03 сек. При уменьшении времени контактирования ниже 0,01 сек падает степень превращения метанола, т.е. наблюдается его “проскок” через слой катализатора. При времени контакта, превышающем оптимальное, заметную роль начинают играть последовательные побочные реакции, главным образом распад формальдегида на оксид углерода(II) и водород по реакции (3.1.6). Для сохранения получившегося формальдегида проводят “закалку” образовавшейся парогазовой смеси, т.е. резко снижают ее температуру с 600-700ОС до 100ОС. Быстрое снижение температуры предотвращает распад формальдегида. “Закалка” продуктов реакции является эффективным способом повышения селективности процесса в тех случаях, когда процесс идет при высокой температуре и целевой продукт склонен к вторичным превращениям. В выбранных условиях процесс синтеза формальдегида можно классифицировать как сложный, необратимый, гетерогенный, каталитический процесс, идущий во внешнедиффузионной области. Выход формальдегида в оптимальных условиях достигает 70-80% при селективности 85-90%. Средний состав газообразных продуктов реакции после охлаждения и поглощения формальдегида (в % объем.): 75 N2,10-20 H2, 3-5 CO2, 0,5-1,5 CO и до 0,4 O2. |
