ыва. Практикум по ОХТ[155]. Основы химической технологии
 Скачать 5.15 Mb. Скачать 5.15 Mb.
|
Объем спирта, поступившего в реактор……………………….…... млб) Масса этанола с колбой и пробкой после опыта………………………………………………. г до опыта………………………………………..…………..г Масса спирта, поступившего в реактор……………………………….... г Для установок с дозатором – пункт – «а»), с капельной воронкой – пункт - «б»). Масса склянки Тищенко до опыта..........................................................................................г после опыта.....................................................................................г Масса альдегида и эфира.......................................................................г Масса конденсата с колбой и пробкой...................................................г Масса колбы с пробкой.......................................................................... г Масса конденсата....................................................................................г Масса углеводородов с делительной воронкой....................................г Масса делительной воронки.................................................................. г Масса углеводородов..............................................................................г Масса спирто-водного конденсата.........................................................г Контроль процесса Детальный качественный и количественный анализ контактного газа достаточно сложен и поэтому определяют только основные компоненты, используя метод газоадсорбционной хроматографии. Описание техники анализа и приемы расчета хроматограммы даны в Приложении. Результаты хроматографического анализа заносят в табл.3.2.2. Таблица 3.2.1. Экспериментальные результаты опыта.
Общее количество газа за время опыта (при температуре и давлении в лаборатории)………………………..л Общее количество газа за время опыта, пересчитанное к н.у…( VГн.у. )……………………………………………л Таблица 3.2.2. Данные хроматографического анализа контактного газа
3.2.7. Расчет материального баланса реактора На основании полученных данных рассчитывают приближенный баланс синтеза 1,3-бутадиена, так как составление точного материального баланса для процесса, в котором получается кроме основного несколько десятков побочных продуктов, весьма затруднено. Ниже приводится форма записи материального баланса реактора (табл.3.2.3). Базис расчета задается преподавателем. Массу введенного сырья рассчитывают по разности масс водного раствора спирта до и после опыта. По заданному составу исходного водного спирта находят массы введенных спирта и воды. Объем каждого компонента газовой смеси, образовавшейся при контактировании, подсчитывают, умножая общий объем газа, приведенный к нормальным условиям, на содержание данного компонента газовой смеси в объемных процентах. Массу каждого компонента определяют по его объему и плотности. Последнюю находят, взяв отношение соответствующей молекулярной массы к молекулярному объему газа. Общее количество жидких продуктов складывается из масс конденсата, собранного в приемнике 4, и эфиров и альдегидов, задержанных в склянке Тищенко 6. Массу непрореагировавшего этилового спирта определяют как разность между массой спирто-водного конденсата (без углеводородов) и массой воды, реакционной и введенной со спиртом. Таблица 3.2.3. Материальный баланс реактора синтеза бутадиена. Базис расчета.............................
Массу реакционной воды рассчитывают по основной реакции (3.2.1) и побочным реакциям (3.2.6), (3.2.8), (3.2.9): 2С2Н5ОНС4Н8 + 2Н2О , (3.2.8) 3С2Н5ОН2С3Н6 + 3Н2О (3.2.9) или по формуле (СС4Н6 + СС4Н8 + 0,5СС2Н4 + 0,75 СС3Н6) VГн.у. 2МН2О  mН2О = , mН2О = ,100 22,4 где СС4Н6 , СС4Н8 , СС2Н4 , СС3Н6 - концентрации дивинила и алкенов в газе, % объем.; VГн.у. - объем полученного контактного газа при н.у., л; МН2О - молекулярная масса воды. Невязку баланса определяют как разность между массами введенных и полученных веществ. На основании данных материального баланса рассчитывают технологические критерии процесса. 3.2.8. Задание 1. Провести процесс получения дивинила при заданных преподавателем условиях с записями всех данных по прилагаемой форме. 2. По хроматограмме контактного газа рассчитать состав газовой смеси в объемных процентах. 3. Составить приближенный материальный баланс реактора синтеза дивинила на заданный преподавателем базис. 4. Рассчитать технологические критерии процесса: степень превращения спирта, выход дивинила на этанол, селективность процесса по 1,3-бутадиену на этанол, интенсивность работы катализатора, расходные коэффициенты на 1,3-бутадиен по этанолу (практический и стехиометрический). 5. Рассчитать время контактирования . 6. На основании технологических показателей дать оценку качества проведения ХТП. Библиографический список Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. - М.: Химия, 1988. – 592 Соколов Р.С. Химическая технология: Учебное пособие для студ. высш. учеб. заведений в 2-х томах. Т.2- М.: Гуманит. Изд. Центр. Владос, 2000.- 448с. 3.3. Получение низкомолекулярных алкенов пиролизом фракций нефти. 3.3.1 Цель работы. Ознакомить студентов с основными закономерностями химических превращений углеводородов под действием высоких температур, с приемами проведения и исследования термических процессов на примере пиролиза фракций нефти. 3.3.2. Введение Этилен и пропилен – наиболее крупнотоннажные мономеры, на основе которых промышленность органического синтеза производит продукты полимеризации (полиэтилен, полипропилен), гидратации (этиловый, изопропиловый спирты), хлорирования (дихлорэтан, винилхлорид), окисления (уксусный альдегид, оксиды этилена, пропилена, акролеин, акриловая кислота). В настоящее время основным способом получения этих алкенов является пиролиз (высокотемпературный крекинг) углеводородов. Пиролизу подвергают фракции прямой перегонки нефти, состоящие из алканов, циклоалканов и аренов, природные и попутные нефтяные газы, содержащие алканы. 3.3.3. Теоретические основы процесса Термодинамика процесса. При температурах пиролиза (700-850оС) наиболее значительную часть химических превращений составляет термический распад углеводородов; одновременно идут также реакции синтеза: полимеризация, конденсация, гидрирование, алкилирование. При оценке возможных термических превращений важную роль играет термодинамическая стабильность углеводородов сырья, а также получающихся в процессе алкенов. Как известно, термодинамическая стабильность соединений и направление их взаимных превращений определяются изменением энергии Гиббса. На рис. 3.3.1. приведена температурная зависимость изменения энергии Гиббса ∆Gо при образовании углеводородов из простых веществ. Изменение энергии Гиббса при взаимном превращении углеводородов может быть определено для данной температуры как разность ординат точек на соответствующих кривых. Система всегда стремится перейти в состояние, характеризующееся наименьшим значением энергии Гиббса, поэтому из рис. 3.3.1 следует, что при 500 К реакция превращения н-гексана в бензол термодинамически не разрешена (∆Gо бензола - ∆Gо н-гексана >0) и возможна при 900 К (∆Gо бензола - ∆Gо н-гексана <0) . Как видно из рис. 3.3.1 при температурах пиролиза термодинамическая стабильность углеводородов разных классов с одинаковым числом углеводородных атомов в молекуле понижается в следующем ряду: арены >алкены>цикланы>алканы. Таким образом, в процессе пиролиза термодинамически более вероятно образование аренов и алкенов. Качественно оценить влияние температуры и давления на термодинамическую вероятность того или иного превращения можно исходя из принципа Ле Шателье. Повышение температуры способствует протеканию эндотермических реакций распада и дегидрирования, повышение давления – протеканию реакций гидрирования, алкилирования, полимеризации, идущих с уменьшением объема. 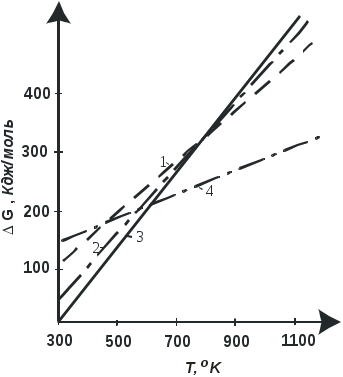 Рис. 3.3.1. Зависимость изменения энергии Гиббса GO при образовании углеводородов из простых веществ от температуры: 1 - гексен, 2 - циклогексан, 3 – н-гексан, 4 - бензол. Кинетика процесса.Для осуществления той или иной реакции мало создать условия, обеспечивающие термодинамическую возможность и благоприятное положение равновесия. Необходимо, чтобы реакция протекала с приемлемой для технологических целей скоростью. Энергии активации реакций пиролиза достаточно велики. Они находятся в пределах 200-280 кДж/моль. Следовательно, изменение температуры оказывает значительное влияние на скорость реакций пиролиза. Преобладающим типом первичных превращений углеводородов является их распад (разрыв связей С-С и С-Н, образование кратных связей). Константы скорости реакций распада представляют собой с достаточной степенью приближения функцию количества энергии, которую необходимо затратить для разрыва (диссоциации) определенного типа связи, т.е. являются функцией энергии связи. Анализ значений энергий связей показывает, что при температурах пиролиза с наибольшей скоростью распадаются алканы, значительно медленнее арены (табл. 3.3.1) Алкены и циклоалканы занимают промежуточное положение. Таблица 3.3.1Усредненные энергии связей
Как известно, влияние давления на скорость газофазных реакций зависит от кинетических порядков в уравнении для скорости реакции по парциальным давлениям реагентов (кинетический порядок – это показатель степени давления данного реагента в кинетическом уравнении). Скорость реакции конденсации описывается уравнением приблизительно второго порядка, тогда как реакции распада – первого порядка по давлению исходных углеводородов. Поэтому понижение давления уменьшает отношение скорости реакции конденсации к скорости реакции распада для каждого углеводорода, участвующего в процессе. Механизм превращения углеводородов в процессе пиролиза Алканы. При температурах пиролиза с большими скоростями протекают реакции распада, в результате которых образуются низкомолекулярные алкены и алканы: C5H12 C2H6 + C3H6 Последние (этан, пропан) – дегидрируются. Распад и дегидрирование алканов осуществляются по радикально-цепному механизму, включающему стадии инициирования, продолжения и обрыва цепи. 1. Термическое и фотохимическое инициирование цепи происходит как гомолитическое расщепление одной из связей С-С с образованием двух радикалов, например: С8Н18 С2Н5 + С6Н13 2. Продолжение цепи. Низкомолекулярные очень реакционноспособны и передают цепь на большие молекулы С2Н5 + С8Н18 С2Н6 + С8Н17 Большие радикалы термически неустойчивы и обладают чрезвычайно малым временем жизни. Поэтому они претерпевают цепное расщепление по связи С-С, находящейся в β-положении к радикальному центру: С    Н3 --- СН2СН2 --- СН2СН2 --- СН2СНСН3 С3Н6 + 2С2Н4 + СН3 Н3 --- СН2СН2 --- СН2СН2 --- СН2СНСН3 С3Н6 + 2С2Н4 + СН3Описанный процесс определяет выход этилена при пиролизе алканов. 3. Обрыв цепной реакции происходит за счет рекомбинации или диспропорционирования низкомолекулярных радикалов, например: СН3 + С2Н5 С3Н8, СН3 + С2Н5 СН4 +С2Н4 Расщепление углеводородов протекает преимущественно по реакциям продолжения цепи, причем общая скорость расщепления исходного углеводорода может значительно (более чем в 10 раз) превышать скорость его расщепления по реакции инициирования. Поэтому состав и строение продуктов пиролиза почти целиком определяются реакциями продолжения цепи. Циклоалканы. Их превращения сводятся в основном к отрыву боковых цепей и распаду кольца с образованием алкенов 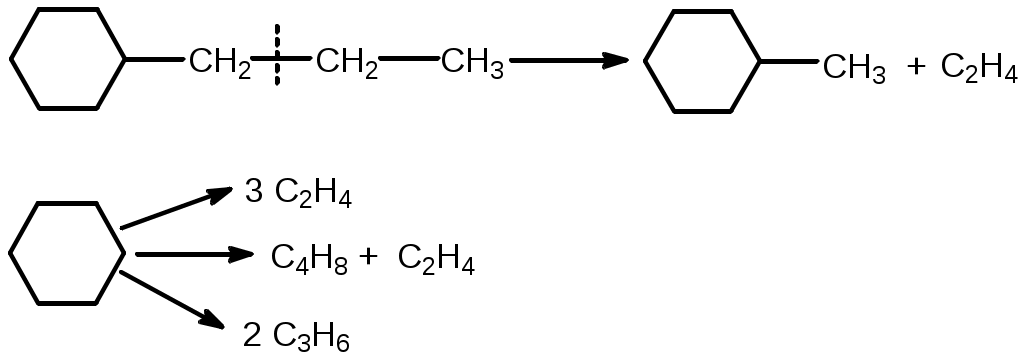 Разрыв кольца может приводить и к возникновению диеновых углеводородов и низкомолекулярных алканов: 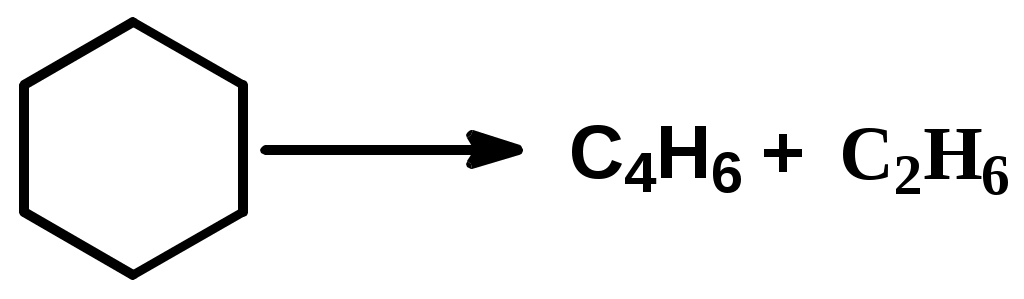 Все вышеуказанные превращения протекают по радикально-цепному механизму. В условиях пиролиза со значительно меньшими скоростями, чем реакции распада по связи С-С, из-за большей энергии связей С-Н идут реакции дегидрирования. В результате дегидрирования шестичленных циклоалканов получаются арены: 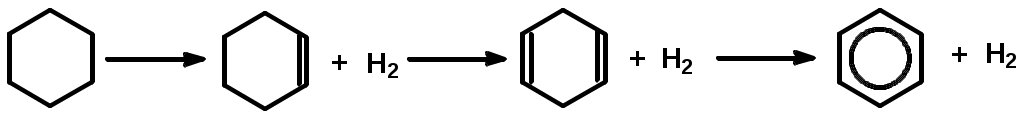 Арены. В процессе пиролиза реакции деалкилирования алкилароматических углеводородов идут по радикально-цепному механизму. Преимущественное место отрыва связи находится в β-положении от углерода кольца, поэтому при деалкилировании получаются главным образом метилзамещенные ароматические углеводороды: 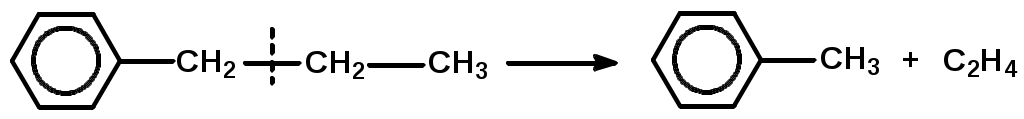 Ароматические кольца, в отличие от циклановых, при температурах пиролиза не распадаются, они «неуничтожимы». Их превращения сводятся к радикально-цепным реакциям дегидроконденсации с образованием полициклических углеводородов и водорода: 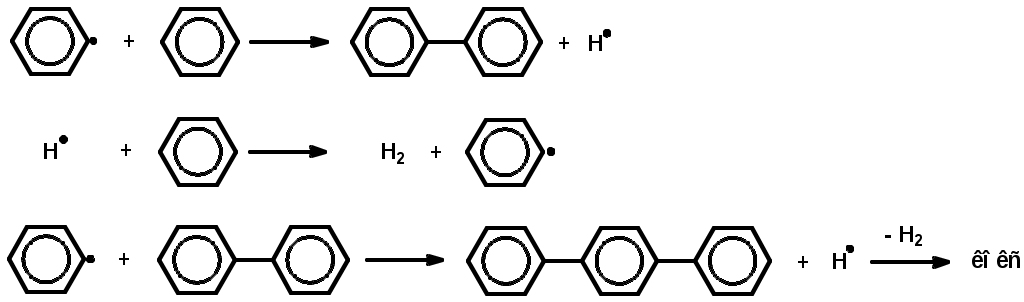 Вторичные реакции. С увеличением степени превращения парциальное давление исходных углеводородов понижается, а парциальное давление первичных продуктов пиролиза повышается вплоть до некоторого максимального значения, при котором скорость образования данного продукта равна скорости его дальнейшего превращения. При еще более высоких степенях конверсии скорости образования первичных продуктов становятся меньше скоростей их дальнейшего превращения, в результате чего концентрации первичных продуктов уменьшаются (см. ниже рис.3.3.3). Этилен обладает сравнительно большой термической устойчивостью, однако он может вступать во вторичные реакции диспропорционирования и конденсации: 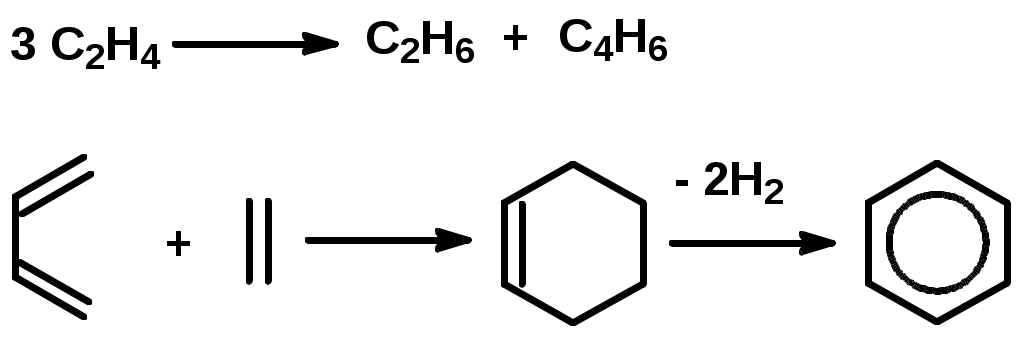 Более высокомолекулярные алкены подвергаются реакциям распада, дегидрирования и конденсации с образованием аренов. Реакции уплотнения алкенов, диенов и аренов приводят к образованию многоядерных аренов, которые претерпевают вторичные превращения, давая кокс. Из большого разнообразия химических превращений в качестве преобладающих при пиролизе могут быть выделены реакции распада, дегидрирования, дегидроконденсации и деалкилирования Продуктами пиролиза являются газообразные, жидкие и твердые вещества. Газ пиролиза содержит алкены, алканы, бутадиен и водород. Жидкие продукты – смола пиролиза – состоят главным образом из аренов и алкенов. Твердые продукты – кокс – продукты глубокой дегидроконденсации аренов, а также углерод, образующийся в результате распада углеводородов до элементарного углерода. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
