ыва. Практикум по ОХТ[155]. Основы химической технологии
 Скачать 5.15 Mb. Скачать 5.15 Mb.
|
Библиографический списокКараваев М.М., Засорин А.П., Клещев Н.Ф. Каталитическое окисление аммиака. -М.: Химия, 1983. -232 с. 2. Кутепов A.M.. Бондарева Т.И., Беренгартен М.Г. Общая химическая технология. - М.: ИКЦ “Академкнига” ., 2003. -528 с. 2.2. Электрохимическое получение гидроксида натрия, хлора и водорода диафрагменным методом 2.2.1. Цель работы. Знакомство студентов с основными закономерностями протекания электролиза в диафрагменной ванне непрерывного действия, особенностями расчета основных технологических показателей и составлением материального баланса электрохимического процесса. 2.2.2. ВведениеОсновным промышленным способом одновременного получения гидроксида натрия, хлора и водорода является электролиз водного раствора хлорида натрия. Существуют два параллельных производства гидроксида натрия: с использованием жидкого ртутного катода (амальгамный метод) и с твёрдым катодом (диафрагменный метод). Последний реализуется в проточных электролитических ваннах с фильтрующей диафрагмой, разделяющей анодное и катодное пространство. Электролит, находящийся в катодном пространстве называют католитом, в анодном – соответственно анолитом. Диафрагменный способ прост в аппаратурном оформлении, относительно дешев и не использует ртуть, пары которой опасны для здоровья человека. Однако, необходимо отметить, что гидроксид натрия, получаемый при использовании электролизёра диафрагменного типа, не обладает достаточной чистотой и не может быть использован, например, в производстве искусственного волокна или целлюлозы. 2.2.3. Теоретические основы процессаПроцесс электрохимического получения гидроксида натрия, хлора и водорода, как и любой другой химико-технологический процесс, может быть проанализирован с термодинамической и кинетической точки зрения. Электродные реакции и термодинамика процесса электролиза водного раствора хлорида натрия в диафрагменной ванне. Электролиз концентрированного раствора хлорида натрия можно охарактеризовать как сложный гетерогенный процесс, протекающий на границе раздела фаз: твердый электрод – жидкий электролит – газ. Процесс может быть описан суммарным уравнением: 2NaCl + 2Н2О = 2NaOH + H2 + Cl2 (2.2.1) электролит катодный анодный продукт продукт В реальных условиях получения гидроксида натрия в ванне диафрагменного типа протекают следующие основные электродные реакции: на катоде выделение водорода (процесс восстановления): К 2Н2О + 2е- = Н2 + 2ОН-, (2.2.2) на аноде - хлора (процесс окисления): А 2Cl- - 2e- = Cl2 (2.2.3) Вероятность протекания различных электродных реакций на катоде и аноде при проведении процесса в стандартных условиях (25ОС, Р = 1 атм., активность ионов равна 1) можно оценить на основании величины стандартного электродного потенциала (ЕО). На катоде в первую очередь протекают те процессы, стандартный электродный потенциал которых наиболее электроположителен, на аноде реализуются процессы с наиболее электроотрицательным значением ЕО. Стандартные потенциалы электродных реакций, протекание которых принципиально возможно при электролизе раствора хлорида натрия, приведены в табл. 2.2.1. Таблица 2.2.1. Электродные реакции и потенциалы разряда ионов
Анализируя данные табл. 2.2.1 можно сделать вывод, что при стандартных условиях (электрод Pt) на катоде наиболее вероятным является выделение водорода, а на аноде – кислорода в результате разрядки гидроксоаниона. Выделение металлического натрия из водного раствора на твердом электроде невозможно, поскольку эта реакция (табл. 2.2.1, реакция 3) имеет большой отрицательный потенциал. В кислой среде возможно совместное выделение хлора и кислорода, т.к. их потенциалы электродных реакций близки между собой. В условиях, отличных от стандартных, электродный потенциал называют равновесным (ЕP) и рассчитывают по уравнению Нернста: где ЕО – величина стандартного электродного потенциала, В; R – газовая постоянная, равная 8,315 Дж/моль∙K; Т – температура, К; n – число электронов, участвующих в электродной реакции; F – число Фарадея, равное 96500 кулонов (или 26,8 Ач) на моль; Второе слагаемое уравнения (2.2.4) учитывает отклонение от стандартных условий температуры и активности ионов. Равновесный потенциал электрода характеризует термодинамическое равновесие, которое устанавливается на электроде без протекания тока. Таким образом, термодинамический анализ электрохимических потенциалов можно осуществлять на основании величины равновесных электродных потенциалов. В случае выделения на катоде водорода (табл. 2.2.1, реакция 4) равновесный электродный потенциал равен: 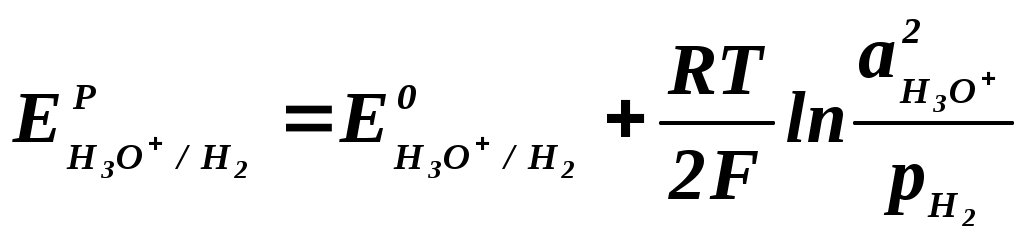 (2.2.5) (2.2.5)При выделении хлора на аноде (табл. 1, реакция 1): 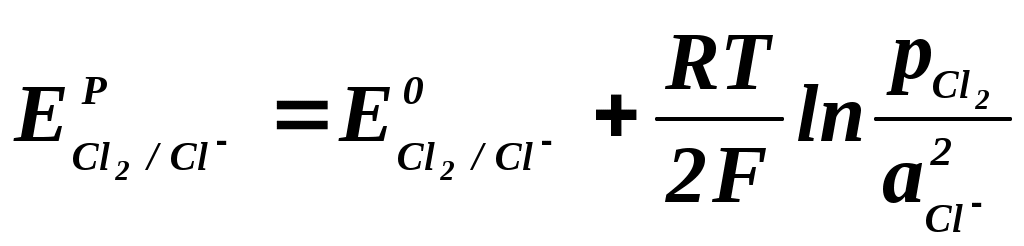 (2.2.6) (2.2.6)Из уравнений (2.2.5-2.2.6) следует, что равновесие электродных реакций, так же, как и в других ХТП, можно смещать в сторону исходных или конечных продуктов, изменяя температуру, активность ионов (Н3О+ или Cl-) исходных реагентов и парциальные давления ( Кроме того, практические, то есть реализующиеся в условиях электролиза потенциалы разряда ионов всегда выше, чем рассчитанные по уравнению Нернста. Практический потенциал (Е) отличается от равновесного на величину перенапряжения (см. Кинетику электродных процессов): где - потенциал перенапряжения, соответственно, на аноде или катоде. Таким образом, практический потенциал разряда иона равен алгебраической сумме величин равновесного потенциала и перенапряжения (потенциал анода становится более положительным, а потенциал катода – более отрицательным). Следует отметить, что в реальных условиях на одном и том же электроде могут протекать несколько параллельных электродных реакций. Так, при электролизе раствора хлорида натрия на аноде могут одновременно выделяться хлор и кислород. Как видно из табл. 2.2.1 согласно значениям равновесных потенциалов на аноде прежде всего должно происходить выделение кислорода (реакция 2), так как равновесный электродный потенциал данной реакции меньше, чем равновесный потенциал выделения хлора. Варьируя условия электролиза (температуру, концентрацию хлорид-анионов, материал анода) можно, меняя перенапряжение, ускорить процесс выделения хлора по сравнению с выделением кислорода, чего и добиваются в реальных условиях (практический потенциал выделения кислорода становится больше соответствующей величины для хлора). Одновременно с основной реакцией в объеме электролита и на электродах могут протекать вторичные побочные реакции. В анодном пространстве выделяющийся хлор может растворяться в электролите и взаимодействовать с водой, образуя соляную и слабо диссоциирующую хлорноватистую кислоты: Cl2 + H2O HCl + HClO (2.2.7) В случае проникновения гидроксид-ионов из катодного пространства в анодное образуются хорошо диссоциирующие хлорид и гипохлорит натрия: HClO + NaOH NaClO + H2O (2.2.8) HCl + NaOH = NaCl + H2O (2.2.9) Таким образом, суммарная реакция образования гипохлорита натрия выглядит так: Cl2 + 2NaOH = NaClO + NaCl + H2O (2.2.10) Кроме того, гипохлорит натрия может диспропорционировать при повышенных температурах с образованием хлората натрия: 3NaClO NaClO3 + 2NaCl (2.2.11) Образующийся кислород может взаимодействовать с графитовым анодом: С + О2 = СО2 (2.2.12) Могут протекать и другие побочные электродные процессы. Например, восстановление гипохлорит-ионов на катоде (2.2.13) и их окисление на аноде (2.2.14): К ClO- +2H+ + 2e- = Cl- + H2O , (2.2.13) A 6ClO- + 3H2О - 6e- = 2ClO3 - + 4Cl- +1,5O2 +6H+ (2.2.14) Доля побочных электродных реакций в оптимальных условиях проведения процесса невелика (3-5%), но эти реакции могут существенно снижать качество и выход основных продуктов при нарушении технологических режимов, а также вызывают разрушение диафрагмы. Таким образом, электрохимическое равновесие, устанавливающееся на электроде, зависит от концентраций исходных и конечных продуктов, температуры, давления и может быть смещено в ту или другую сторону. В отличие от других ХТП, равновесие электродной реакции можно смещать, прикладывая ДОПОЛНИТЕЛЬНОЕнапряжение с помощью внешнего источника постоянного тока. Кинетика электродных процессов. Скорость многостадийного процесса, которым является электролиз, может лимитироваться наиболее медленной стадией. Таковыми могут быть стадии, связанные с массопереносом, с доставкой (отводом) реагирующих веществ-ионов (молекул) к электроду или от электрода, или стадии, связанные с химическими реакциями, протекающими в приэлектродном пространстве, или электрохимические на электродах. Так, при выделении водорода на катоде (табл.2.2.1, реакция 4) имеют место следующие стадии: доставка ионов (Н3О+) к поверхности электрода за счет миграции и диффузии; разряд ионов водорода с образованием адсорбированных атомов; рекомбинация атомов водорода в молекулу Надс + Надс = Н2 с одновременной десорбцией; удаление водорода с границы раздела «электрод-электролит». Аналогичные стадии имеют место и для процессов выделения хлора и кислорода. Любая из вышеперечисленных стадий, в принципе, может быть лимитирующей и определять скорость всего электрохимического процесса. В случае, если скорость лимитируют стадии доставки или отвода продуктов, то считается, что процесс для обычных ХТП, протекает в ДИФФУЗИОННОЙ области, а в случае электролиза – в области КОНЦЕНТРАЦИОННОЙ ПОЛЯРИЗАЦИИ. Если скорость процесса лимитируют химические стадии реакции, то для обычных ХТП область протекания называют КИНЕТИЧЕСКОЙ, а в случае электролиза – ХИМИЧЕСКОЙ ПОЛЯРИЗАЦИЕЙ. При проведении электрохимических процессов к чисто химическим стадиям, с которыми мы сталкиваемся в обычных ХТП, добавляются электрохимические (разряд ионов с переносом электронов через границу раздела электрод-электролит). Обычно химическая поляризация включает все процессы с лимитирующими химическими и электрохимическими стадиями. Наиболее характерна химическая поляризация для электродных процессов, связанных с выделением газов: водорода, хлора, кислорода и др. В обычных ХТП, для того, чтобы процесс шел с достаточной скоростью, необходимо преодолеть энергетический барьер, который определяется наблюдаемой ЭНЕРГИЕЙ АКТИВАЦИИ. В электрохимических процессах необходимо также преодолеть энергетический барьер, который называют ПЕРЕНАПРЯЖЕНИЕМ и выражают в электрических единицах – вольтах. Перенапряжение численно равно разности между равновесным потенциалом и потенциалом под током(практическим). Величина перенапряжения зависит от того, какая стадия, химическая или электрохимическая, лимитирует скорость процесса электролиза. В зависимости от технологических параметров электролиза: состава электролита, температуры, силы тока, материала электрода процесс выделения водорода (аналогично хлора и кислорода) может лимитировать стадия разряда ионов. Например, при использовании Pt-го катода ПЕРЕНАПРЯЖЕНИЕ выделения водорода этом случае невелико и составляет 0,1-0,3 В. На железных или никелевых электродах величина ПЕРЕНАПРЯЖЕНИЯ увеличивается до значений 0,6-0,8 В. ПЕРЕНАПРЯЖЕНИЕ (величина энергетического барьера) зависит от материала электродов, температуры электролита и концентраций ионов в электролите. Отличительной особенностью электрохимических процессов является то, что энергия, необходимая для осуществления электролиза, создается напряжением, подаваемым на электроды от внешнего источника постоянного тока. Оптимальные технологические параметры выбирают таким образом, чтобы перенапряжение для основных электродных процессов было минимальным, а для побочных – максимальным. В этом случае можно добиться высокой селективности и скорости протекания электрохимических процессов. Основные технологические показатели электролиза. Эффективность работы электрохимического производства характеризуют с помощью следующих технологических показателей: выхода по току (Э), удельного расхода электроэнергии (WУД), коэффициента использования электроэнергии (N) и степени превращения сырья (Х). Эти показатели позволяют количественно оценить насколько рационально организован технологический процесс электролиза. Выход по токуВыход по току – это отношение практически полученной массы продукта (Gпр.) в процессе электролиза к теоретически возможной (GT), рассчитанной по закону Фарадея: В соответствии с первым законом Фарадея масса вещества (GТ), полученная при электролизе, пропорциональна количеству пропущенного электричества (Q) т.е., силе тока (I) и времени электролиза (): где Эх – электрохимический эквивалент вещества, (г/Ач), который определяется по формуле: М – молярная масса вещества, г/моль; n – число электронов, участвующих в электродной реакции; F – число Фарадея, 26,8 Ач/моль-экв. I – сила тока, А - время электролиза, ч Для гидроксида натрия, хлора и водорода электрохимические эквиваленты соответственно равны (г/Ач): Удельный расход электроэнергии Теоретический расход электроэнергии на 1000 г целевого продукта(WT) рассчитывают по формуле: где UT – теоретическое напряжение разложения, равное разности равновесных потенциалов анода и катода; для хлорида натрия в условиях промышленного электролиза UT = 2,1-2,2 В. Подставляя в формулу (2.2.21) значение GT из (2.2.16) и сократив I, , получим: На практике напряжение на электролизной ванне (Uпр.) значительно выше теоретического напряжения разложения, т. к. в реальных условиях необходимо учитывать перенапряжение на аноде и катоде, падение напряжения на диафрагме, в электролите, контактах и т. д. Кроме того, количество полученного продукта меньше теоретического, эту разницу учитывает выход по току. Поэтому удельный расход электроэнергии (WУД ) равен: где Э – в долях единицы. В соответствии с уравнением (2.2.23) удельный расход электроэнергии пропорционален напряжению на ванне и обратно пропорционален выходу по току. Поэтому все мероприятия, направленные на увеличение выхода по току и снижение напряжения на ванне, приводят к снижению удельного расхода электроэнергии. Коэффициент использования электроэнергии По существу коэффициент использования электроэнергии(N) является долей полезного использования электроэнергии, количественно его выражают как отношение теоретического расхода электроэнергии на единицу массы целевого продукта к фактическому расходу, выраженное в процентах: С учетом (2.2.22) и (2.2.23), получим: Степень использования электроэнергии тем выше, чем больше выход по току и ближе значения практического и теоретического напряжений. Поскольку выход по току для процесса получения гидроксида натрия изменяется на практике незначительно (93-98%), основной вклад в коэффициент использования электроэнергии вносит напряжение на ванне. Оно складывается из разности равновесных потенциалов анода (Ea) и катода (Ek) (35-42%), перенапряжений на аноде (а) и катоде (k) (23-26%), падения напряжения на диафрагме (Uд) (4-6%), в электролите (UЭ) (10-15%), на электродах и контактах (UК, 2-5%). Uпр. = (Ea - Ek) + (а + k)+ UЭ + UК + UД (2.2.26) В процессе работы эти соотношения могут изменяться, особенно в случае нарушения режимов процесса и возникновения неполадок: износ электродов, забивание диафрагмы, окисление контактов и др. Конверсия сырья Конверсия сырья – это отношение массы хлорида натрия, израсходованного в процессе электролиза, к общей массе хлорида натрия, поступившего в процесс: 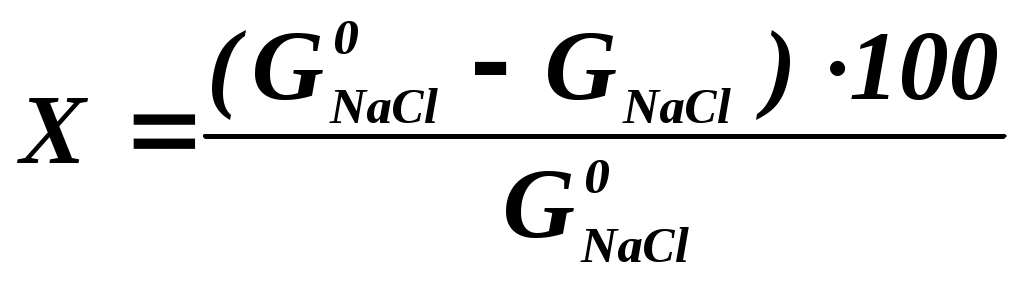 , (2.2.27) , (2.2.27)где GoNaCl - масса хлорида натрия, поступившего на электролиз ; GNaCl - масса хлорида натрия, не прореагировавшего в процессе электролиза. В промышленных условиях за один цикл конверсия хлорида натрия составляет 40-45% при содержании NaOH в католите 120-140 г/л. 2.2.4. Выбор оптимального технологического режима Процесс электролиза хлорида натрия проводят в условиях, позволяющих получить максимальное количество высококачественных продуктов: гидроксида натрия, хлора и водорода при наименьших затратах сырья и, особенно, электроэнергии. | ||||||||||||||||||
