Основы химической термодинамики
 Скачать 2.79 Mb. Скачать 2.79 Mb.
|
Следствия из закона ГессаПрактическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты химических процессов. В термохимических расчетах обычно используют ряд следствий из закона Гесса: 1. Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье – Лапласа). 2. Для двух реакций, имеющих одинаковые исходные, но разные конечные состояния, разность тепловых эффектов представляет собой тепловой эффект перехода из одного конечного состояния в другое. С + О2 ––> СО + 1/2 О2 ΔН1 С + О2 ––> СО2 ΔН2 СО + 1/2 О2 ––> СО2 ΔН3 3. Для двух реакций, имеющих одинаковые конечные, но разные исходные состояния, разность тепловых эффектов представляет собой тепловой эффект перехода из одного исходного состояния в другое. С(алмаз) + О2 ––> СО2 ΔН1 С(графит) + О2 ––> СО2 ΔН2 С(алмаз) ––> С(графит) ΔН3 4. Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты. 5. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты. (I.21) При условии протекания в системе химических или фазовых превращений энтальпию также следует рассматривать как функцию . Тогда: Принимая во внимание определение энтальпии (I, 51) и (I, 31), после дифференцирования можем записать: Если Р = const и = const, то . Итак, окончательно получим: где Первые два слагаемых в правой части уравнения по первому закону термодинамики (смотри (I, 7а)) равны , тогда : Следовательно, и с учётом (I,59) для элементарной теплоты получаем: Тепловой эффект химической реакции – это количество теплоты, выделившейся или поглощённой при протекании реакции до конца () и постоянных значениях параметров системы. Это понятие следует отличать от понятия теплоты реакции, которое не имеет такого строгого термодинамического смысла как тепловой эффект. Теплота реакции – опытная величина, она может быть определена во всех случаях, когда реакция протекает не до конца или, например, температура исходных веществ и продуктов реакции отличаются и т.д. По этой причине теплота реакции не несёт какой-либо существенной информации об особенностях протекающих в системе химических превращений и имеет ограниченное применение.
Тепловой эффект - количество теплоты, выделившееся или поглощенное химической системой при протекании в ней химической реакции. Тепловой эффект обозначается символом Q. Его величина соответствует разности между энергиями исходного и конечного состояний реакции. В экзотермических реакциях Q > 0. В эндотермических реакциях Q < 0. Чтобы тепловой эффект являлся величиной, зависящей только от характера протекающей химической реакции, необходимо соблюдение следующих условий: Реакция должна протекать либо при постоянном объёме Qv(изохорный процесс), либо при постоянном давлении Qp(изобарный процесс). В системе не совершается никакой работы, кроме возможной при P = const работы расширения. Если реакцию проводят при стандартных условиях при Т = 298,15 К = 25 ˚С и Р = 1 атм = 101325 Па, тепловой эффект называют стандартным тепловым эффектом реакции или стандартной энтальпией реакции ΔHrO. В термохимии стандартный тепловой эффект реакции рассчитывают с помощью стандартных энтальпий образования. Под стандартной теплотой образования понимают тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях. Например, стандартная энтальпия образования 1 моль метана из углерода и водорода равна тепловому эффекту реакции: С(тв) + 2H2(г) = CH4(г) + 76 кДж/моль. В литературе часто встречается другое обозначение стандартной энтальпии — ΔH298,150, где 0 указывает на равенство давления одной атмосфере (или, несколько более точно, на стандартные условия), а 298,15 — температура. Иногда индекс 0 используют для величин, относящихся к чистому веществу, оговаривая, что обозначать им стандартные термодинамические величины можно только тогда, когда в качестве стандартного состояния выбрано именно чистое вещество. Стандартным также может быть принято, например, состояние вещества в предельно разбавленном растворе. Энтальпия образования простых веществ принимается равной нулю, причем нулевое значение энтальпии образования относится к агрегатному состоянию, устойчивому при T = 298 K. Например, для йода в кристаллическом состоянии ΔHI2(тв)0 = 0 кДж/моль, а для жидкого йода ΔHI2(ж)0 = 22 кДж/моль. Энтальпии образования простых веществ при стандартных условиях являются их основными энергетическими характеристиками. Тепловой эффект любой реакции находится как разность между суммой теплот образования всех продуктов и суммой теплот образования всех реагентов в данной реакции (следствие закона Гесса): ΔHреакцииO = ΣΔHfO (продукты) — ΣΔHfO (реагенты) Термохимические эффекты можно включать в химические реакции. Химические уравнения в которых указано количество выделившейся или поглощенной теплоты, называются термохимическими уравнениями. Реакции, сопровождающиеcя выделением тепла в окружающую среду имеют отрицательный тепловой эффект и называются экзотермическими. Реакции, сопровождающиеся поглощением тепла имеют положительный тепловой эффект и называются эндотермическими. Тепловой эффект обычно относится к одному молю прореагировавшего исходного вещества, стехиометрический коэффициент которого максимален. Стандартная энтальпия сгорания — ΔHгоро, тепловой эффект реакции сгорания одного моля вещества в кислороде до образования оксидов в высшей степени окисления. Теплота сгорания негорючих веществ принимается равной нулю. Закон Гесса — основной закон термохимии, который формулируется следующим образом:
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). 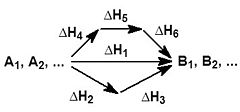 На рисунке приведено схематическое изображение некоторого обобщенного химического процесса превращения исходных веществ А1, А2… в продукты реакции В1, В2…, который может быть осуществлен различными путями в одну, две или три стадии, каждая из которых сопровождается тепловым эффектом ΔHi. Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением: |
