Основы химической термодинамики
 Скачать 2.79 Mb. Скачать 2.79 Mb.
|
Следствия из закона ГессаПрактическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты химических процессов. В термохимических расчетах обычно используют ряд следствий из закона Гесса: 1. Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье – Лапласа). 2. Для двух реакций, имеющих одинаковые исходные, но разные конечные состояния, разность тепловых эффектов представляет собой тепловой эффект перехода из одного конечного состояния в другое. С + О2 ––> СО + 1/2 О2 ΔН1 С + О2 ––> СО2 ΔН2 СО + 1/2 О2 ––> СО2 ΔН3 3. Для двух реакций, имеющих одинаковые конечные, но разные исходные состояния, разность тепловых эффектов представляет собой тепловой эффект перехода из одного исходного состояния в другое. С(алмаз) + О2 ––> СО2 ΔН1 С(графит) + О2 ––> СО2 ΔН2 С(алмаз) ––> С(графит) ΔН3 4. Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты. 5. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты
Под стандартной теплотой образования понимают тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях. Например, стандартная энтальпия образования 1 моль метана из углерода и водорода равна тепловому эффекту реакции: С(тв) + 2H2(г) = CH4(г) + 76 кДж/моль. В литературе часто встречается другое обозначение стандартной энтальпии — ΔH298,150, где 0 указывает на равенство давления одной атмосфере (или, несколько более точно, на стандартные условия), а 298,15 — температура. Иногда индекс 0 используют для величин, относящихся к чистому веществу, оговаривая, что обозначать им стандартные термодинамические величины можно только тогда, когда в качестве стандартного состояния выбрано именно чистое вещество. Стандартным также может быть принято, например, состояние вещества в предельно разбавленном растворе. Энтальпия образования простых веществ принимается равной нулю, причем нулевое значение энтальпии образования относится к агрегатному состоянию, устойчивому при T = 298 K. Например, для йода в кристаллическом состоянии ΔHI2(тв)0 = 0 кДж/моль, а для жидкого йода ΔHI2(ж)0 = 22 кДж/моль. Энтальпии образования простых веществ при стандартных условиях являются их основными энергетическими характеристиками. Тепловой эффект любой реакции находится как разность между суммой теплот образования всех продуктов и суммой теплот образования всех реагентов в данной реакции (следствие закона Гесса): ΔHреакцииO = ΣΔHfO (продукты) — ΣΔHfO (реагенты) Термохимические эффекты можно включать в химические реакции. Химические уравнения в которых указано количество выделившейся или поглощенной теплоты, называются термохимическими уравнениями. Реакции, сопровождающиеcя выделением тепла в окружающую среду имеют отрицательный тепловой эффект и называются экзотермическими. Реакции, сопровождающиеся поглощением тепла имеют положительный тепловой эффект и называются эндотермическими. Тепловой эффект обычно относится к одному молю прореагировавшего исходного вещества, стехиометрический коэффициент которого максимален. Стандартная энтальпия сгорания — ΔHгоро, тепловой эффект реакции сгорания одного моля вещества в кислороде до образования оксидов в высшей степени окисления. Теплота сгорания негорючих веществ принимается равной нулю. Известны теплоты образования самых разнообразных веществ из составляющих их элементов. Например: CO2(г): 393,5 кДж/моль (из C и O2, энергия выделяется); SiO2(тв): 859 кДж/моль (из Si и O2, энергия выделяется); NaCl (тв): 411 кДж/моль (из моля Na и 0,5 моль Cl2, энергия выделяется) и т.д. Опубликованы обширные таблицы теплот образования веществ. В чем же полезность этих величин? Дело в том, что теплоты образования веществ из элементов чрезвычайно удобны для расчета тепловых эффектов любых реакций, в которых эти вещества могли бы участвовать. Теплота любой реакции (даже пока не осуществленной на практике) может быть вычислена как разность между суммой теплот образования всех продуктов и суммой теплот образования всех реагентов в данной реакции. Однако здесь необходимо строго соблюдать "правила игры", принятые в термохимии. Например, мы пишем: "C(тв)", но "твердый" углерод может быть как графитом, так и алмазом! В термохимических измерениях стандартным состоянием углерода считается графит, а не алмаз. Во-вторых, нужно договориться о температуре и давлении, при которых находятся вещества, поскольку эти параметры могут заметно влиять на величину теплового эффекта. Принято использовать теплоты образования соединений из чистых элементов в стандартных условиях. Такие стандартные условия чаще называют стандартным состоянием веществ: 1. Для твердых, жидких и газообразных веществ стандартное состояние определяется как наиболее распространенная форма элемента при 25 оС (298 К) и давлении 1 атмосфера (1 атм). 2. Теплота образования чистых элементов по определению равна нулю. Тепловой эффект реакции не обязательно находить экспериментально, его можно рассчитать, используя стандартные теплоты образования и сгорания веществ, следуя закону Гесса. Закон Г.И.Гесса (1840г.) заключается в следующем: Тепловой эффект химической реакции не зависит от пути процесса, а только от вида (например, аллотропной модификации) и агрегатного состояния исходных веществ и конечных продуктов реакции. ^ Стандартная теплота сгорания показывает, сколько кДж энергии выделилось при сгорании 1 моль вещества до высших оксидов. Теплоты сгорания негорючих веществ равна 0. Стандартные теплоты сгорания и образования можно найти в справочных таблицах. Расчёты теплового эффекта реакции проводятся согласно следствию из закона Гесса: тепловой эффект химической реакции равен сумме стандартных теплот образования продуктов реакции за вычетом суммы стандартных теплот образования исходных веществ. Q = ΣQ0обр (продуктов) – ΣQ0обр (исходных веществ) Если даны стандартные теплоты сгорания, то можно использовать следующую формулу для вычисления теплового эффекта реакции: Q = ΣQ0сгор (исходных веществ) – ΣQ0сгор (продуктов).
 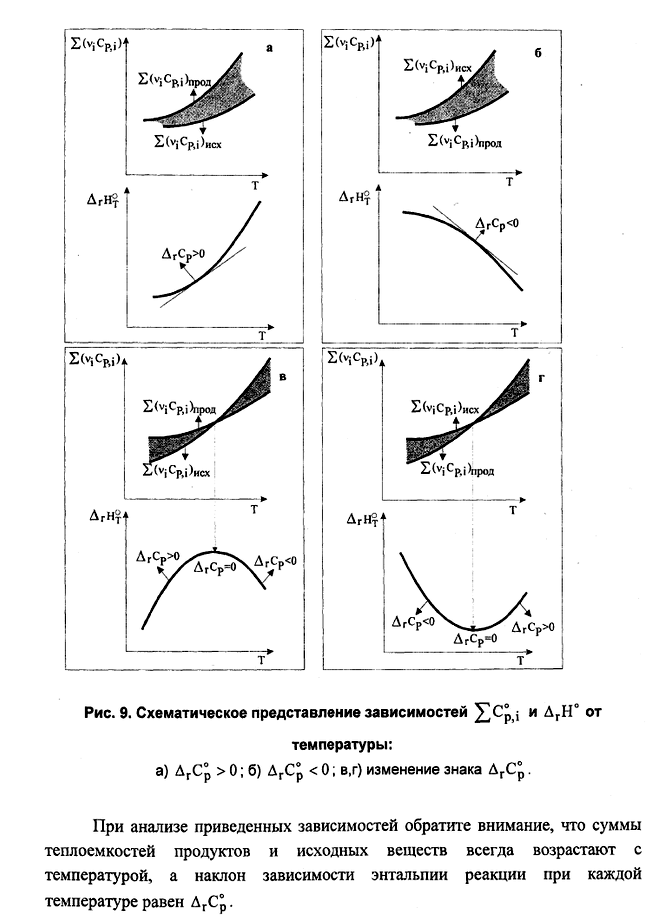 
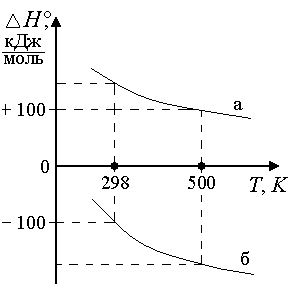
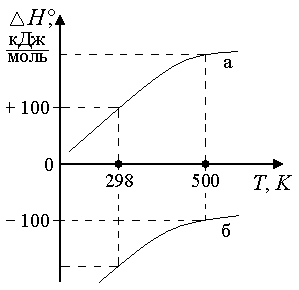
rСр = 0 rНT1= rНT2 . Теплота реакции не зависит от температуры Ср>0, T rН Для эндотермической реакции rН2 > rН1. Для экзотермической реакции rН2 <rН1. Ср < 0, T rН Для эндотермической реакции rН2 < rН1. Для экзотермической реакции rН2 >rН1.
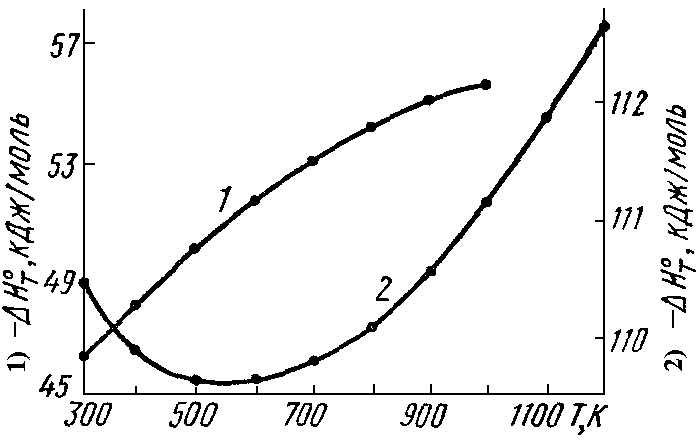
Т Т а) б) Рис. 4.3. Зависимость теплоемкости (а) и теплоты реакции (б) от температуры Интегрирование уравнения Кирхгоффа Для пересчета теплоты реакции с одной температуры на другую нужно использовать определенный интеграл НТ = Н298 + В небольшом интервале температур rСр= const. В противном случае нужно представить rСр в виде температурного ряда и только после этого интегрировать уравнение (4.17) rН2 = rН1 +ra(T2-T1) + rb/2 (T22 –T12) + rc/3( T23- T13) - rc'(1/T2 –1/T1). (4.15) 4.8.6.2. Для вывода общего уравнения зависимости Н = f (T), нужно брать неопределенный интеграл rН=rН0+raT +rb/2 T2+rc/3 T3-rc'1/T.(4.16) Постоянная интегрирования rН0имеет смысл теплоты реакции при температуре 0 К и может быть найдена по известному значению теплоты реакции при определенной температуре, например, при 298 К rН0 = Н298 –(ra∙298 + rb/2∙ 2982 + rc/3 ∙2983 - rc'∙1/298). (4.17) Температурные ряды теплоемкостей могут быть оборваны на любом члене в зависимости от выбранного интервала температур: чем больше разность температур, темболшее число членов температурных полиномов следует учитывать.
Для расчета тепловых эффектов реакций при температурах отличных от стандартной, пользуются интегральной формой уравнений Кирхгоффа (1.25) и (1.26). В нешироком температурном интервале (десятки градусов) можно пренебречь зависимостью теплоемкостей реагентов от температуры и считать ΔСP постоянной величиной, не зависящей от T, тогда для теплового эффекта при температуре T получаем: где ^ T – не слишком отлична от 298 К. При интегрировании уравнения Кирхгоффа в широком интервале температур (298 – T) пользуются температурной зависимостью теплоемкости веществ в виде степенных рядов (1.21) и (1.22), справедливых в данном температурном интервале. В общем случае, если в реакции участвуют и органические и неорганические вещества для разности теплоемкостей конечных и начальных веществ получится выражение вида: ΔCP = Δa + ΔвT + ΔcT2 + Δc’/T2 Тогда для теплового эффекта при высокой температуре T имеем: | ||||||||||||||||||||||||||