Практикум по бх. Практикум по биологической химии Для студентов лечебного и педиатрического
 Скачать 5.3 Mb. Скачать 5.3 Mb.
|
Тема 12.2. | |||||||||||||||||||||||
 |
Принцип
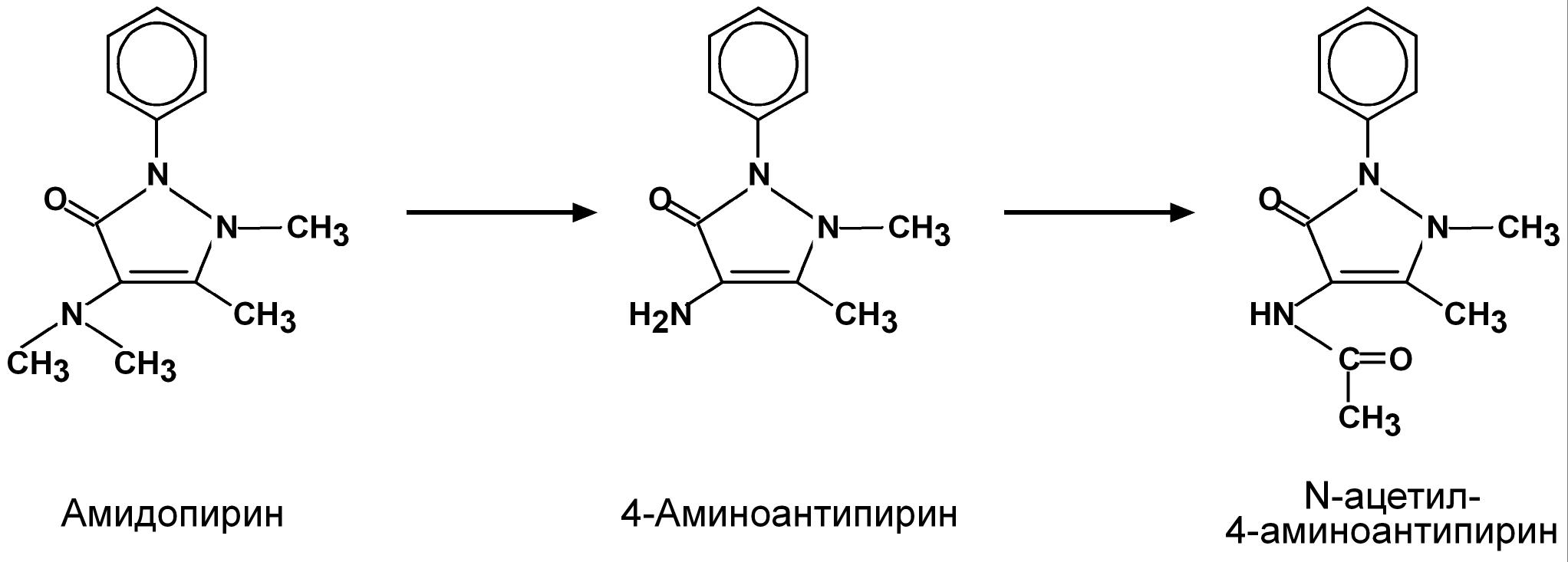
Исследование связано с определением концентрации 4 аминоантипирина в моче. При взаимодействии с фенолом в щелочной среде и присутствии гексацианоферрата калия (III) (K3[Fe(CN)6], красная кровяная соль) 4 аминоантипирин образует соединение типа индофенола, имеющего розовую окраску.
Материал исследования
Моча.
Реактивы
1) Аммиачный буфер, рН 10,5-10,6 (20 г хлорида аммония растворяют в 100 мл 25% раствора аммиака); 2) 0,02% раствор фенола перекристаллизованного; 3) 12,5% раствор трихлоруксусной кислоты (ТХУ); 4) 36% раствор соляной кислоты; 5) 1% раствор гексацианоферрата (III) калия K3[Fe(CN)]6.
Стандартный раствор 4 аминоантипирина 1 г/л для построения калибровочного графика.
Проведение анализа
Обследуемый принимает утром натощак амидопирин из расчета 6 мг/кг веса (Aобщ). Собирается 4 порции мочи в интервале соответственно от 1 до 6 часов, 6-12, 12-24 и 45-48 часов. Объем мочи измеряется. Не позже чем через 24 часа, моча центрифугируется или фильтруется.
Далее исследуется концентрация 4 аминоантипирина (опыт 1) и N ацетил-4-аминоантипирина (опыт 2):
| | Опыт 1, мл | Опыт 2, мл |
| Моча Аммиачный буфер Соляная кислота | 1,5 0,3 0,3 | 1,5 –– 0,3 |
| | Выдержать 15 минут при комнатной температуре | Закрыть пробкой. Выдержать 15 минут при 100С |
| | Пробирки охлаждают и центрифугируют при 1500 об/мин | |
| Аммиачный буфер | –– | 0,6 |
| Вновь центрифугируют при 1500 об/мин | ||
| Надосадок Дистилл. вода ТХУ Раствор фенола Р-р K3[Fe(CN)6] | 0,6 –– 0,5 2,0 0,1 | 0,8 0,2 –– 2,0 0,1 |
| | Инкубируют 10 минут при 20-25°С. Не позднее чем через 60 минут измеряют оптическую плотность проб против воды при 510 нм (зеленый светофильтр) | |
Расчет
Концентрацию продуктов биотрансформации амидопирина в моче (мг/л) определяют по калибровочному графику, построенному с использованием калибровочных растворов антипирина в диапазоне от 3 до 20 мг/л.
Количество 4-аминоантипирина (A1, мг в порции мочи) находят, умножая его концентрацию (опыт 1) на соответствующий объем мочи (л).
Общее количество 4-аминоантипирина и N ацетил-4-аминоантипирина (A1+2, мг в порции мочи) находят, умножая их концентрацию (опыт 2) на соответствующий объем мочи (л).
Количество N-ацетил-4-аминоантипирина (A2), выделенного с мочой за сутки, находят по разности содержания в опыте 1 и опыте 2.
Монооксигеназную активность печени оценивают по формуле:
Активность монооксигеназ (%) =
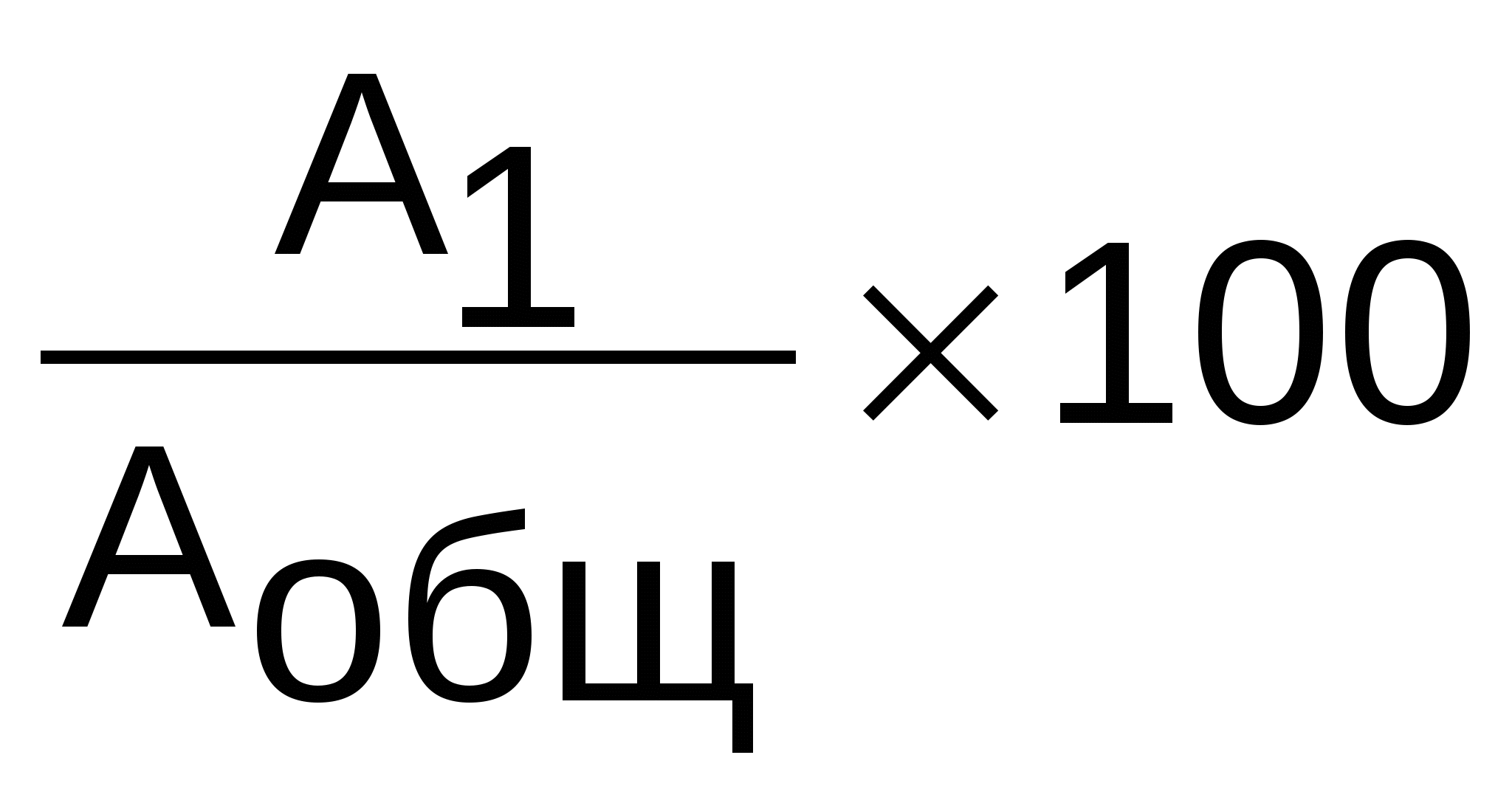 , где
, гдеA1 – количество 4-аминоантипирина в порции мочи,
Aобщ – количество введенного амидопирина.
Ацетилирующую активность ферментных систем печени находят по формуле:
Активность трансфераз (%) =
A2 – количество N-ацетил-4-аминоантипирина в порции мочи,
A1 – количество 4-аминоантипирина в порции мочи.
Общую обезвреживающую способность ферментных систем печени оценивают по формуле:
Общая активность (%) =
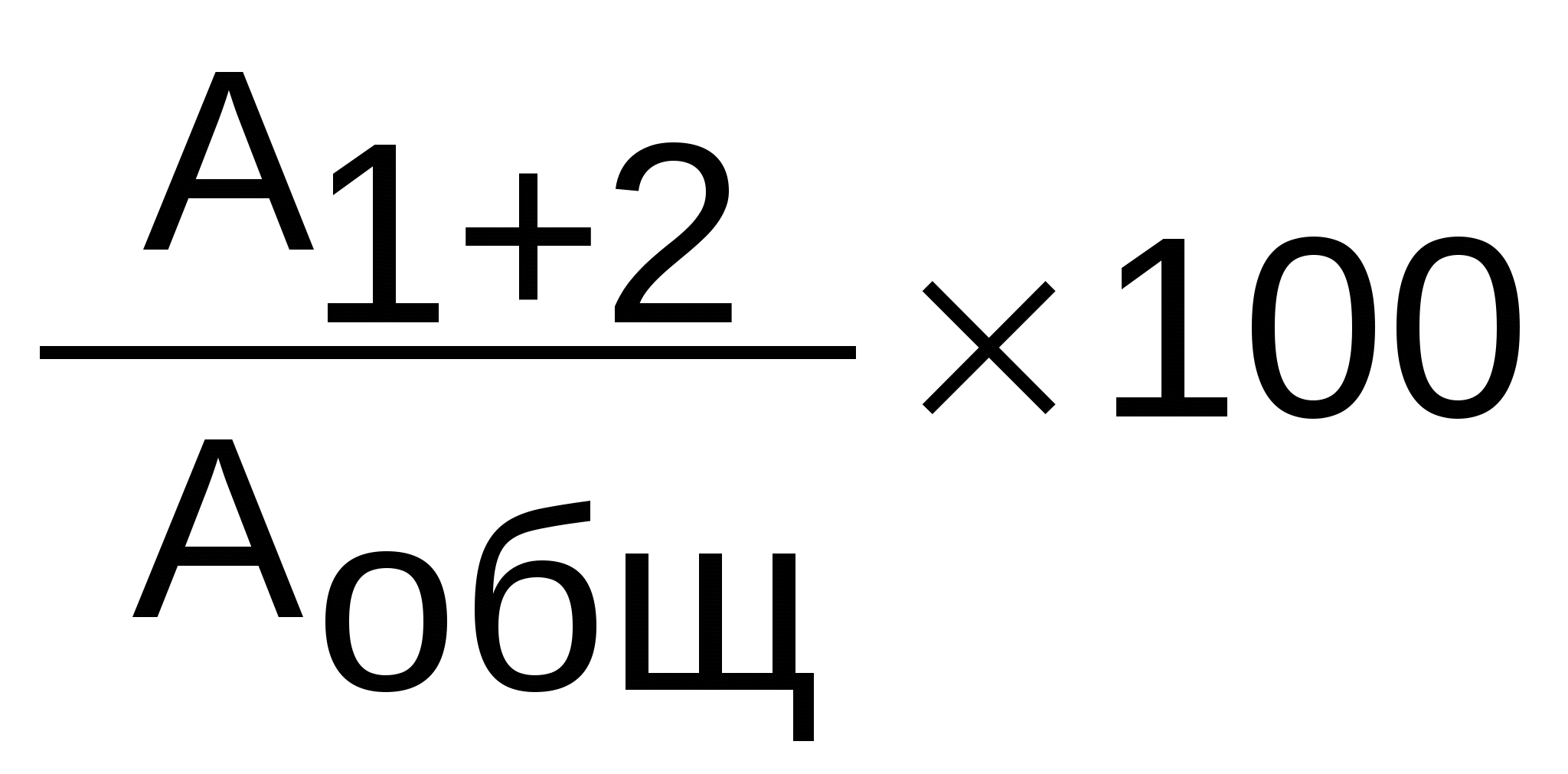
Клинико диагностическое значение
Изучение скорости метаболизма лекарственных веществ, поступающих в организм, позволяет оценивать активность ферментных систем печени, участвующих в биотрансформации ксенобиотиков.
Снижение скорости наблюдается при заболеваниях печени (цирроз, гепатит), с увеличением возраста.
Увеличение скорости наблюдается при регулярном приеме некоторых веществ – барбитураты, этанол.
