Практикум по коллоидной химии Электроповерхностные свойства и устойчивость дисперсных систем
 Скачать 346.5 Kb. Скачать 346.5 Kb.
|
Цель работыОпределение электрокинетического потенциала методом макроэлектрофореза; изучение влияния концентрации противоионов на электрокинетический потенциал; изучение влияния валентности противоионов на электрокинетический потенциал. Теоретическая частьНа границе раздела твердой фазы и раствора, как правило, возникает двойной электрический слой. Происхождение его может быть двояким. Во-первых, возможна ионизация молекул, составляющих поверхностный слой твердой фазы, например ионизация молекул H2SiO3, образующихся на поверхности частиц SiO2 в воде. При этом один из ионов (противоион Н+) переходит в раствор, тогда как другой, связанный с дисперсной фазой более прочно (потенциалопределяющий ион SiO32-), остается на поверхности частиц. Во-вторых, на поверхности твердой фазы может происходить адсорбция одного из ионов, присутствующего в растворе электролита. При этом преимущественно адсорбируются ионы, входящие в состав твердой фазы или изоморфные с ними (например, I- или Ag+ для золя AgI). Если двойной электрический слой возникает в высокодисперсных и, следовательно, обладающих седиментационной устойчивостью системах, то образуется агрегативно устойчивый коллоидный раствор. Представления о строении двойного электрического слоя (ДЭС) отличаются друг от друга, в основном, объяснением расположения противоионов у межфазной границы. Согласно современным взглядам ДЭС состоит из заряженной поверхности с потенциалом и противоположно заряженной части слоя, в которой находятся противоионы (рис. 2. 1). Некоторое число противоионов прочно связано с ядром мицеллы в результате действия как электростатических, так и адсорбционных сил и образует так называемый адсорбционный слой противоионов - слой Штерна. Остальные противоионы, благодаря тепловому движению и взаимному отталкиванию, находятся на некотором расстоянии от межфазной границы, образуя диффузный слой ионов, который удерживается у поверхности только электростатическими силами. Толщина плотного слоя Штерна принимается равной диаметру противоиона. Эту часть ДЭС можно рассматривать как плоский конденсатор, потенциал которого с увеличением расстояния от поверхности снижается линейно. По теории Гуи - Чепмена противоионы диффузионной части ДЭС распределяются в поле поверхностного потенциала в соответствии с законом Больцмана. Теория показывает, что потенциал диффузионной части слоя снижается с расстоянием по экспоненте. При малом значении потенциала эта зависимость выражается уравнением Р 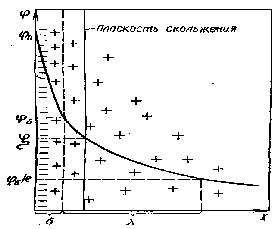 ис. 2.1 Строение ДЭС где Из уравнения (2.1) следует, что за толщину диффузной части слоя принято расстояние, на котором потенциал диффузной части слоя В соответствии с той же теорией толщина диффузной части слоя равна 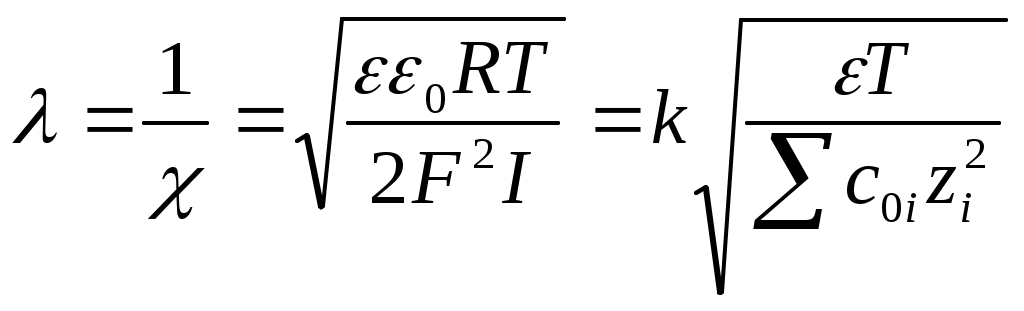 где 0 - электрическая постоянная; - относительная диэлектрическая проницаемость среды; F- постоянная Фарадея; I - ионная сила раствора; c0i - концентрация иона в растворе; zi - заряд иона электролита. Из уравнения (2.2) следует, что уменьшается с ростом концентрации электролита, заряда его ионов и с понижением температуры. Каждая точка электрического поля двойного слоя, образованного потенциалопределяющими ионами и противоионами, характеризуется определенным значением потенциала . Согласно наиболее общим представлениям Штерна, падение потенциала поля с удалением от межфазной границы происходит круто, по прямой, в адсорбционном слое и более полого, по кривой, в диффузионном слое, как это показано на рис. 2.1. Если мицелла находится во внешнем электрическом поле, то наблюдается электрофорез – ядро мицеллы вместе с прочно адсорбированными на нем противоионами движется к одному из электродов, а остальные противоионы перемещаются к другому электроду. Таким образом, электрофорез, как и электролиз, является двусторонним процессом. Однако в отличие от электролиза при электрофорезе не соблюдается зависимость, выражаемая вторым законом Фарадея. Это следует из того, что к коллоидным частицам неприложимо понятие об электрохимическом эквиваленте, так как ни масса частиц, ни их заряд не являются постоянными величинами. Скорость электрофореза зависит от потенциала на границе скольжения, разделяющей две перемещающиеся друг относительно друга части мицеллы. Потенциал двойного слоя, отвечающий границе скольжения, называется электрокинетическим или - потенциалом. Часто принимают, что граница скольжения совпадает с границей между адсорбционным и диффузным слоями. Однако в общем случае эти границы могут не совпадать (рис. 2.1), так как место границы скольжения определяется не только действием адсорбционных и электрических сил, но и гидродинамическими свойствами раствора, окружающего частицы. Поэтому -потенциал не всегда может быть отождествлен с потенциалом на границе адсорбционного и диффузного слоев . На -потенциал весьма сильно влияют концентрация и валентность противоионов, присутствующих в дисперсионной среде. Вследствие того, что для компенсации потенциалопределяющих ионов требуется всегда одно и то же (эквивалентное) количество противоионов, с повышением концентрации противоионов толщина диффузного слоя будет падать и, следовательно, -потенциал будет снижаться. С увеличением валентности противоионов последние будут сильней притягиваться заряженной поверхностью, что будет также вызывать сжатие двойного электрического слоя и обуславливать падение -потенциала. При этом способность противоионов понижать -потенциал возрастает не прямо пропорционально валентности иона, а гораздо в большей степени. -Потенциал частиц является важной характеристикой коллоидных систем, поскольку во многих случаях обнаруживается симбатное изменение этой величины и устойчивости золя. Однако мнение, что -потенциал целиком и полностью определяет устойчивость золя, оказалось неверным. Поэтому представление о так называемом критическом значении электрокинетического потенциала, ниже которого золь становиться агрегативно неустойчивым, себя не оправдало. Значение -потенциала (в В) может быть рассчитано из экспериментально найденной скорости электрофореза по уравнению Гельмгольца – Смолуховского: =Uо/оЕ (2.3) где и - вязкость и диэлектрическая проницаемость среды на границе скольжения; Е – градиент потенциала внешнего электрического поля; U – скорость электрофореза; В этом уравнении Е=V/L (2.4) где V – приложенная извне разность потенциалов, В; L – расстояние между электродами, см. Часто в уравнение Гельмгольца – Смолуховского вводят величину, называемую электрофоретической подвижностью Uэф=U/E=0/. (2.5) Она не зависит от напряженности внешнего электрического поля, а является характеристикой коллоидной системы. Значения и , подставляемые в уравнение Гельмгольца – Смолуховского, берутся обычно для дисперсионной среды. При этом, конечно, допускается некоторая ошибка, так как благодаря повышенной концентрации ионов значения и в двойном электрическом слое иные, чем для дисперсионной среды. Для воды при комнатной температуре можно с достаточной точностью принять, что = 81, а = 0,01 П. Эти значения используются при расчете -потенциала в данной работе. Следует иметь в виду, что вычисление -потенциала по уравнению Гельмгольца – Смолуховского дает приближенные результаты. Для получения точных значений -потенциала необходимо учитывать явления электрофоретического запаздывания и электрической релаксации и вносить соответствующие поправки. Однако эти поправки в ряде случаев невелики и значения -потенциала, вычисленные по уравнению Гельмгольца–Смолуховского, достаточно показательны для решения многих задач. Существует два метода определения скорости электрофореза: микроскопический и макроскопический, или метод передвигающейся границы. Первый метод заключается в непосредственном определении скорости движения частицы под ультрамикроскопом. Золь или суспензию помещают в небольшую стеклянную кювету, прикладывают к раствору разность потенциалов, фиксируют положение какой-нибудь отдельной частицы и измеряют путь, который она проходит за определенный промежуток времени. Недостатком этого метода является необходимость сильно разбавлять золь для наблюдения за отдельной частицей, что может привести к изменению -потенциала. Метод макроэлектрофореза, или передвигающейся границы, заключается в следующем. Коллоидный раствор помещают в U-образную электрофоретическую трубку, сверху наливают слабый раствор некоагулирующего электролита, так называемую боковую жидкость, и наблюдают за скоростью перемещения границы раздела золь – боковая жидкость под действием приложенной к раствору разности потенциалов. В одном колене трубки граница раздела поднимается, так как коллоидные частицы переходят в боковую жидкость, в другом опускается, поскольку коллоидные частицы перемещаются в межмицеллярной жидкости и движутся в глубь коллоидного раствора. Боковая жидкость необходима для создания границы раздела. При выборе боковой жидкости к ней предъявляют следующие требования. Боковая жидкость не должна содержать коагулирующих ионов и по своему составу должна быть близка к межмицеллярной жидкости; иначе при переходе частиц золя в боковую жидкость будет меняться толщина диффузного слоя и, следовательно, электрокинетический потенциал. Для получения четкой границы раздела необходимо, чтобы электропроводность боковой жидкости была равна или немного больше электропроводности золя. Выполнение этого требования важно еще и потому, что облегчает расчеты, так как падение потенциала в электрофоретической трубке будет происходить равномерно и градиент потенциала как в золе, так и в боковой жидкости будет иметь одинаковое значение. Наилучшей боковой жидкостью является межмицеллярная жидкость золя. С помощью ультрафильтрации, центрифугирования или замораживания золя можно получить боковую жидкость, очень близкую по своим свойствам к межмицеллярной. |
