Практикум по коллоидной химии Электроповерхностные свойства и устойчивость дисперсных систем
 Скачать 346.5 Kb. Скачать 346.5 Kb.
|
ТеорияПри добавлении к лиофобным коллоидным системам очень небольших количеств растворов высокомолекулярных веществ наблюдается явление коллоидной защиты, т.е. значительное повышение устойчивости золей, которое проявляется в том, что снижается их чувствительность к действию электролитов или других стабилизирующих факторов (механическому перемешиванию, нагреванию, замораживанию и т.д.). Причина явления коллоидной защиты заключается в адсорбции высокомолекулярного вещества на поверхности лиофобных коллоидных частиц и увеличении устойчивости в основном за счет факторов неэлектростатической природы. Адсорбирующиеся макромолекулы, содержащие полярные группы и поэтому хорошо гидратирующиеся, образуют вокруг частиц гидратные оболочки, которые препятствию слипанию частиц. Адсорбционно-гидратные слои благодаря большим размерам макромолекул имеют значительную толщину и, обладая определенной механической прочностью и упругостью, не позволяют частицам сблизится на те малые расстояния, где действует интенсивное молекулярное притяжение (структурно-механическая и стерическая стабилизация). Важную роль для механизма коллоидной защиты играет энтропийный фактор устойчивости. Кроме того, если в макромолекулах защитного вещества имеются ионогенные группы, то адсорбция таких молекул может привести к повышению заряда коллоидных частиц и отсюда к усилению их электростатического отталкивания. Явление коллоидной защиты обычно связанно с применением высокомолекулярных веществ. Однако оно может происходить при добавлении к золю и двух других стабилизирующих агентов, например, ПАВ неионогенного типа. Стабилизирующее действие вещества характеризуется защитным числом, т.е. минимальной массой вещества, выраженной в мг, которая необходима для защиты 10 мл золя от коагуляции при введении раствора электролита в пороговой концентрации. Ясно, что действие защитного вещества при адсорбции его на поверхности коллоидных частиц зависит от природы адсорбированного вещества – его лиофильности, сродства к дисперсной фазе, строения и свойств молекул и т.д. Явление коллоидной защиты нашло широкое практическое применение. Например, оно используется в фармацевтической промышленности при получении колларгола (золя серебра), при стабилизации натурального и синтетического латексов, для создания однородных и устойчивых смесей латекса с наполнителями, пигментами и т.д. Кроме того, защитное число S можно характеризовать количеством вещества, требуемого для стабилизации единицы объема золя. Защитное число S, как и порог коагуляции, определяют как визуально, так и турбидиметрическим методом. Защитное число S (г/л золя) вычисляют по уравнению где Сст – концентрация стабилизатора раствора, г/л; Vзащ – объем раствора стабилизатора, необходимый для предотвращения коагуляции золя, мл. Значение Vзащ соответствует объему стабилизатора в золе, содержащем пороговый объем электролита, при котором на кривой зависимости D=f(Vст) появляется нижний горизонтальный участок (рис. 4). Действие защитного вещества при адсорбции его на поверхности коллоидных частиц зависит от природы адсорбированного вещества – его лиофильности, сродства к дисперсной фазе, строения и свойств молекул и т. д. Методика проведения работы Для проведения работы необходимы: Бюретки для растворов коагуляторов. Набор пробирок, пипеток, колб. Золь сульфида сурьмы или насыщенный раствор хлорида железа (III) для получения золя гидрата окиси железа. Коагуляторы: 0,002 н. Раствор сульфата натрия или 1 н. Раствор хлорида калия. Защитные вещества: желатин, поливиниловый спирт и неионогенное ПАВ - препарат ОС-20 (оксиэтилированный алифатический спирт). Учащийся проводит коллоидную защиту одного из золей защитными веществами, указанными преподавателем. Работу начинают с приготовления 0,5%-ных растворов защитных веществ по 100 мл каждого раствора. Для этого на технических весах взвешивают навеску вещества и вносят ее в 100 мл дистиллированной воды. При растворении высокомолекулярных веществ (желатин, поливиниловый спирт) смесь выдерживают при комнатной температуре 15-20 мин для набухания и извлечения примесей, затем осторожно сливают раствор над гелем. Снова наливают воду и растворяют при перемешивании защитное вещество, нагревая его на водяной бане (воду в бане не следует доводить до кипения). ПАВ растворяют на водяной бане без предварительного набухания. Золь Fe(OH)3 готовят следующим образом. В конической колбе нагревают до кипения 200 мл дистиллированной воды, затем, отставив горелку, осторожно добавляют 3 мл насыщенного раствора FeCl3 и смесь кипятят 2-3мин. Образуется красновато-коричневый золь Fe(OH)3. Полученный золь охлаждают. Затем определяют порог коагулящии золя, взяв в качестве коагулятора для золя Fe(OH)3 раствор Na2SO4, а для золя Sb2S3 – раствор KCl. В три пробирки наливают по 10 мл золя и добавляют возрастающие количества раствора коагулятора: в первую пробирку из бюретки наливают 0,5 мл раствора электролита, в каждую последующую – на 0,5 мл больше. Отмечают состояние золя в каждой пробирке (отсутствие или появление мутности). Полученные результаты записывают в таблицу (см. табл. III.4), при этом наличие коагуляции отмечается знаком «+», отсутствие коагуляции – знаком «-». Защитное число вещества определяют следующим образом. В 10 пробирок наливают по 10 мл исследуемого золя. Затем в первую пробирку добавляют 0,1 мл раствора стабилизатора, а в каждую последующую на 0,1 мл больше, чем в предыдущую. Через 8-10 мин после добавления стабилизатора и встряхивания во все пробирки наливают раствор коагулятора в количестве, соответствующем порогу коагуляции, и через 3 мин отмечают состояние золя. Результаты опыта записывают в ту же таблицу (четвертая и пятая графа). Наличие коагулюма или помутнение в пробирке означает, что данного количества стабилизатора недостаточно для защиты золя. Отмечают то количество стабилизатора, при котором наступает коллоидная защита. Взяв среднее значение между этим количеством стабилизатора и тем количеством, при котором еще не происходит защита (в предыдущей пробирке), и учитывая концентрацию стабилизатора в растворе, рассчитывают защитное число. Определив защитные числа для ряда стабилизирующих веществ, сопоставляют полученные результаты и записывают соответствующие выводы в лабораторный журнал. Таблица 2.3. Форма записи результатов опытов по коллоидной защите Номер пробиркиОпределение порога коагуляцииОпределение защитного числаОбъем введенного раствора электролита, млНаличие или отсутствие коагуляцииОбъем введенного стабилизатора, млНаличие или отсутствие коагуляции РАБОТА 4 Получение эмульсий и изучение их физико-химических свойств. Цель работы: Получение эмульсии первого рода и наблюдение за явлением обращения фаз; определение устойчивости эмульсий методом диаграмм стабильности; определение пороговой концентрации эмульгатора. Теоретическая часть Эмульсией называется дисперсная система, состоящая из двух (или нескольких) жидких фаз. Условие образования таких систем – полная или частичная нерастворимость вещества дисперсной фазы в среде. Поэтому вещества, образующие различные фазы, должны сильно различаться по своей полярности. Практический интерес и наибольшее распространение получили эмульсии, в которых одна из фаз – вода. В этих случаях вторую фазу представляет неполярная или малополярная жидкость, называемая в общем случае маслом (бензол, хлороформ, керосин, растительные и минеральные масла и т.д.). Эти фазы обуславливают два основных типа эмульсий – дисперсии масла в воде (М/В) и воды в масле (В/М), прямые и обратные эмульсии соответственно. В зависимости от концентрации дисперсной фазы (С) эмульсии подразделяют на три класса: разбавленные (С0,1%); концентрированные (0,1%С74%) и высококонцентрированные, по структуре близкие к пенам (С 74%). Граница между двумя последними классами определяется тем, что частицы дисперсной фазы могут сохранить сферическую форму вплоть до объемной доли, соответствующей плотнейшей упаковке шаров. Эмульсии в основном относятся к грубодисперсным системам с размером капель от 1 до 100 мкм. Как и все дисперсные системы, эмульсии занимают промежуточное положение между молекулярными системами и сосуществующими макрофазами. Поэтому и к получению их ведут два пути: либо дробление крупных капель до требуемой дисперсности, либо объединение молекул в агрегаты указанных размеров. Конденсационный метод. Пар одной жидкости (дисперсная фаза) инжектируется под поверхностью другой, образующей дисперсионную среду. В таких условиях пар становится пересыщенным и конденсируется в виде капель с размерами порядка 1 мкм. Конденсационный метод широко применяют для получения аэрозолей. Если в несильно пересыщенный пар ввести очень маленькие (до 10-6 см) частицы и позволить им расти в течение некоторого времени, как было установлено, все капли будут иметь практически одинаковые размеры. Если такие аэрозоли станут оседать в жидкую среду, то тем самым образуется монодисперсионая эмульсия. Наиболее распространенными методами получения эмульсий являются диспергационные методы, в которых эмульгирование осуществляется с помощью пропеллерных мешалок, коллоидных мельниц, ультразвука, гомогенизаторов и др. Эмульсии – термодинамически нестабильные системы, обладающие значительной свободной энергией. Исключение составляют самоэмульгирующиеся системы с низким межфазным натяжением. Поэтому вопросы изучения устойчивости являются основными при исследовании эмульсий. Обычно выделяют три вида устойчивости: седиментационная (кинетическая); коагуляционная (агрегативная); по отношению к коалесценции. Седиментационная устойчивость. Седиментация – оседание или всплывание капель дисперсной фазы. Этот процесс приводит к образованию слоя концентрированной эмульсии («Сливок») и происходит преимущественно в разбавленных эмульсиях. Коагуляция (флокуляция) – образование агрегатов частиц дисперсной фазы в объеме дисперсионной среды. Коагуляция эмульсий экспериментально исследована слабо, так как до последнего времени отсутствовали надежные методы изучения этого процесса. Необходимо отличать коагуляцию эмульсий, стабилизированных низкомолекулярными ПАВ, от слипания эмульсионных оболочек высокомолекулярных ПАВ из-за переплетения их цепей. Значительная часть современных фундаментальных работ по теории стабильности эмульсий посвящена вопросу, в какой степени классическая теория устойчивости коллоидов ДЛФО объясняет свойства эмульсий. Нужно подходить с осторожностью в применении этой теории к микроскопическим каплям масла, стабилизированным адсорбированными эмульгирующими агентами. Она может довольно хорошо описывать стабилизацию эмульсий ионными низкомолекулярными ПАВ. Однако ее нельзя использовать для определения скорости коалесценции, так как этот процесс зависит от разрушения адсорбционной пленки. Она не применима к эмульсиям, стабилизированным твердыми частицами или гидрофильными коллоидами. В случае обратных эмульсий в непрерывной фазе отсутствует двойной электрический слой. При стабилизации эмульсий следует учитывать не только силы отталкивания-притяжения между каплями, но и адсорбцию ПАВ. Иначе трудно объяснить, почему только определенные ПАВ являются стабилизаторами эмульсий. Коалесценция – слияние мелких капель в крупные с конечным выделением вещества дисперсной фазы в гомогенный слой. Лишь процесс коалесценции приводит к необратимому разрушению эмульсий. Возможно также разрушение эмульсии при растворении малых капель и конденсации вещества на более крупных каплях (изотермическая перегонка) в результате зависимости давления насыщенного пара над каплей от ее кривизны RTln P0/Pr=Vir – уравнение Томсона-Кельвина. Однако этот процесс может вносить заметный вклад в разрушение лишь крайне высокодисперсных эмульсий (r10-5см), имеющих при этом достаточно широкое распространение по размерам, и, видимо, не является лимитирующим. Как и всякий кинетический процесс, коалесценция определятся движущей силой и сопротивлением. Разрушаются эмульсии благодаря тому, что разделяющая фазы пленка стремится приобрести меньшую свободную энергию за счет сокращения поверхности. Следовательно, поверхностное натяжение и межмолекулярные силы создают тенденцию к коалесценции. Препятствуют коалесценции силы, удерживающие молекулы ПАВ на поверхности раздела (работа адсорбции), так как при коалесценции происходит десорбция ПАВ. Таким образом, работа адсорбции служит энергетическим барьером. При приближении двух капель друг к другу защитный слой ПАВ должен предотвратить коалесценцию, сохраняя расстояние между каплями больше, чем радиус действия дисперсионных сил в жидкости (10А). Следовательно, часть молекулы ПАВ, находящаяся в непрерывной фазе, должна быть более 10А; молекулы ПАВ должны прочно удерживаться на границе раздела фаз, т.е. не десорбироваться ни в одну из граничащих фаз; концентрация ПАВ на поверхности должна быть такой, чтобы не образовывались участки поверхности без защитного слоя, т.е. адсорбция практически равна предельной монослойной. Второе условие предотвращения коалесценции соблюдается при величинах работы адсорбции ПАВ, определяемых по каждой из граничащих фаз, больших Wmin= 17 КДж/моль. На устойчивость к коалесценции большое влияние оказывает вязкость непрерывной фазы. В высоковязкой среде каплям трудно приблизиться друг к другу, они как бы «замурованы» в непрерывной фазе и вероятность из столкновения низка. При таких условиях возможно существование устойчивых эмульсий и без стабилизаторов. При адсорбции на границе жидкость/жидкость высокомолекулярных ПАВ образуются слои, обладающие значительной толщиной и, как правило, гелеобразной структурой (структурно-механический барьер), адсорбция подобных ПАВ необратима. Кроме того, коалесценции капель препятствует и энтропийный фактор. При перекрывании адсорбционных слоев полимерных ПАВ сокращается число доступных конформаций макромолекул, что термодинамически невыгодно. Для полиэлектролитов определенный вклад в устойчивость эмульсий вносит и электростатический фактор. Большинство растворов полимерных ПАВ также обладают повышенной вязкостью. Поэтому эмульсии, стабилизированные природными (белки, полисахариды) и синтетическими (поливиниловый спирт, твины) полимерными ПАВ, обладают крайне высокой стабильностью к коалесценции. Устойчивость эмульсий к коалесценции в основном определяется структурно-механическими характеристиками адсорбционных слоев ПАВ. Тип эмульсии, образующейся при механическом диспергировании, в значительной мере зависит от соотношения объемов фаз. Жидкость, содержащаяся в большом объеме, обычно становится дисперсионной средой. При равном объемном содержании двух жидкостей при диспергировании возникают эмульсии обоих типов, но "выживает" из них та, которая имеет более высокую агрегативную устойчивость и определяется природой эмульгатора. Способность эмульгатора обеспечяивать устойчивость эмульсии того или иного типа определяется энергетикой взаимодействия его с полярной и неполярной средами, которая может быть охарактеризована при помощи полуэмпирической характеристики - числа гидрофильно-лиофильного баланса (ГЛБ) поверхностно-активных веществ. ПАВ, имеющие низкие значения ГЛБ (2-6), лучше растворимы в органических средах и стабилизируют эмульсии вм, тогда как при ГЛБ = 12-18 ПАВ лучше растворяются в воде и стабилизируют эмульсии мв. Щелочные соли жирных кислот средней молекулярной массы всегда дают эмульсии типа мв, а соли двухвалентных металлов, например магния, - эмульсии вм. При постепенном увеличении концентрации двухвалентных ионов в эмульсии мв, стабилизированной мылом с катионом однозарядного металла, происходит обращение эмульсии и ее переход в эмульсию типа вм. В настоящее время существует две количественных характеристики эмульсии, полученной с помощью определенного раствора ПАВ: максимальный объем эмульсии (V) и максимальная поверхность эмульсии (S). Однако Vнедостаточно объективная характеристика, так как зависит от метода получения эмульсии. При более интенсивном смешении фаз капли получаются меньшего размера и при одном и том же количестве ПАВ V будет меньше, чем при слабом перемешивании. S является константой, не зависящей от внешних параметров. Одна и та же поверхность в эмульсии может реализоваться по-разному – в виде различных соотношений крупных и мелких капель. Размер капель и распределение их по размерам зависит от метода получения эмульсии и служит характеристикой самой эмульсии, а не ПАВ. Экспериментально показано, что S не зависит от поверхностной активности ПАВ, а определяется предельной адсорбцией Г и концентрацией ПАВ в системе. S не связана с устойчивостью эмульсий: при большом значении S эмульсии могут быть неустойчивыми и наоборот. Появление в последнее время автоматических анализаторов изображений, позволяющих быстро определять распределение капель эмульсии по размерам, сделало возможным гораздо менее трудоемкое экспериментальное определение параметров Г и S . Нижний предел концентрации ПАВ. Пределы концентрации, в которых ПАВ проявляют эмульгирующие свойства, необходимо знать при практическом использовании ПАВ, ибо определенной концентрации (Се) ПАВ не только не проявляют эмульгирующих свойств, но и практически не понижают поверхностное натяжение. ПАВ являются стабилизаторами эмульсий при образовании насыщенного адсорбционного слоя. Отсюда Се можно определить из уравнения Ленгмюра при условии Г/ Г I, т.е. Се = С. Однако при этих расчетах необходимо задаваться соотношением Г/ Г близким, а не равным I, так как при Г/ Г = I Се = . Отношение Г/ Г, при котором ПАВ стабилизирует эмульсии, различается для разных классов ПАВ, и, как правило, превышает 0,9. Экспериментальная часть Для проведения работы необходимы: Пробирки, Пипетки, Микроскоп, Предметные и покровные стекла, Толуол, подкрашенный суданом III, Растворы олеата натрия и хлорида кальция, Колба емкостью 100 мл, Раствор ПАВ. Вариант 1 Получение эмульсии масло/вода и наблюдение за явлением обращения фаз. В пробирку наливают 0,5 мл толуола, подкрашенного маслорастворимым красителем суданом III и добавляют 0,5 мл воды. Пробирку сильно встряхивают. Убеждаются в том, что образовавшаяся эмульсия неустойчива. Далее в ту же пробирку добавляют 0,5 мл 3%-ного раствора олеата натрия и вновь сильно встряхивают. Каплю эмульсии помещают на предметное стекло и рассматривают в микроскопе при небольшом увеличении. Добавляют в пробирку 0,5 мл 2%-ного раствора хлорида кальция и 0,5 мл толуола и пробирку сильно встряхивают. Рассматривают в микроскопе каплю эмульсии и убеждаются, что произошло обращение фаз. Микроскопическую картину эмульсии мв и вм зарисовывают в тетрадь, затушевывая области, соответствующие углеводородной фазе. Схематически показывают строение слоя эмульгатора на поверхности капель, пользуясь общепринятыми символами молекулы поверхностно-активного вещества:  Вариант 2 Определение устойчивости эмульсий методом диаграмм стабильности Сущность метода. Метод диаграмм стабильности характеризует устойчивость эмульсий по отношению к коалесценции и флотации. Приготовляют серию эмульсий с различным соотношением масло/вода, но постоянным суммарным объемом. Эмульсии помещают в градуированные пробирки и выдерживают в них до полного разделения фаз. Затем измеряют объемы водной и неполярной фаз. Таким образом, получают две точки на одном вертикальном сечении диаграммы. Линии, соединяющие экспериментальные точки, определяют области существования свободных фаз и эмульсии. Диаграммы (рис.2.4) позволяют определить следующие качественные характеристики эмульсии: начальное содержание неполярной фазы, при котором резко снижается устойчивость эмульсии (точка А на диаграмме), и отношение площади, соответствующей существованию эмульсии, к полной площади диаграммы С. Порядок проведения работы. Приготовить 100 мл раствора ПАВ указанной преподавателем концентрации. Приготовить эмульсии, содержащие 20, 30, 40, 50, 55, 60, 65, 70, 75 и 80% декана (или другой неполярной жидкости) с суммарным объемом 10 мл. Перелить эмульсии в градуированные пробирки и выдержать до конца занятия. Провести замеры отделившихся фаз. На следующем занятии провести повторные замеры. Построить диаграмму стабильности и определить значения А и С. 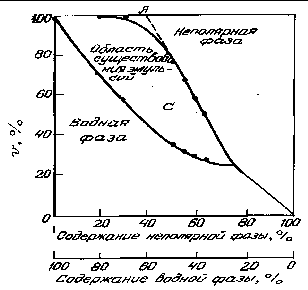 Рис.2.4. Диаграмма стабильности эмульсий Вариант 3 Определение пороговой концентрации эмульгатора. Сущность метода. Метод позволяет определить пороговую концентрацию эмульгатора при определенном способе получения эмульсии. Эмульсии типа масло в воде приготовляют двумя способами: ручным встряхиванием и на лабораторном гомогенизаторе. При этом получают эмульсии с существенно разными распределениями по размерам и величинами дисперсности. Эмульгирование проводят при постоянном соотношении полярной и неполярной фаз, варьируя концентрацию эмульгатора. Эмульсию считают устойчивой, если за промежуток времени в один час не наблюдают отделения неполярной фазы. Минимальную концентрацию ПАВ, при которой существует устойчивая эмульсия, принимают за пороговую концентрацию. Порядок работы. Из исходного раствора ПАВ приготовить последовательным разбавлением в два раза 10 растворов. Ручным встряхиванием приготовить эмульсии с содержанием неполярной фазы 30% в градуированных пробирках на 20 мл. На гомогенизаторе приготовить эмульсии общим объемом 50 мл, непосредственно после перемешивания отбирая 20 мл эмульсии в градуированные пробирки. Через час после приготовления эмульсий проверяют наличие отделившейся неполярной фазы и определяют пороговую концентрацию стабилизатора. Сравнивают значения пороговой концентрации стабилизатора для различных способов диспергирования и объясняют полученный результат. РАБОТА 5 Получение пен и изучение их устойчивости. Цель работы: Получение пены и изучение влияния рН, вязкости дисперсной среды, добавок высокомолекулярного соединения на ее устойчивость. Теоретическая частьПена – дисперсия газа (чаще всего воздуха) в жидкой или твердой дисперсионной среде, представляет собой типичную лиофобную систему. Различают разбавленные дисперсии газа в жидкости, которые за сходство с разбавленными эмульсиями обычно называют газовыми эмульсиями, и собственно пены с содержанием газовой фазы более 70 объемных процентов. В качестве характеристики концентрации пены часто используют отношение объема пены к объему содержащейся в ней жидкости; эту величину называют кратностью пены. Для «влажных» пен, состоящих из сферических пузырьков газа, разделенных толстыми прослойками жидкости, кратность меньше 10; для «сухих» пен с тонкими прослойками кратность достигает 1000. Для получения пен применяют как диспергационные (встряхивание, интенсивное перемешивание, продавливание газа в жидкость через пористый фильтр), так и конденсационные методы (выделение газовой фазы при кипении или пересыщении); примером последнего может служить получение пенобетона в результате протекания реакции 2Al + 2Ca(OH)2 + 2H2O 2CaHAIO2 + 3H Ячейки пены имеют сферическую форму при кратности менее 15. При высоких значениях кратности пены ячейки принимают форму многогранников и разделены тонкими пленками жидкости. Характерной фигурой ячеек пен является пентогональный додекаэдр (двенадцатигранник с пятиугольными гранями, имеющий тридцать ребер и двадцать вершин) На рис.2.5. а приведены элементы сферической пены и элементарная ячейка полиэдрической пены (рис.2.5.б). 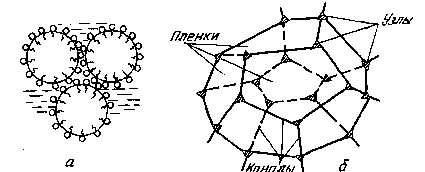 Рис. 2.5.Строенте сферической пены (а), элементарная ячейка полиэдрической пены (б). Ребрами ячейки пены служат заполненные дисперсионной средой каналы Гиббса-Плато. Плато показал, что в одном канале могут сходиться только три пленки, расположенные под углами 1200 . Поверхность канала имеет сложную вогнутую форму, описываемую условием постоянства сумм двух главных кривизн; капиллярное давление под вогнутой поверхностью обуславливает пониженное давление в канале Гиббса-Плато. Вершины соседних пентагональных додекаэдров образуют узлы, в которые сходятся четыре канала. Каналы и узлы образуют единую разветвленную систему, по которой может осуществляться перенос дисперсионной среды, в частности ее стекание под действием силы тяжести. Для пен различают седиментационную и агрегативную устойчивости. Понятие седиментационной устойчивости имеет смысл только для шаровых пен. При превращении ее в связную, полиэдрическую это понятие не используется. Агрегативная устойчивость пен характеризуется скоростью укрупнения частиц дисперсной фазы за счет коалесценции и изотермической перегонки. Стабилизации пен достигают с помощью ПАВ. При использовании ионогенных ПАВ, являющихся слабыми пенообразователями, устойчивость пен определяется электростатическим фактором. При стабилизации пен высокомолекулярными веществами образуются высоковязкие и обладающие механической прочностью адсорбционные слои, сильно замедляющие утончение и разрыв пленки. В этом случае основным фактором устойчивости пен является структурно-механический барьер. Для пен характерен специфический фактор устойчивости, названный эффектом Гиббса-Марангони. Согласно Гиббсу при быстром растяжении пленки происходит обеднение растянутого участка молекулами ПАВ, и, следовательно, увеличение . В результате растянутый участок стремиться сжаться. В динамических условиях при быстром растяжении или сжатии пленки равновесие между поверхностным слоем и объемной фазой успевает установиться не всей толщине пленки, а лишь на некоторую глубину, градиент концентрации ПАВ оказывается более крутым, что приводит к повышению упругости пленки. Это повышение упругости в динамических условиях получило название Марагони. Устойчивость пен характеризуют временем существования элемента пены (пузырька или пленки) или определенного объема пены. Кинетические зависимости разрушения пен получают, измеряя объем отделяющейся жидкости, изменения электропроводности, дисперсности и т.д. Экспериментальная часть. Для проведения работы необходимы: прибор для вспенивания; сосуд для вспенивания; колба емкостью 500 мл; стаканы химические, стеклянные градуированные цилиндры; секундомер; рН-метр; вискозиметр; раствор ПАВ; глицерин. Вариант 1 Изучение влияния рН водного раствора стабилизатора на устойчивость пен В мерной колбе на 500 мл готовят 0,5% раствор олеата натрия. Затем с помощью мерного цилиндра отбирают по 100 мл раствора в пять стаканов. Доводят значения рН до 6; 8; 10; 12; 13,5. Далее последовательно вспенивают растворы до кратности 7. Кратность определяют по метке на сосуде для вспенивания. Если какой-либо из растворов не вспенивается до заданной кратности, то этот факт отмечают в лабораторном журнале. Вспененную жидкость немедленно переносят в мерный цилиндр (до отметки 100 мл), включают секундомер и каждые 30 с регистрируют уровень отделившейся жидкости. Измерения проводят с течение 10-12 мин после включения секундомера. Результаты измерений заносят в таблицу. рН = 7рН = 10рН = 12рН = 13,5τ, с h, ммτ, с h, ммτ, с h, ммτ, с h, мм Для каждого значения рН строят зависимость высоты столба жидкости от времени. Скорость разрушения пены определяют по наклону начального участка. Строят зависимость устойчивости (ctg()) пены от рН. Делают вывод о характере влияния рН на пенообразующую способность ПАВ. Вариант 2 Изучение влияния вязкости водного раствора, содержащего стабилизатор, на устойчивость пен. В мерной колбе на 500 мл готовят 0,5%-ный раствор олеата натрия. Доводят рН раствора до 10. В четыре химических стакана переносят по 25 мл раствора олеата натрия и добавляют 75, 50 и 25 мл глицерина. Во все стаканы добавляют дистиллированную воду, доводя объем растворов до 100 мл. Повторно проверяют рН при необходимости доводят его до 10. С помощью вискозиметра Оствальда определяют вязкость растворов (см. работу 6). Далее определяют устойчивость пен так, как описано в первом варианте работы. Результаты измерений заносят в таблицу. С глицерина =0Сглицерина=25%Сглицерина=50%Сглицерина=75%τ, с h, ммτ, с h, ммτ, с h, ммτ, с h, мм Для каждого значения Сглиц. строят график в координатах . О скорости стекания пены судят, как и в первом варианте работы по тангенсу угла наклона начального участка графика. Строят график зависимости устойчивости пены (ctg ) от вязкости пенообразующих растворов и делают вывод о влиянии этого фактора на устойчивость пен. Вариант 3 Изучение влияния неионогенных ПАВ на устойчивость пен. В химических стаканах готовят растворы для вспенивания, содержащие различные количества ионогенных и неионогенных ПАВ: Номер раствора12345Ионогенное ПАВ, мл1007550250Неионогенное ПАВ, мл0255075100 Далее определяют устойчивость пен, как описано в первом варианте работы. Строят зависимость устойчивости пены от соотношения ионогенного и неионогенного ПАВ, Делают вывод об устойчивости пен в зависимости от состава смеси. РАБОТА 6 ИССЛЕДОВАНИЕ ЗАВИСИМОСТИ ВЯЗКОСТИ РАСТВОРОВ ПОЛИМЕРОВ ОТ ИХ КОНЦЕНТРАЦИИ |
