Практикум по коллоидной химии Электроповерхностные свойства и устойчивость дисперсных систем
 Скачать 346.5 Kb. Скачать 346.5 Kb.
|
|
Министерство образования Российской Федерации Московская Государственная академия тонкой химической технологии им. М. В. Ломоносова (МИТХТ) Кафедра коллоидной химии Практикум по коллоидной химии «Электроповерхностные свойства и устойчивость дисперсных систем» Москва, МИТХТ 2002г. УДК 541 ББК 24.6 Рецензент: профессор Молочко В. А. Практикум по коллоидной химии. Электроповерхностные свойства и устойчивость диспетсных систем. Буканова Е. Ф., Туторский И. А. Учебно-методическое пособие. – М.: ИПЦ МИТХТ, 2002г. Учебно-методическое пособие предназначено для выполнения лабораторных работ по дисциплине «Коллоидная химия» студентами 3 – 4 курсов бакалавриата. В предлагаемом пособии представлен теоретический материал и описание лабораторных работ по разделу: «Электроповерхностные свойства и устойчивость дисперсных систем и растворы ВМС». Московская Государственная академия тонкой химической технологии им. М. В. Ломоносова (МИТХТ), 2002 г. Учебно-методическое пособие Буканова Е. Ф., Туторский И. А. Практикум по коллоидной химии «Электроповерхностные свойства и устойчивость диспетсных систем» (для студентов бакалавриата) Сдано в печать Формат 60*90.16 Отпечатано на ризографе Тираж 800 экз. Заказ № Москва, пр. Вернадского 86 Издательско-полиграфический центр МИТХТ им. М. В. Ломоносова 1. Введение Одним из важнейших свойств дисперсных систем является их устойчивость, т. е. способность сохранять своё первоначальное состояние. Различают седиментационную и агрегативную устойчивость системы. Седиментационная или, кинетическая устойчивость характеризует способность системы к равномерному распределению частиц по всему объёму системы. Эта устойчивость зависит от интенсивности теплового движения частиц, влияния на них гравитационного поля и вязкости дисперсионной среды. Коллоидные системы, особенно лиозоли, имеющие частицы малого размера, обладают достаточно высокой седиментационной устойчивостью. Грубодисперсные системы, например суспензии или эмульсии, относятся к седиментационно неустойчивым системам. Наибольшее теоретическое и практическое значение имеет агрегативная устойчивость коллоидных систем, т. е. способность частиц не слипаться и сохранять первоначальный размер. Агрегативная устойчивость определяется свойствами поверхности или поверхностного слоя на границе дисперсной фазы и дисперсионной среды, т.е. определяется поверхностной энергией или силами, действующими между частицами в поверхностных слоях. Имеются две трактовки агрегативной устойчивости - термодинамическая и с позиций физической кинетики. Согласно термодинамической трактовке причины агрегативной неустойчивости заключены в самих признаках коллоидного состояния системы - ее гетерогенности и высокой дисперсности. Совокупность этих признаков обуславливает достаточно высокое значение свободной поверхностной энергии, что и является причиной неустойчивости коллоидной системы. Снижение поверхностной энергии, а значит более устойчивое состояние системы, возможно либо в результате уменьшения поверхности (коагуляция), либо в результате уменьшения поверхностного натяжения за счет адсорбции третьего компонента - стабилизатора на границе раздела фаз (стабилизация). Следовательно, присутствие в системе стабилизатора может обеспечивать постоянство размера частиц и является необходимым условием существования коллоидной системы. В зависимости от природы стабилизатора различают термодинамические и кинетические факторы устойчивости (стабилизации) дисперсных систем. К термодинамическим факторам устойчивости относятся: 1.Электростатический фактор, заключающийся в уменьшении поверхностного натяжения вследствие возникновения двойного электрического слоя на поверхности частиц в соответствии с уравнением Липпмана. 2.Адсорбционно-сольватный фактор, состоящий в уменьшении поверхностного натяжения в результате взаимодействия частиц с дисперсионной средой (уравнение Дюпре) или благодаря адсорбции стабилизатора (адсорбционное уравнение Гиббса). 3.Энтропийный фактор, проявляющийся в стремлении дисперсной фазы к равномерному распределению по всему объёму системы под действием теплового движения. К кинетическим факторам устойчивости относятся: 1.Структурно-механический фактор, связанный с тем, что на разрушение плёнок, образующихся в результате адсорбции на поверхности частиц длинноцепочечных ПАВ и макромолекул ВМС, и обладающих упругостью и механической прочностью, требуется энергия и время. 2.Гидродинамический фактор, заключающийся в снижении скорости движения частиц при изменении вязкости и плотности дисперсионной среды. Для реальных систем наиболее характерны смешанные факторы, агрегативная устойчивость обеспечивается действием нескольких факторов одновременно. Каждому фактору устойчивости соответствует специфический метод его подавления. Например, электростатический фактор очень чувствителен к введению электролита. Действие структурно-механического фактора можно подавить с помощью веществ, разжижающих упругие структурированные слои на поверхности частиц, а также механическим и термическим способами и др. Устойчивость дисперсных систем определяется балансом сил притяжения и сил отталкивания частиц. Силы притяжения обусловлены межмолекулярными силами Ван-дер-Ваальса, из которых наиболее универсальными являются лондоновские силы дисперсионного взаимодействия, изменяющиеся по степенному закону. По теории ДЛФО (Дерягина, Ландау, Фервея, Овербека), учитывающей только электростатическую составляющую расклинивающего давления, энергия отталкивания убывает с расстоянием по экспоненциальному закону. Суммарная энергия взаимодействия частиц равна где К - константа, зависящая от величины потенциала диффузионного слоя, его толщины, диэлектрической проницаемости дисперсионной среды; А – константа Гамакера, являющаяся суммой констант когезионного и адгезионного взаимодействия; h - расстояние межму частицами; n - показатель степени, изменяющийся от 1 до 3. Взаимодействие двух частиц дисперсной фазы принято характеризовать с помощью потенциальных кривых - зависимостей энергии взаимодействия от расстояния (рис. 1) Р 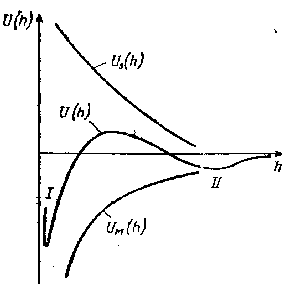 ис. 1.1 Зависимость энергии электростатического отталкивания Uэ, энергии молекулярного притяжения Uм и суммарной энергии взаимодействия частиц (пластин) U от расстояния. Суммарная потенциальная энергия имеет сложный вид. При h Рассмотренные факторы и закономерности устойчивости и коагуляции в дисперсных системах относятся к лиозолям, микрогетерогенным системам (эмульсиям и пенам) 2. ЛАБОРАТОРНЫЕ РАБОТЫ РАБОТА 1. ОПРЕДЕЛЕНИЕ ЭЛЕКТРОКИНЕТИЧЕСКОГО ПОТЕНЦИАЛА КОЛЛОИДНЫХ ЧАСТИЦ И ИЗУЧЕНИЕ ВЛИЯНИЯ НА НЕГО ЭЛЕКТРОЛИТОВ |
