Практикум по коллоидной химии Электроповерхностные свойства и устойчивость дисперсных систем
 Скачать 346.5 Kb. Скачать 346.5 Kb.
|
Экспериментальная частьДля проведения работы необходимы: Прибор для макроэлектрофореза типа Кёна или стенд, состоящий из трех таких приборов. Источник постоянного тока и вольтметр. Набор колб, пипеток и бюреток. Латекс, разбавленный до 1%-ного содержания сухого остатка. Боковая жидкость. Электролиты: растворы хлоридов калия и кальция. Перед проведением работы студент должен узнать у преподавателя, какой вариант он выполняет. Работу выполняют с помощью прибора типа Кёна* (рис.2.2). Если изучают влияние электролитов на -потенциал, опыт ведут одновременно на трех приборах, скомпонованных на одном щите. От обычного прибора Кёна данный прибор отличается тем, что позволяет работать с неполяризующимися электродами (например, CuSO4) и боковой жидкостями осуществляется при помощи агарагаровых мостиков, насыщенных KCl. В качестве исследуемой коллоидной системы в первом варианте работы используют латекс. Боковой жидкостью служит дистиллированная вода, в которую добавляют небольшое количество раствора KCl, чтобы электропроводности боковой жидкости и латекса были одинаковыми. Эта боковая жидкость должна быть заранее приготовлена и находиться на рабочем месте. Для изучения влияния концентрации противоионов на электрокинетический потенциал (второй вариант работы) берут исходный Рис. 2.2. Схема прибора для макроэлектрофореза типа Кена. латекс и два латекса, содержащих различные концентрации KCl или CaCl2. Для изучения влияния валентности противоионов на электрокинетический потенциал (третий вариант работы) наряду с исходным латексом исследуют латексы, содержащие KCl и CaCl2 в одинаковой концентрации. Во втором и третьем вариантах работы боковой жидкостью служит раствор электролита той же концентрации, что концентрация электролита в латексе. Концентрации электролитов указываются преподавателем. Разбавление латексов растворами электролитов проводят следующим образом. В мерную колбу емкостью 50 мл из бюретки вводят определенный объем исходного раствора электролита и при перемешивании доводят объем раствора до метки исходным латексом. Б 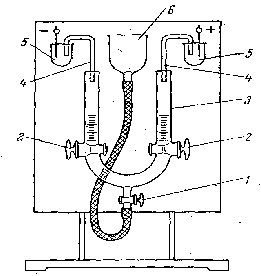 оковую жидкость готовят так же, только содержимое колб доводят до метки не латексом, а дистиллированной водой. Таким образом, при работе по второму и третьему варианту студент должен иметь три образца латекса и три соответствующие боковые жидкости. Порядок работы на приборе (рис.2.2). В колена U-образной электрофоретической трубки 3 при открытых кранах 1 и 2 через воронку 6 наливают латекс до тех пор, пока жидкость не выступит из верхних отверстий кранов 2. После этого высвобождают U-образную трубку из штатива и, взяв в руки, осторожно поднимая и отпуская ее, полностью вытесняют пузырьки воздуха из жидкости. Затем закрывают все краны прибора, осторожно сливают избыток латекса, находящегося в боковых коленах трубки, и промывают последние сначала дистиллированной водой, а потом небольшим количеством боковой жидкости для данного латекса. После этого оба колена трубки почти доверху заполняют жидкостью так, чтобы уровни жидкости в обоих коленах трубки были одинаковы. Прибор закрепляют в штативе и в верхние отверстия электрофоретической трубки вводят длинные концы агар-агаровых мостиков 4. Короткие концы агар-агаровых мостиков погружают в небольшие стаканчики 5, заполненные раствором сульфата меди. Необходимо следить за тем, чтобы в боковую жидкость погружалось всегда одно и то же колено агар-агарового мостика, не побывавшее в растворе сульфата меди. В противном случае, поскольку раствор сульфата меди пропитывает агар-агаровый студень, при погружении в боковую жидкость ионы меди могут диффундировать и вызвать коагуляцию латекса. После заполнения прибора осторожно открывают краны 2 в боковых коленах прибора и подают напряжение. С помощью реостата поддерживают постоянство показаний вольтметра, включенного в электрическую цепь (110-120 В). Пользуясь секундомером, по шкале, нанесенной на боковых коленах трубки, определяют скорость передвижения границы раздела латекс – боковая жидкость (наблюдения ведут только за поднимающейся границей). Скорость электрофореза для каждого образца латекса замеряют три раза, каждый раз наблюдая за перемещением границы на расстояние 5 мм. По окончании измерений прибор выключают и с помощью шнура или гибкой проволоки определяют вдоль U-образной трубки расстояние L между концами агар-агаровых мостиков. Электрическим сопротивлением самих мостиков можно пренебречь ввиду высокой концентрации в них электролита. На основании полученных данных рассчитывают -потенциал по формуле 2.3. Экспериментальные и расчетные данные записывают в таблицу (см. табл. 2.1) Таблица 2.1. Форма записи экспериментальных и расчетных результатов по определению электрокинетического потенциала латекса и влиянию на него электролитов*
Составляют отчет с выводом, обобщающим полученные экспериментальные данные. * В приборе такого типа можно определять -потенциал только таких коллоидных систем, дисперсная фаза которых имеет плотность больше единицы. * При выполнении работы по первому варианту первые три столбца таблицы не заполняются. РАБОТА 2 ИССЛЕДОВАНИЕ КИНЕТИКИ КОАГУЛЯЦИИ ЛАТЕКСОВ, СТАБИЛИЗОВАННЫХ ИОНОГЕННЫМИ ПАВ. Цель работы Изучение кинетики коагуляции синтетических латексов электролитами; определение порога быстрой коагуляции и выяснение влияния на него валентности ионов (вывод правила значности); установление зависимости порога коагуляции от свойств защитного слоя стабилизатора. Теоретическая часть Обычные коллоидные системы являются агрегативно неустойчивыми. Присутствие стабилизатора на поверхности частиц обеспечивает временную устойчивость этих систем. Различные, порой незначительные воздействия на систему приводят к нарушению ее устойчивости, к процессу коагуляции. Поэтому вопросы устойчивости систем составляют важнейшую проблему, которая может быть решена лишь при глубоком теоретическом и экспериментальном изучении явления коагуляции. Коагуляция может происходить при введении различных электролитов и неэлектролитов, механическом воздействии, нагревании или замораживании. Наиболее важное место среди астабилизующих факторов занимает введение электролитов. Электролитная коагуляция особенно ярко протекает в тех коллоидных системах, в которых стабилизатор имеет ионный характер и устойчивость в огромной степени обеспечивается электростатическим отталкиванием коллоидных частиц. Коагулирующие действие электролита заключается в его влиянии на свойства двойного электрического слоя, в результате чего происходит уменьшение электростатического отталкивания частиц, а значит и возможное их слипание. В зависимости от интенсивности коагулирующего влияния электролита возможна различная вероятность слипания частиц (меньшая или равная единице) и, соответственно, протекает медленная или быстрая коагуляция. Коагулирующая способность электролита характеризуется его минимальной концентрацией, необходимой для протекания в системе коагуляции. Эта концентрация называется порогом коагуляции. Различают два типа электролитной коагуляции коллоидных систем: 1) нейтрализационную, происходящую в результате снижения поверхностного потенциала частиц; 2) концентрационную, протекающую вследствие сжатия диффузной части двойного электрического слоя (потенциал поверхности в этом случае не изменяется). Введение электролитов снижает высоту потенциального барьера (см. рис.1.1), но при небольших концентрациях электролита энергетический барьер остаётся достаточно велик и коагуляция частиц не происходит. Агрегация наступает при введении определённого для данной системы количества электролита, соответствующего порогу коагуляции. Порог быстрой коагуляции Ск определяет количество электролита, необходимое для коагуляции единицы объема коллоидной системы при полном исчезновении потенциального барьера. При сохранении небольшого потенциального барьера в системе протекает медленная коагуляция. Поскольку скорость медленной коагуляции меняется в достаточно широком интервале, определения порога медленной коагуляции можно проводить при произвольно выбранной скорости процесса. В таком случае найденное значение порога медленной коагуляции является условным, характеризующим лишь относительную способность электролитов – коагулянтов. Более объективную оценку коагулирующих свойств электролита выражает порог быстрой коагуляции. Чем больше требуется электролита для протекания в системе быстрой коагуляции, тем выше силы отталкивания коллоидных частиц и, значит, выше энергетический барьер на результирующей кривой взаимодействия частиц. Следовательно, порог быстрой коагуляции является теоретически обоснованной мерой устойчивости системы и может быть использован для сравнительной характеристики различных коллоидный систем. При электролитной коагуляции по концентрационному механизму (для сильно заряженных золей) порог коагуляции Ск в соответствие с правилом Дерягина-Ландау обратно пропорционален заряду z противоионов в шестой степени, т. е. В процессе коагуляции латексов образуются сравнительно небольшие по размерам седиментационно устойчивые агрегаты. Поэтому исследование коагуляции латексов удобнее всего проводить турбидиметрическим методом. Применимость этого метода основывается на сильной зависимости интенсивности светорассеяния от размеров частиц. При коагуляции частиц она повышается, соответственно увеличивается оптическая плотность латекса. Порог быстрой коагуляции находят по пороговому объему электролита Vк (мл), при котором оптическая плотность золя достигает максимального значения, а при дальнейшем добавлении электролита не изменяется (рис.2.3). Значение Ск рассчитывают по формуле где Сэл – концентрация введённого электролита, моль/л; V – объем золя, мл. Существует другой, ускоренный метод определения порога быстрой коагуляции, который основан на следующей зависимости. Как показал эксперимент, мутность или оптическая плотность коагулирующей системы через определенный небольшой промежуток времени после введения электролита (например, через 1 мин) сначала увеличивается с ростом концентрации электролита, а затем при концентрации, соответствующей порогу быстрой коагуляции, перестает меняться. Таким образом, достаточно 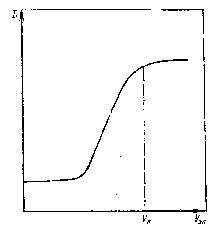 Рис. 2.3. Зависимость оптической плотности золя от объема электролита. получить зависимость “минутной” мутности или оптической плотности от концентрации электролита и тогда по перегибу на соответствующей кривой можно найти значение порога быстрой коагуляции. Экспериментальная часть Для проведения работы необходимы: Фотоэлектроколориметр-нефелометр КФК-3. Набор колб и пипеток. Секундометр. Латекс, разбавленный в 103 раз. Электролиты: 1М раствор хлорида калия; 0,1 М раствор хлорида кальция; 0,01М раствор хлорида алюминия. Из исходных раствором электролитов готовят рабочие растворы следующих концентраций: 100; 200; 300; 400; 500; 600 и 900 ммоль/л для KCl; 5; 10; 15; 20; 30; 40; 50; и 60 ммоль/л для CaCl2 и 0,5; 1; 1,5; 2; 3; 4 и 5 ммоль/л для AlCl3. После приготовления растворов электролитов приступают к определению оптической плотности коагулирующего латекса. Предварительно знакомятся с принципом действия и порядком работы на приборе КФК-3, описанном в работе. При выполнении работы по первому варианту определяют значения оптической плотности коагулирующей системы во времени. Для этого в кювету прибора наливают 4 мл раствора электролита (концентрация уточняется преподавателем), добавляют 1 мл латекса и включают секундомер. Через 1 мин проводят первое измерение оптической плотности, затем проводят измерения в течение 1-1,5 ч через каждые 10-15 мин. По полученным данным строят нефелометрическую кривую коагуляции, по которой определяют длительность первой стадии коагуляции. Проведя опыт для двух электролитов при равной их концентрации или для одного электролита двух концентраций, делают вывод о коагулирующем влиянии электролита и характере первой стадии коагуляции. Для определения порога быстрой коагуляции (второй вариант работы) в кювету прибора наливают 4 мл раствора электролита, вводят 1 мл латекса и через 1 мин измеряют оптическую плотность. Результаты определения «минутной» оптической плотности для различных концентраций электролитов записывают в таблицу (см. табл. III.3). Строят графики зависимости оптической плотности D от электролита cэл (рис. 2.3). Из точки пересечения продолжения обоих прямолинейных участков кривой опускают на ось абсцисс и находят порог быстрой коагуляции для каждого электролита. Получив полученные значения порогов коагуляции на наименьшее из них, выводят правило значности и сопоставляют с правилом Дерягина – Ландау. Таблица 2.2. Форма записи результатов измерений оптической плотности коагулирующего латекса KClCaCl2AlCl3cэл, ммоль/лDcэл, ммоль/лDcэл, ммоль/лD0 100 200 300 400 500 600 9000 5 10 15 20 30 40 500 0.5 1 1.5 2 3 4 5 Для выполнения работы по третьему варианту определяют порог быстрой коагуляции, как это описано выше, для двух латексов, стабилизованных различными ПАВ при действии какого-нибудь одного электролита (по указанию преподавателя). Работа завершается анализом полученных экспериментальных данных РАБОТА 3 КОЛЛОИДНАЯ ЗАЩИТА Цель работы Определение защитного числа и выяснение влияния природы защитных веществ на их стабилизирующее действие. | ||||||||||||||||||||||||||||||
