Аналитическая химия. !курс лекций 5 семестр. Предмет аналитической химии
 Скачать 4.18 Mb. Скачать 4.18 Mb.
|
ГЛАВА 9 9.1. Общая характеристика и классификация Всякий раз, когда химик сталкивается с необходимостью анализа сложного объекта, в котором наряду с интересующим его соединением содержится много других веществ, и, кроме того, концентрация этого соединения очень мала, перед ним обязательно встают следующие проблемы. Во-первых, как добиться того, чтобы посторонние вещества не мешали определению? Во-вторых, можно ли повысить концентрацию вещества в исследуемом объекте? Для решения подобных проблем в аналитической химии используют разнообразные методы разделения и концентрирования. Разделение- любой процесс или операция, в результате которых компоненты, составляющие исходную смесь, отделяются один от другого. Процесс, в котором нужные компоненты выделяют в самостоятельную фазу или часть фазы, называется выделением. 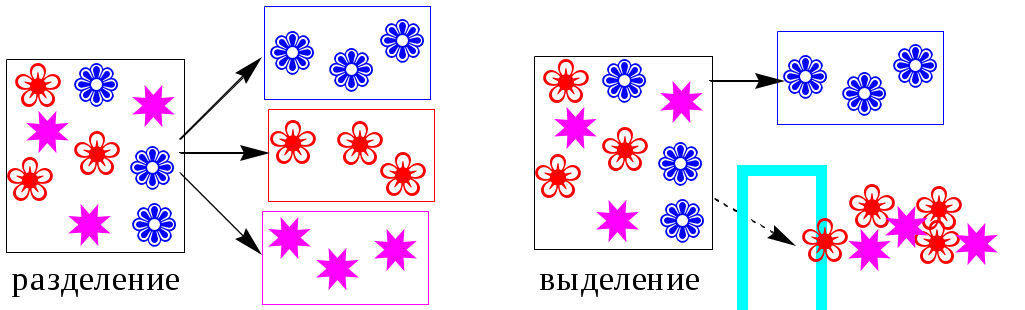 Концентрирование - процесс или операция повышения содержания определяемого вещества по отношению к матрице или матричным компонентам. 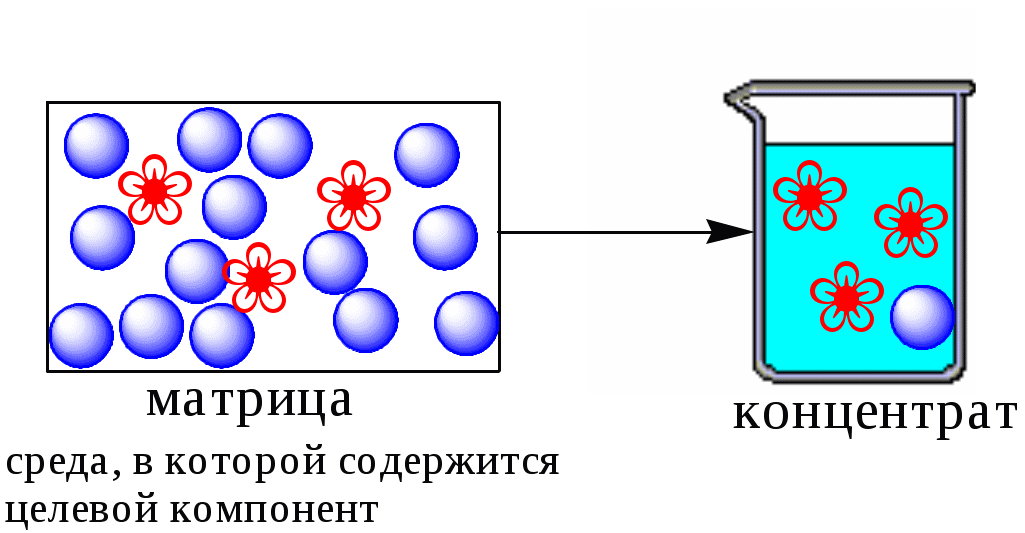 Концентрирование является частным случаем разделения. В основе этих операций лежат, как правило, одни и те же процессы. Различие между ними заключается в целях проведения. Цель разделения - упрощение способов определения интересующего нас вещества, цель концентрирования - снижение предела обнаружения (определения) вещества. Для количественной характеристики эффективности разделения и концентрирования используют, соответственно, коэффициент разделения и коэффициент концентрирования. Рассмотрим, например, процесс разделения веществ, основанный на их различном распределении между двумя фазами. Отношение общих концентраций вещества в одной и второй фазах называется коэффициентом распределения (D). Коэффициент разделения (KA/B) - это отношение коэффициентов распределения двух веществ. 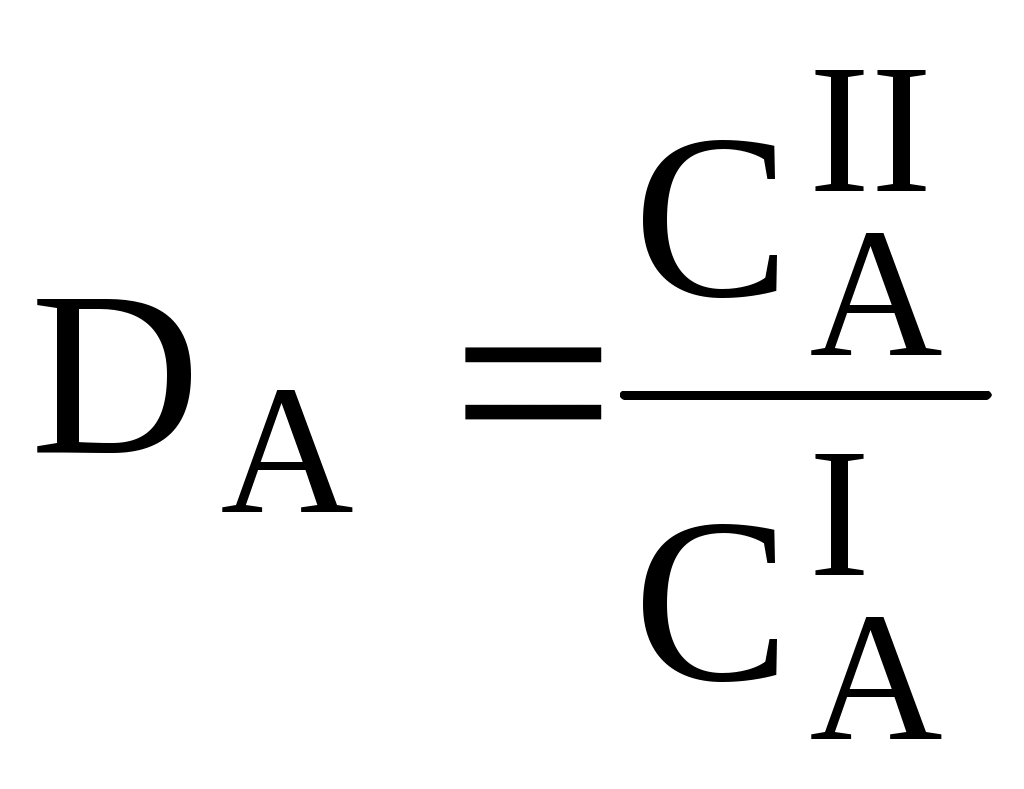 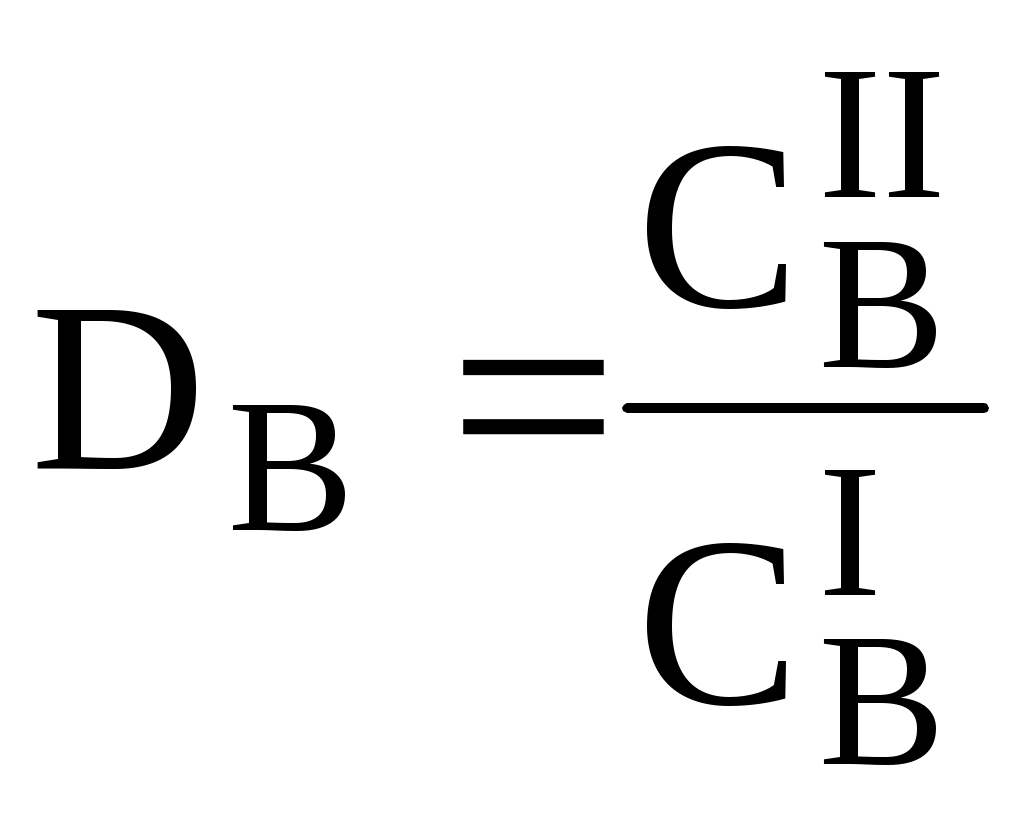 Разделение считается эффективным, если значение KA/B велико, а произведение DADB близко к 1. Коэффициент концентрирования – величина, показывающая во сколько раз изменяется отношение абсолютных количеств микро - и макрокомпонента в концентрате по сравнению с исследуемой матрицей. В настоящее время известны десятки различных методов разделения и концентрирования веществ. Единой и общепринятой их классификации нет. Обычно в качестве основного классификационного критерия используют наличие и характер фазовых переходов. Методы разделения, основанные на различном межфазном распределении веществ, в которых одна из фаз является подвижной, а другая - неподвижной и процесс переноса вещества между ними происходит многократно, называются хроматографическими. Хроматографические процессы могут протекать в системе жидкость-жидкость (жидкость-жидкостная хроматография), жидкость - твёрдое вещество (адсорбционная хроматография, ионообменная хроматография и др.), газ - жидкость (газожидкостная хроматография) и т.д. 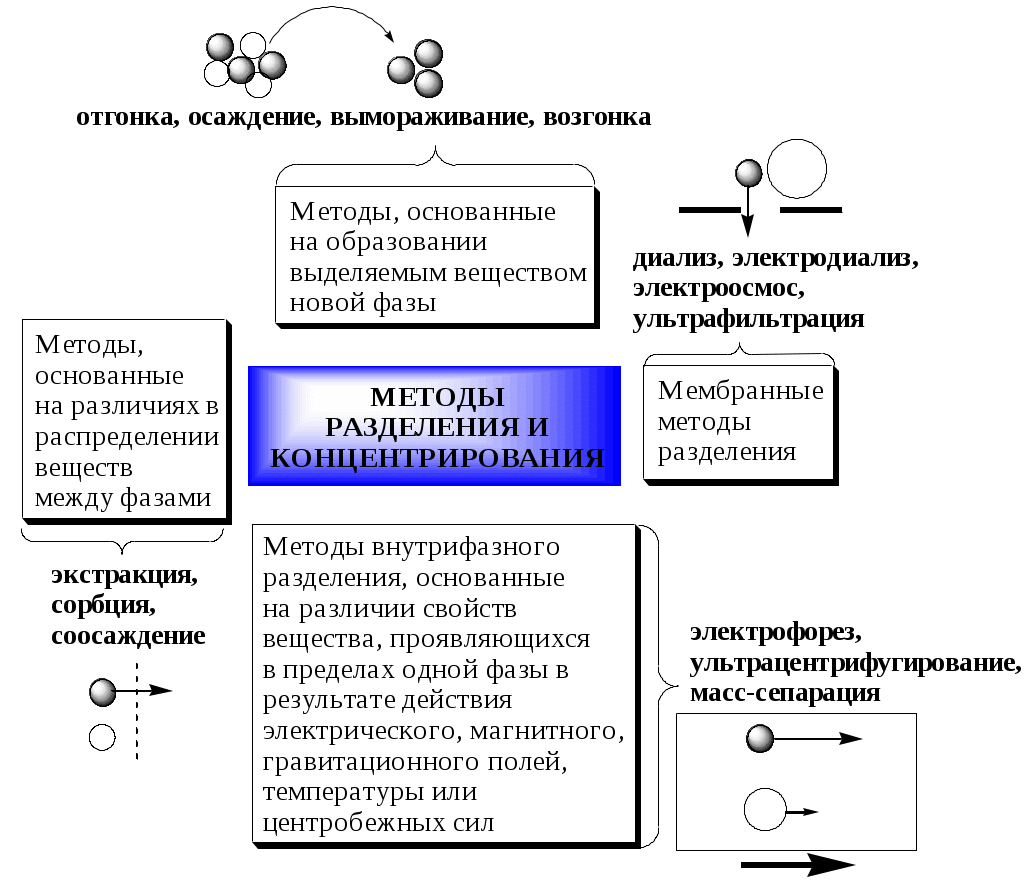 9.2. Жидкость - жидкостная экстракция Жидкость-жидкостная экстракция - метод разделения и концентрирования веществ, основанный на их различном распределении между двумя несмешивающимися жидкими фазами, обычно между водой и несмешивающимся с ней органическим растворителем. Жидкая фаза (органический растворитель или их смесь), в которую переходит вещество, например, из водной фазы называется экстрагентом. Если экстракция обусловлена образованием новых химических соединений, то экстрагентом обычно называют реагент, при взаимодействии с которым образуется экстрагируемое соединение. Отделённая органическая фаза, содержащая вещество, экстрагированное из водной фазы, называется экстрактом. Процесс обратного извлечения вещества из экстракта в водную фазу называется реэкстракцией. Раствор, используемый для извлечения вещества из экстракта, называется реэкстрагентом. Отделённая водная фаза, которая содержит вещества, извлечённые из экстракта в результате реэкстракции, называется реэкстрактом. 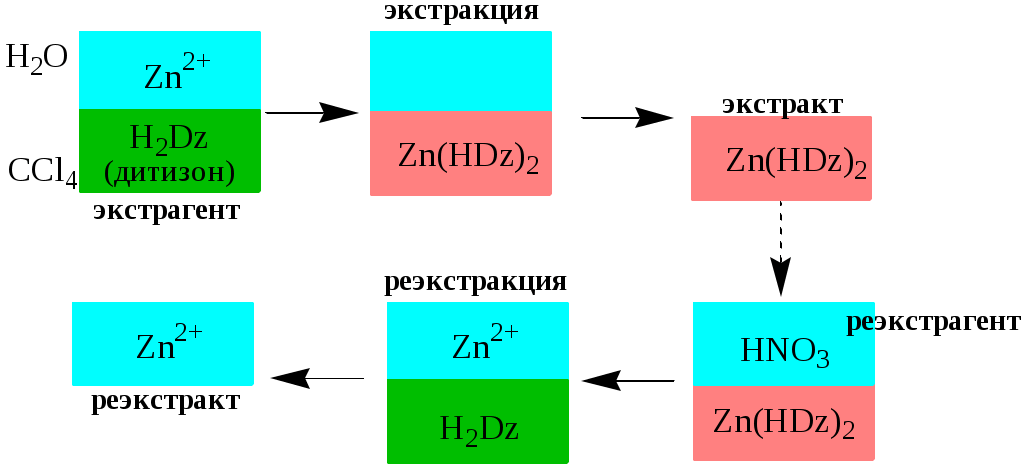 9.2.1. Количественные характеристики экстракционного равновесия Экстракционное равновесие описывается с помощью закона распределения Нернста. При постоянной температуре третий компонент, добавленный к системе, состоящей из двух несмешивающихся или ограниченно смешивающихся жидкостей, распределяется между ними в определённом постоянном для данной температуры соотношении. 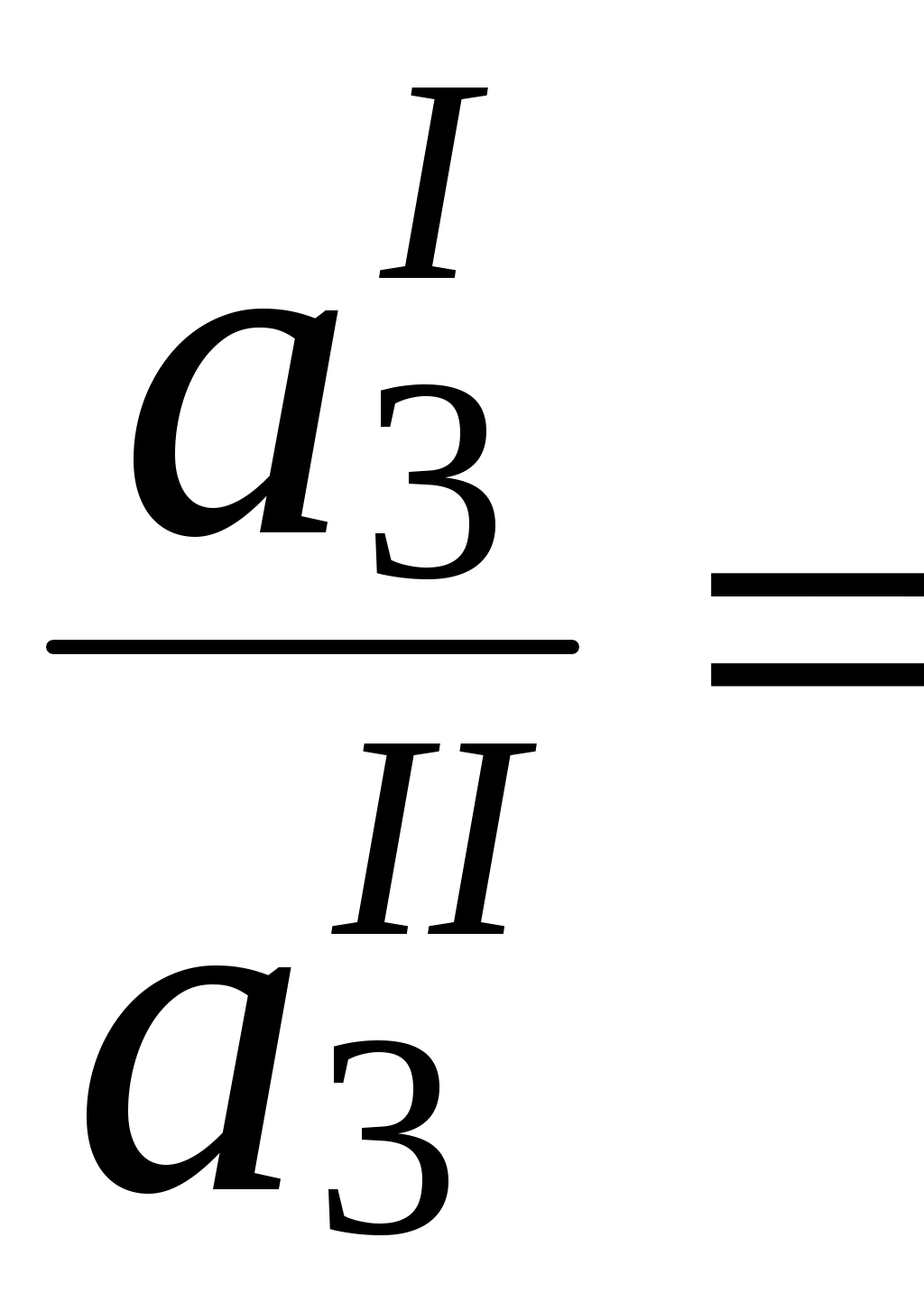 K0 - термодинамическая константа экстракции K0 - термодинамическая константа экстракцииНа практике для описания экстракционного равновесия используют: константа распределения (P0), коэффициент распределения (D), степень однократной экстракции (R), константа экстракции (Kex). Константа распределения - это отношение равновесной концентрации строго определённой формы вещества в органической фазе к равновесной концентрации этой же формы в водной фазе. Коэффициент распределения - это отношение общей концентрации всех форм существования экстрагируемого вещества в органической фазе к общей концентрации всех его форм, находящихся в водной фазе. Например, при экстракции слабой кислоты из водной фазы неполярным органическим растворителем 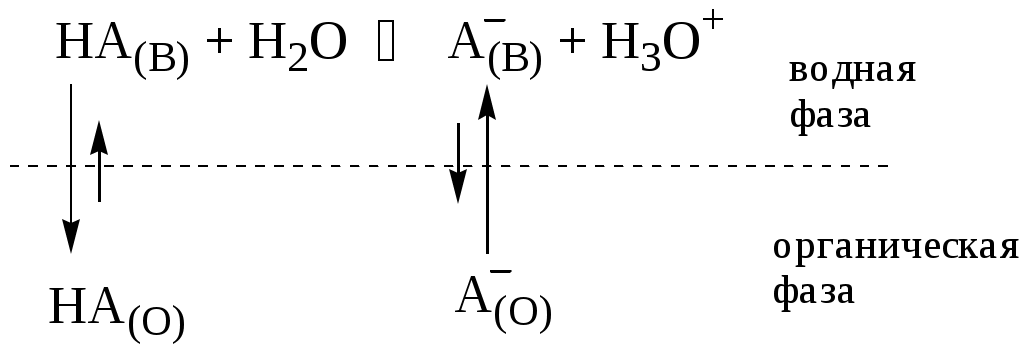 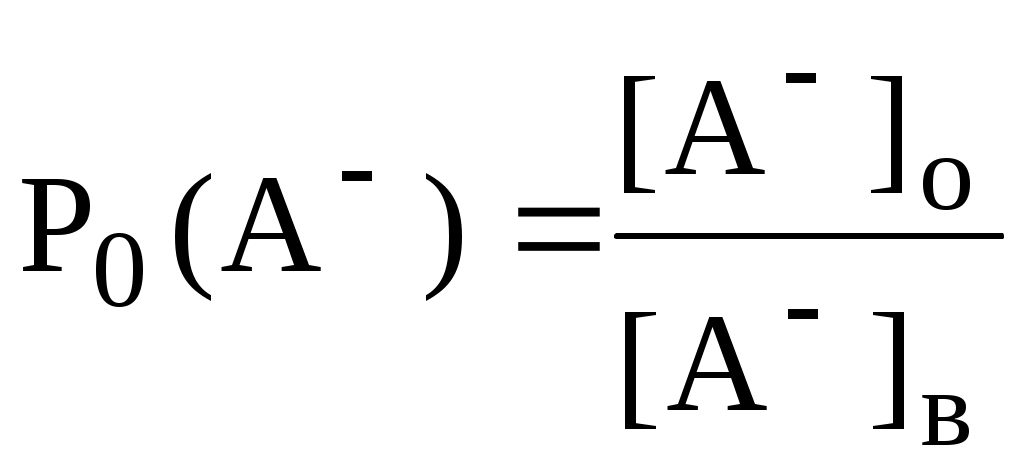 Степень однократной экстракции - доля вещества от его начального количества, экстрагируемая в фазу органического растворителя за одну экстракцию при данных условиях. Если в процессе экстракции протекает химическая реакция, то для характеристики экстракционного равновесия используют константу экстракции. Например 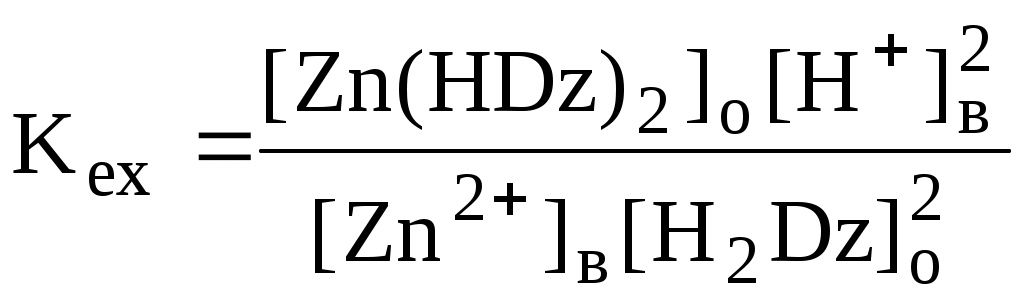 9.2.2. Экстракционные системы и экстрагенты Все экстракционные системы можно разделить на 2 группы  В первом типе экстракционных систем разделение происходит в результате разности энергий сольватации и гидратации экстрагирующегося вещества. В органическую фазу переходят вещества, которые плохо гидратируются в водных растворах. Обычно это незаряженные соединения с крупными неполярными молекулами. Наличие гидрофильных групп в молекуле вещества уменьшает его способность экстрагироваться неполярным органическим растворителем, в то время как крупные углеводородные остатки увеличивают эту способность. В гомологическом ряду с увеличением числа атомов углерода (n) способность вещества экстрагироваться неполярным растворителем повышается, причём lgP0 линейно зависит от n (рис. 9.1). 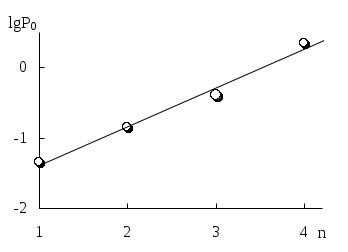 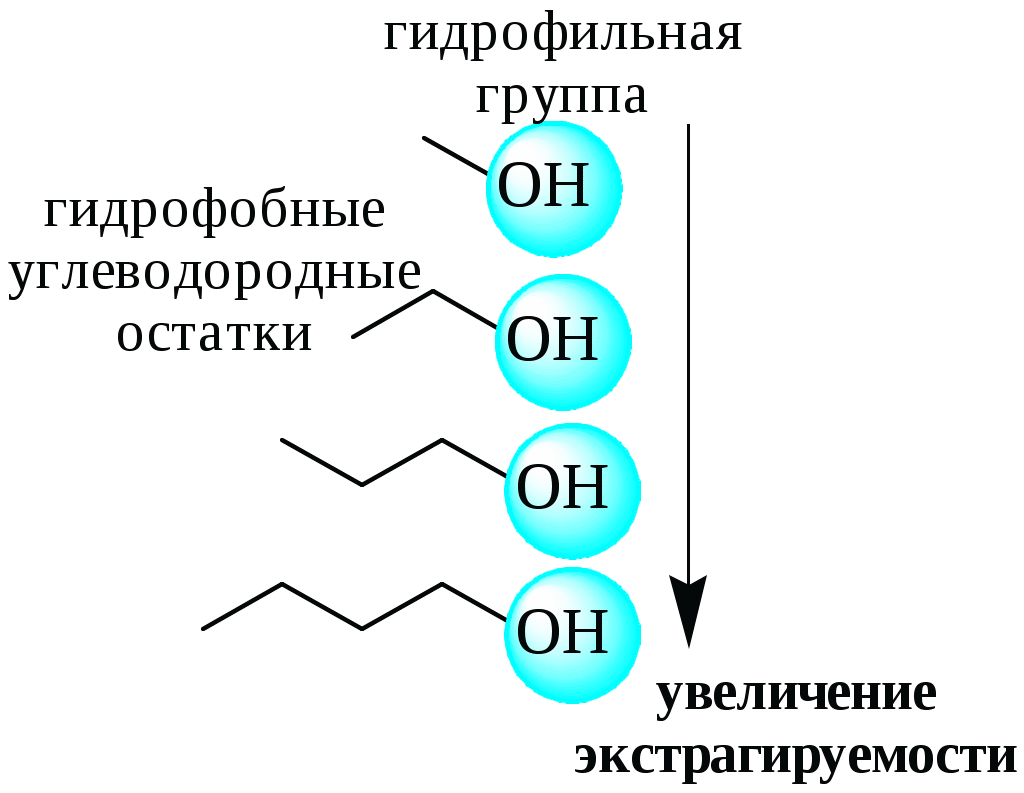 Рис. 9.1. Изменение экстрагируемости в гомологическом ряду н-алканолов в системе хлороформ-вода В основе реакционной экстракции лежит взаимодействие вещества с экстрагентом с образованием соединения, которое экстрагируется лучше, чем исходное вещество. В зависимости от кислотно-основных свойств экстракционные реагенты обычно разделяют на 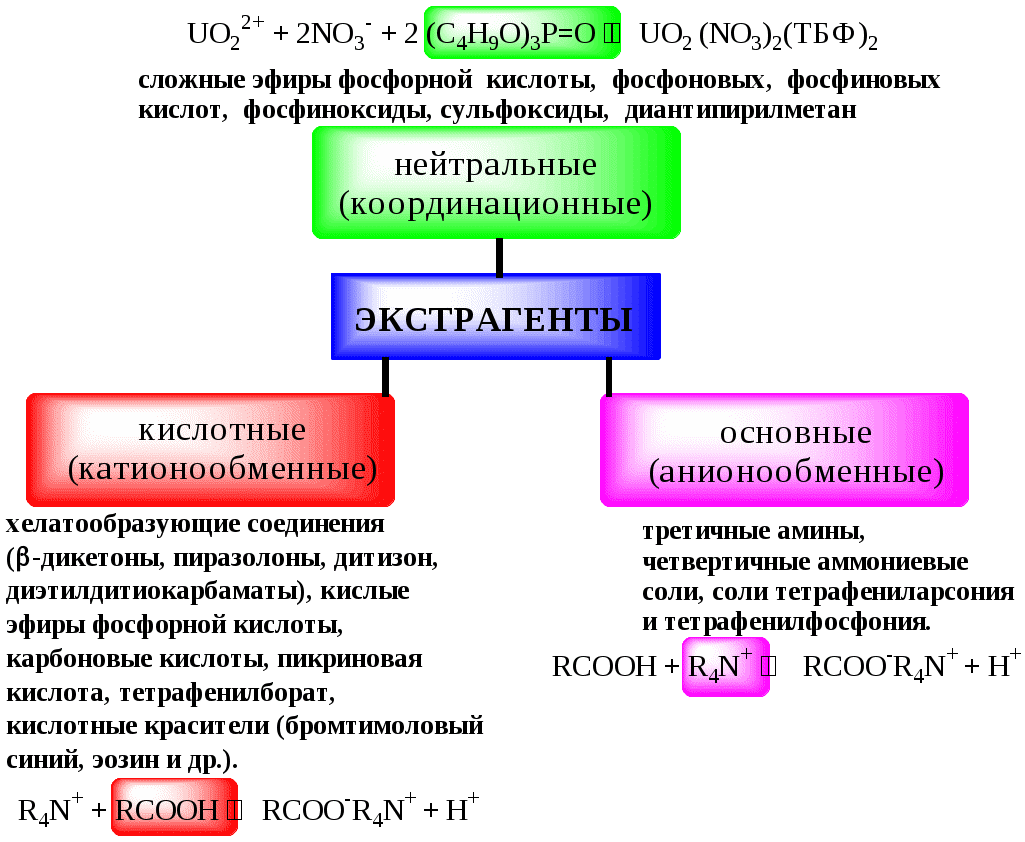 9.2.4. Влияние различных факторов на процесс экстракции Основными факторами, влияющими на процесс экстракции, являются: природа экстрагируемого вещества и экстрагента, температура, рН, соотношение объёмов водной и органической фаз, методика проведения экстракции, присутствие электролитов в водной фазе. рНВеличина рН влияет на экстракцию соединений, склонных к ионизации. Заряженные частицы гидратируются значительно лучше, чем нейтральные молекулы, а последние, в свою очередь, лучше сольватируются неполярными органическими растворителями. Поэтому, как правило, нейтральные молекулы экстрагируются значительно лучше, чем ионы. Слабые кислоты При рН < pKa - 2 более 99% кислоты будет находиться в неионизированном состоянии (D P0), поэтому при таких значениях рН кислота будет хорошо экстрагироваться неполярным растворителем. При рН > pKa + 2 более 99% кислоты будет находиться в ионизированном состоянии. Эта область рН неблагоприятна для экстракции. Слабые основанияМаксимальная экстракция происходит при рН > pKBH+ + 2, а при рН < pKBH+ - 2 слабые основания будут плохо экстрагироваться неполярным растворителем. Амфолиты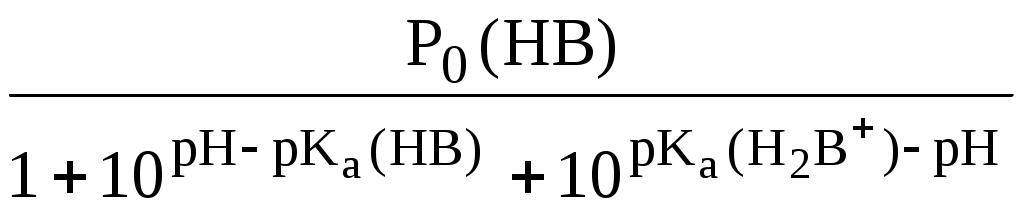 Экстракция амфолита максимальна в изоэлектрической точке. Примеры зависимости коэффициентов распределения слабых кислот, оснований и амфолитов от рН показаны на рис. 9.2. 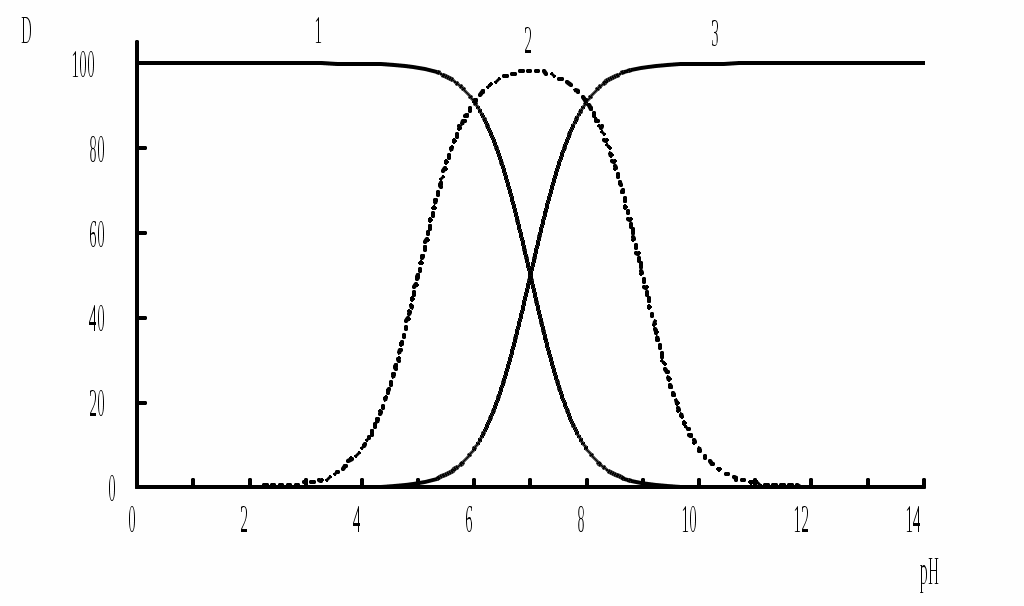 Рис. 9.2 Зависимость коэффициента распределения слабой кислоты (1), амфолита (2) и слабого основания (3) от рН Po(неионизированной формы) =100, Po(ионизированной формы) 0; pKa =7, pKBH+ = 7; амфолит (pKa =5, pKBH+ = 9). Объём экстрагента 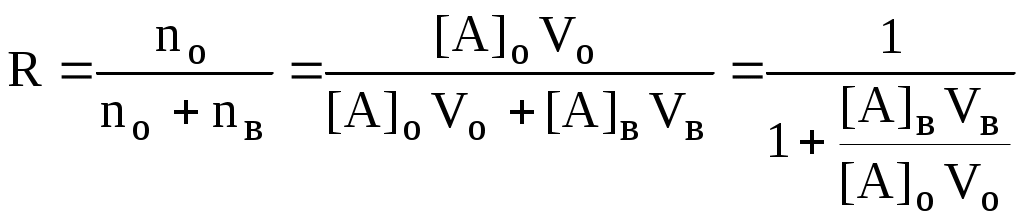 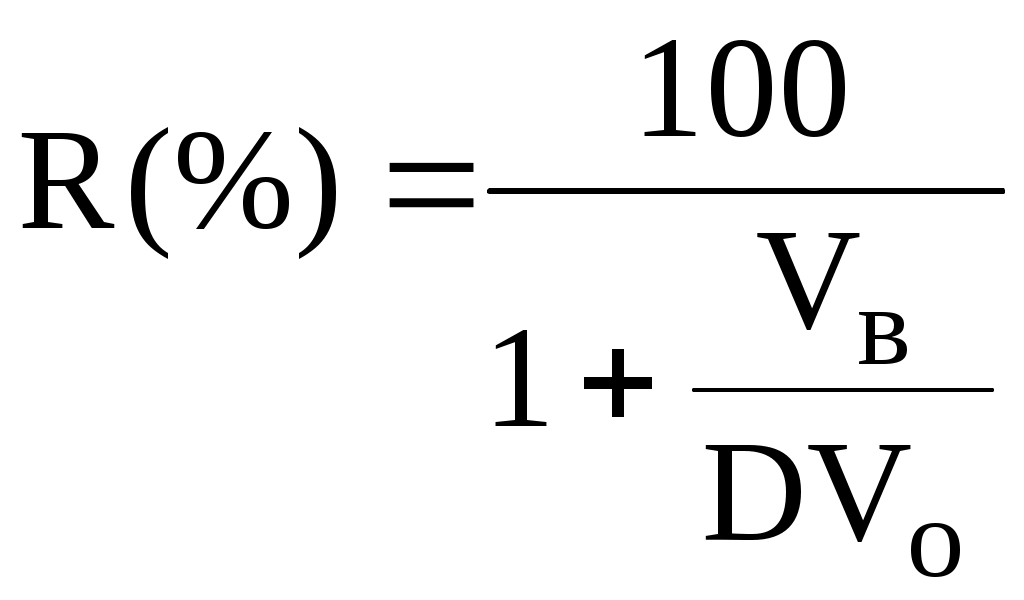 При увеличении соотношения Vв/Vo степень однократной экстракции уменьшается. Например, для того чтобы при однократной экстракции экстрагировалось 99% вещества, имеющего D = 5, объём экстрагента должен быть приблизительно в 20 раз больше объёма водной фазы. Если их объёмы будут равными, величина R составит 83%. Экстрагент можно добавлять не одномоментно, а в виде нескольких порций. В этом случае эффективность экстрагирования будет повышаться. Пусть к водной фазе добавлена первая порция экстрагента. После первой экстракции останется непроэкстрагированным 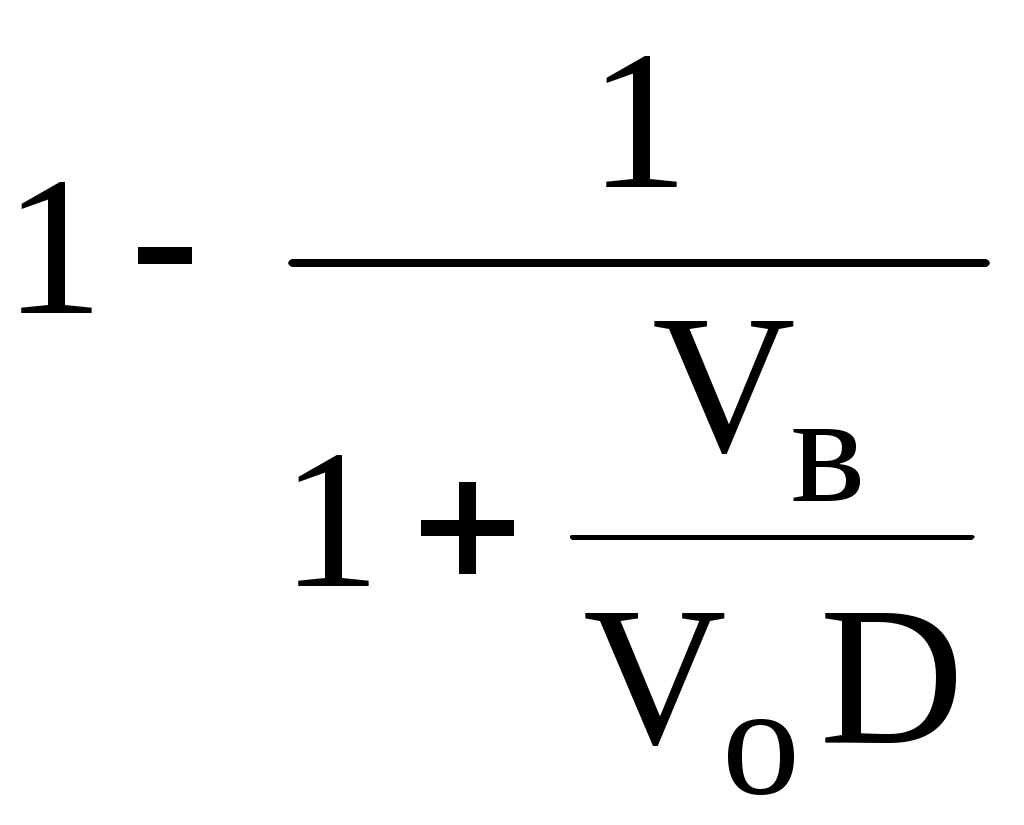 = =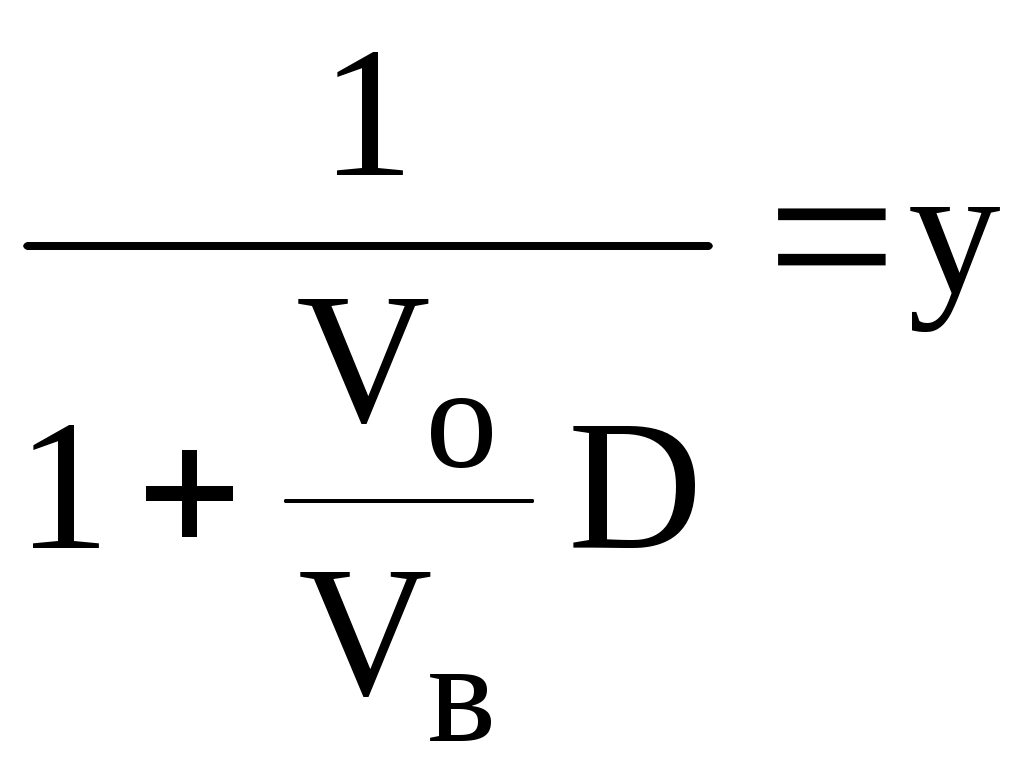 После второй экстракции останется (1-R) от y, т.е. y2. После n-экстракции yn. 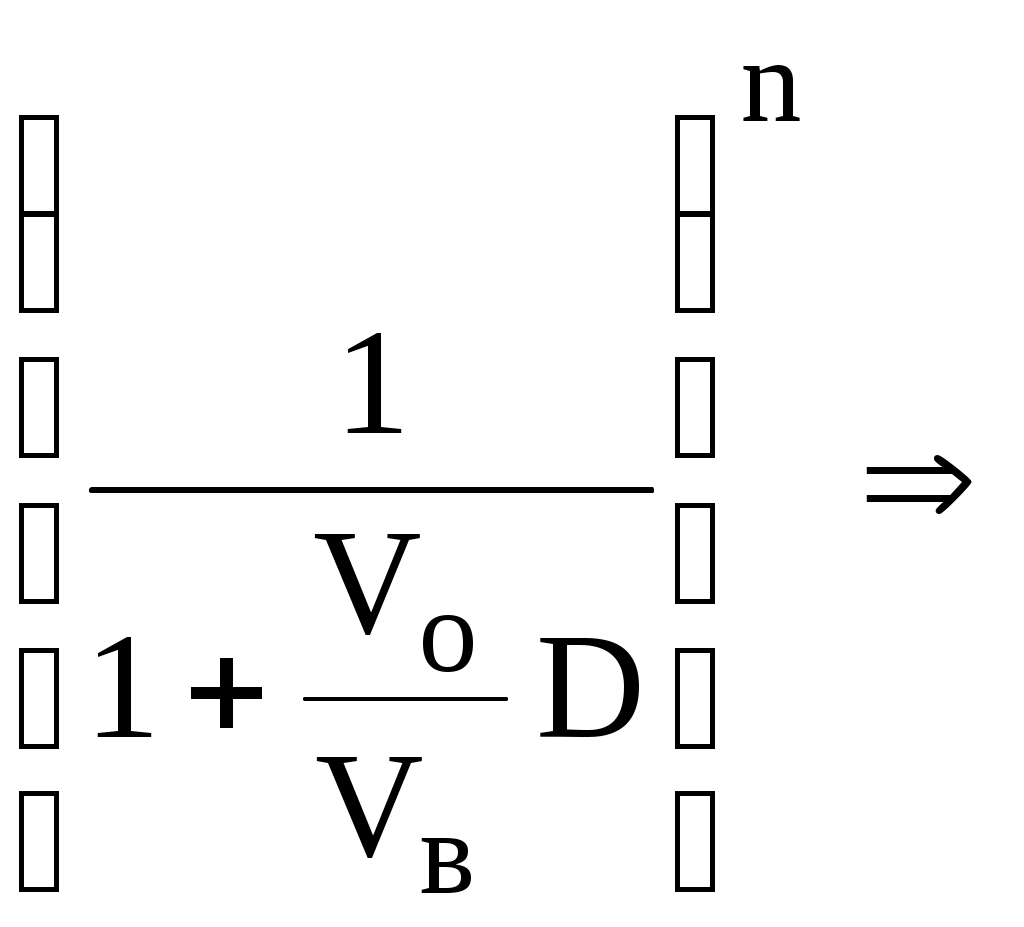 Rn = 1 - Rn = 1 - 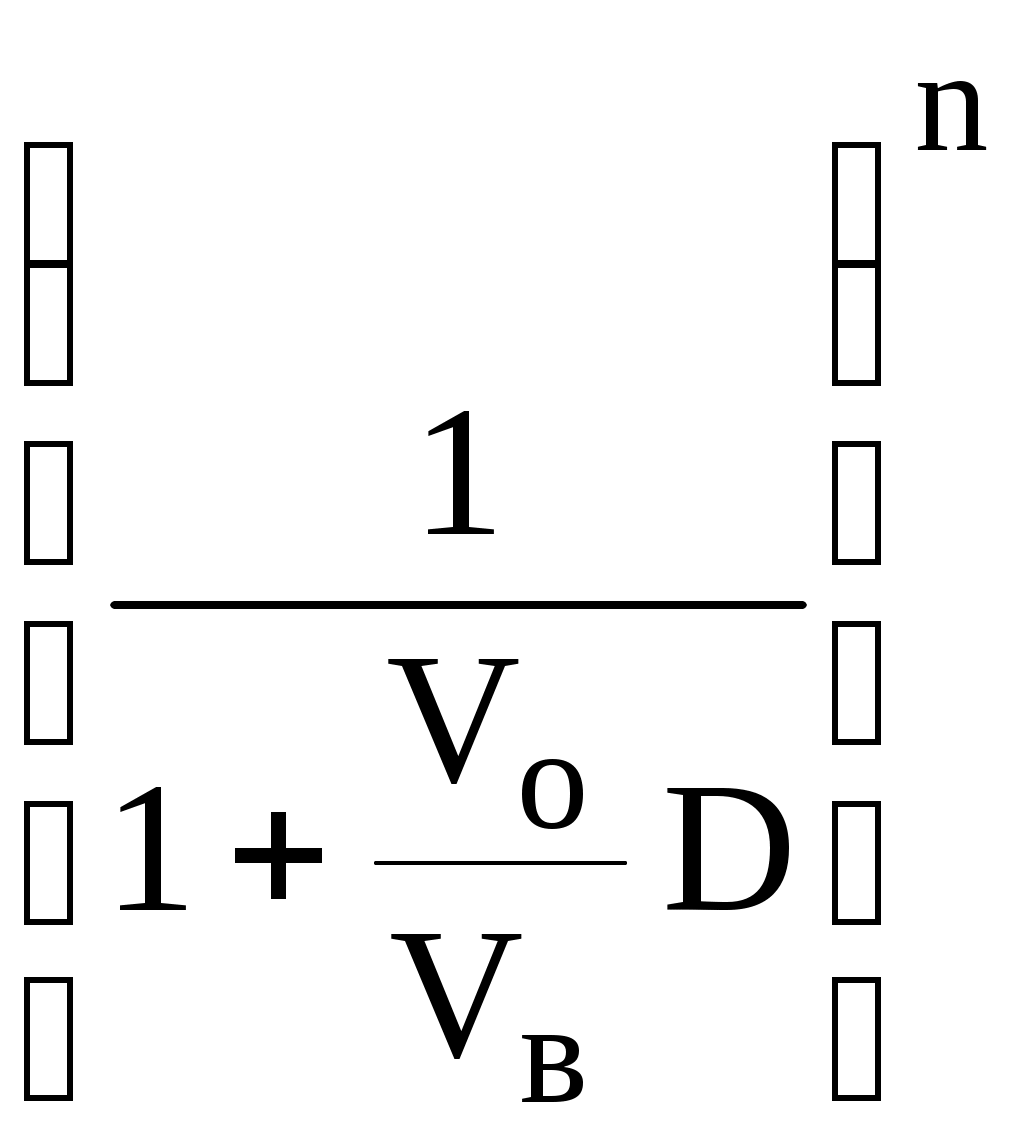 Для того чтобы экстрагировать 99% вещества, имеющего D = 5, из 10 мл водной фазы, необходимо провести 3 экстракции порциями экстрагента по 10 мл (т.е. затратить всего лишь 30 мл экстрагента, что в 6 раз меньше, чем при однократной экстракции). Выбор приёма экстракции (однократная большим объёмом экстрагента или многократная малыми объёмами) зависит от конкретных условий. Если необходимо сэкономить экстрагент, то предпочтительнее второй вариант, если время (или важна хорошая воспроизводимость результатов), то первый. Присутствие сильных электролитовПри добавлении к водной фазе больших количеств хорошо растворимых сильных электролитов растворимость веществ может уменьшаться (высаливание), иногда растворимость увеличивается (всаливание). При проведении экстракции в системах с высаливанием коэффициент распределения вещества увеличивается, в случае всаливания - уменьшается. 9.2.5 Способы осуществления экстракции  9.2.6. Применение экстракции разделение веществ (выделение микрокомпонента, очистка макрокомпонента); концентрирование; в гибридных методах анализа (экстракционная фотометрия, экстракционная флуориметрия и др.) изучение различных равновесий. |
