Аналитическая химия. !курс лекций 5 семестр. Предмет аналитической химии
 Скачать 4.18 Mb. Скачать 4.18 Mb.
|
ГЛАВА 7 7.1. Общая характеристика окислительно-восстановительных реакций Окислительно-восстановительными называют реакции, в процессе которых происходит обмен электронами между реагирующими веществами. 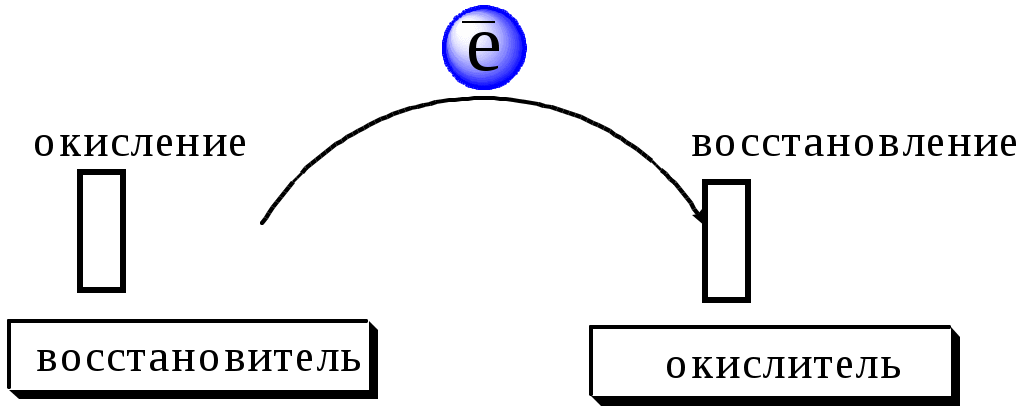 В любой окислительно-восстановительной реакции окислитель и восстановитель взаимодействуют друг с другом c образованием нового восстановителя и нового окислителя. 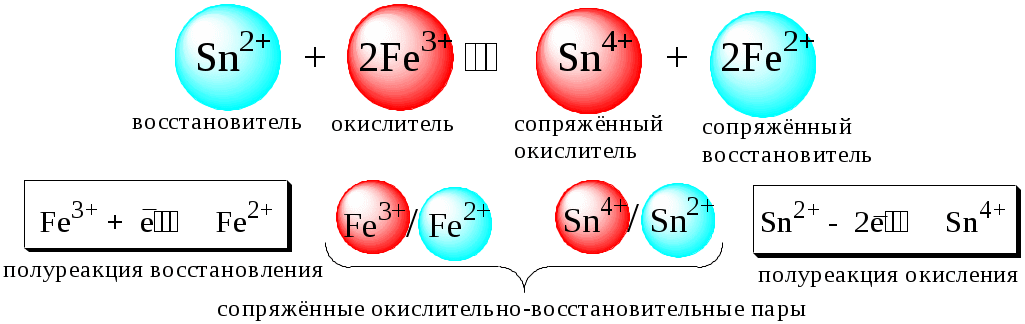 Поскольку в процессе окислительно-восстановительной реакции происходит лишь перераспределение электронов между реагирующими веществами, то число электронов, отданных восстановителем, должно быть равно числу электронов, полученных окислителем. 7.2. Количественная оценка окислительно-восстановительной способности веществ Обычно для количественной оценки способности веществ отдавать и принимать электроны используют не константы равновесия, а электродные потенциалы. Это возможно потому, что процессы окисления и восстановления могут быть пространственно разделены. Электродные потенциалыЭлектродом в электрохимии называется поверхность раздела между проводником электрического тока с электронной проводимостью и проводником электрического тока с ионной проводимостью, или, иными словами, место, где электронный механизм переноса электрического заряда изменяется на ионный (и наоборот). В более узком смысле слова электродом часто называют проводник электрического тока с электронной проводимостью. 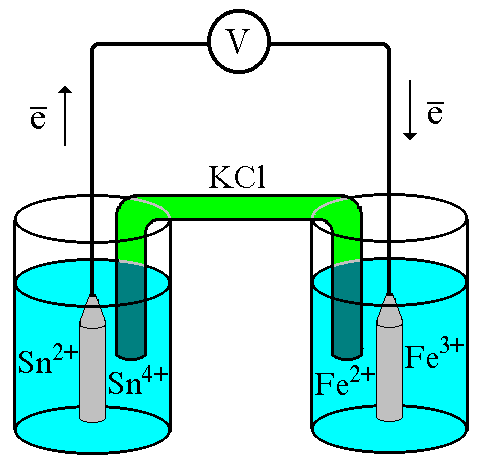 Рис. 7.1. Схематическое изображение гальванического элемента Проведём реакцию взаимодействия Sn2+ и Fe3+ так, чтобы процессы окисления и восстановления были пространственно разделены (рис. 7.1). В сосуде, содержащем Sn2+ и Sn4+, будут проходить следующие процессы. Ионы Sn2+ будут отдавать электроны платиновой проволоке и превращаться в Sn4+. Параллельно будет происходить и обратный процесс. Через некоторое время в системе установится равновесие: Sn4+ + 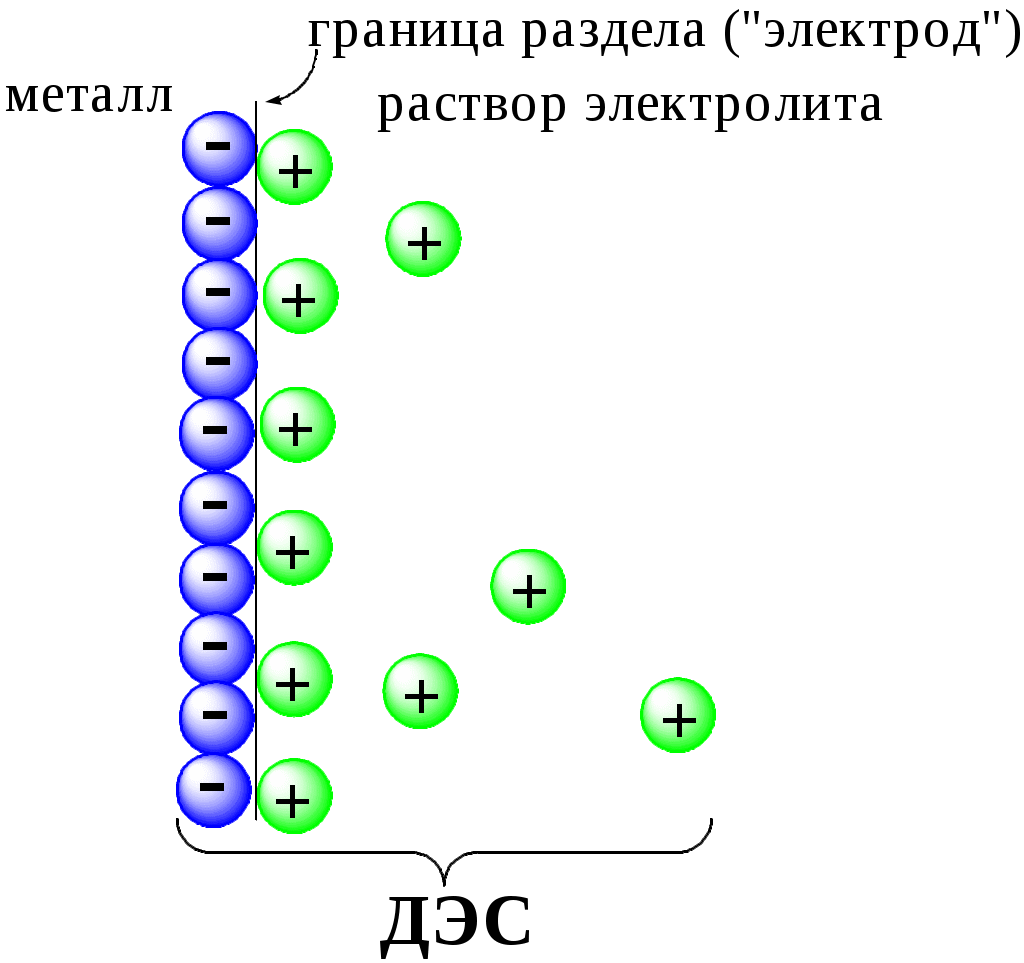 Рис. 7.2. Возникновение электродного потенциала Вследствие установления данного равновесия поверхность платиновой проволоки и раствор вблизи неё будут иметь различный заряд, произойдёт образование так называемого «двойного электрического слоя» (рис. 7.2). На границе раздела «металл - раствор» возникнет разность потенциалов, называемая электродным потенциалом. Аналогичные процессы будут происходить и в системе, содержащей Fe2+ и Fe3+. Однако, так как ионы Fe2+ обладают меньшей способностью отдавать электроны, чем Sn2+, а ионы Fe3+, соответственно, большей способностью принимать электроны, чем Sn4+, то поверхность платиновой проволоки, опущенной в раствор, содержащий Fe2+ и Fe3+, будет заряжена менее отрицательно, чем опущенной в раствор Sn2+ и Sn4+. Соединим платиновые пластинки, опущенные в растворы, металлическим проводником. Для замыкания цепи соединим оба раствора солевым мостиком - трубкой, содержащей раствор KCl. В полученной системе, называемой гальваническим элементом, начнёт протекать электрический ток. Если включить в данную цепь потенциометр или высокоомный вольтметр, то можно измерить её ЭДС, которая будет характеризовать способность ионов Fe3+ получать электроны от Sn2+. Абсолютную величину электродного потенциала индивидуального электрода определить невозможно. Возможно определить лишь разность потенциалов двух электродов. В принципе, это можно делать для каждой конкретной реакции. Однако гораздо более удобно выбрать какой-нибудь один стандартный электрод, относительно которого затем будут проводиться все измерения электродных потенциалов. В качестве такого электрода сравнения используется стандартный водородный электрод. 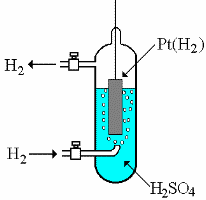 Рис. 7.3 Стандартный водородный электрод Стандартный водородный электрод представляет собой платиновую пластинку, насыщенную водородом, которая находится в растворе H2SO4 или HCl с 2H+ + Потенциал стандартного водородного электрода принят равным нулю при любой температуре. Стандартный электродный потенциал полуреакции (E0, 0) - это ЭДС гальванического элемента, состоящего из находящегося в стандартных условиях электрода, на котором протекает данная полуреакция, и стандартного водородного электрода. Водородный электрод неудобен в работе, поэтому на практике в качестве стандартных используются вторичные стандартные электроды, потенциал которых относительно СВЭ определён с высокой точностью. Одним из таких электродов является хлоридсеребряный электрод, Знак стандартного потенциала полуреакции зависит от выбранного направления полуреакции. При изменении направления знак меняется на противоположный. Например, для полуреакции (А) E0 = +0,771 В, следовательно, для обратной ей полуреакции (Б) E0 = - 0,771 В. (А) Fe3+ + Потенциал, характеризующий процесс восстановления, например, такой как (А), называется восстановительным, а потенциал, характеризующий процесс окисления, например, такой как (Б) - окислительным. В настоящее время величину электродного потенциала полуреакции принято относить к процессу восстановления окисленной формы Чем больше величина электродного потенциала, тем более сильными окислительными свойствами обладает окисленная форма вещества и более слабыми восстановительными свойствами его восстановленная форма. Например, перманганат-ион при стандартных условиях в кислой среде является более сильным окислителем, чем дихромат-ион. Cr2O72- + 14H+ + MnO4- + 8H+ + Если для интересующей нас полуреакции значение Е0 в справочной литературе, по той или иной причине, не приведено, то его можно рассчитать, используя потенциалы других полуреакций. Пример 7.1. Рассчитайте величину Е0 для окислительно-восстановительной пары Fe3+/Fe, если известно, что Fe2+ + 2 При сложении первого и второго уравнения мы получим уравнение интересующей нас полуреакции: Fe3+ + 3 Значение стандартного электродного потенциала данной полуреакции не будет равно сумме В отличие от электродного потенциала G зависит от количества вещества, поэтому G3 = G1 + G2. Следовательно Разность электродных потенциалов окислителя, участвующего в прямой реакции, и окисленной формы восстановителя, образующегося в процессе реакции, называется ЭДС реакции (Е). По величине ЭДС можно судить о том, возможно или нет самопроизвольное протекание данной реакции.  Пример 7.2. Определить, может ли самопроизвольно протекать при стандартных условиях реакция окисления иодид-ионов ионами Fe3+. 2Fe3+ + 2I- 2Fe2+ + I2 Данная реакция может самопроизвольно протекать в прямом направлении. Уравнение НернстаВлияние активности компонентов, участвующих в процессе, и температуры на величину потенциала описывается уравнением Нернста 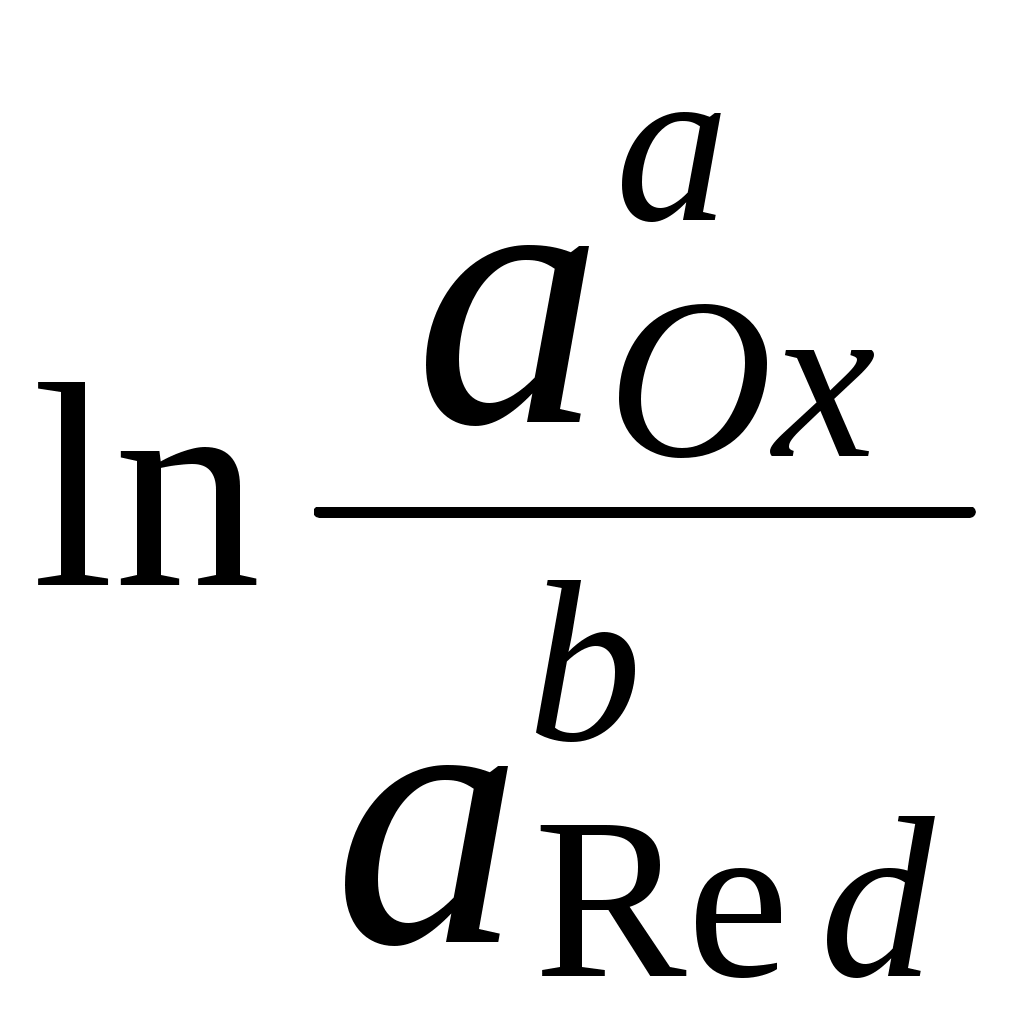 Если объединить постоянные величины в одну константу, а натуральный логарифм заменить десятичным, то при T = 298 К 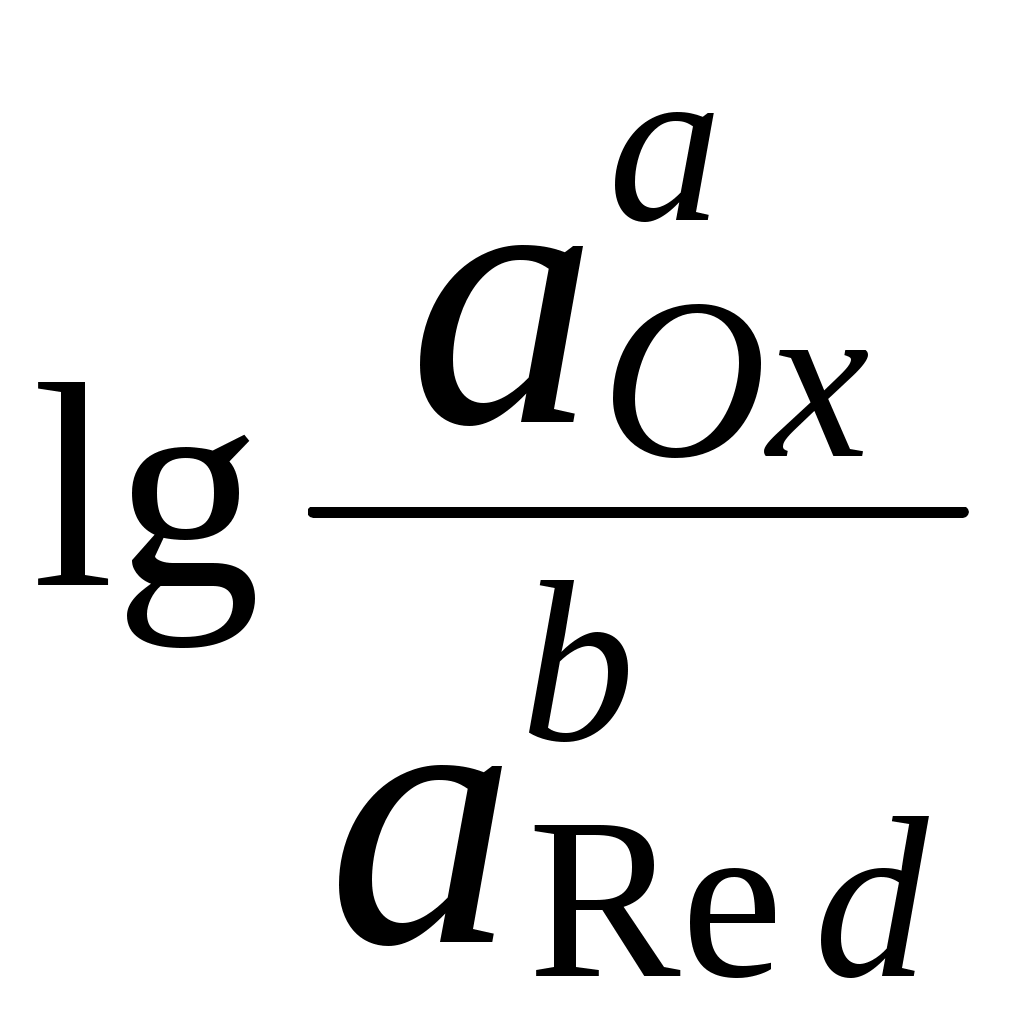 Например, для Cr2O72- + 14H+ + 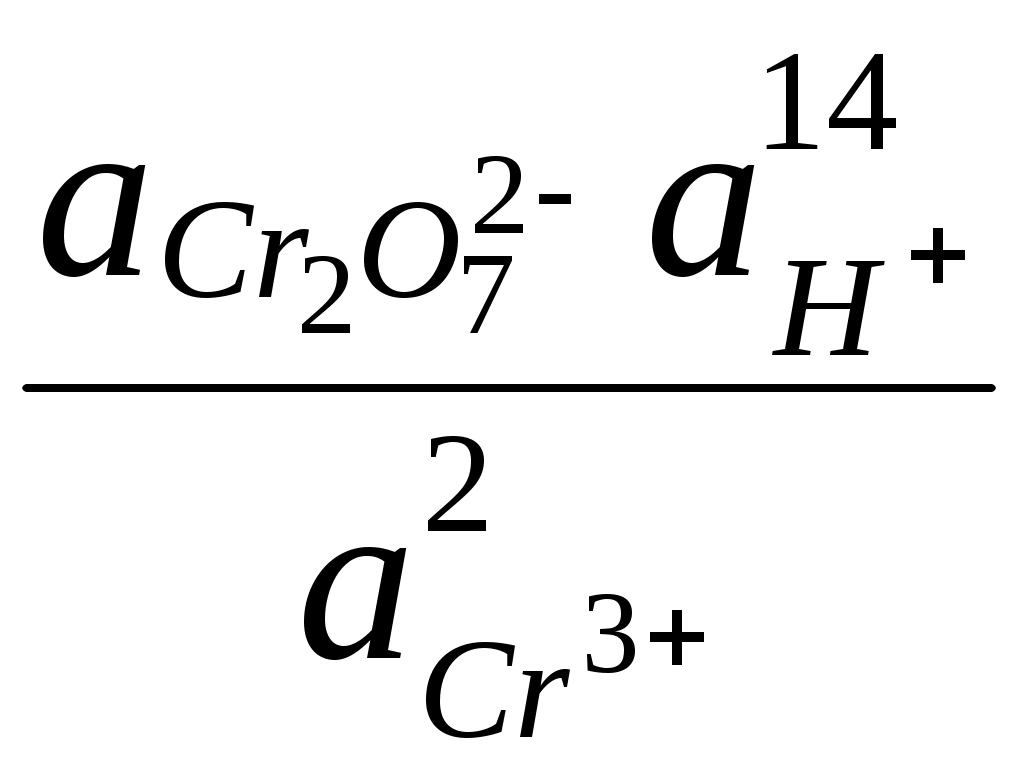 Формальный электродный потенциал 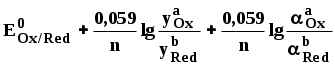 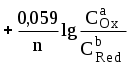 Формальный электродный потенциал является аналогом условной концентрационной константы равновесия в рассмотренных ранее равновесиях. Он равен выделенной полужирным шрифтом сумме первых трех членов в приведенном выше уравнении. Величина формального потенциала зависит от ионной силы раствора, природы и концентрации посторонних электролитов. Например, для Fe3+/Fe2+:  Константа равновесия окислительно-восстановительной реакции Способность одного вещества отдавать электроны другому веществу можно оценить также с помощью константы равновесия окислительно-восстановительной реакции. Эта константа связана с ЭДС реакции следующим образом. Пусть реакция между окислителем Ox1 и восстановителем Red2 состоит из двух полуреакций (полуреакцию с участием Red2 для удобства запишем как процесс восстановления окисленной его формы): Ox1 + n1 Ox2 + n2 Наименьшее общее кратное для n1 и n2 обозначим как m. Суммарное уравнение реакции будет иметь следующий вид aOx1 + bRed2 aRed1 + bOx2, где a = m/n1, b = m/n2. 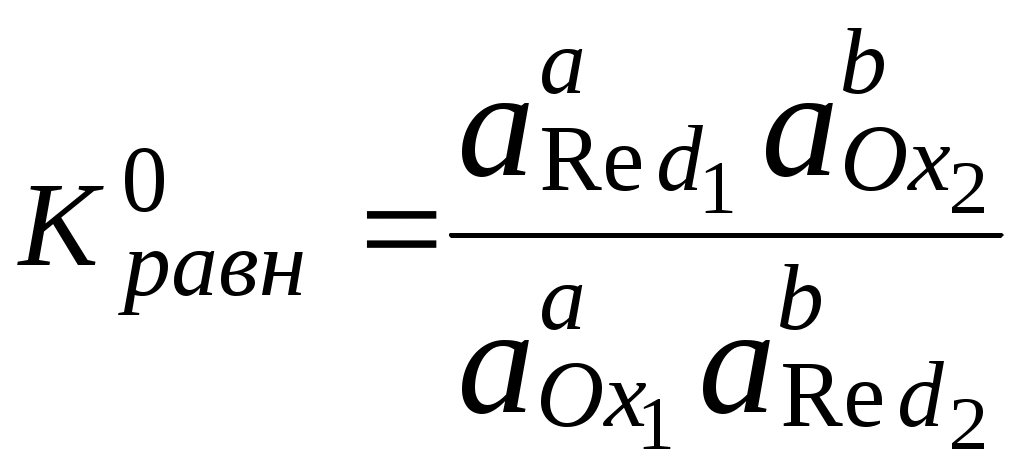 В состоянии равновесия G = 0, Е = 0 и 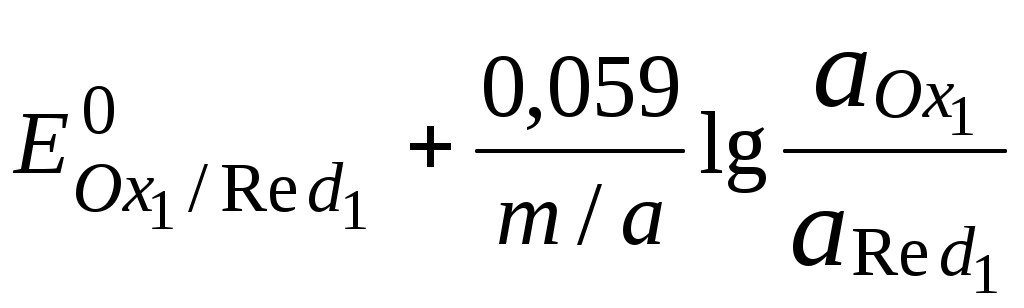 = = 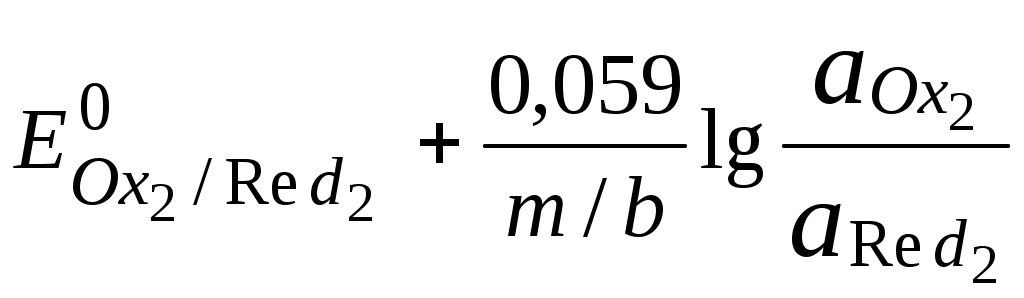 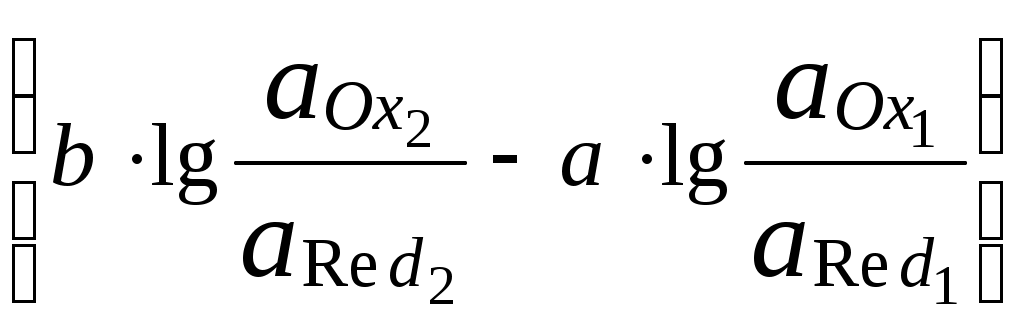 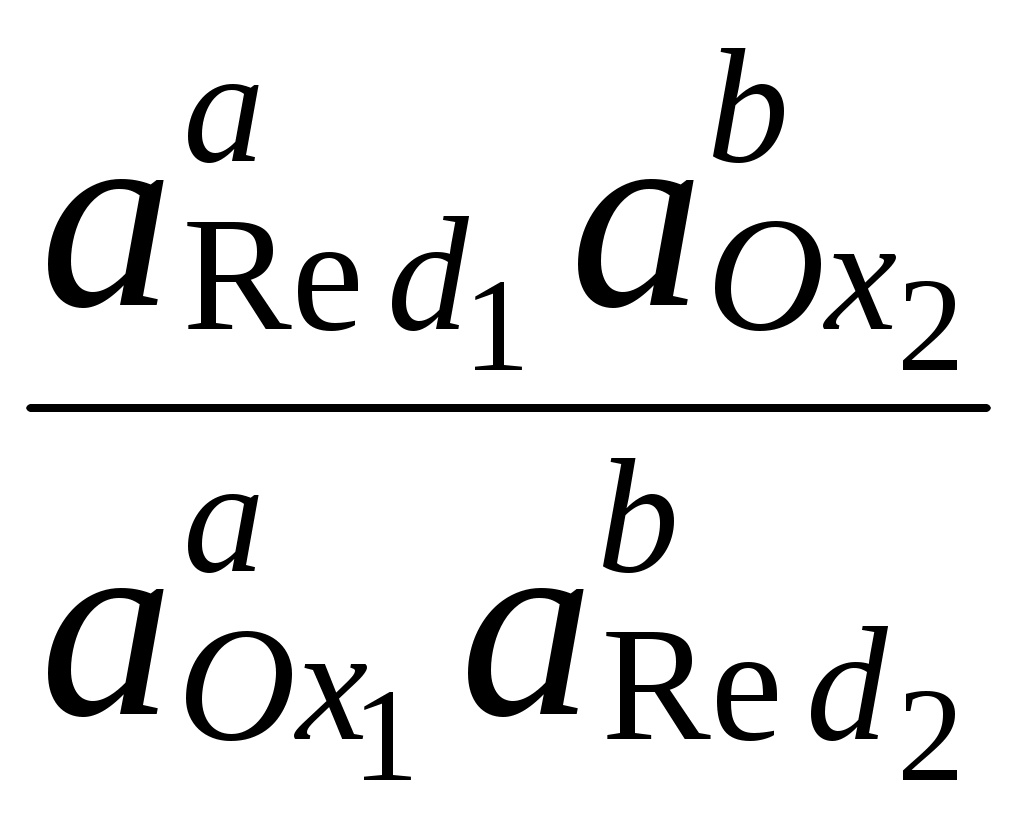 = = Обратите внимание, что в выражение для расчёта константы равновесия окислительно-восстановительной реакции входит не произведение числа электронов n1 и n2, а их наименьшее общее кратное m, которое может быть равно этому произведению, а может быть и не равно. Если lgK > 0, реакция может самопроизвольно протекать в прямом направлении. Чем больше величина K, тем больше “глубина” протекания окислительно-восстановительной реакции. Пример 7.3. Рассчитать термодинамическую константу равновесия реакции если 7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций ТемператураТемпература влияет как на константу равновесия окислительно-восстановительных реакций, так и на их скорость. Как правило, окислительно-восстановительные реакции обладают большим тепловым эффектом, поэтому изменение температуры оказывает значительное влияние на константу равновесия. Однако, часто константы равновесия окислительно-восстановительных реакций настолько велики, что и при увеличении температуры на несколько десятков градусов реакция остаётся практически необратимой. Многие окислительно-восстановительные реакции идут при комнатной температуре медленно (например, реакция окисления оксалат-ионов перманганат-ионами), и для их проведения требуется нагревание. Иногда, наоборот, нагревание является нежелательным, так как приводит к улетучиванию реагирующих или образующихся веществ (например, при использовании в качестве окислителя иода), повышению скорости реакции окисления веществ кислородом воздуха и т.д. Посторонние ионыПрисутствие посторонних индифферентных ионов в растворе приводит, во-первых, к повышению ионной силы раствора. Если коэффициенты активности окисленной и восстановленной формы при этом изменяются неодинаково, то изменяется и величина окислительного потенциала. Во-вторых, посторонние ионы могут оказывать влияние на скорость реакции. Анионы влияют на реакцию между катионами, катионы - на реакцию между анионами. Например, скорость реакции восстановления иона [Fe(CN)6]3- до [Fe(CN)6]4- максимальна, если в качестве катиона выступает ион K+. Иногда посторонние ионы могут являться катализаторами окислительно-восстановительных реакций. Например, ион Ag+ является катализатором реакции окисления Mn2+ до MnO4- персульфат-ионом. Влияние рНИоны H+ могут, во-первых, сами участвовать в окислительно-восстановительной реакции, во-вторых, окисленная или восстановленная форма может протонироваться, образуя новые окислительно-восстановительные пары. MnO4- + 8H+ +5 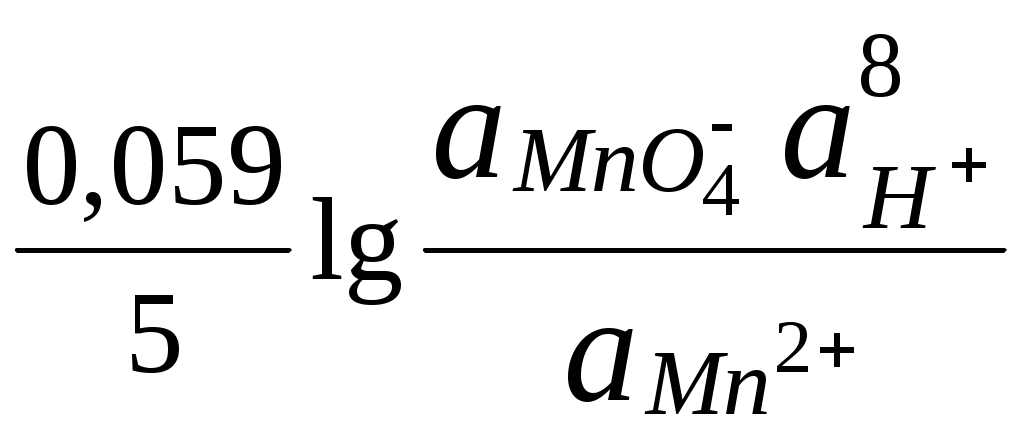 Если С увеличением рН значение электродного потенциала данной окислительно-восстановительной пары уменьшается. Образование малорастворимых соединенийОбразование малорастворимых соединений приводит к уменьшению концентрации окисленной или восстановленной формы и, следовательно, к изменению величины электродного потенциала. Пример 7.4. Известно, что 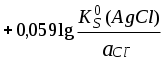 Е = Сумма двух констант в данном выражении, выделенная полужирным шрифтом, представляет собой Комплексообразование Окисленная или восстановленная форма либо они обе вместе могут связываться в комплексные соединения с ионами, присутствующими в растворе. Это приводит к изменению величины электродного потенциала. Пример 7.5. Известно, что 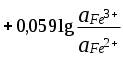 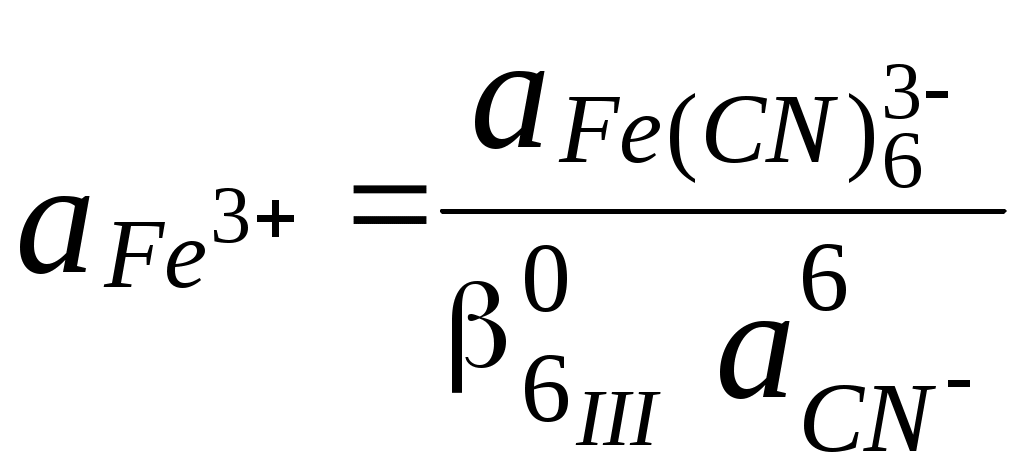 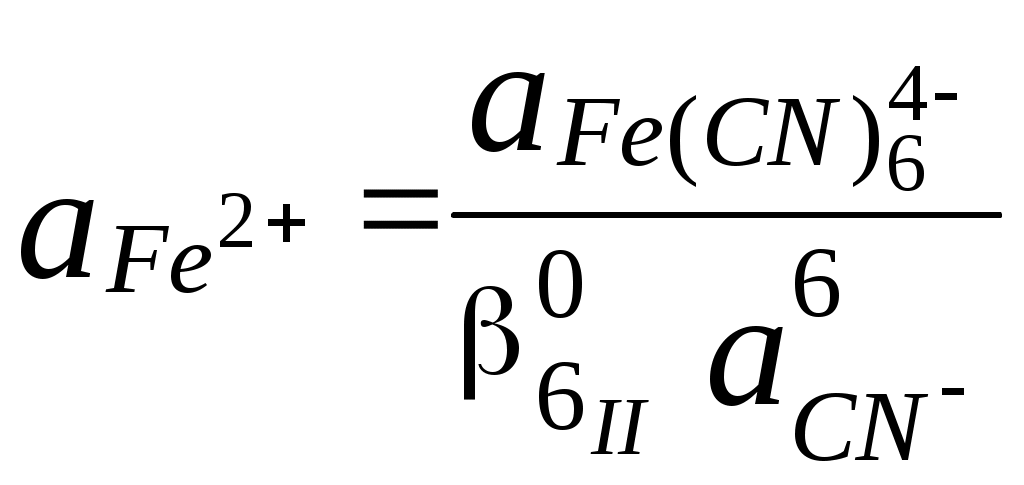 E = 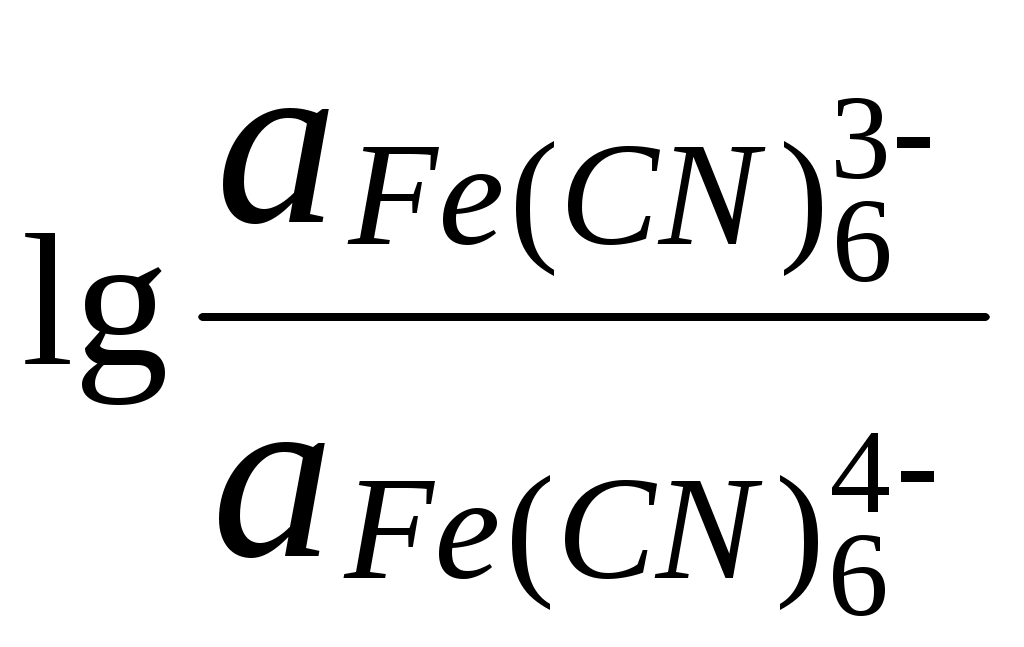 Ион Fe3+ образует более устойчивый цианидный комплекс, чем Fe2+, поэтому величина электродного потенциала пары Fe(CN)63-/Fe(CN)64- меньше, чем у пары Fe3+/Fe2+. 7.4. Расчёт различных констант с использованием электродного потенциала По величине электродных потенциалов можно рассчитать KS малорастворимого электролита, константу образования комплексного соединения, Ka слабой кислоты и т.д. Пример 7.6. Рассчитать величину |
