|
|
Аналитическая химия. !курс лекций 5 семестр. Предмет аналитической химии
ГЛАВА 5
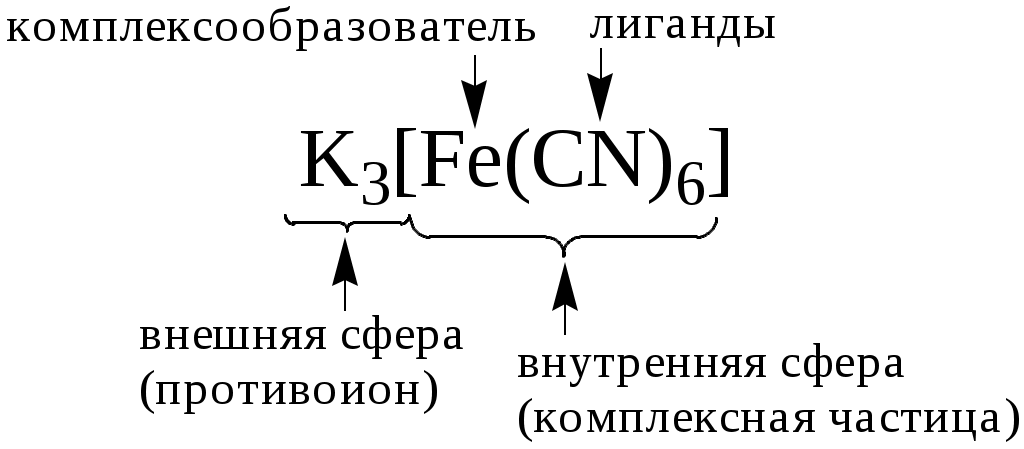
5.1. Понятие о комплексном соединении
Чаще всего комплексом называют частицу, образованную в результате донорно-акцепторного взаимодействия атома (иона), называемого центральным атомом (ионом), или комплексообразователем, и заряженных или нейтральных частиц (лигандов). Комплексообразователь и лиганды должны быть способны к самостоятельному существованию в среде, где происходит реакция комплексообразования.
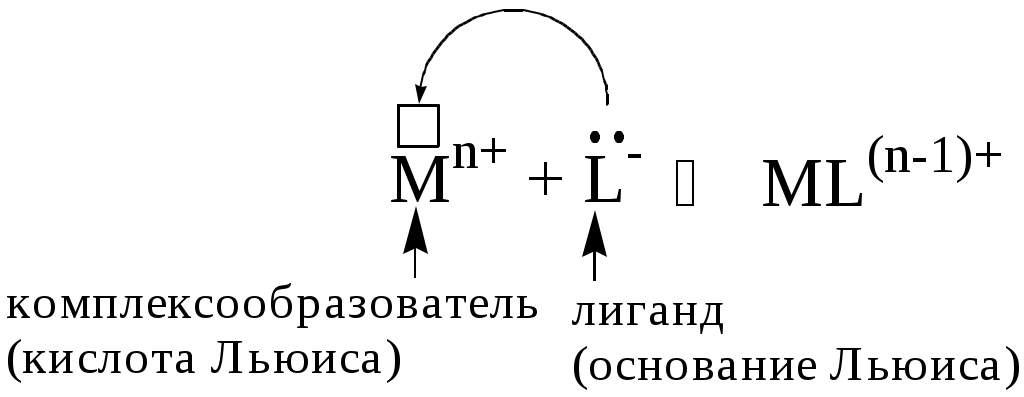
Реакцию комплексообразования можно рассматривать как реакцию взаимодействия кислоты и основания Льюиса.
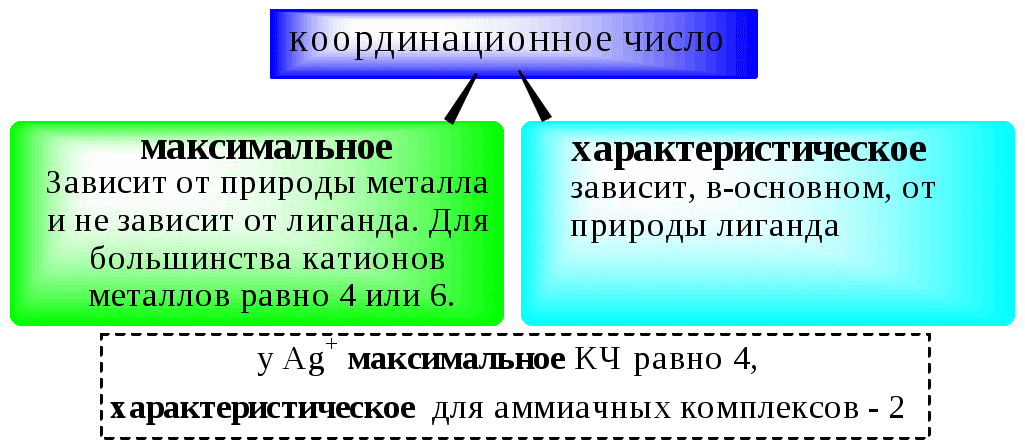
Количественной характеристикой способности комплексообразователя и лиганда участвовать в донорно-акцепторном взаимодействии при образовании комплексной частицы являются, соответственно, координационное число и дентатность.
Дентатностью лиганда называется число донорных центров (неподелённых электронных пар либо -связей) лиганда, участвующих в донорно-акцепторном взаимодействии при образовании комплексной частицы.
Лиганды бывают:
монодентатными (Cl-, H2O, NH3),
бидентатными (C2O42-, этилендиамин, 1,10-фенантролин)
...
полидентатными.
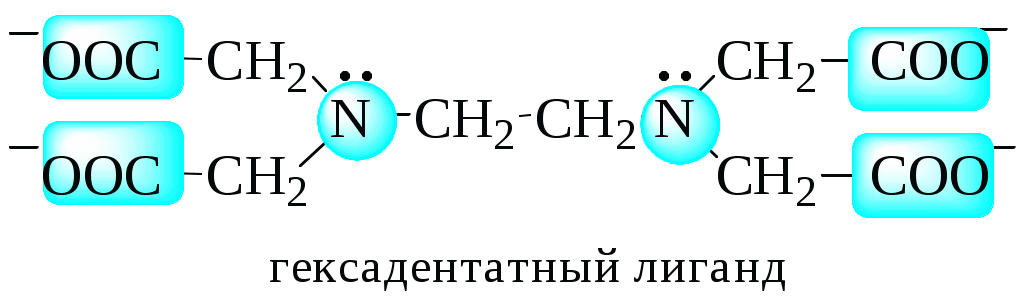
Координационным числом называется число донорных центров лигандов, с которыми взаимодействует данный центральный атом (ион).

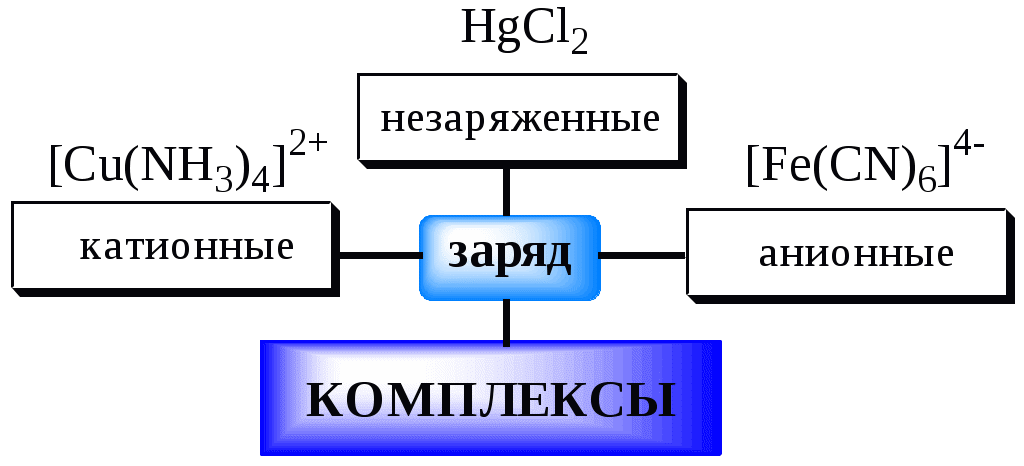
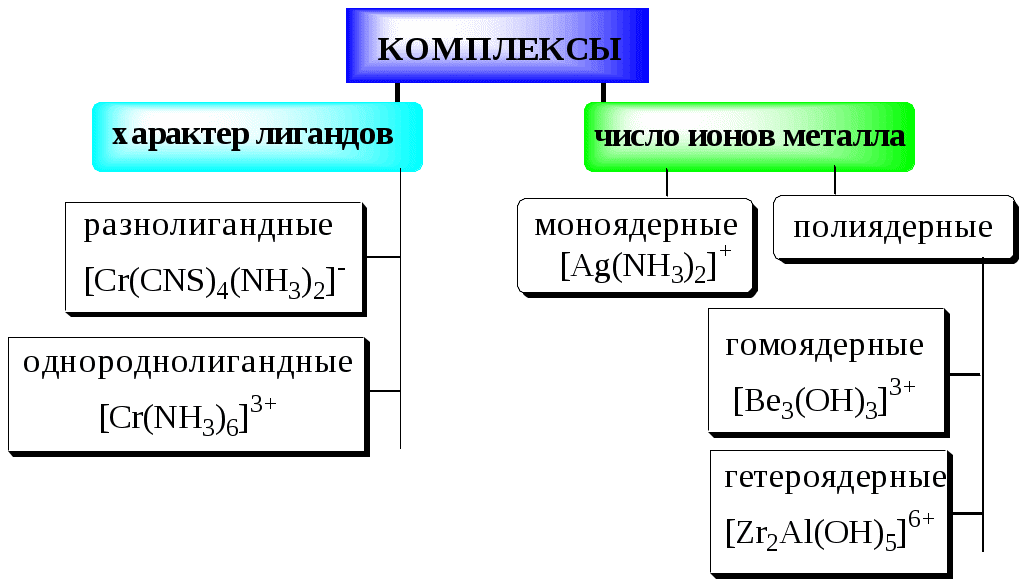
5.2. Классификация комплексных соединений
Соединения, образующиеся при взаимодействии насыщенных по координационному числу внутрисферных комплексов и любых частиц, находящихся во внешней сфере, называются внешнесферными комплексами.
Например (внутрисферные комплексные частицы выделены полужирным шрифтом):
[(C4H9)N4]2[Co(SCN)4]; [Ba(OH2)6] RSO3;
[Сd(phen)2](RCOO)2, (phen – фенантролин);
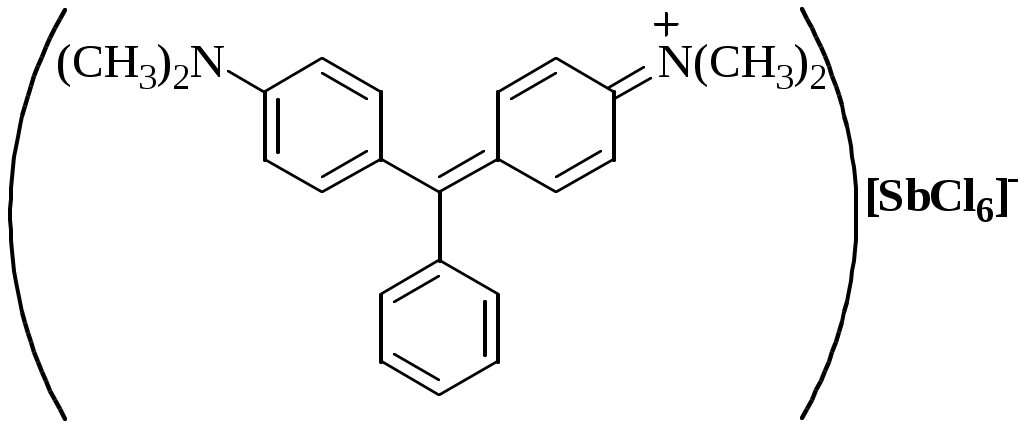
При образовании внешнесферного комплекса центральный ион не образует новой химической связи, взаимодействие происходит между лигандами внутренней сферы и частицами внешней сферы. Внешнесферные комплексы отличаются от обычных ионных пар (ионных ассоциатов) тем, что последние образуются в результате только электростатического взаимодействия полностью или частично сольватированных ионов, в то время как при образовании внешнесферных комплексов происходит образование ковалентной связи, водородной связи, имеет место ион-дипольное, гидрофобное взаимодействие и др.
Циклические комплексные соединения катионов металлов с полидентатными лигандами (обычно органическими), в которых центральный ион металла входит в состав одного или нескольких циклов, называются хелатами.
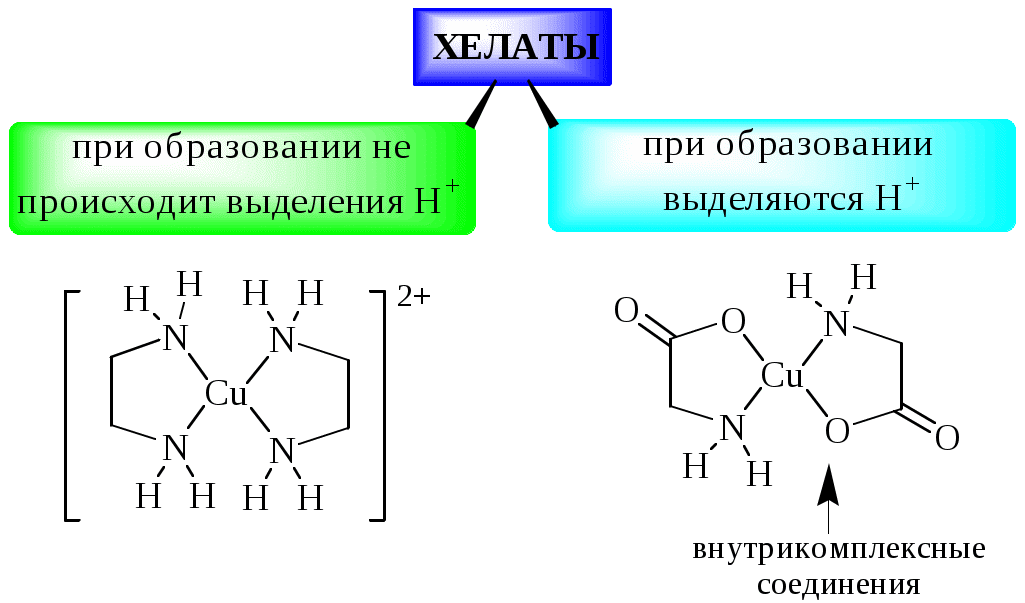
Ковалентные связи, образованные по донорно-акцепторному механизму, часто обозначают стрелкой , показывающей переход электронов от донорного центра лиганда к иону металла. Поскольку такие связи ничем не отличаются от обычных ковалентных связей, то их можно обозначать и простой чёрточкой.
5.3. Равновесия в растворах комплексных соединений
Внутренняя сфера связана с внешней ионной связью, поэтому в растворе соединение, содержащее комплексный ион, ведёт себя как сильный электролит. Например:
[Ag(NH3)2]NO3 [Ag(NH3)2]+ + NO3-
Между центральным ионом и лигандами образуются ковалентные связи по донорно-акцепторному механизму. Процесс комплексообразования происходит обратимо.
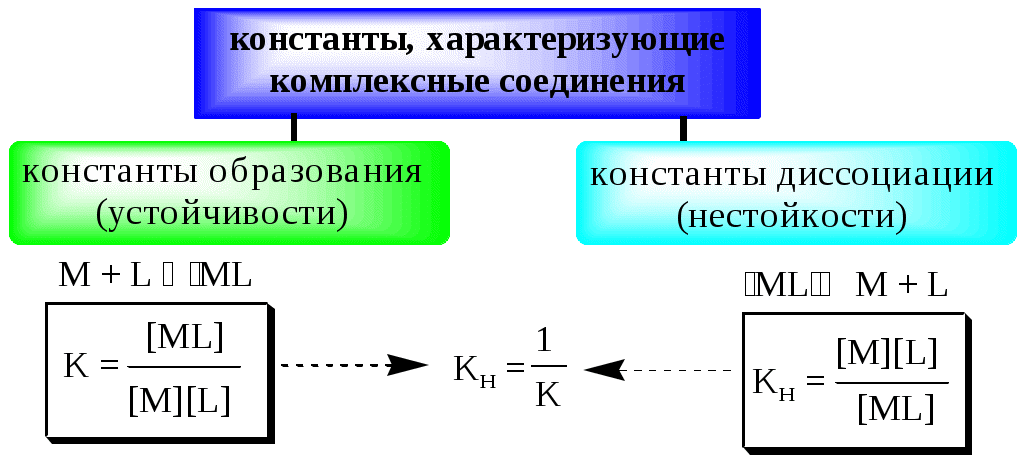
Обычно в состав комплексного соединения входит несколько лигандов, и процессы комплексообразования протекают ступенчато. Константы равновесия, характеризующие отдельную ступень, называются ступенчатыми (K). Произведение ступенчатых констант представляет собой общую константу (n, n – число ступеней), например (табл. 5.1).
Табл. 5.1
Константы образования аммиачных комплексов серебра
Комплекс
|
Ступенчатая константа
образования
|
Общая константа
образования
|
[Ag(NH3)]+
|
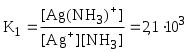
lgK1 = 3,32
|
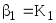
|
[Ag(NH3)2]+
|
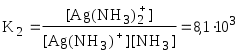 lgK2 = 3,91 lgK2 = 3,91
|
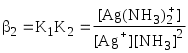 = =1,7107 = =1,7107
lg2 = lg K1 + lgK2 = 7,23
| |
|
|
 Скачать 4.18 Mb.
Скачать 4.18 Mb.


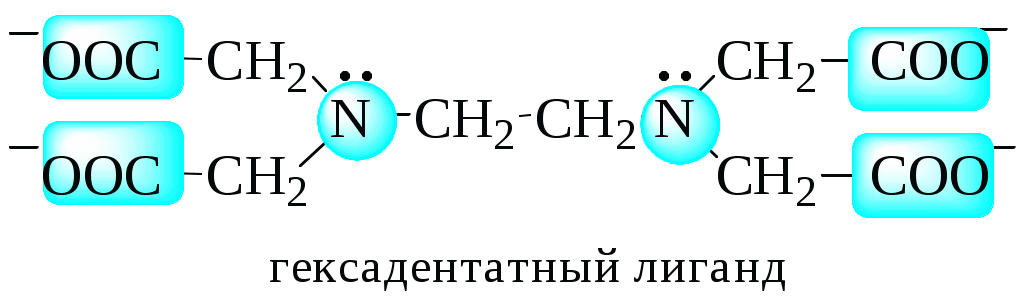
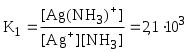
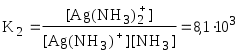 lgK2 = 3,91
lgK2 = 3,91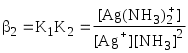 = =1,7107
= =1,7107






