Аналитическая химия. !курс лекций 5 семестр. Предмет аналитической химии
 Скачать 4.18 Mb. Скачать 4.18 Mb.
|
ГЛАВА 4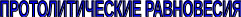 4.1. Важнейшие теории кислот и оснований Первая научная теория кислотности была предложена в 1780-х годах А. Лавуазье. Согласно данной теории все кислоты должны были обязательно содержать атом кислорода, что и было отражено в названии этого элемента.  В 1816 году Г. Дэви высказал предположение, что в состав кислот должен обязательно входить атом водорода. В 1833 году Ю. Либих уточнил это определение - кислота - вещество, в состав которого входят атомы водорода, способные замещаться атомами металла. В 1880-х годах С. Аррениус и В. Оствальд предложили ионную теорию кислот и оснований, согласно которой 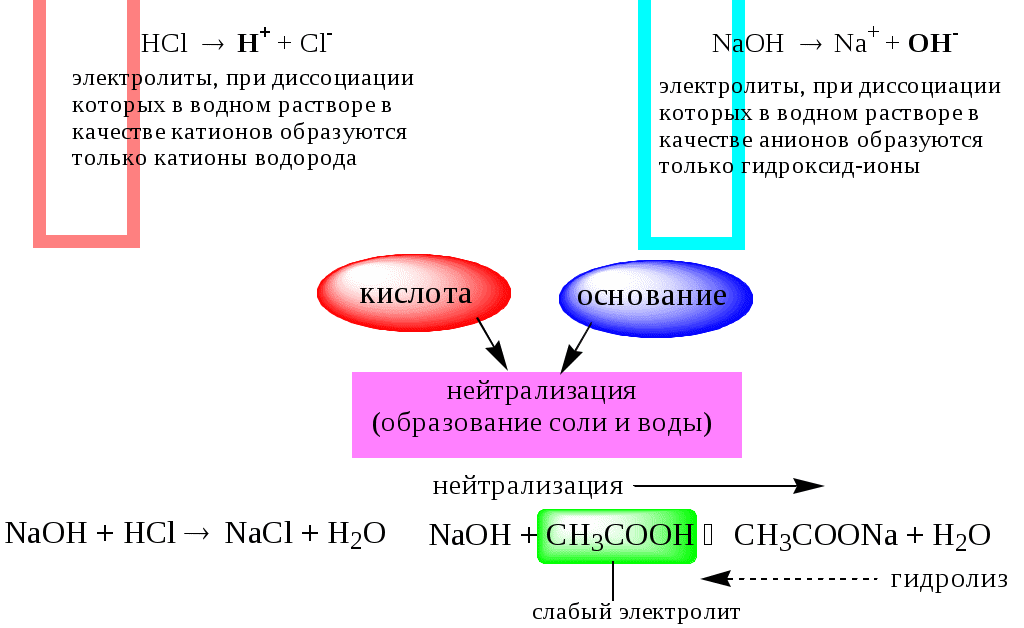 В 1923 году почти одновременно появились ещё 2 теории кислот и оснований. Автором первой были датский химик И.Н. Брёнстед и английский химик Т.М. Лоури, а второй – американский физикохимик Г.H. Льюис. Согласно теории Брёнстеда - Лоури, названной протолитической теорией кислот и оснований: 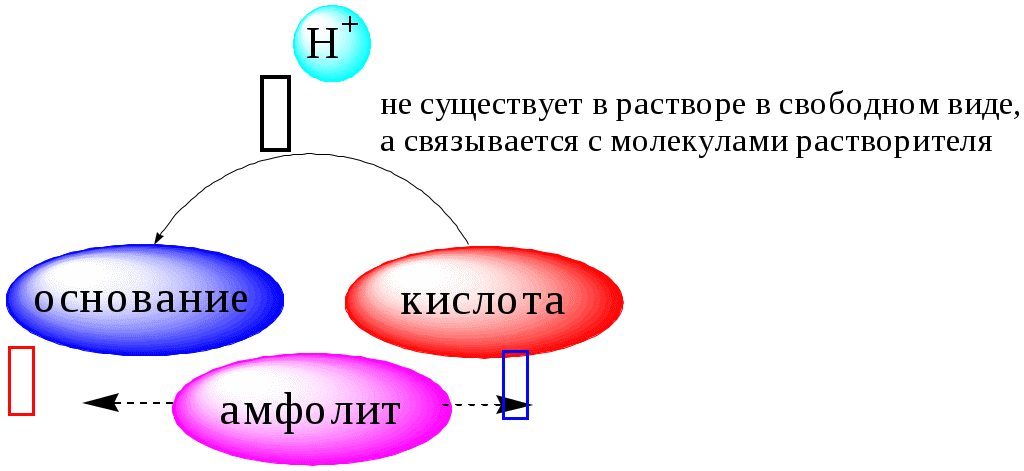 Кислоты, основания и амфолиты могут быть как электронейтральными, так и иметь заряд. 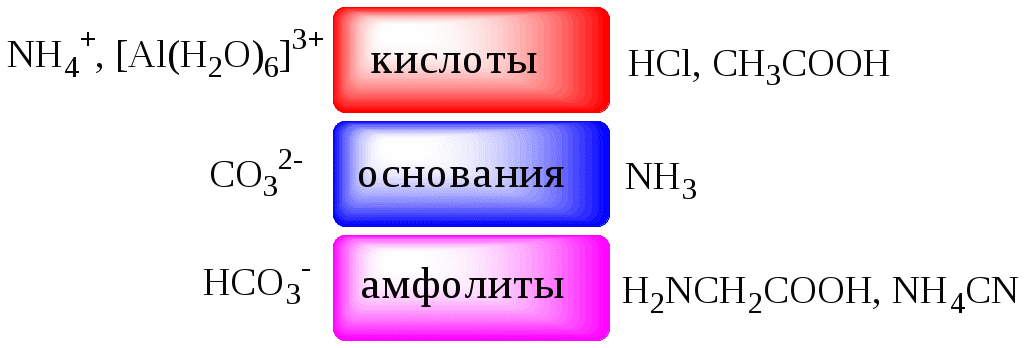 Кислотно-основное взаимодействие заключается в обратимом переносе протона от кислоты к основанию. Кислоты и основания существуют как сопряжённые пары. В процессе взаимодействия друг с другом кислота и основание не исчезают, например, образуя соль, а превращаются в новое основание и новую кислоту. 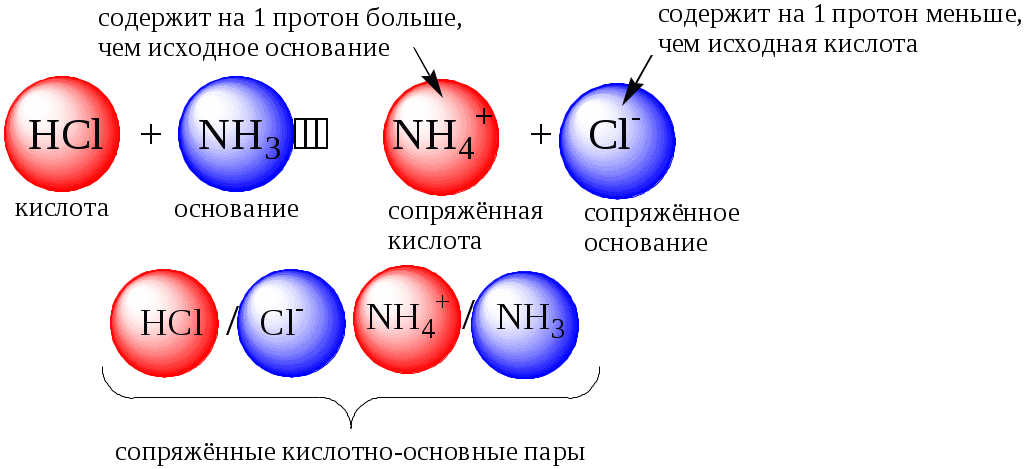 Понятие «соль» в протолитической теории вообще не используется и, тем более, отсутствует понятие «гидролиз соли». Так, например, тот факт, что раствор NH4Cl имеет слабокислую среду, объясняется не гидролизом данной соли с образованием слабого электролита NH4OH и сильного электролита HCl, а тем, что катион аммония является слабой кислотой. Более того, никакого «слабого электролита» NH4OH на самом деле не существует (связь между атомами кислорода и азота не может быть ковалентной, так как азот не бывает пятивалентным). Согласно теории Льюиса, названной электронной теорией кислот и оснований 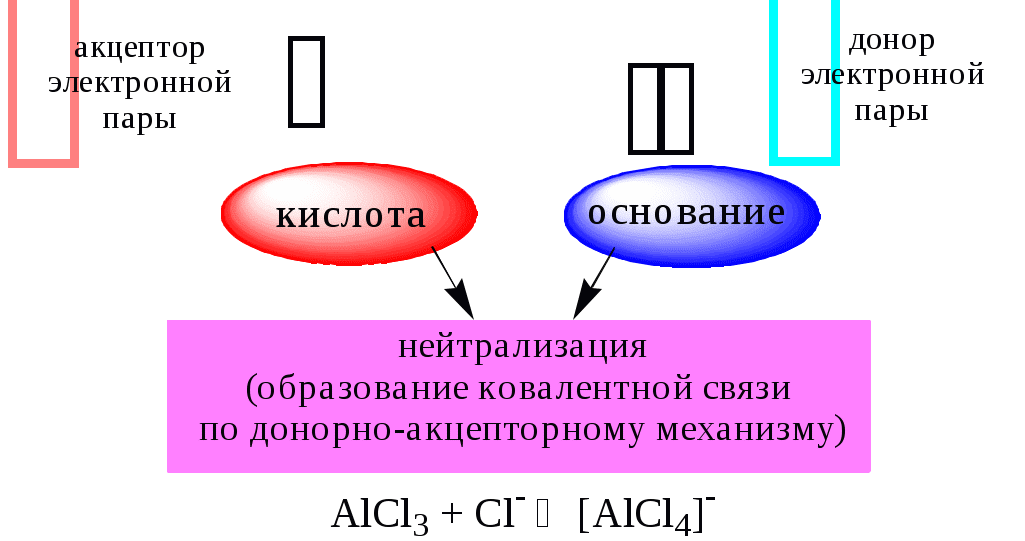 Основания Брёнстеда и основания Льюиса представляют собой одни и те же соединения, понятие «кислота» согласно протолитической и электронной теориям отличается. В аналитической химии преимущественно используется протолитическая теория. Это связано с тем, что теория Льюиса имеет слишком общий характер и её трудно применить для количественных расчётов. 4.2. Количественное описание силы кислот и оснований Для количественной характеристики силы кислот, находящихся в растворе, используют константу, характеризующую способность кислоты отдавать протон молекуле растворителя, выступающей в качестве основания. Такая константа называется константой кислотности (Ka). 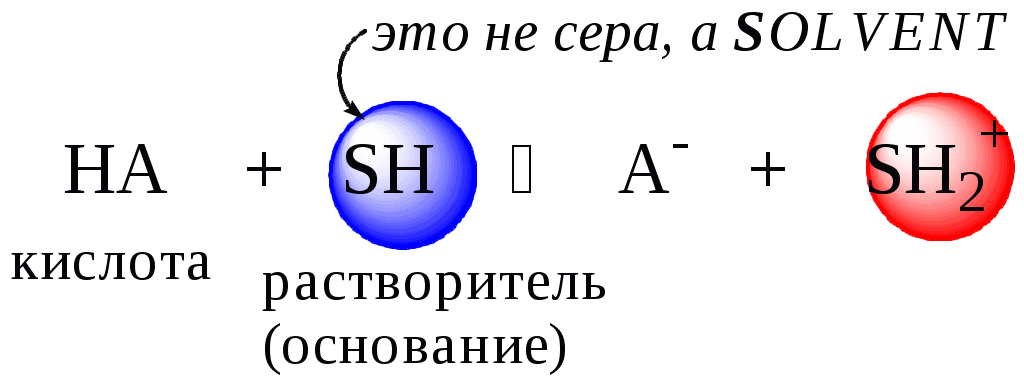 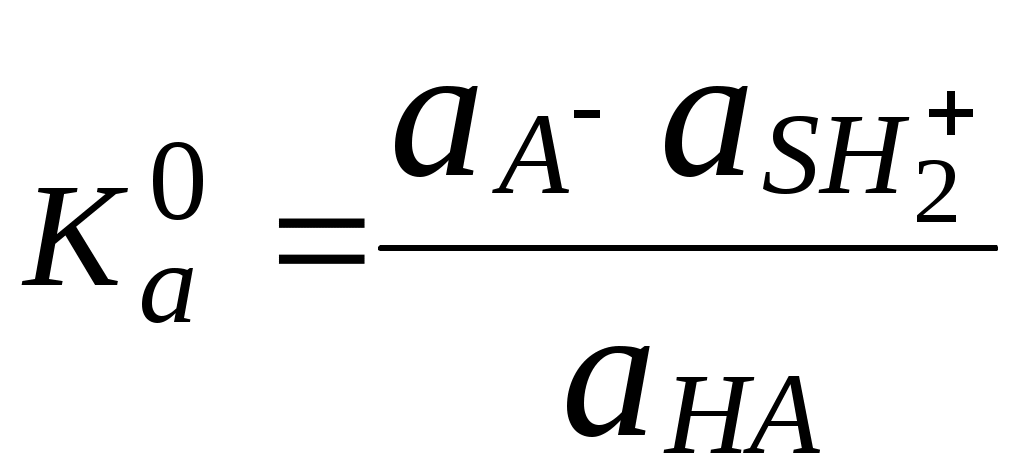 Активность растворителя не входит в выражение константы, так как считается равной 1. Для водных растворов 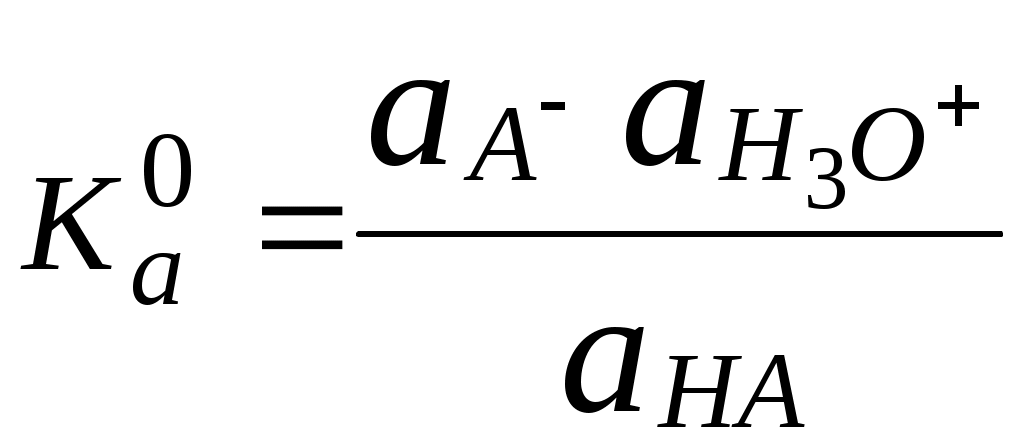  Силу оснований можно описывать двояко: с помощью константы основности (Kb) либо с помощью константы кислотности сопряженной кислоты (KBH+ или Ka). В случае водных растворов данные константы описывают следующие равновесия: B + H2O BH+ + OH- BH+ + H2O B + H3O+ Константа основности в современной аналитической химии практически не применяется. Это связано с тем, что при использовании данной константы, приходится работать с активностью (или концентрацией) гидроксид-ионов, в то время как среду раствора принято описывать с помощью концентрации ионов водорода. Кроме того, при использовании константы кислотности сопряжённой кислоты все протолиты (и кислоты и основания) можно объединить в одну таблицу. Константа основности не несёт никакой новой информации, так как её легко рассчитать, зная величину константы кислотности сопряжённой кислоты. Обозначения KBH+ и Ka равнозначны между собой. Первый из них мы в дальнейшем будем использовать в тех случаях, когда речь идёт о характеристике силы основания через сопряжённую с ним кислоту. Это особенно удобно в случае сложных органических молекул, содержащих несколько кислотных и основных центров. 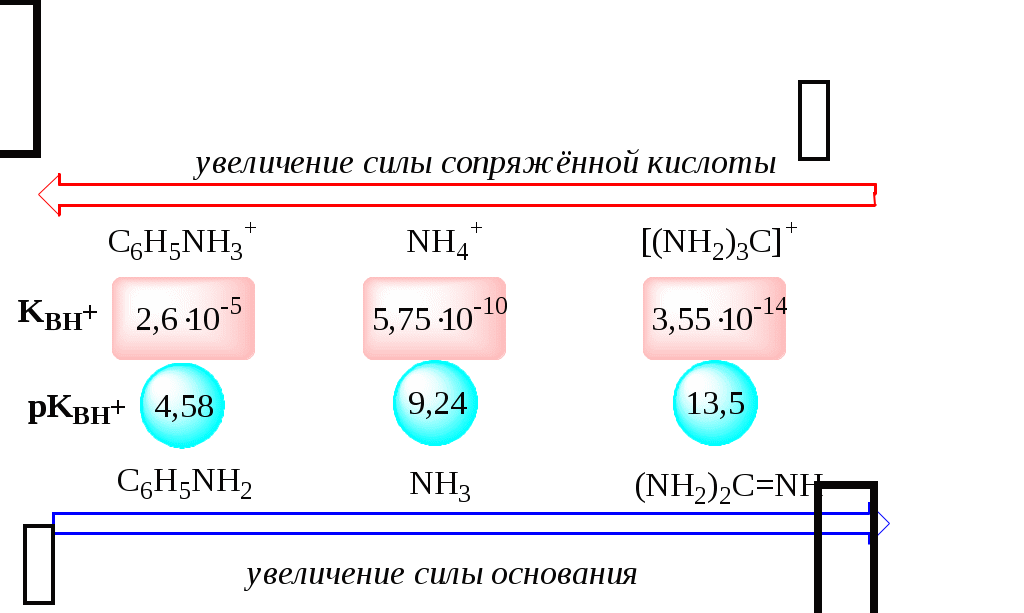 4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества Кислотно-основные свойства растворителя Сила кислоты зависит от природы взаимодействующего с ней основания, а сила основания - от взаимодействующей с ним кислоты. Например, первичный амин в воде является более слабым основанием, чем в уксусной кислоте.  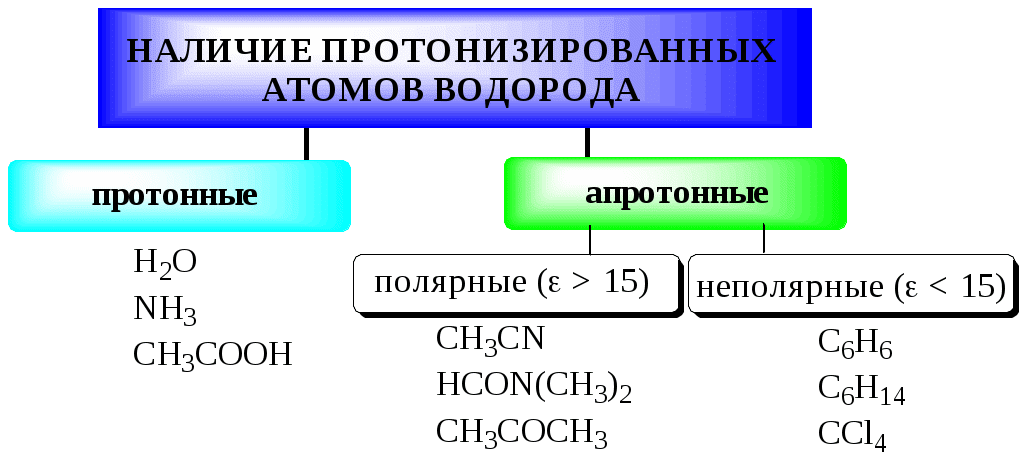  Протонизированным называют атом водорода, связанный с атомом сильно электроотрицательного элемента и способный легко отщепляться от молекулы в виде протона (поэтому иногда его называют «подвижным»). В зависимости от кислотно-основных свойств растворители бывают: 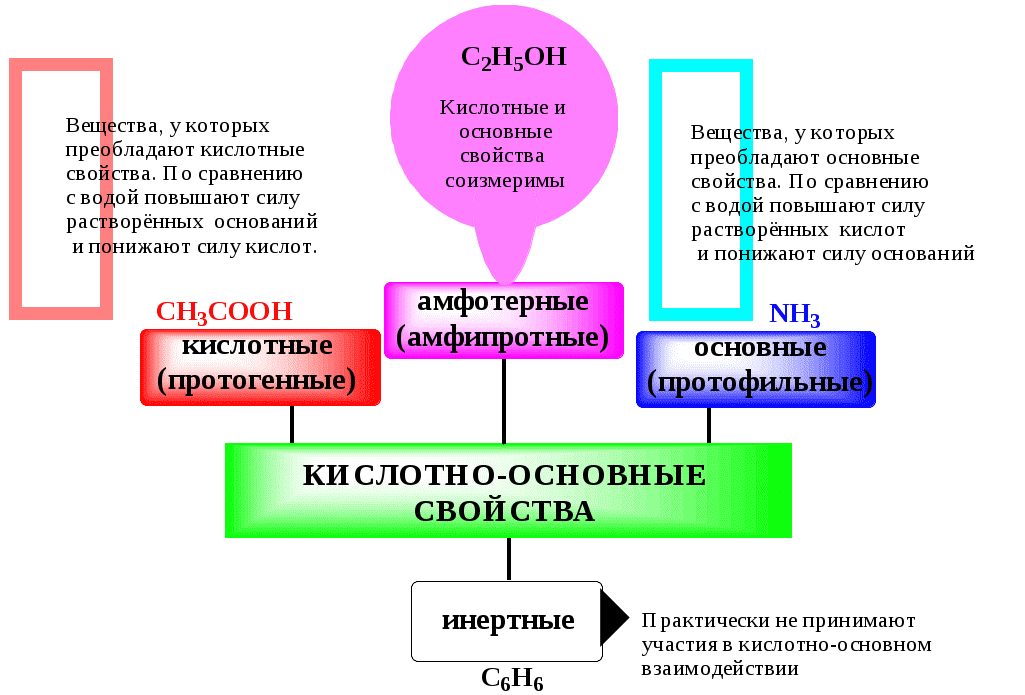 Протонные растворители могут относиться как к кислотным (уксусная кислота), так и к основным (аммиак) или амфотерным растворителям (вода). Одни из представителей полярных апротонных растворителей, например, диметилформамид, обладают основными свойствами, другие (кетоны, ацетонитрил, диметилсульфоксид), а также неполярные апротонные растворители вообще не склонны к реакциям кислотно-основного взаимодействия. Автопротолиз растворителя. Константа автопротолиза Автопротолизом называют процесс кислотно-основного взаимодействия между двумя молекулами вещества, при котором одна молекула ведёт себя как кислота, а вторая - как основание. H2O + H2O H3O+ + OH- СH3COOH + СH3COOH СH3COO- + СH3COOH2+ C2H5OH + C2H5OH C2H5O- + C2H5OH2+ NH3 + NH3 NH2- + NH4+ Автопротолизу в той или иной степени подвергается большинство растворителей. Однако у одних веществ он идёт более интенсивно, у других - менее интенсивно. Рассмотрим реакцию кислотно-основного взаимодействия между двумя молекулами растворителя 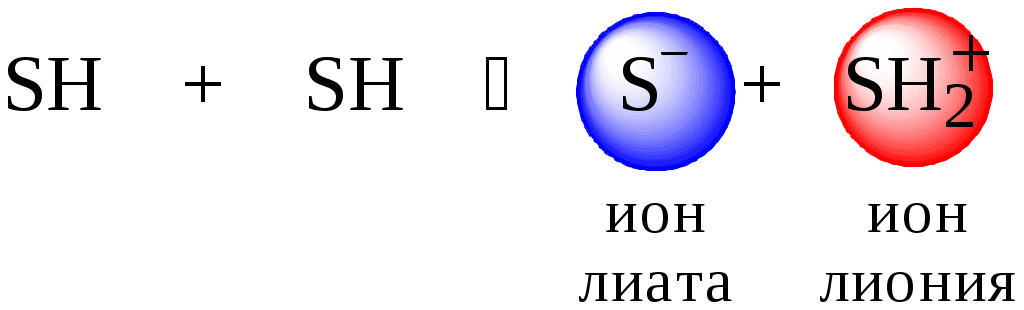 Для чистого растворителя Полученная константа называется константой автопротолиза(KSH). В случае воды выражения для константы автопротолиза (обычно обозначается как KW) выглядит следующим образом: При 25 С Показатель константы автопротолиза является мерой протяжённости шкалы кислотности (от 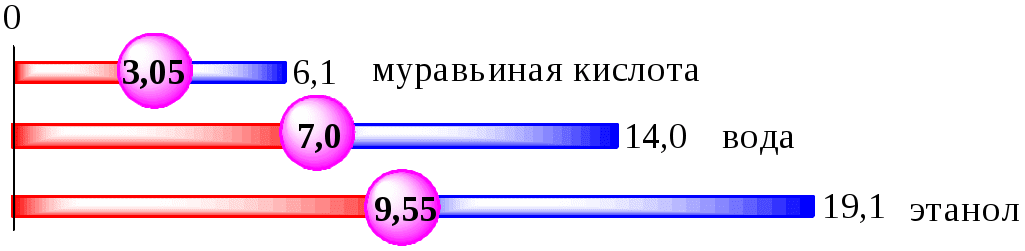 Константа автопротолиза растворителя связывает между собой константы кислотности и основности частиц, образующих сопряжённую кислотно-основную пару. Например, для водных растворов: Диэлектрическая проницаемость Диэлектрической проницаемостью среды () называют безразмерную величину, которая показывает, во сколько раз взаимодействие между двумя точечными электрическими зарядами в данной среде слабее, чем в вакууме. Чем выше диэлектрическая проницаемость растворителя, тем лучше происходит диссоциация растворённого в нём электролита. Растворители, у которых > 15, называются полярными, а те, у которых < 15 - неполярными. Диэлектрическая проницаемость влияет на величину константы автопротолиза. 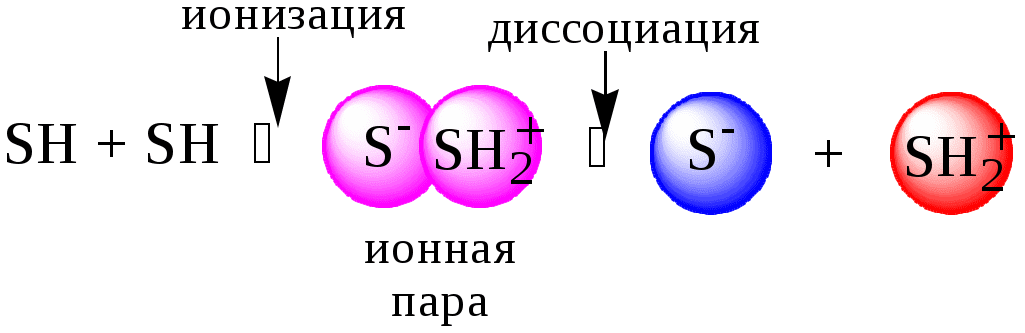 Если растворитель имеет малую диэлектрическую проницаемость, то константа диссоциации ионной пары будет также мала, следовательно, и значение константы автопротолиза будет небольшим.
Диэлектрическая проницаемость растворителя оказывает влияние на константу кислотности (или основности) растворённого вещества. При уменьшении величины данных констант уменьшаются. Причём у заряженных частиц они изменяются менее сильно, чем у незаряженных.
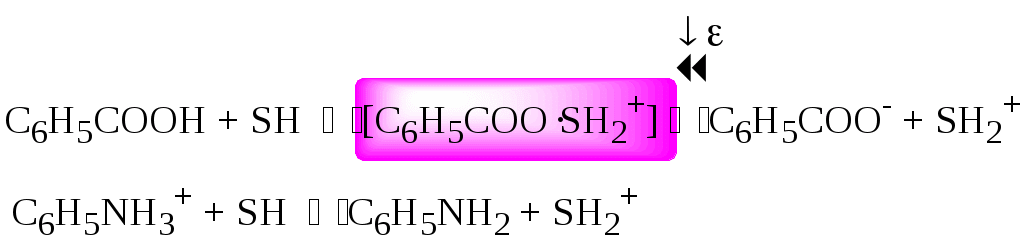 4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания Самая сильная кислота, которая может существовать и оставаться устойчивой в среде растворителя - ион лиония (в случае воды - это H3O+), а самое сильное основание - ион лиата (для воды ОН-). Кислоты, проявляющие более сильные кислотные свойства, чем ион лиония, и основания, проявляющие более сильные основные свойства, чем ион лиата, называются сильными. Для частицы H3O+ pKa = 0, сильными считаются кислоты, у которых pKa < 0. К ним относятся, например, HClO4, HI, HBr, HCl, H2SO4, HNO3. Экспериментально определить различия в силе кислотности у данных соединений практически невозможно. В водном растворе они все будут вести себя практически одинаково. HClO4 + H2O H3O+ + ClO4- Основания, проявляющие более сильные основные свойства, чем ион OH- (pKBH+ = 14), в водном растворе также уравниваются по силе. К таким основаниям относятся NH2-, O2-, CH3-, H- и др. NH2- + H2O NH3 + OH- Кислоты, являющиеся более слабыми, чем ион лиония, и основания, проявляющие более слабыми основными свойствами, чем ион лиата (если только они не являются слишком слабыми кислотами или основаниями), проявляют индивидуальные свойства. У кислот средней силы величина pKa находится в интервале примерно 0 - 4 (границы условны!). HSO4- + H2O SO42- + H3O+ (pKa =1,94 ) У слабых кислот pKa > 4: H2S + H2O HS- + H3O+ (pKa = 6,99) Основания, имеющие pKBH+ от 10 до 14, иногда называют основаниями средней силы, а основания, у которых pKBH+ < 10, - слабыми. S2- + H2O HS- + OH- (pKBH+ = 12,6) C6H5NH2 + H2O C6H5NH3+ + OH- (pKBH+ = 4,6) Уравнивание по силе кислот более сильных, чем ион лиония, и оснований более сильных, чем ион лиата, а также очень слабых кислот и оснований называется нивелирующим действием растворителя. Не слишком сильные и не слишком слабые кислоты и основания можно практически различить по силе. Растворитель оказывает на них дифференцирующее действие (рис. 4.1). 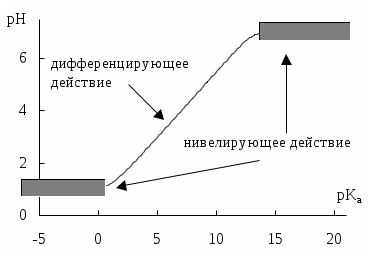 Рис. 4.1. Значения pH 0,1 М кислот в воде Способность растворителя оказывать нивелирующее или дифференцирующее действие зависит от: кислотно-основных свойств растворителя; его склонности к автопротолизу. 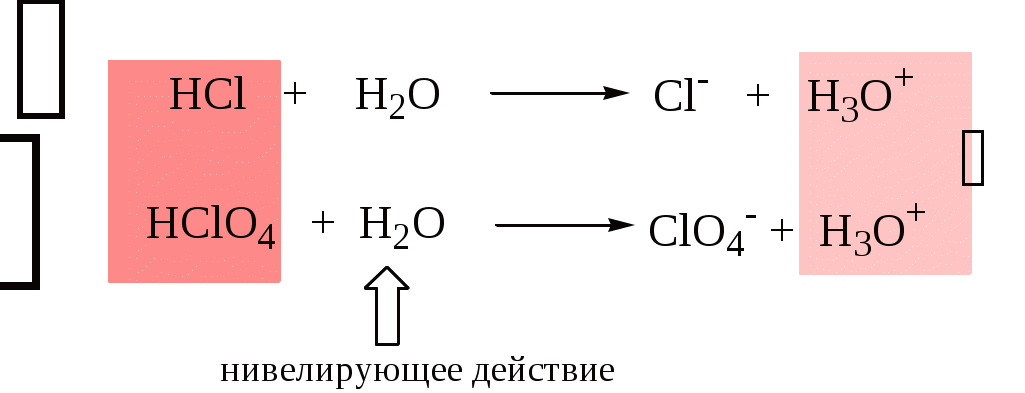 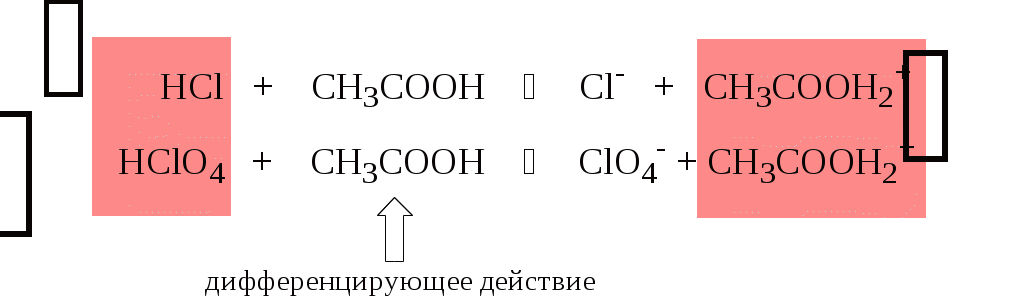 В аммиаке невозможно отличить по силе не только хлорную и хлороводородную кислоты, но и хлорную и уксусную, т.к. NH4+ является значительно более слабой кислотой, чем H3O+. Таким образом, аммиак обладает ещё более сильным, чем вода, нивелирующим действием на кислоты. Растворитель с сильными основными свойствами нивелирует силу кислот и дифференцирует силу оснований. Сильно кислотный растворитель, наоборот, дифференцирует силу кислот и нивелирует силу оснований. Чем меньше величина константы автопротолиза растворителя, тем больше вероятность того, что он будет оказывать дифференцирующее действие на силу кислот и оснований (рис. 4.2). 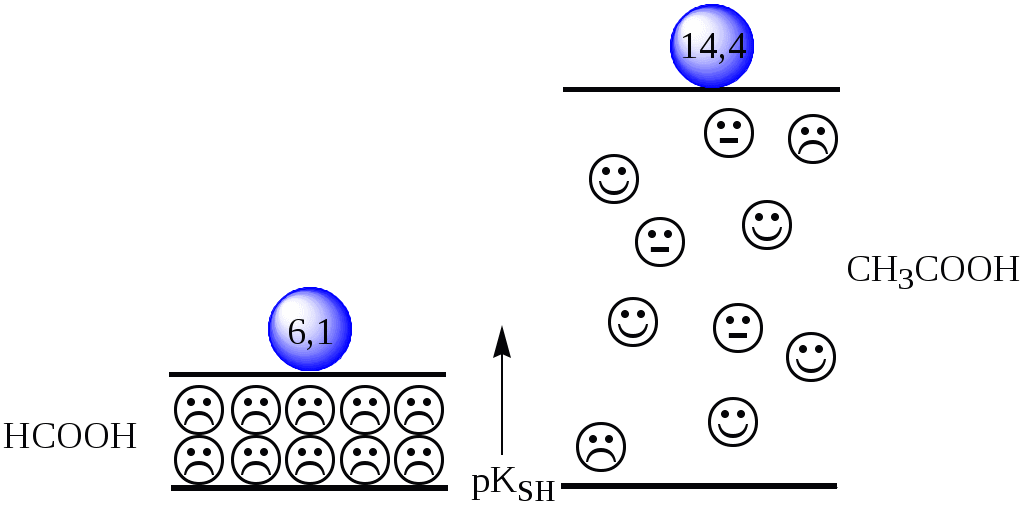 Рис. 4.2. Константа автопротолиза растворителя и его дифференцирующее действие 4.5. Расчёт рН водных растворов различных протолитов Водородным показателем (рН) называется отрицательный десятичный логарифм активности (или молярной концентрации) ионов водорода в растворе. pH Для водных растворов pH Для концентрированных растворов величины рН, рассчитанные через активность и молярную концентрацию, отличаются, поэтому для них иногда даже используют разные обозначения, соответственно, paH и pcH. Обозначение рН используется для экспериментально определяемой величины, которая в точности не соответствует ни paH ни pcH, но ближе к первой, чем ко второй. Для характеристики кислотности и щёлочности водных растворов используется интервал рН от 0 до 14. В более кислых и более щелочных растворах понятие рН теряет смысл, так как активность и концентрация H3O+ обычно значительно отличаются, причём еще и по-разному у различных веществ. Растворы сильных кислот или сильных оснований В водном растворе сильной кислоты имеются следующие протолитические равновесия: HA + H2O H3O+ + A- H2O + H2O H3O+ + OH- Если CHA > 10-6 моль/л, то ионами H3O+, образующимися при автопротолизе воды, можно пренебречь. Тогда Если CHA < 10-6 моль/л, то необходимо учесть и те протоны, которые образовались при автопротолизе. В данном случае физический смысл имеет только один из корней полученного квадратного уравнения, так как концентрация не может быть отрицательной. 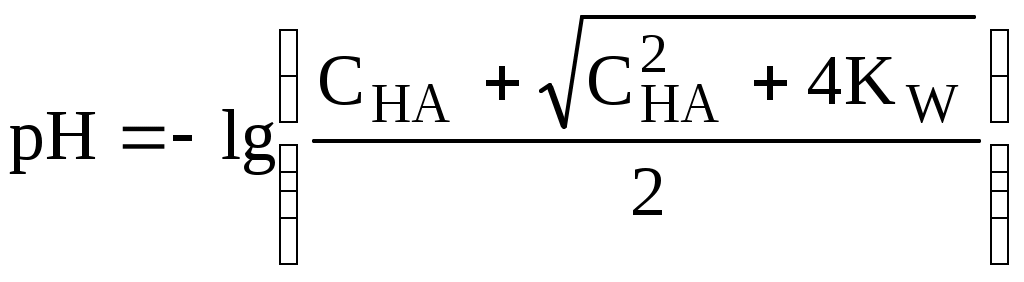 Аналогичные формулы можно получить и для сильных оснований. 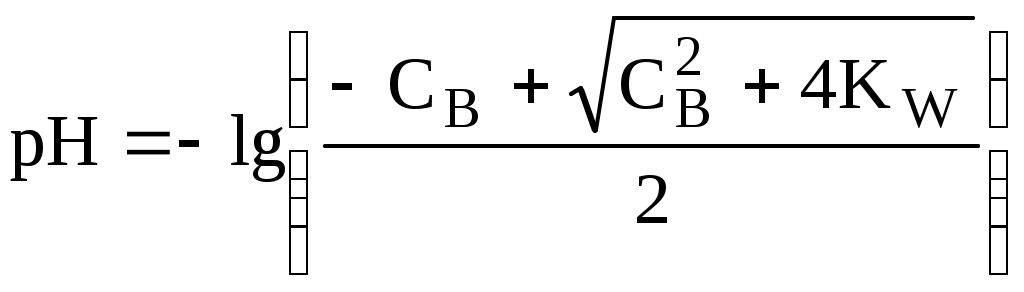 Пример 4.1. Рассчитать рН 0,01 М HCl и 0,01 М NaOH, а также 1,010-8 М HCl. 1) pH = -lg0,01 = 2,0 2) pH = 14,0 + lg0,01 = 12,0 3) pH Точный расчёт рН для последнего случая имеет чисто теоретический интерес, поскольку наличие в растворе даже незначительных количеств примесей (например, растворённого CO2) приведёт к заметно большему изменению рН, чем присутствие в растворе такого ничтожного количества HCl. Растворы слабых кислот или слабых оснований В водном растворе слабой кислоты, наряду с автопротолизом воды, имеется следующее протолитическое равновесие HA + H2O H3O+ + A- Если кислота достаточно слабая (степень протолиза менее 5%), то можно принять, что [HA] CHA. Если не учитывать автопротолиз воды, Если степень протолиза превышает 5% 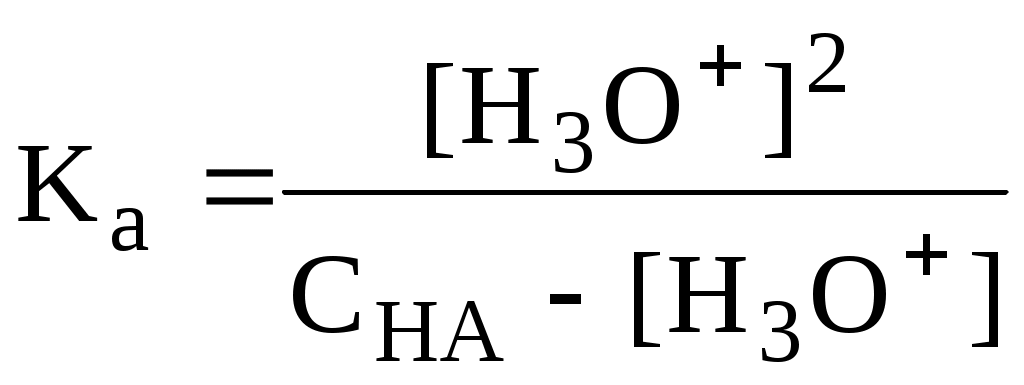 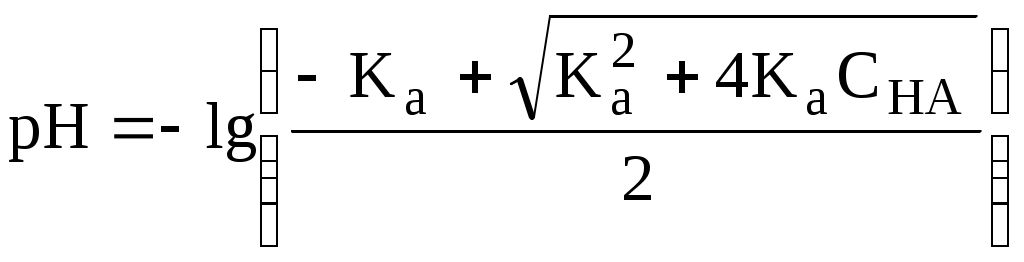 Степень протолиза кислоты зависит от её константы кислотности и концентрации в растворе: Для 0,1 М CH3COOH pKa + lgCHA = 4,75 – 1 = 3,75 ( < 5%), для 0,1 М H3PO4 pKa + lgCHA = 2,15 – 1 = 1,15 ( > 5%) Если кислота очень слабая или концентрация её слишком мала (СHAKa < 10-12 или pKa – lgCHA < 12), то уже нельзя считать, что В водном растворе слабого основания имеется следующее равновесие, описываемое константой основности B + H2O BH+ + OH- Для вывода формулы для расчёта рН раствора слабого основания рассмотрим взаимодействие кислоты, сопряжённой с рассматриваемым основанием, с водой. Такое равновесие описывается KBH+ BH+ + H2O B + H3O+ Приняв, что [B] CB, и так как [BH+] = [OH-] = 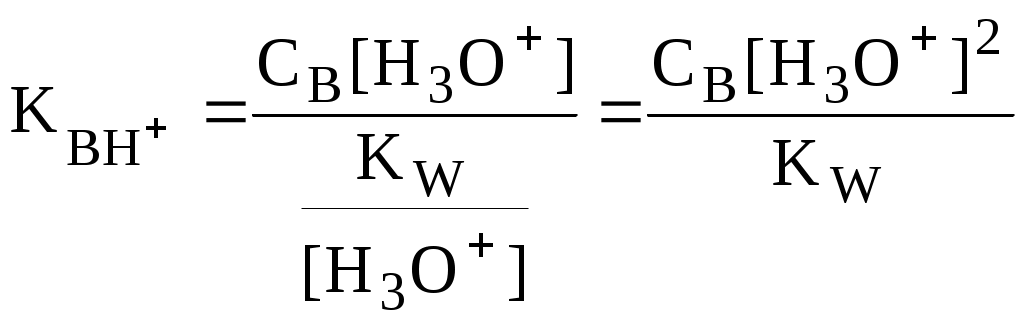 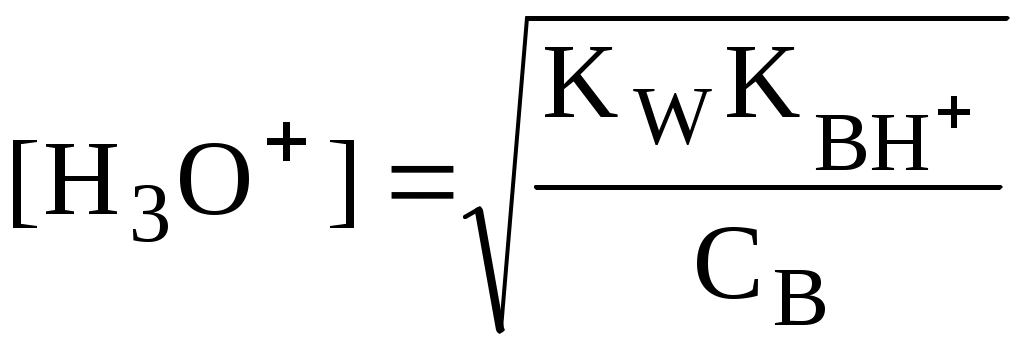 Если нельзя принять, что [B] CB, то [B] = CB – [OH-] 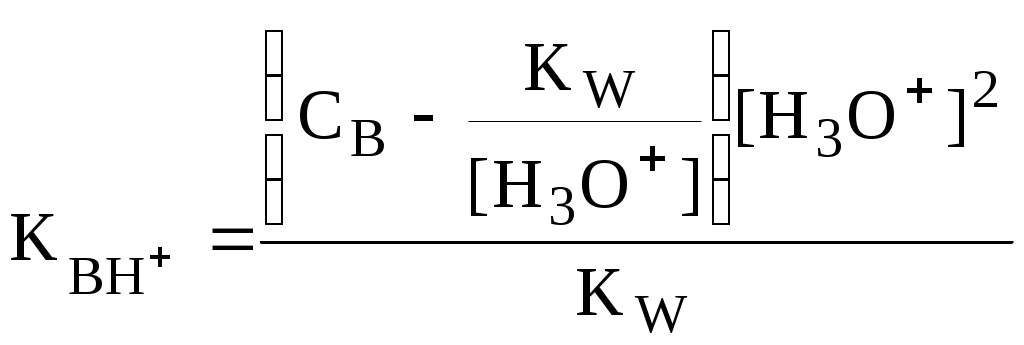 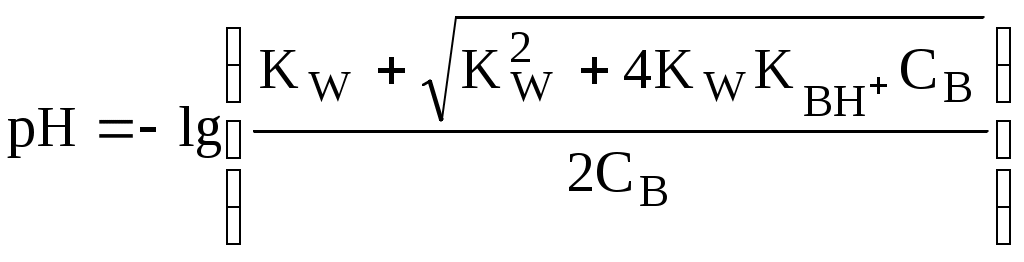 Пример 4.2 Рассчитать рН 0,10 М CH3COOH (pKa = 4,76), 0,10 М CCl3COOH (pKa = 0,70, Ka = 0,20), 0,10 М NH4Cl (pKa(NH4+)= 9,24) 0,10 М NH3 и 0,10 М CH3COONa 1) рН 2) pKa + lgCHA = 0,7 – 1 = -0,7 (степень протолиза больше 5%) рН 3) рН 5) рН Смеси кислот или оснований и многопротонные протолиты Пусть в растворе присутствуют две кислоты HA1 и HA2, имеющие константы кислотности, соответственно, Ka1 и Ka2. Если степень протолиза кислот меньше 5%, то их равновесные концентрации можно заменить общими. Кроме того, если Ka[HA] >> KW, то автопротолиз воды можно не учитывать. Для n слабых кислот Если произведение KaCдля двух кислот значительно отличаются, то при расчёте рН влиянием той из них, для которой это произведение значительно меньше, можно пренебречь. Рассмотрим случай, когда одна из кислот, например, HA1 является сильной, а вторая - слабой. С учётом того, что для слабой кислоты Если в растворе присутствуют два слабых основания, то уравнение электронейтральности (без учёта автопротолиза) имеет следующий вид 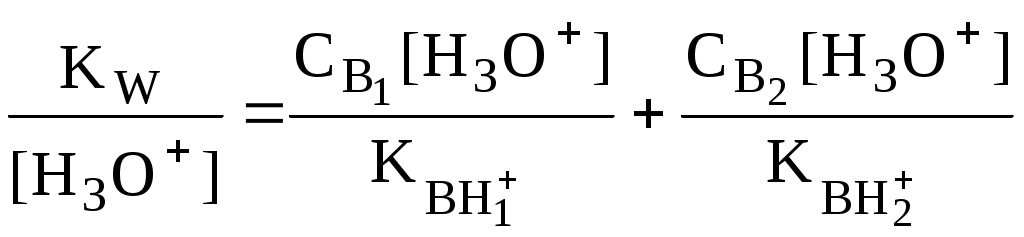 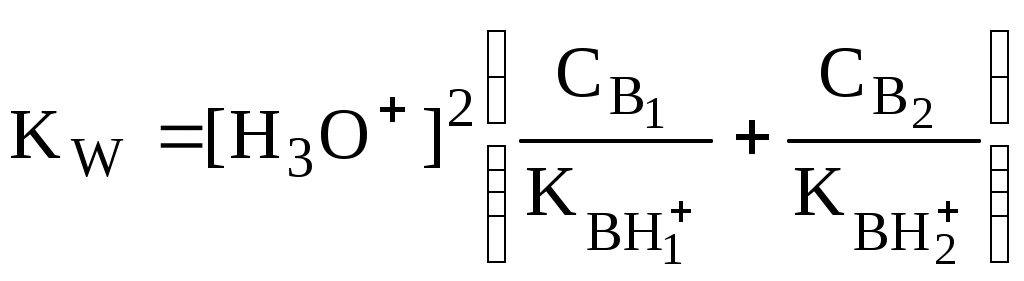 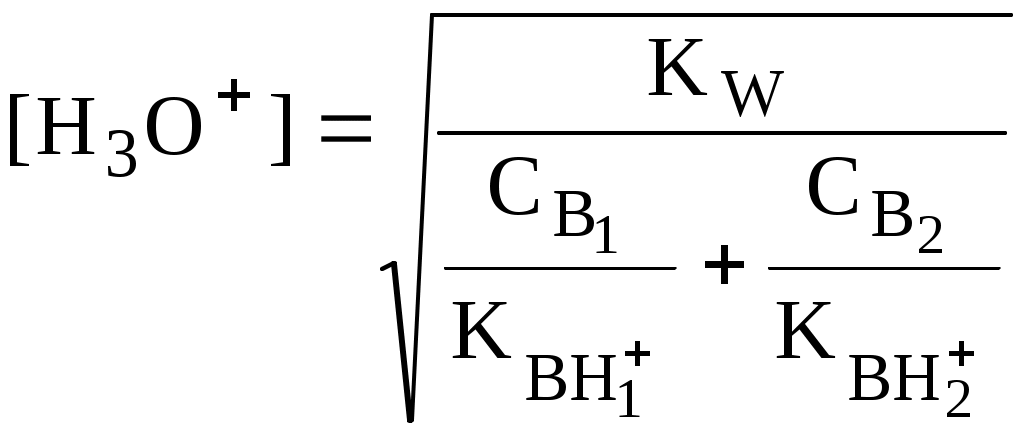 Полученные формулы применимы и для многоосновных кислот и многокислотных оснований. Например, многоосновную кислоту можно рассматривать как смесь кислот (например, H2A и HA-). Так как обычно Ka1 >> Ka2 и [H2A] во много раз превышает [HA-], то расчёт проводят по тем же формулам, что и для одноосновных кислот. Пример 4.3. Рассчитать рН: 1) раствора, содержащего 0,10 моль/л CH3COOH (Ka= 1,7510-5) и 0,10 моль/л HCOOH(Ka= 1,810-4);2) 0,10 М аскорбиновой кислоты (pKa1 = 4,04, pKa2 = 11,34); 3) 0,1 М Na2CO3 (для угольной кислоты pKa1 = 6,35, pKa2 = 10,32) 1) 2) 3) Растворы амфолитовРассмотрим поведение амфолита HA- (например, HCO3-) в водном растворе. HA- + H2O H3O+ + A2- HA- + H3O+ H2A + H2O 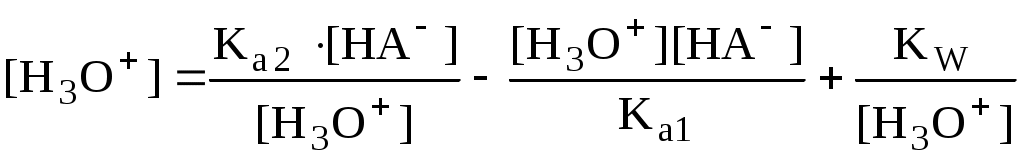 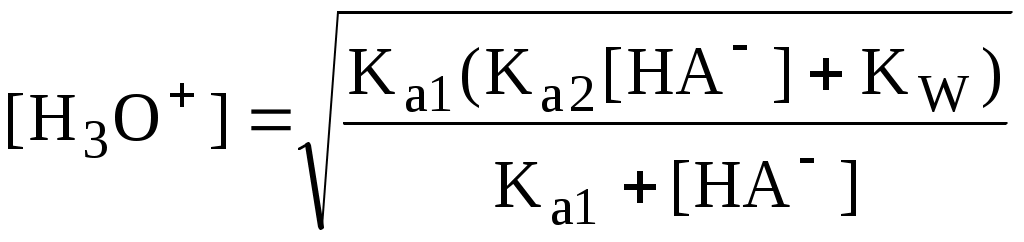 Если 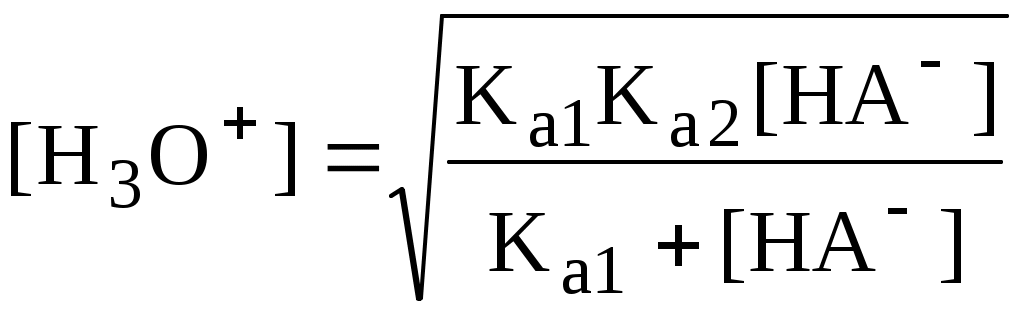 Если [HA-] CHA- и [HA-] >> Ka1, то Такие же формулы используются и для амфолитов типа BH+A- Пример 4.4. Рассчитать рН 0,10 М NaHCO3 и 0,10 М HCOONH4 1) 2) 4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН Рассмотрим двухосновную кислоту H2A. 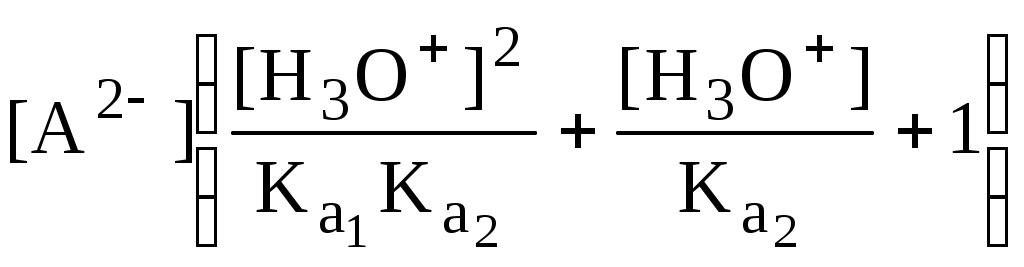 = == 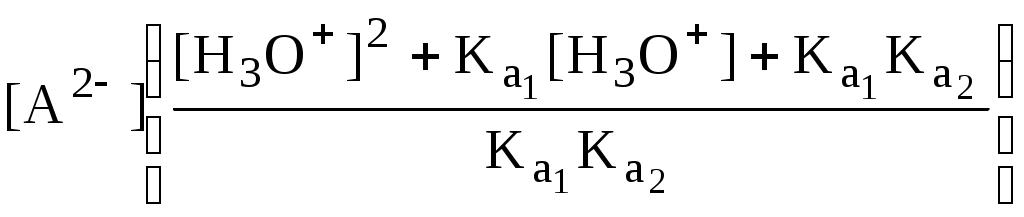 Молярные доли частиц будут равны: 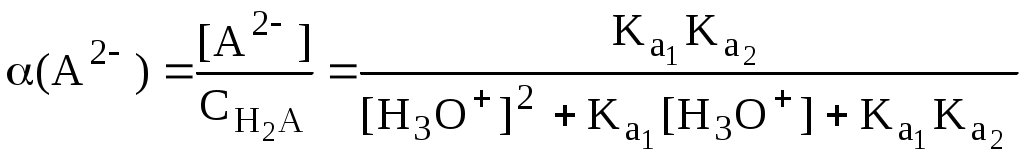 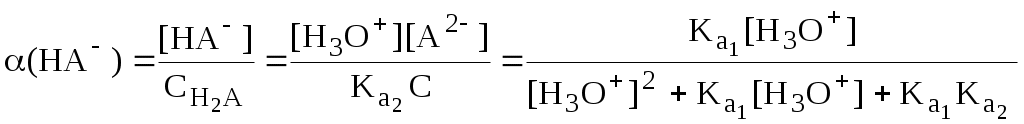 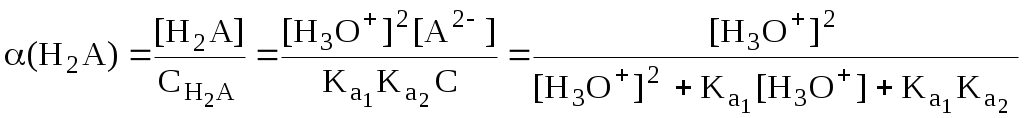 В общем виде формула для расчёта молярной доли частицы 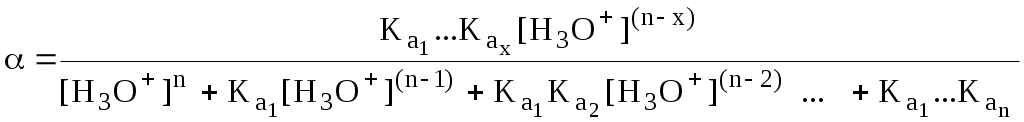 Для одноосновной кислоты 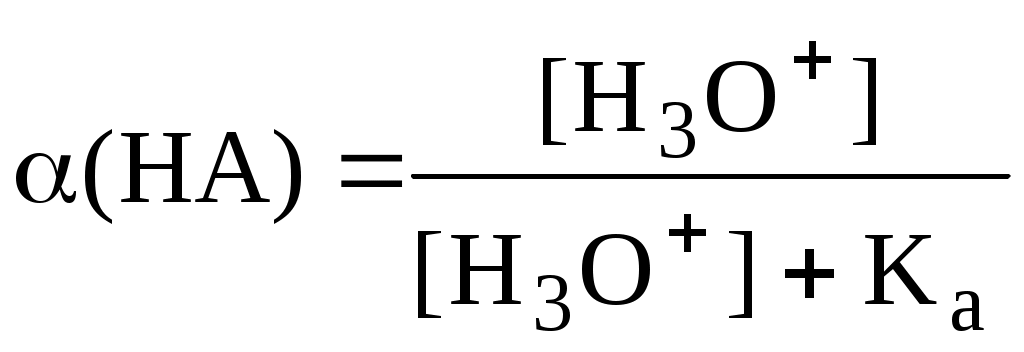 С учётом того, что Из данных формул следует, что при рН = pKa (HA) = (A-) = 0,5. Если рН превышает рKa на 1, то молярная доля А- в 10 раз больше, чем HA, если на 2 - то в 100 раз, на 3 - в 1000 и т.д. При уменьшении рН аналогичным образом увеличивается (HA) (рис. 4.3). Если значения Ka для некоторой многоосновной кислоты отличаются друг от друга на 4 и более порядка, то можно считать, что при любом значении рН в равновесной смеси будут присутствовать только два вида частиц, а концентрация остальных пренебрежимо мала. Например, если необходимо рассчитать молярную долю молекул H3PO4 (pKa1 = 2,15; pKa2 = 7,21) при рН 3, то можно принять, что в равновесной смеси присутствуют только частицы H3PO4 и H2PO4-.Рассчёт можно провести по той же формуле, что и для одноосновной кислоты. 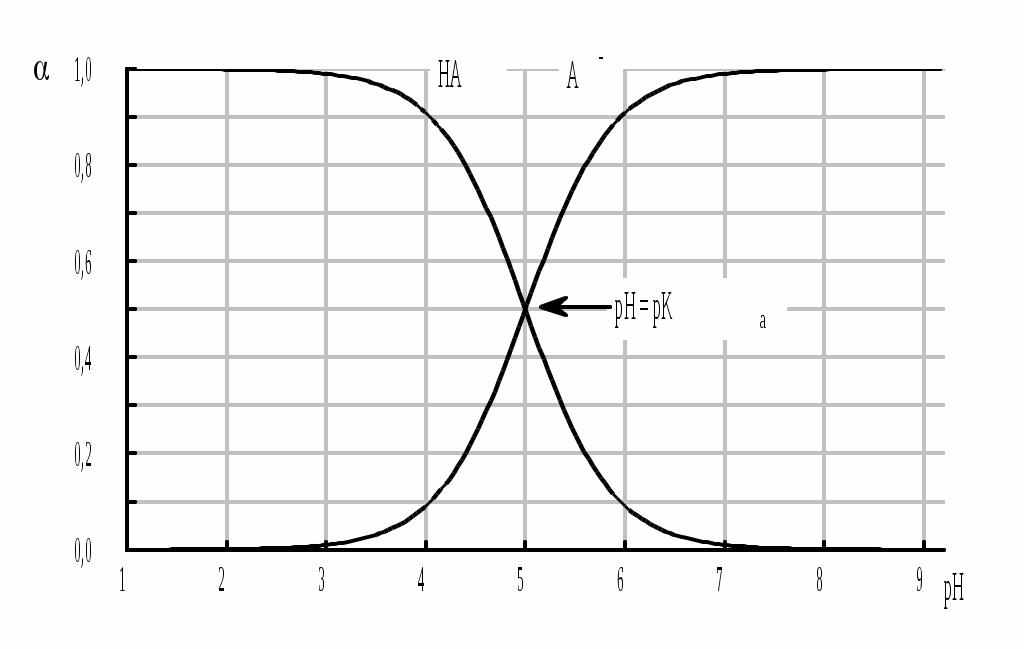 Рис. 4.3. Распределительная диаграмма для слабой кислоты (pKa = 5) Пример 4.5. Рассчитать [NH3] в растворе с общей концентрацией аммиака 0,10 моль/л при рН 7,0. 4.7. Кислотно-основные буферные растворы Буферными растворами, в широком смысле слова, называют системы, поддерживающие определённое значение какого-либо параметра (рН, потенциала системы, концентрации катионов металла), при изменении состава системы. Кислотно-основным называется буферный раствор, сохраняющий примерно постоянным значение рН при добавлении к нему не слишком больших количеств сильной кислоты или сильного основания, а также при разбавлении или концентрировании. Кислотно-основные буферные растворы содержат (в не слишком малых количествах) слабые кислоты и сопряжённые с ними основания. 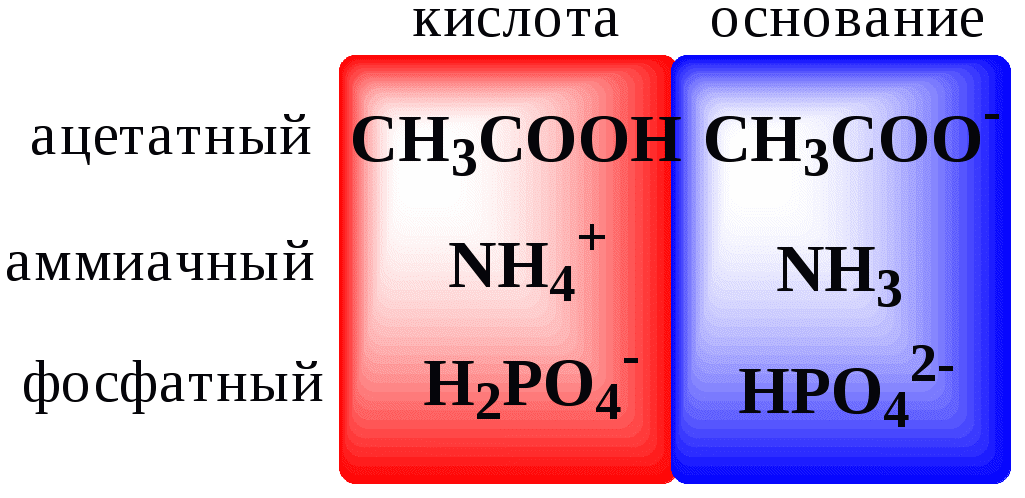 Причина буферного действия таких растворов заключается в следующем. 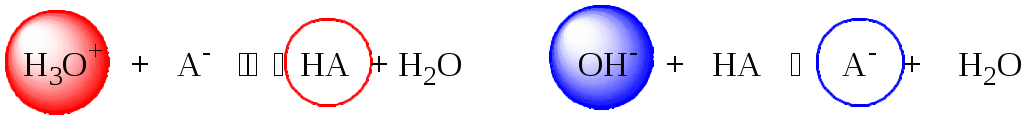 Сильная кислота при добавлении к буферному раствору «превращается» в слабую кислоту, а сильное основание - в слабое основание. Следовательно, заметного изменения рН раствора при этом не происходит. Формулу для расчёта рН буферного раствора можно получить следующим образом. Будем считать, что Полученное уравнение называется уравнением Гендерсона - Хассельбаха. Из этого уравнения следует что, что рН буферного раствора зависит от отношения концентраций слабой кислоты и сопряжённого с ней основания и поэтому незначительно изменяется при разбавлении (или концентрировании). Разбавление, само собой, не может быть безграничным. При значительном разбавлении рН раствора изменится, так как, во-первых, концентрации компонентов станут такими малыми, что нельзя будет пренебречь автопротолизом воды, во-вторых, коэффициенты активности незаряженных и заряженных частиц по-разному зависят от ионной силы. Пример 4.6. Рассчитать рН растворов, полученных 1) при смешивании 100 мл 0,10 М HCOOH и 200 мл 0,10 М HCOONа; 2) 200 мл 0,10 М NH3 и 100 мл 0,10 М HCl. Вместо концентрации в уравнение Гендерсона-Хассельбаха могут быть подставлены количества кислоты и основания или объёмы их растворов (если концентрация растворённых веществ в последних одинакова) 1) Способность буферного раствора сопротивляться изменению рН зависит от соотношения концентраций слабой кислоты и сопряжённого с ней основания, а также от их суммарной концентрации в растворе и характеризуется буферной ёмкостью. Буферной ёмкостью ( или ) называют отношение бесконечно малого увеличения концентрации сильной кислоты или сильного основания в растворе (без изменения его объёма) к вызванному этим увеличением изменению рН. Буферную ёмкость раствора можно рассчитать по следующим уравнениям: На рис. 4.4. приведён пример зависимости β от рН. В сильнокислой и сильнощелочной среде буферная ёмкость значительно увеличивается. Растворы, в которых достаточно высока концентрация сильной кислоты или сильного основания, также обладают буферными свойствами, причём даже в большей степени, чем растворы, традиционно рассматриваемые в качестве «буферных». Для растворов сильных кислот = 2,3[H3O+], для растворов сильных оснований = 2,3[OH-]. 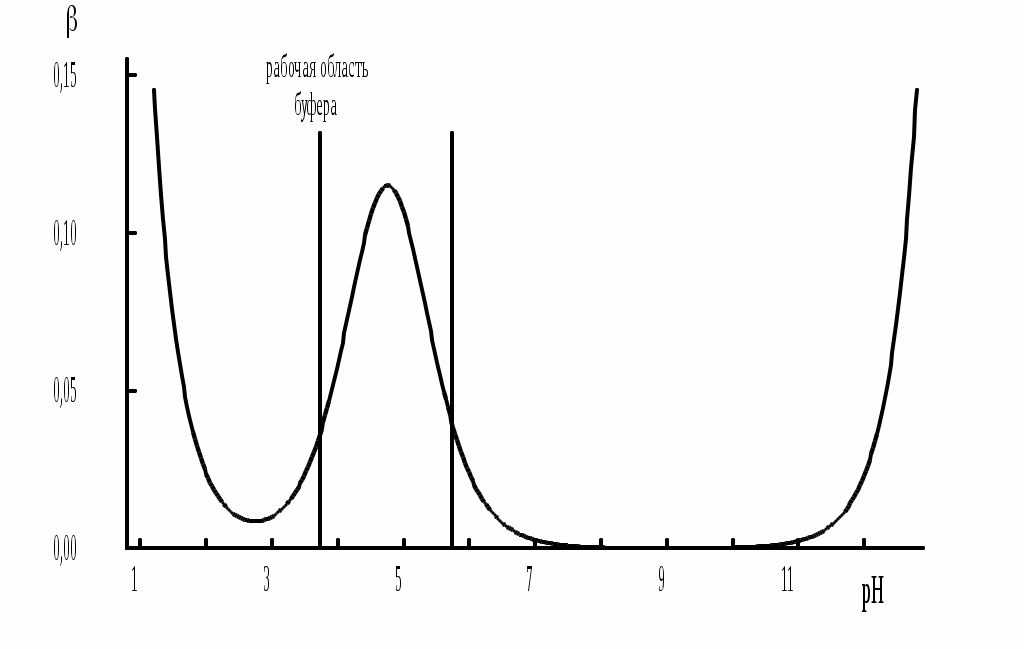 Рис. 4.4. Зависимость буферной ёмкости 0,2 М ацетатного буферного раствора от рН Буферная ёмкость максимальна при рН = рКa и составляет 2,3·0,5·0,5 Cбуф = 0,575Cбуф. Для поддержания некоторого значения рН следует использовать такой буферный раствор, у которого величина рКa входящей в его состав слабой кислоты находится как можно ближе к этому рН. Буферный раствор имеет смысл использовать для поддержания рН, находящегося в интервале рКa 1. Такой интервал называется рабочей областью буфера. Например, рабочая область рН для ацетатного буферного раствора составляет примерно 3,8 - 4,8. Совершенно бессмысленно использовать такой буферный раствор для рН, например, 9. Пример 4.7. Рассчитать буферную ёмкость формиатного буферного раствора, упомянутого в примере 4.6. Каким станет рН этого раствора, если к 1 л его добавить 5,010-3 моль сильной кислоты? |
