Предмет, задачи и основные разделы патофизиологии. Методы патофизиологических исследований. Значение патофизиологии для клинической и профилактической медицины
 Скачать 0.63 Mb. Скачать 0.63 Mb.
|
|
Стадия снижения температуры. Переход в эту стадию обусловлен уменьшением или прекращением образования в организме вторичных пирогенов. Их действие на нейроны теплорегулирующего центра ослабевает, «установочная точка» возвращается к нормальному уровню, и повышенная температура «ядра» тела начинает восприниматься как чрезмерная. Это является стимулом для снижения теплообразования и усиления теплоотдачи. Происходит расширение поверхностных сосудов и увеличение потоотделения. Теплообразование возвращается к норме, иногда может быть несколько ниже или выше нормы, но в любом случае имеет место превалирование теплоотдачи над теплообразованием.
Существует два варианта снижения температуры тела - критическое и литическое. В первом случае снижение происходит быстро, в течение нескольких часов, вследствие резкого расширения поверхностных сосудов и обильного потоотделения, что может сопровождаться падением артериального давления вплоть до развития коллапса. При литическом варианте снижение температуры тела происходит медленно, на протяжении нескольких дней, что представляет меньшую опасность для больного. ВИДЫ ЛИХОРАДКИ В зависимости от продолжительности лихорадка может быть эфемерной (1-3 дня), острой (до 15 дней), подострой (до 1,5 месяца) и хронической (более 1,5 месяца). По степени подъема температуры различают лихорадку субфебрильную (37,1-37,9 °С), умеренную (38-39,5 °С), высокую (39,6- 40,9 °С) и гиперпиретическую (41 °С и выше). В зависимости от размера суточных колебаний температуры во вторую стадию лихорадки ее подразделяют на: Постоянная лихорадка febris continua) характеризуется высоким подъемом температуры с суточными колебаниями не выше 1 °С (крупозная пневмония, сыпной тиф и др.). Послабляющая лихорадка f. remittens) - при ней суточные колебания температуры превышают 1 °С, но снижения до нормы не происходит; такой вид лихорадки наблюдается при большинстве вирусных и многих бактериальных инфекциях (экссудативный плеврит, туберкулез и др.).
Перемежающаяся лихорадка (f. intermittens) характеризуется большими колебаниями суточной температуры с падением ее по утрам до нормы или ниже (гнойная инфекция, туберкулез, некоторые разновидности малярии, ревматоидный артрит, лимфомы и др.). Изнуряющая лихорадка f. hectica) - суточные колебания температуры достигают 3-4 °С; наблюдается при гнойных процессах, сепсисе, туберкулезе и других заболеваниях. Возвратная лихорадка (f. recurrens) характеризуется чередованием лихорадочных и безлихорадочных периодов, длительность которых колеблется от одних до нескольких суток (возвратный тиф, лимфогранулематоз, малярия и др.). Атипичная лихорадка f. athypica) отличается совершенно незакономерными колебаниями температуры, причем максимальный подъем ее происходит утром (некоторые формы туберкулеза, сепсис и др.). БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ЛИХОРАДКИ Защитно-приспособительное значение лихорадки подтверждается следующими наблюдениями: • при лихорадке усиливается иммунный ответ организма вследствие активации Т- и В-лимфоцитов, ускорения превращения последних в плазматические клетки, что стимулирует образование антител; повышается образование интерферона; • умеренная степень подъема температуры тела может активировать функцию фагоцитирующих клеток и NK-клеток (натуральные киллеры); • активируются ферменты, угнетающие репродукцию вирусов; • замедляется размножение многих бактерий и снижается устойчивость микроорганизмов к лекарственным препаратам; • возрастают барьерная и антитоксическая функции печени; • гепатоциты усиленно продуцируют так называемые белки острой фазы; некоторые из этих протеинов связывают бивалентные катионы, необходимые для размножения микроорганизмов; • кроме того, повышение температуры тела при лихорадке достаточно часто является первым и единственным признаком какого-либо заболевания, это сигнал тревоги.
Отрицательное воздействие лихорадки на организм: - при резко выраженном и длительном повышении температуры тела. Оно связано со стимуляцией функции сердца, которая может привести к развитию перегрузочной формы сердечной недостаточности, особенно у людей пожилого и старческого возраста, а также у пациентов, ранее уже имевших то или иное заболевание сердца. -Представляет опасность возможность развития коллапса при критическом снижении температуры тела в заключительную стадию лихорадки. -При лихорадке высокой степени может произойти подавление иммунных реакций. – -У детей при высокой лихорадке могут развиться судороги, которые не всегда устраняются приемом жаропонижающих препаратов. При температуре выше 41 °С у детей может развиться отек мозга или острая недостаточность кровообращения из-за лабильности водно-солевого обмена. -Длительно лихорадящие больные (при туберкулезе, бруцеллезе, сепсисе) обычно находятся в состоянии резкого истощения и ослабления жизненных функций. Конечно, при инфекционных заболеваниях нарушения вызываются не только действием высокой температуры, но и микробными токсинами. Лихорадку следует отличать от других гипертермических состояний и от гипертермических реакций. При лихорадке имеет место не нарушение, а перестройка терморегуляции. Организм сам поддерживает высокую температуру, поскольку "установочная точка" терморегуляторного центра настроена на более высокий уровень. Если лихорадящее животное охлаждать, то его температура не уменьшается, сохраняется высокой. При гипертермии нарушена терморегуляция. Температура тела повышается вопреки стремлениям организма поддерживать температурный гомеостаз. "Установочная точка" терморегуляторного центра не меняется. Если животное с гипертермией охлаждать, то в результате резкого увеличения теплоотдачи температура тела начинает уменьшаться 17. Понятие о первичных и вторичных пирогенах. Патогенез лихорадки при инфекционном процессе, асептическом повреждении тканей и иммунных реакциях. Пирогены - вещества, вызывающие повышение температуры тела, лихорадку, поступая в организм из окружающей среды, или образуясь непосредственно в нем самом. Пирогены разделяют на экзогенные (первичные) и эндогенные (вторичные). Важно запомнить, что лихорадочную реакцию запускают не первичные, а вторичные пирогены, выделяемые макрофагами и нейтрофилами. Экзогенные пирогены (инфекционные и неинфекционные) - продукты метаболизма патогенных и непатогенных бактерий, не влияют непосредственно на центр терморегуляции. Наиболее известными являются липополисахариды грамотрицательных бактерий. Основным представителем экзогенных пирогенов является эндотоксин. Бактериальные пигорены используются для стимуляции функций иммунной системы. Эндогенные пирогены (лейкоцитарные) - вещества, поступающие в кровь при разрушении лейкоцитов. Их источником являются гранулоциты и клетки иммунной памяти. К эндогенным пирогенам относятся интерфероны и интерлейкины. В отличие от первичных (бактериальных и небактериальных) пирогенов, вторичные строго специфичны, они являются истинными медиаторами лихорадки. Механизм действия вторичных пирогенов: пирогены проникают в ЦНС, далее воздействуют на тормозные интернейроны передней области гипоталамуса. На мембранах таких нейронов находятся специфические рецепторы, которые при взаимодействии с пирогенами, активируют аденилатциклазную систему. В результате в клетках повышается содержание цикличногоаденозинмонофосфата (цАМФ) - вещества изменяющего чувствительность центра терморегуляции к тепловым и холодовым сигналам. В патогенезе развития инфекционного процесса ключевую роль играет взаимодействие возбудителей болезней и фагоцитов. Результат этого взаимодействия во многом определяет особенности течения инфекционного процесса. В классическом варианте защитная роль фагоцитов состоит в поглощении и уничтожении микроорганизмов. Однако возбудители некоторых инфекционных болезней обладают резистентностью к деструкции фагоцитами и даже способны размножаться в них. Асептические лихорадки, возникающие при повреждении различных отделов мозга, например, спинного мозга в шейном отделе, при кровоизлияниях в мозг, при опухолях, локализующихся вблизи центра терморегуляции, при так называемом «тепловом уколе» (в эксперименте) в область гипоталамуса и др., связаны также с развитием реактивного асептического воспаления, хотя в известных случаях играет роль и механическое раздражение центральных терморегулирующих структур мозга. В основе развития лихорадочной реакции лежит функциональная перестройка центра терморегуляции, наблюдающаяся при раздражении его пирогенами. Изменения в нервных центрах предшествуют повышению температуры тела и выражаются объективно в изменении порогов чувствительности центра терморегуляции к поступающим в него температурным (холодовым и тепловым) афферентным сигналам. Передняя область гипоталамуса обладает высокой чувствительностью к локальным изменениям в ней температуры. При повышении температуры тела проницаемость гематоэнцефалического барьера увеличивается, повышается общая и иммунная реактивность организма, что облегчает лечение больного 18. Изменения физиологических показателей организма при лихорадке. Участие нервной, эндокринной и иммунной систем в развитии лихорадки. Патофизиологические принципы жаропонижающей терапии. Изменения физиологических показателей организма: 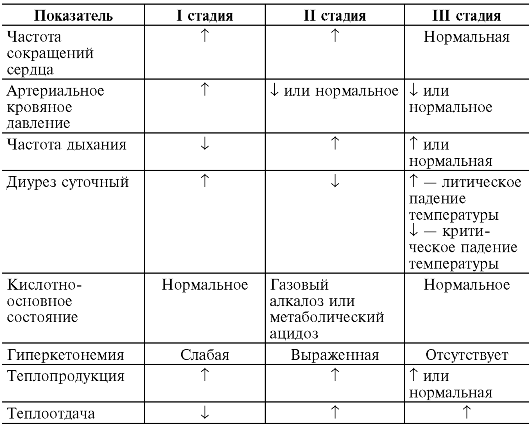 Нервная система при лихорадке Большинство инфекционных и неинфекционных пирогенов, а также лейкоцитарные пирогенные цитокины не оказывают специфического повреждающего действия на нервные структуры. Они вызывают лишь метаболические и/или функциональные реакции. К причинам изменения структуры, функции и обмена веществ в нервной системе по ходу развития лихорадки относятся действие этиологических факторов лихорадки и вторичные расстройства в организме. Проявления • Неспецифические нервно-психические расстройства: раздражительность, плохой сон, сонливость, головная боль, спутанность сознания, заторможенность, иногда — галлюцинации. • Повышенная чувствительность кожи и слизистых оболочек. • Нарушение рефлексов. • Изменение болевой чувствительности, невропатии. Эндокринная система принимает участие в большинстве процессов, развивающихся в организме при лихорадке в качестве компонента сложной системы адаптации организма к действию пирогенного фактора и как объект различных патогенных влияний на неё. Проявления • Активация гипоталамо-гипофизарного комплекса ведёт к увеличению синтеза отдельных либеринов, а также АДГ в гипоталамусе. • Увеличение продукции АКТГ и ТТГ в аденогипофизе. • Повышение в крови уровней кортикостероидов, катехоламинов, Т3 и Т4, инсулина. • Изменение содержания так называемых тканевых, местных БАВ — Пг, лейкотриенов, кининов и др. Иммунной системы при лихорадке усиливается иммунный ответ организма вследствие активации Т- и В-лимфоцитов, ускорения превращения последних в плазматические клетки, что стимулирует образование антител; повышается образование интерферона; Принципы жаропонижающей терапии В медицинской практике исскуственно можно моделировать лихорадку с помощью введения особых веществ – лекарственных пирогенов (высокоочищенные препараты липополисахарида А2), такие как пирогенал, пирифер. Смысл заключается в том, что при лихорадке повышается проницаемость различных физиологических барьеров (ГЭБ) для 9 антибактериальных и иных веществ. Также стимулируется неспецифическое звено иммунитета. Усиливается общая реактивность организма. При повышении t° многие микроорганизмы теряют свою активность, или же у них усиливается чувствительность к антибактериальным препаратам. Физиологическая лихорадка стимулирует эритро- и лейкопоэз. Улучшаются тканевой метаболизм и оксигенация. В качестве жаропонижающих средств используются нестероидные противовоспалительные препараты (ацетилсалициловая кислота, парацетамол, амидопирин и др.), хинин, глюкокортикоиды и другие лекарства. Основной принцип действия этих препаратов заключается в блокировке выработки простагландинов- производных арахидоновой кислоты. 19. Общая характеристика основных видов нарушений тканевого роста. Определение понятия “опухоль”. Принципы классификации опухолей. Признаки злокачественности опухоли. Основных видов нарушений тканевого роста В регуляции тканевого роста выделяют три уровня: центральный, тканевой, генный. Нарушение тканевого роста может быть связано с изменением функции любого из звеньев процесса размножения, что приводит к количественному или качественному изменению роста. - Гипертрофия - увеличение массы органа за счет увеличения массы каждой клетки. - Гиперплазия - увеличение массы органа за счет увеличения количества клеток. - Гипертрофия и гиперплазия бывают истинными и ложными, физиологическими и патологическими. - Ложные гипертрофия и гиперплазия наблюдаются при увеличении объема органа не за счет паренхимы, а вследствие разрастания других тканей, чаще всего соединительнотканной стромы органа. Количество паренхиматозных клеток не увеличивается, часто даже уменьшается, функциональная способность органа снижается. - Гипертрофия и гиперплазия называются физиологическими, если развиваются в физиологических условиях. Например, увеличение массы скелетных мышц при физической работе. Патологической называют гипертрофию, которая развивается в патологических условиях. - Регенерация - процесс восстановления разрушенных или устраненных тканей, органов и отдельных частей живых существ. Регенерация бывает физиологической и патологической. - Физиологическая регенерация - это процесс постоянного восстановления клеток многоклеточного организма. Она совершается в митотических тканях: костном мозге, коже, эпителии слизистых и т.д. - Патологическая регенерация - восстановление тканей и органа после их повреждения. - Атрофия - процесс уменьшения объема клеток органа. - Дистрофия и дегенерация - различные виды нарушения обмена клеток органа и ткани. ОПУХОЛЬ - типический патологический процесс представляющий собой нерегулируемое, беспредельное разрастание ткани, не связанное с общей структурой пораженного органа и его функциями. Классификация по гистогенетическому принципу (предложена Комитетом по номенклатуре опухолей): - эпителиальные опухоли без специфической локализации (органонеспецифические); - эпителиальные опухоли экзо- и эндокринных желез, а также эпителиальные опухоли покровов (органоспецифические); - мезенхимальные опухоли; - опухоли из мышечной ткани; - опухоли нервной системы и оболочек мозга; - опухоли системы крови (гемобластоз); - тератомы (в результате дисонтогенеза, когда происходит дифференцировка 2 или 3 зародышевых листков); Признаки злокачественной опухоли: 1) для злоачественных опухолей характерен и клеточный и таневой атипизм. 2) извращение обмена веществ имеется только у злокачественных опухолей. 3) злокачественные опухоли не имеют капсулу. 4) злокачественные опухоли обладают как правило инфильтрирующим ростом, они прорастают в окружающие ткани. 5) метастазирование свойственно злокачественным опухолям. 6) кахексии отмечаются, как правило, при злокачественных опухолях. 20. Биологические особенности опухолевого роста: беспредельность роста, лимит деления, контактное торможение. Морфологические, функциональные, биохимические и антигенные особенности опухолевой ткани. Беспредельность роста – это избыточность пролиферации опухолевых клеток. У опухолевых клеток понижено свойство контактного торможения, отсутствует предел клеточного деления. Утрата контактного торможения деления (подавление пролиферации клеток при их контакте друг с другом). Нормальные клетки в культуре тканей растут монослоем (т.е. по достижении определенной плотности клеток и контакте их друг с другом, деление клеток прекращается). Опухолевые клетки в культуре тканей образуют многослойные беспорядочные культуры. В норме в процессе межклеточного взаимодействия осуществляется контактное торможение роста клеток: во время пролиферации дальнейшее деление клетки тормозится соседними. В опухоли контактное торможение клеток заблокировано. Отсутствие предела клеточного деления. Нормальные клетки имеют генетически ограниченное число делений («лимит Хейфлика»), после чего включается программа их естественной гибели – апоптоз. В нормальных клетках за программу апоптоза отвечают гены-супрессоры клеточного деления – антионкогены (например, р53). В опухолевых клетках антионкогены инактивированы, поэтому программа апоптоза не включается. В результате опухолевые клетки не гибнут, становятся иммортализованными(«бессмертными»), что в условиях неограниченного числа клеточных делений обусловливает прогрессирующее увеличение количества клеток в ткани. Беспредельность роста обеспечивается также растормаживанием пролиферации за счет увеличения продукции факторов роста, что опосредуется активацией в опухолевых клеткахпротоонкогенов – генов, кодирующих ростовые факторы. Опухолевая клетка осуществляет аутокринную регуляцию своей жизнедеятельности путем самостоятельной продукции и активной рецепции факторов роста. Таким образом, под влиянием генетического сигнала опухолевая клетка сама может стимулировать свое собственное размножение, продуцируя митогены (факторы роста) и их рецепторы. Морфологические особенности опухолевой клетки. Опухоль может развиваться из всех клеток любой ткани организма. Они имеют органоидное строение: паренхиму и строму. Паренхима составляет основную массу опухоли, определяет ее свойства. Строение клеток паренхимы опухоли может сохранять структуру исходных клеток настолько, что их сложно отличить. Строму опухоли составляют соединительная ткань, сосуды, нервы. Клетки опухолевой ткани чаще чем нормальной ткани отличаются между собой по форме, размерам, соотношениям массы ядра и цитоплазмы и рядом других морфологических особенностей, которые детально изучаются в курсе патологической анатомии. Биохимические особенности опухолевой клетки. Опухолевая клетка отличается от нормальной своим химическим составом. В ней повышено содержание воды, калия водорода, холестерина, снижен уровень кальция, магния, железа. Вследствие повышения количества воды и ионов водорода возрастает электропроводимость опухолевой ткани. Повышается отрицательный заряд мембраны опухолевой клетки, что связано с увеличением количества электроотрицательных радикалов нейраминовой кислоты на внешней поверхности мембраны. В опухолевой ткани снижено тканевое дыхание (окисление) и повышен анаэробный и аэробный гликолиз, при этом даже в аэробных условиях преобладает анаэробный гликолиз (негативный эффект Пастера). Это обусловлено снижением активности ферментов аэробного гликолиза – гексокиназы, фосфофрукткиназы, пируваткиназы, и повышением активности ферментов анаэробного гликолиза – дегидрогеназы, гексозофосфатизомеразы; активность ферментов, которые угнетают гликолиз (глюкозо-6-фосфатаза) резко снижается. Вследствие этого повышается анаэробный гликолиз, что ведет к накоплению в большом количестве молочной кислоты (в опухолевой клетке молочной кислоты в 20 раз больше, чем в миозитах в состоянии покоя, и в 8 раз больше , чем в состоянии активности). Этим можно объяснить явление базофилии опухолевой клетки – синее окрашивание гематоксилином. Вследствие преобладания анаэробного и аэробного гликолиза повышается потребность опухолевой клетки в глюкозе, в крови наблюдается гипогликемия. Именно поэтому опухолевую клетку называют «ловушкой» для глюкозы. В опухолевой клетке останавливается синтез структурных белков, ферментов, которые предназначены для исполнения специфической функции. Повышается синтез ДНК и белков митотического аппарата, что обусловливает резкое повышение скорости деления опухолевых клеток. Повышается синтез нуклеиновых аминокислот вследствие изменения набора ДНК-полимераз: снижение активности ДНК-полимеразы-3, которая использует только нативную матрицу ДНК, и увеличение активности ДНК-полимеразы-2, которая может использовать не только нативную матрицу ДНК, но и денатурированную. Изменяется также и метаболизм белков – снижается способность опухолевых клеток к переаминированию и дезаминированию аминокислот, что способствует накоплению в опухоли аминокислот, которые необходимы для поддержания роста. Также увеличивается захват аминокислот из крови, вследствие чего окружающие нормальные клетки теряют аминокислоты. В опухолевой клетке снижается синтез некоторых аминокислот, например, аспарагиновой кислоты. Интенсивный аэробный и анаэробный гликолиз ведет к образованию большого количества низкомолекулярных веществ, которые используются для синтеза аминокислот и нуклеотидов Физиологические особенности опухолевой клетки. В опухоли в значительной степени изменяется и физиология клеток. Одним из этих изменений является потеря опухолевыми клетками контактного торможения. В культуре нормальной ткани при тесном контакте между клетками рост и размножение угнетаются. Опухолевые клетки, не зависимо от тесного контакта между собой, продолжают расти и размножаться, при этом образовывая многослойные участки. Считают, что в основе этого явления лежит изменение структуры цитоскелета – фосфорилирования белков цитоскелета, повышение негативного заряда клетки вследствие уменьшения количества электроотрицательных радикалов нейроаминовой кислоты в мембране клеток. Все это обусловливает потерю контактного торможения клеточного деления. Антигенный атипизм опухоли проявляется в том, что она содержит ряд свойственных только ей антигенов. Среди опухолевых антигенов различают: 1) антигены вирусных опухолей; 2) антигены опухолей, вызванных канцерогенами; 3) изоантигены трансплантационного типа; 4) эмбриональные антигены; 5) гетероорганные антигены. Антигены вирусных опухолей детерминированы вирусным геномом ДНК и РНК-содержащих вирусов, но принадлежат опухолевой клетке. Это ядерные и мембранные антигены, которые идентичны для любых опухолей, вызванных данным вирусом. 21. Этиология опухолей. Роль физических, химических, биологических факторов и наследственности в возникновении опухолей. Факторы риска, предопухолевые состояния. ЭТИОЛОГИЯ ОПУХОЛЕЙ. Этиология опухолей изучена не до конца. В данный момент ведущей считается мутационная теория канцерогенеза. Ниже перечислены основные исторически сложившиеся теории. 1) Вирусно-генетическая теория решающую роль в развитии опухолей отводит онкогенным вирусам, к которым относят: герпесоподобный вирус Эпштейна-Барр (лимфома Беркитта), вирус герпеса (лимфогранулематоз, саркома Капоши, опухоли головного мозга), папилломавирус (рак шейки матки, бородавки обыкновенные и ларингеальные), ретровирус (хронический лимфолейкоз), вирусы гепатитов B и C (рак печени). Согласно вирусно-генетической теории интеграция генома вируса с генетическим аппаратом клетки может привести к опухолевой трансформации клетки. При дальнейшем росте и размножении опухолевых клеток вирус перестает играть существенную роль. 2) Физико-химическая теория основной причиной развития опухолей считает воздействие различных физических и химических факторов на клетки организма (рентгеновское и гамма-излучение, канцерогенные вещества), что приводит к их онкотрансформации. Помимо экзогенных химических канцерогенов рассматривается роль в возникновении опухолей эндогенных канцерогенов (в частности, метаболитов триптофана и тирозина) путем активации этими веществами протоонкогенов, которые посредством синтеза онкобелков приводят к трансформации клетки в опухолевую. 3) Теория дисгормонального канцерогенеза рассматривает в качестве причины возникновения опухолей различные нарушения гормонального равновесия в организме. 4) Дизонтогенетическая теория причиной развития опухолей считает нарушения эмбриогенеза тканей, что под действием провоцирующих факторов может привести к онкотрансформации клеток ткани. 5) Теория четырёхстадийного канцерогенеза объединяет все вышеперечисленные теории Канцерогенные факторы - Химические факторы Вещества ароматической природы (полициклические и гетероциклические ароматические углеводороды, ароматические амины), некоторые металлы и пластмассы обладают выраженным канцерогенным свойством благодаря их способности реагировать с ДНК клеток, нарушая ее структуру (мутагенная активность). Канцерогенные вещества в больших количествах содержатся в продуктах горения автомобильного и авиационного топлива, в табачных смолах. При длительном контакте организма человека с этими веществами могут возникнуть такие заболевания, как рак легкого, рак толстого кишечника и др. Известны также эндогенные химические канцерогены(ароматические производные аминокислоты триптофана), вызывающие гормонально зависящие опухоли половых органов. - Физические факторы Солнечная радиация (в первую очередь ультрафиолетовое излучение) и ионизирующее излучение также обладает высокой мутагенной активностью. Так, послеаварии Чернобыльской АЭС отмечено резкое увеличение заболеваемости раком щитовидной железы у людей, проживающих в зараженной зоне. Длительное механическое или термическое раздражение тканей также является фактором повышенного риска возникновения опухолей слизистых оболочек и кожи (рак слизистой рта, рак кожи, рак пищевода). Также есть давнее мнение А.А. Белостоцкого, что чисто механические факторы могут быть причиной почти любого вида рака. Избыточное или наоборот, недостаточное, механическое воздействие на ткани могло бы приводить к изменениям в тканях (изменения во взаимодействии клетки с другими клетками и с внеклеточным матриксом), которые и приводят к канцерогенезу - Биологические факторы Доказана канцерогенная активность вируса папилломы человека в развитии рака шейки матки, вируса гепатита B в развитии рака печени, ВИЧ — в развитии саркомы Капоши. Попадая в организм человека, вирусы активно взаимодействуют с его ДНК, что в некоторых случаях вызывает трансформацию собственных протоонкогенов человека в онкогены. Геном некоторых вирусов (ретровирусы) содержит высокоактивные онкогены, активирующиеся после включения ДНК вируса в ДНК клеток человека. - Наследственная предрасположенность Изучено более 200 наследственных заболеваний, характеризующихся повышенным риском возникновения опухолей различной локализации. Развитие некоторых типов опухолей связывают с врожденным дефектом системы репарации ДНК (пигментная ксеродерма) Предопухолевые состояния (предраки) Предраковое состояние характеризуется развитием атрофических и пролиферативных процессов с высоким риском малигнизации и трансформации в злокачественную опухоль. При этих заболеваниях совсем не обязательна трансформация в злокачественную опухоль, однако высокий риск злокачественного перерождения при предраковом состоянии всегда существует. К данной категории заболеваний относятся все неспецифические и специфические хронические длительные воспаления, дистрофии, дисплазии, метаплазии, гиперпролиферации тканей, различные иммунодефициты. Например, фактором повышенного риска малигнизации является хронический гастрит, хроническая бронхопневмония, хронический аднексит и другие воспаления. 22. Стадии патогенеза опухолей. Мутационный и эпигеномный механизмы трансформации. Механизмы промоции и опухолевой прогрессии. В опухолевом росте выделяют несколько стадий: Инициация. Процесс изменения генома клетки-мишени под воздействием факторов окружающей среды. При этом единичной мутации недостаточно. Необходимы изменения как минимум в двух генах, один из которых обеспечивает бессмертие клетки, а другой — собственно развитие злокачественного фенотипа. Промоция. На этой стадии происходит увеличение популяции клеток с изменениями в геноме и находящимися под влиянием промоторов канцерогенеза. В результате формируется и нарастает популяция мутировавших клеток. Эта предраковая стадия является обратимой, т.к. возможно регулирование действия промоторов, которые способны инициировать дальнейшие изменения генома. Прогрессия. На этой стадии происходит активный рост клона мутировавших клеток, что и приводит к образованию опухоли. Наблюдается снижение степени дифференцировки клеток, проявление инвазивных свойств и, как следствие, способности к метастазированию. Первую стадию выявить сегодня крайне сложно. Вторую стадию часто удается обнаружить при регулярном целенаправленном обследовании групп риска. Это касается выявления различных маркеров предраковых заболеваний (клинических и лабораторных). К сожалению, фаза прогрессии на ранних стадиях часто является бессимптомной, а успех лечения во многом зависит от своевременности выявления новообразования. Мутационный канцерогенез. Предположим, что мутагенный фактор вызвал нарушение в гене-репрессоре I и активный репрессор I не может быть синтезирован. В этом случае растормаживается ген инициативы клеточного деления и начинается репликация ДНК. Образовавшиеся в результате деления клетки не располагают геном-репрессором I, вследствие чего клетки продолжают репликацию ДНК, и при делении образуется семейство клеток, способных к беспредельному неконтролируемому делению. Очевидно, это и есть опухолевые клетки. К беспредельному клеточному делению могут привести также мутации и других генов данной регуляторной системы, например, мутация гена, кодирующего инициатор клеточного деления, в результате которой он становится недоступным тормозящему влиянию гена-репрессора I. Таким образом, механизм канцерогенеза данного пути развития заключается в мутации и потере генов, кодирующих репрессоры деления клеток. Эпигеномный канцерогенез предполагает приобретение нормальной клеткой опухолевых свойств путем воздействия на геном клетки факторов, которые не принадлежат к геному данной клетки и не вызывают мутацию, но создают устойчивое нарушение нормальной регуляции генома, приводящее к беспредельному росту. Передающееся из поколения в поколение эпигеномное влияние может сформироваться, например, под действием вируса, инфицирующего исходную клетку и попадающего в каждую новообразовавшуюся клетку в митозе. Механизм канцерогенеза, развивающегося по этому пути, состоит в инги-бировании генов, кодирующих репрессоры деления клеток. Мутационный и эпигеномный механизмы канцерогенеза не исключают друг друга, а могут быть сопряжены. Между началом действия трансформирующегося агента и появлением клинически выраженной опухоли имеется латентный период, который у человека может длиться годами. В механизмах развития промоции важная роль отводится нарушениям взаимодействия онкогенов и антионкогенов, увеличению синтеза онкобелков, ограничению синтеза белков-супрессоров, пролиферации, в частности, р53, индукторов апоптоза, ДНК-репарирующих ферментов. ОПУХОЛЕВАЯ ПРОГРЕССИЯ- генетически закреплённое, наследуемое опухолевой клеткой и необратимое изменение одного или нескольких её свойств. Изменения в геноме, приводящие к трансформации нормальной клетки в опухолевую - лишь первый этап на пути дальнейшей модификации генома. В генетической программе клетки, ставшей опухолевой, постоянно происходят изменения, в основе которых лежат мутации. • Фенотипически это проявляется изменением биохимических, морфологических, электрофизиологических и функциональных признаков опухоли. • Изменения различных свойств опухолевых клеток происходят независимо друг от друга, поскольку мутации каждого отдельного гена автономны.
• Сроки изменений свойств разных опухолевых клеток сильно варьируют. В связи с этим признаки их появляются и изменяются без какой-либо закономерной хронологии. • При опухолевой прогрессии формируются клоны клеток с самой различной комбинацией признаков (феномен клональной селекции бластомы). В связи с этим разные субклоны клеток одного новообразования могут весьма существенно отличаться друг от друга. • Модификации в геноме опухолевой клетки наследуются, т.е. передаются дочерним клеткам. Указанные выше отклонения генотипа и фенотипа клеток больше характерны для бластом. Они были описаны американским патологом Л. Фулдсом (1969 г.) и названы им феноменом опухолевой прогрессии. 23. Взаимодействие опухоли и организма. Механизмы метастазирования. Патогенез раковой кахексии. Механизмы противоопухолевой защиты: антиканцерогенные, антимутационные, антицеллюлярные. Взаимодействие опухоли и организма состоит из влияния опухоли на организм и защиты организма от опухоли. Действие опухоли на организм хозяина может быть локальным и общим. ● Локальное воздействие включает нарушения метаболизма, сдавление прилежащих сохранных тканей, их разрушение растущей опухолью, прорастание стенок сосудов, что может приводить к местному венозному застою. Некроз и изъязвление опухоли могут вызвать кровотечение, присоединение вторичных инфекций. ● Общее воздействие опухоли на организм может приводить к развитию различных видов анемии, раковой интоксикации, раковой кахексии и паранеопластических синдромов. Механизм образования метастазов сложен и до конца не изучен. В его основе лежит как активация в опухолевой клетке способности к миграции, так и перестройка сосудов, питающих опухоль. В норме миграция присуща стволовым клеткам и лейкоцитам крови. Опухолевая клетка вследствие нарушения дифференцировки (анаплазия) по свойствам приближается к стволовой. Миграцию стимулируют особые белки — факторы роста. Данные факторы выделяются спонтанно либо под действием гипоксии как самими опухолевыми клетками, так и клетками стромы (фибробластами). Более того, онкобелки (продукты онкогенов) часто сами являются компонентами внутриклеточного пути передачи сигнала, исходящего от фактора роста. В таком случае активация миграции клеток извне не нужна. Особенность опухолевых капилляров — отсутствие базальной мембраны и перицитов. В отдельных капиллярах нет даже эндотелия и стенку сосуда образуют опухолевые клетки. Не существует также зависимости метастазирования от размеров опухоли: некоторые опухоли, первичный узел которых бывает еле виден невооружённым глазом, дают обширные метастазы по всему организму. В то же время ряд опухолей, обладающих местнодеструирующим ростом (например, базалиома), метастазов не дают. Различают следующие механизмы противоопухолевой защиты: 1. Антиканцерогенные: • препятствие проникновению канцерогенов в организм, клетку, ядро; • препятствие действию канцерогенов на геном клетки. 2. Антимутационные: • подавление экспрессии онкогена; • обнаружение и устранение онкогена. 3. Антицеллюлярные: • обнаружение и устранение опухолевой клетки; • обнаружение и торможение роста опухолевой клетки.
Гипокси́я (др.-греч. ὑπό — под, внизу + греч. οξογόνο — кислород; кислородное голодание) — пониженное содержаниекислорода в организме или отдельных органах и тканях. Гипоксия возникает при недостатке кислорода во вдыхаемом воздухе и в крови (гипоксемия), при нарушении биохимических процессов тканевого дыхания. Вследствие гипоксии в жизненно важных органах развиваются необратимые изменения. Наиболее чувствительными к кислородной недостаточности являются центральная нервная система, мышца сердца, ткани почек, печени Механизмы доставки: Наполнение легких кислородом Переход кислорода из легких в кровь. Транспорт кислорода с кровью Переход кислорода из крови в клетки через мембрану Доставка в клетке кислорода к митохондриям и его использование.
Классификация По этиологии[
По распространенности процесса
По скорости развития[
В общем случае гипоксию можно определить как несоответствие энергопродукции энергетическим потребностям клетки. Основное звено патогенеза — нарушение окислительного фосфорилирования в митохондриях, имеющее 2 последствия:
|
