Программа блока гетерофункциональные углеводороды
 Скачать 6.9 Mb. Скачать 6.9 Mb.
|
Стереохимия. Для углеводов свойственна оптическая изомерия. 1. Открытые формы моносахаридов. В молекулах моносахаридов имеются асимметрические атомы углерода (хиральные центры), что служит причиной существования большого числа стереоизомеров, соответствующих одной и той же структурной формуле.
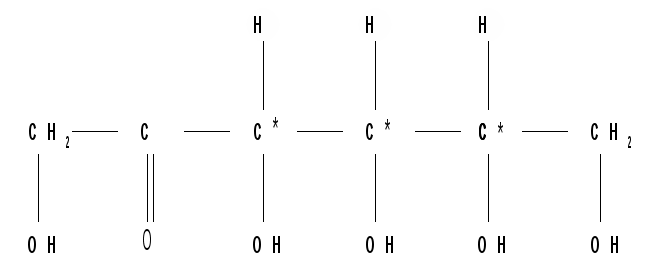
Проекционные формулы Фишера, D- и L – ряды. Для изображения стереоизомеров удобно пользоваться проекционными формулами Э. Фишера. Для получения проекционной формулы углеродную цепь моносахарида располагают по вертикали с оксогруппой в верхней части цепи, а сама цепь должна иметь форму полукольца, обращенного выпуклостью к наблюдателю. Все асимметрические углеродные атомы находятся в заслоненной конформации, и группы Н и ОН направлены к наблюдателю (рис.2). 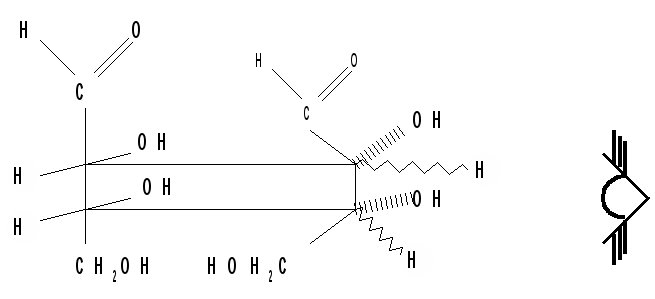 Рисунок 2 – Получение проекционной формулы тетрозы ( эритрозы ). Так как энантиомеры – это пространственные изомеры, являющиеся зеркальным отражением друг друга, то каждой паре энантиомеров дано одно название и указывается их противоположная конфигурация (D и L). Например, для глюкозы: 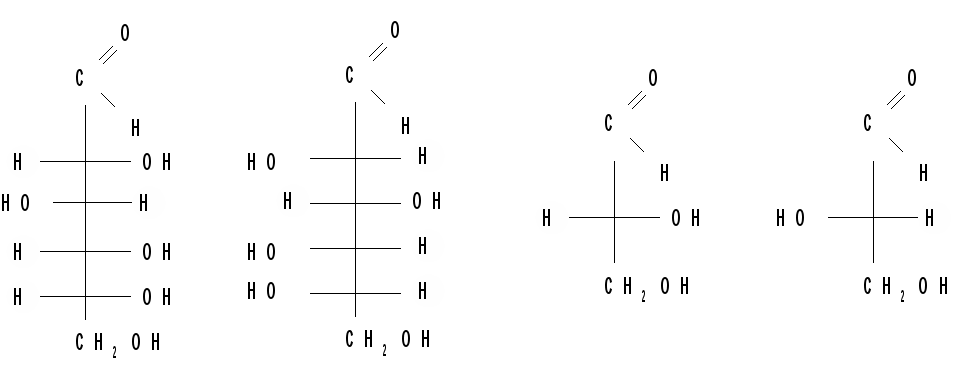
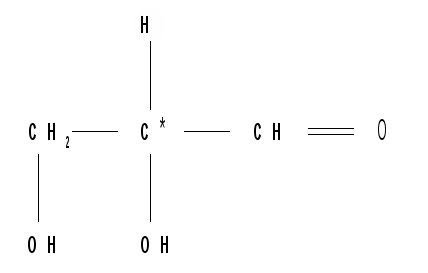
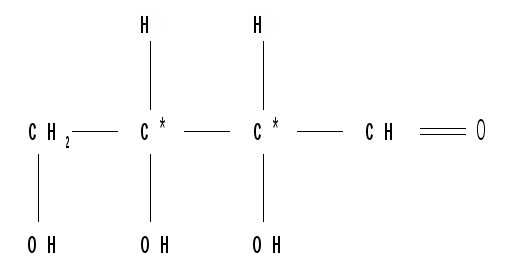
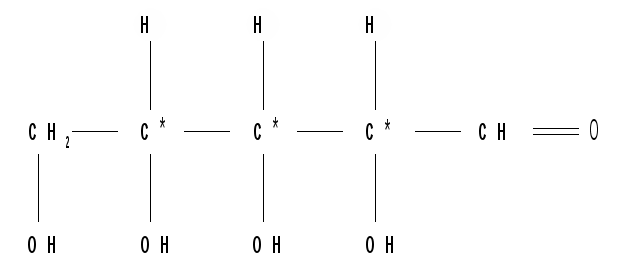
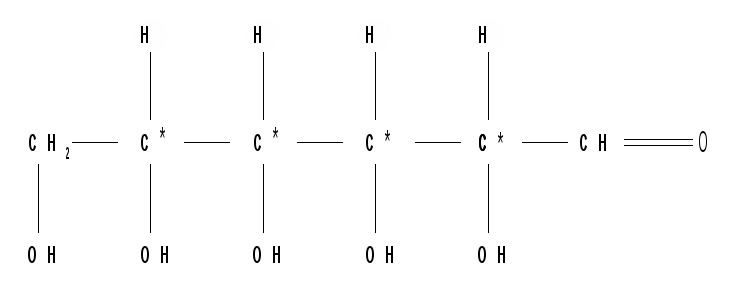
Относительная конфигурация моносахаридов (отношение к D- или L- ряду) определяется по конфигурационному стандарту – глицериновому альдегиду. С конфигурацией его хирального центра сравнивается конфигурация наиболее удаленного от карбонильной группы («концевого») асимметрического атома углерода, имеющего наибольший номер. В альдопентозах таким атомом будет С4, а в альдогексозах – С5, в кетогексозах – С5 и т. д. Если у моносахарида эта ОН-группа находится справа, как у D- глицеринового альдегида, то моносахарид относится к D- ряду. Знак вращения плоскости поляризации поляризованного света моносахаридами непосредственно нельзя связать с их принадлежностью к D- и L- ряду, он определяется экспериментально. Так, среди альдопентоз и альдогексоз D-стереохимического ряда имеются как лево-, так и правовращающие соединения. Например, природные фруктоза и глюкоза обозначается: D(–) фруктоза (или раньше D, l фруктоза), т. е. фруктоза обладает левым вращением; D(+) глюкоза (или раньше D,d глюкоза), т. е. глюкоза обладает правым вращением. D(+) и L(–) глицериновые альдегиды являются родоначальниками генетических рядов сахаров (альдоз). Каждый моносахарид в этом ряду, начиная с глицеринового альдегида, при введении еще одного атома углерода дает два стереоизомера (диастереомера) – (рис. 3). Семейство кетоз (рис. 4) формально можно произвести от дигидроксиацетона путем последовательного наращивания цепи на один атом углерода. 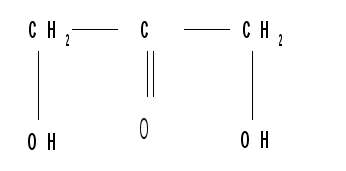 кетотриоза 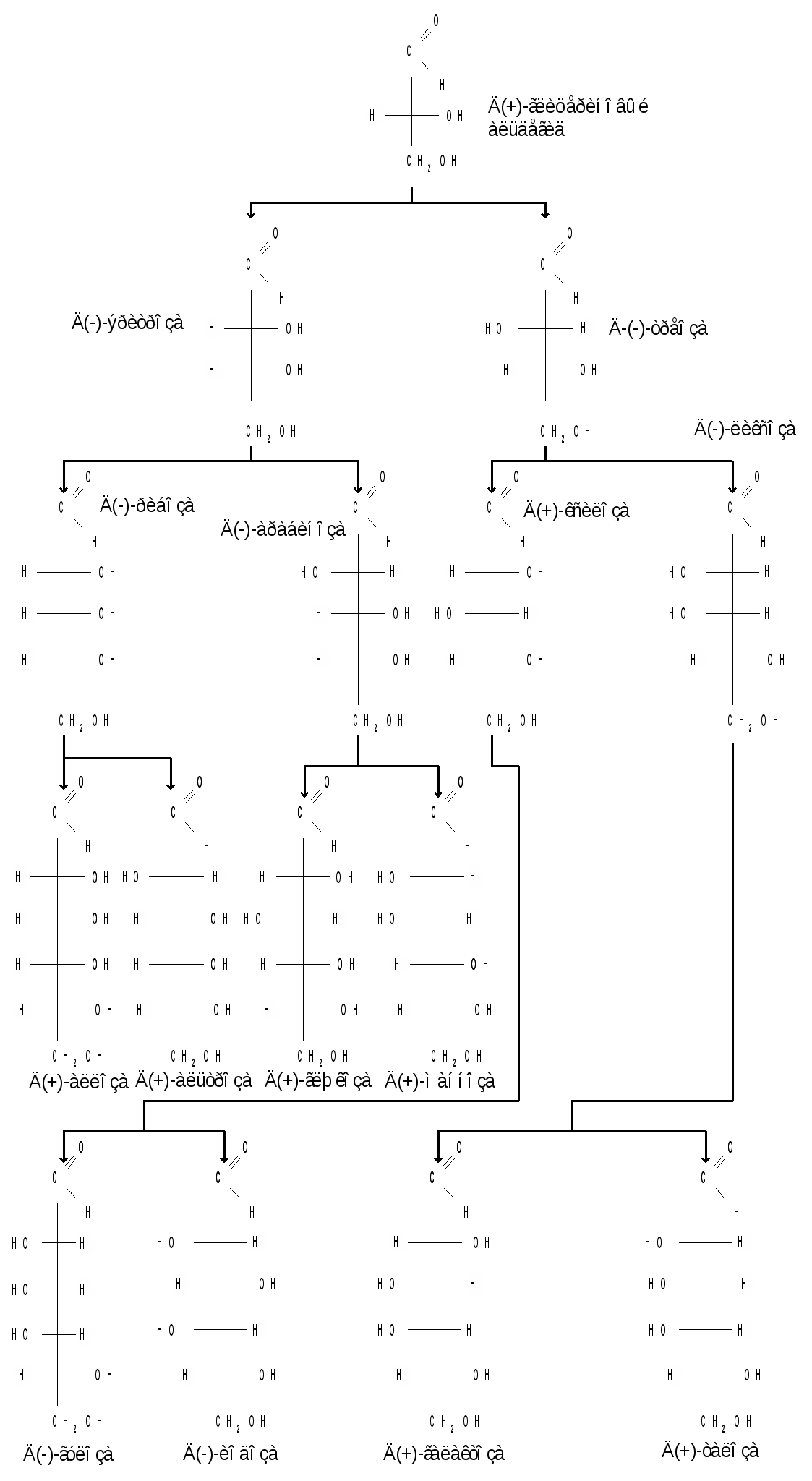 Рисунок 3 – Генетический D-ряд альдоз Рисунок 4 – Генетический D-ряд кетоз Подавляющее большинство природных моносахаридов принадлежит к D-ряду. Каждой альдозе D-ряда соответствует энантиомер L-ряда с противоположной конфигурацией всех (!) центров хиральности. Как следует из схемы, восемь стереоизомеров Д-альдогексоз имеют одинаковое химическое строение, но отличаются конфигурацией одного или нескольких асимметрических атомов углерода, т. е. являются диастереоизомерами и поэтому каждый из них имеет свое название (глюкоза, манноза, галактоза и т. д.). Альдозы, отличающиеся одна от другой конфигурацией только одного соседнего с карбонильной группой асимметрического атома углерода, называются эпимерами. Так, глюкоза и манноза, рибоза и арабиноза являются эпимерами. Эпимеры – частный случай диастереоизомеров. Понятие о конформационной изомерии. Для сахаров в циклической форме возможен еще один вид пространственной изомерии – конформационная изомерия, связанная с расположением в пространстве углеродных атомов шестичленного цикла. Однако, если для циклогексана известно всего две конформации – «кресло» и «ванна», то для моносахаридов в пиранозной форме известно 8 конформаций – две креслообразных и шесть типа ванны ввиду присутствия в шестичленном цикле гетероатома – кислорода. Шесть ваннообразных конформаций энергитически менее выгодны и их существование можно не учитывать. Из двух креслообразных конформаций 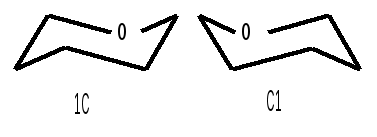 С1 – изомер более предпочтителен, так как подавляющее число заместителей в нем ориентировано в экваториальном, совпадающем с плоскостью цикла, направлении. Именно в виде С1 – конформации существует большинство моносахаридов, например, для D-глюкопиранозы в этой конформации первичноспиртовая СН2ОН-группа и гидроксильные группы занимают экваториальные положения. При этом полуацетальный гидроксил у -аномера находится в экваториальном, а у -аномера – в оксиальном положениях. Поэтому -аномер D-глюкозы преобладает в равновесной смеси над -аномером: 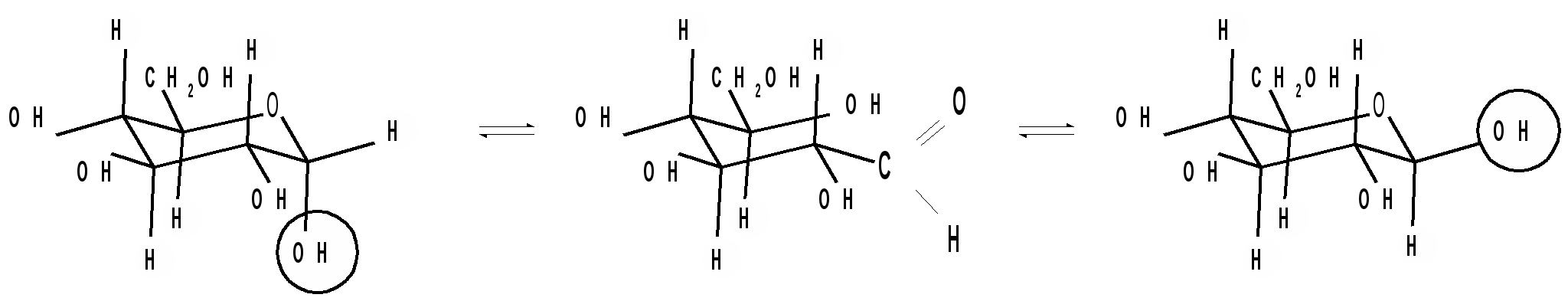
Аномеры образуются не в равных количествах, а с преобладанием термодинамически более устойчивого диастереоизомера. Конформационное строение D-глюкопиранозы обьясняет уникальность этого моносахарида. -D-глюкопираноза – моносахарид с полным экваториальным расположением объемных заместителей. Обусловленная этим высокая термодинамическая устойчивость – основная причина широкой распространенности ее в природе. Конформационное строение моносахаридов обуславливает формирование пространственного строения длинных полисахаридных цепей, т. е. вторичную структуру. Наличие в пиранозном цикле атома кислорода определяет ряд дополнительных факторов, влияющих на устойчивость аномеров. Например, при замещении в молекуле D-глюкопиранозы полуацетальной гидроксильной группы на алкоксильную (при образовании гликозидов) более выгодной может стать -аномерная форма. Стремление алкоксильной группы занять аксиальное положение связано с так называемым аномерным эффектом, который проявляется как результат отталкивания между сближенными в пространстве электронными парами двух атомов кислорода – циклического и входящего в состав алкосиальной группы. В -аномере такое отталкивание электронных пар отсутствует, т. к. атомы кислорода пространственно удалены. R-, S- номенклатура моносахаридов. D, L- система обозначений для моносахаридов не вполне универсальна, так как основывается на конфигурации одного из многих центров хиральности. Однако она используется в химии углеводов и лишь в редких случаях заменяется R-, S- номенклатурой. Например, D-глюкоза получает название (2R,3S,4R,5R)-2,3,4,5,6-пентагидроксигексаналь: 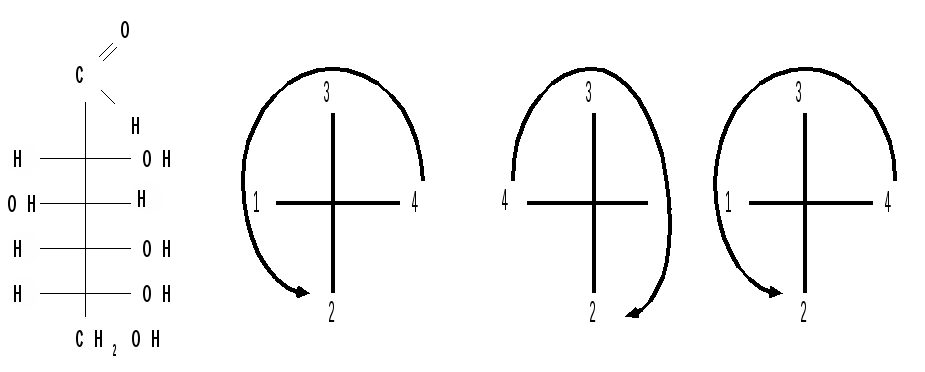
В циклических формах моносахаридов независимо от размера кольца (пиранозное или фуранозное) атом углерода карбонильной группы становится асимметрическим и он также имеет 2 зеркальные конфигурации. Например, для D-глюкозы: 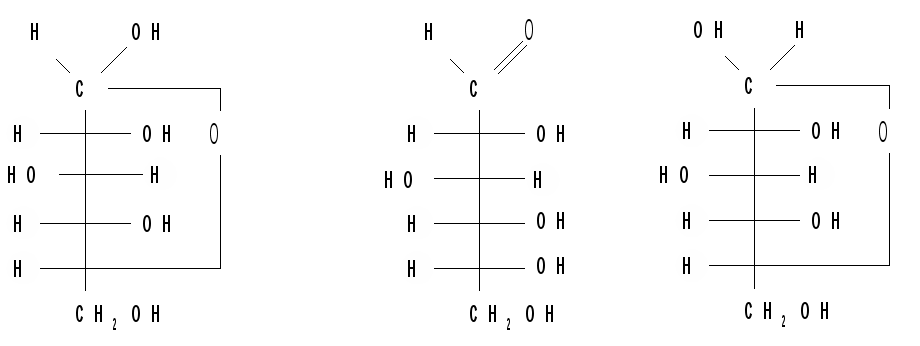
С1 – новый хиральный центр, этот атом называют аномерным. Две стереоизомерные формы глюкозы отличаются конфигурацией одного хирального центра С1 и называются - и -формами, - и -аномерами. У -аномера конфигурация аномерного центра одинакова с конфигурацией «концевого» хирального центра, определяющего принадлежность к D- или L-ряду, а у -аномера – противоположна, т. е. эти ОН-группы находятся на противоположных сторонах. Аномерные префиксы - и - используют только в сочетании с конфигурационными префиксами (D- и L-). Но в целом - и -аномеры из-за наличия еще нескольких центров хиральности являются не энантиомерами (зеркальными изомерами), а диастерео-изомерами. Циклические формы моносахаридов, следовательно, содержат на один асимметрический атом углерода больше, чем открытые, поэтому у них в два раза больше оптически активных изомеров, т. е. N = 25 = 32. Перспективные формулы Хеуорса. Для изображения циклических форм моносахаридов можно пользоваться более наглядными перспективными формулами Хеуорса. Формулы Хеуорса представляют собой шестиугольники и пятиугольники, изображенные в перспективе – цикл лежит в горизонтальной плоскости, связи, расположенные ближе к наблюдателю, изображаются более жирными линиями. Атом кислорода располагается в пиранозном цикле в правом верхнем углу, в фуранозном - за плоскостью цикла, углеродные атомы, входящие в цикл, не пишутся, а только нумеруются от кислорода по часовой стрелке. Все группы (Н и ОН), расположенные справа в формуле Фишера, пишут под плоскостью цикла, а расположенные слева – над плоскостью цикла, концевая СН2ОН группа располагается сверху от плоскости молекулы, если моносахарид относится к D-ряду, и снизу от плоскости, если он относится к L-ряду. Таким образом, в формулах Хеуорса полуацетальный гидроксил и концевая СН2ОН группа располагаются у -аномеров по разные стороны кольца, а у -аномеров – по одну сторону (кружком обведены полуацетальные гидроксилы): 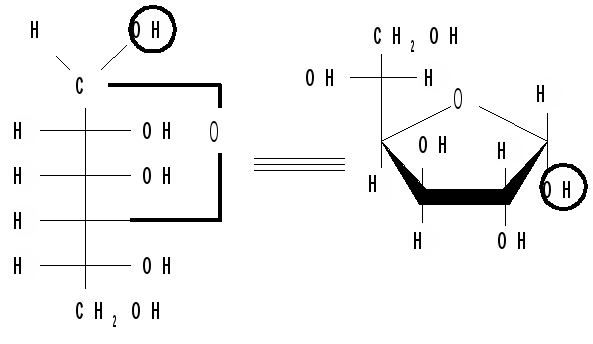
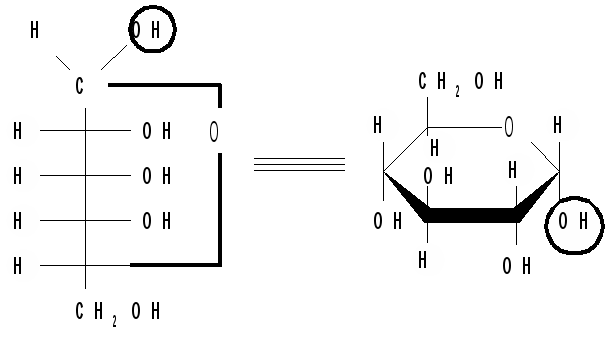
Аналогично можно осуществить переход от формул Фишера к формулам Хеуорса на примере одного из аномеров фуранозной формы D-фруктозы: 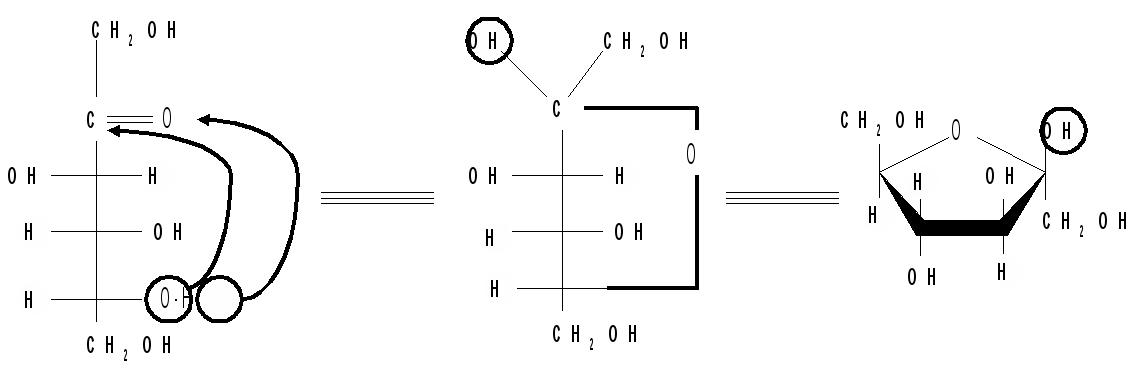
Таутомерия моносахаридов в растворах. Характерной особенностью моносахаридов является их ярко выраженная способность к таутомерным превращениям. Углеводы были исторически одними из первых веществ, для которых наблюдалось явление таутомерии. Различают два вида изомерии моносахаридов в растворах:
Кето-енольная таутомерия моносахаридов происходит при действии щелочей и состоит в переходе карбонильной формы (альдегидной или кетонной) в ендиольную с двумя ОН-группами при атомах углерода, связанных двойной связью, т. е. в образовании ендиола общего для эпимерных моносахаридов. Благодаря кето-енольной таутомерии, эпимерные моносахариды могут превращаться друг в друга. Например, в щелочной среде фруктоза претерпевает таутомерное превращение в глюкозу, которая и реагирует с фелинговой жидкостью: 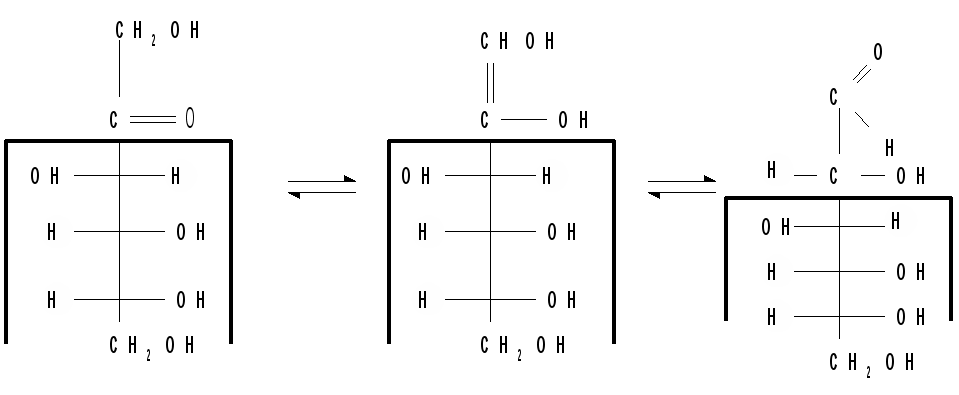
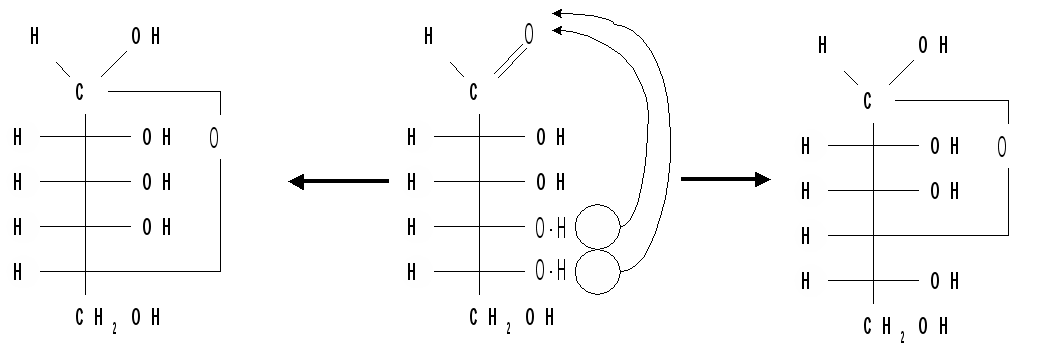
Кольчато-цепная таутомерия моносахаридов заключается в существовании кольчатых (циклических) форм и цепной (т. е. с открытой углеродной цепью) формы моносахарида, находящихся в растворе в динамическом равновесии. Обычно циклические формы моносахаридов преобладают над открытой цепной формой. Например, известно, что в водных растворах глюкоза находится, главным образом, в виде - и - глюкопираноз, в меньшей степени – в виде - и -глюкофураноз и совсем небольшое количество глюкозы – в виде открытой, альдегидной формы (0,024 %). В целом пиранозные формы резко преобладают над фуранозными формами. В растворах установление равновесия между четырьмя циклическими таутомерами моносахаридов протекает через открытую форму - оксо-форму: 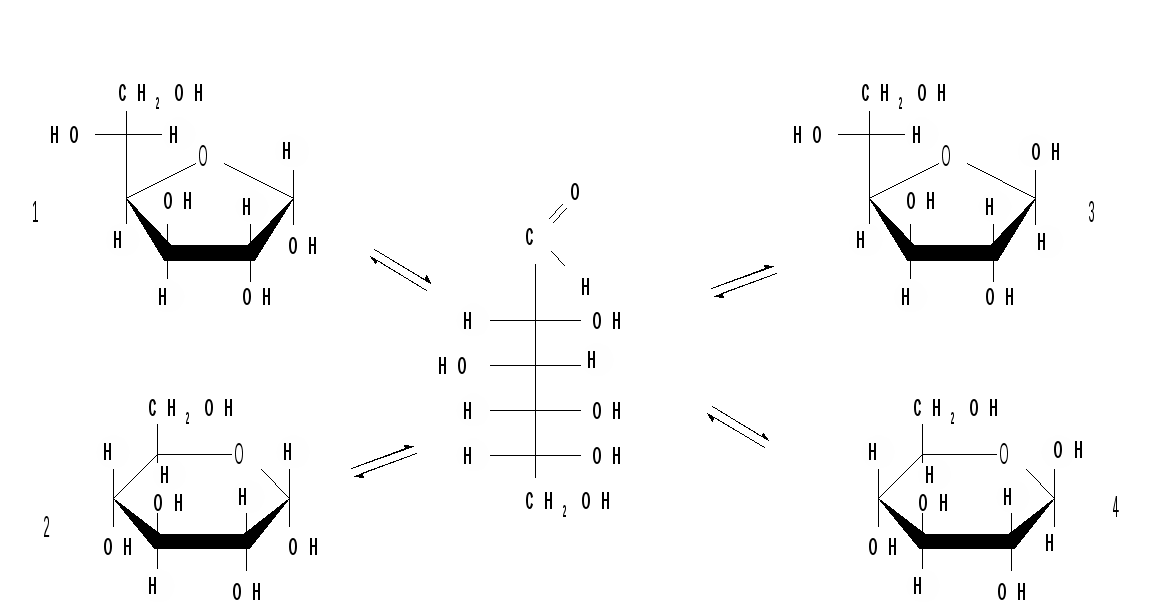
В зависимости от условий реакции и примененных реагентов моносахариды реагируют в одной из таутомерных форм: пиранозной, фуранозной или ациклической, оксо-форме, так как расходование одной из них в ходе реакции сдвигает таутомерное равновесии в сторону реагирующей формы. Например, несмотря на незначительное содержание оксо-формы, глюкоза вступает в реакции, характерные для альдегидной группы. Таутомерия лежит в основе множественности химических свойств моносахаридов. Аналогичные таутомерные превращения происходят в растворах со всеми моносахаридами и большинством известных дисахаридов. Так, для важнейшего представителя кетогексоз D-фруктозы схема таутомерных превращений имеет следующий вид: 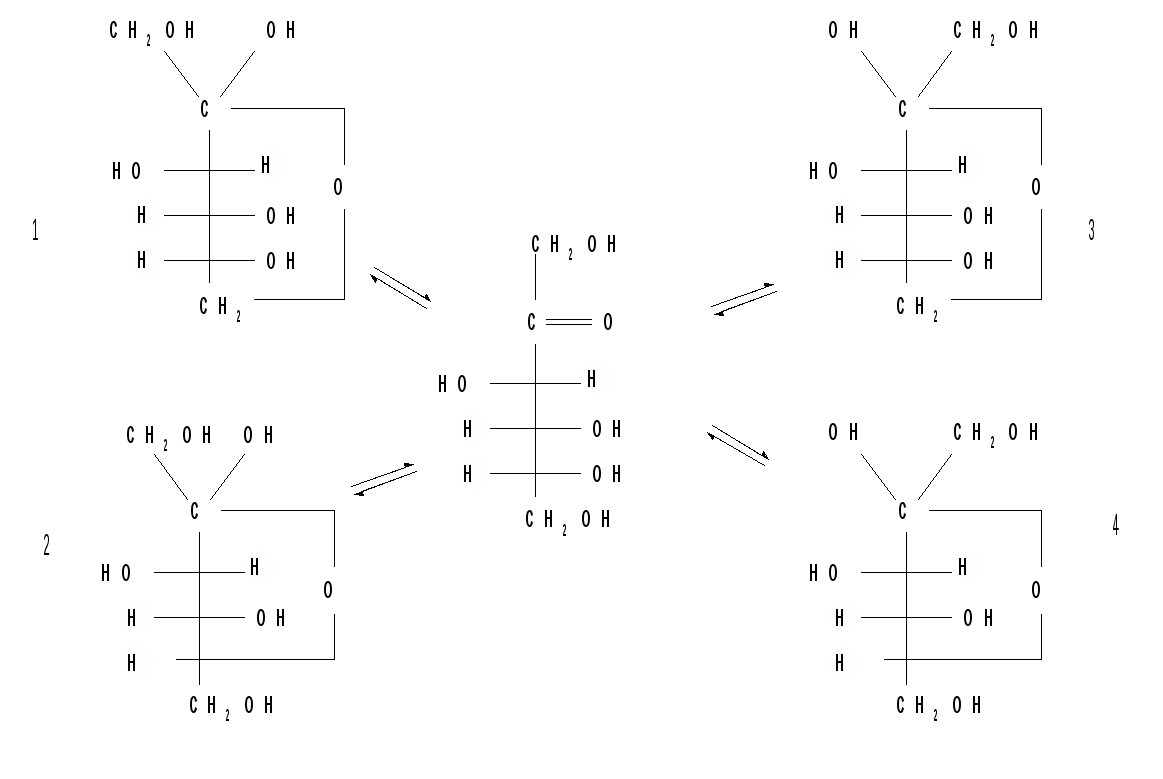
|