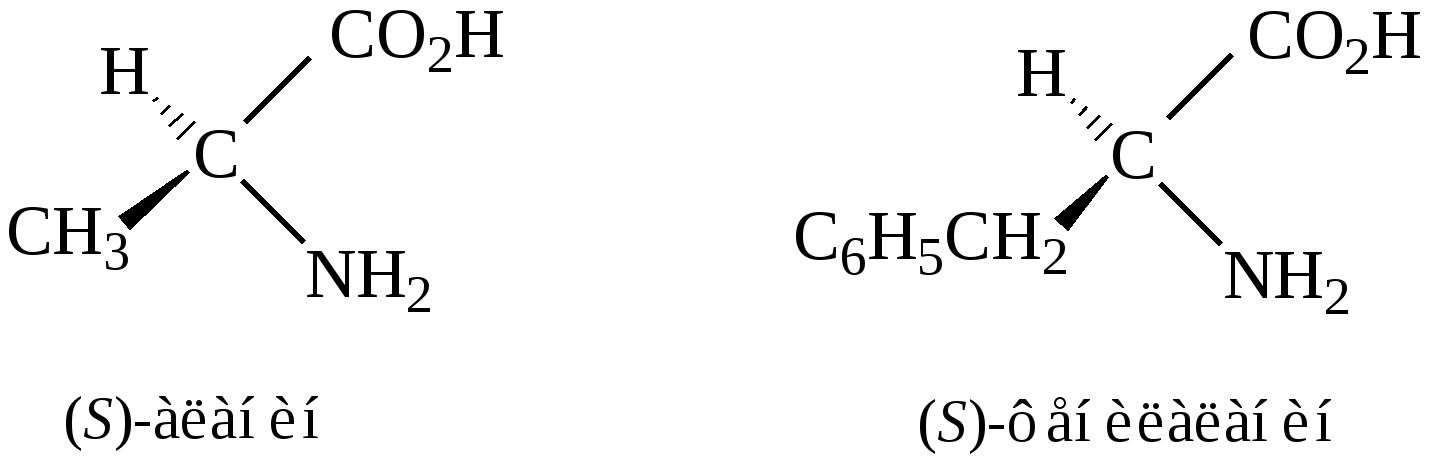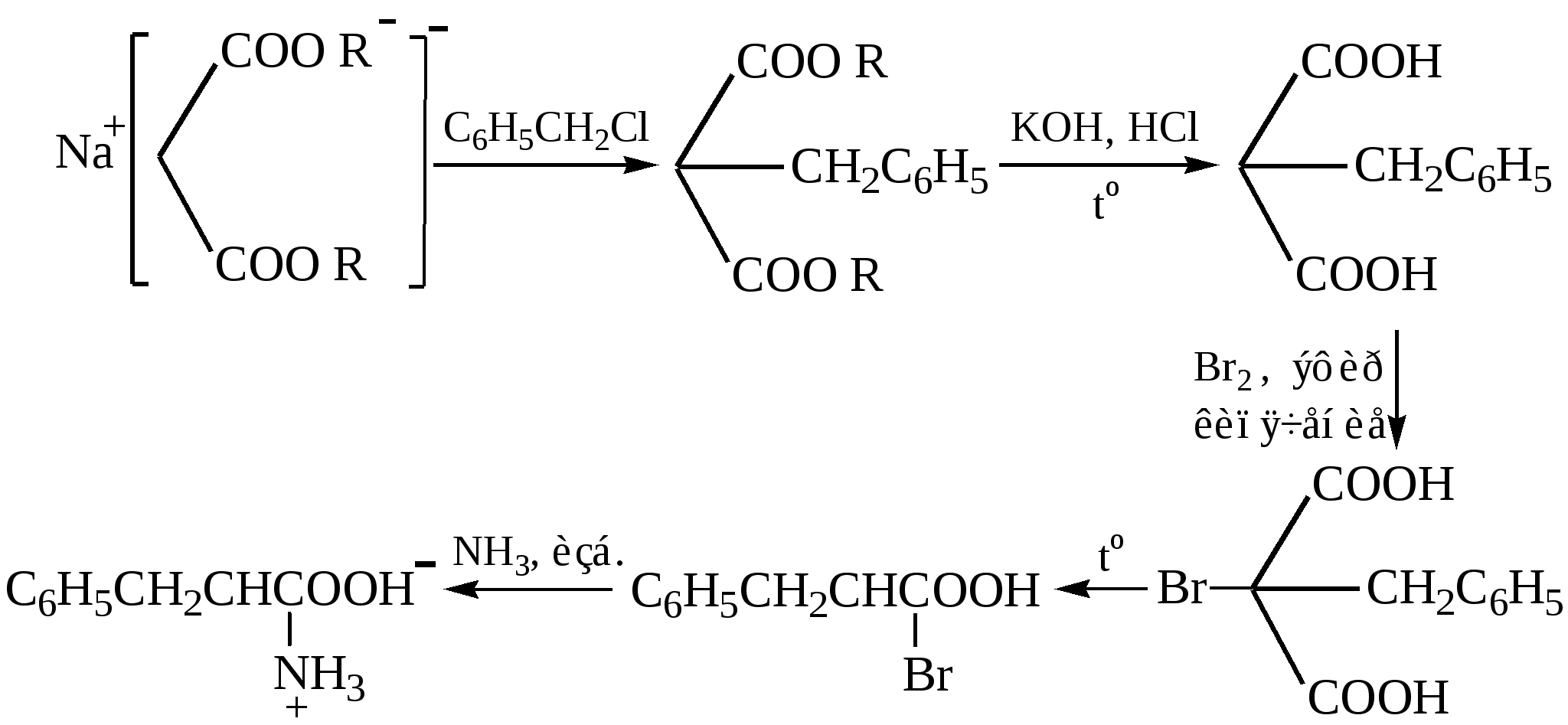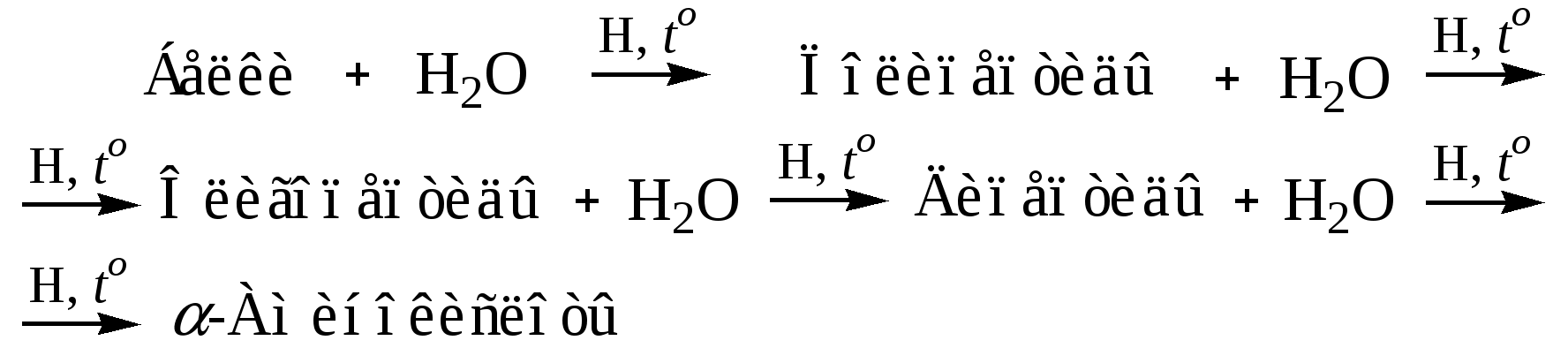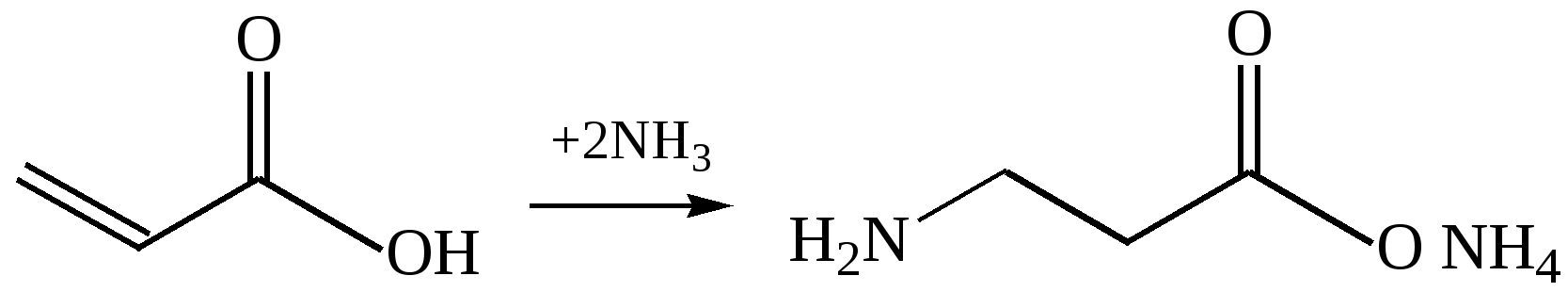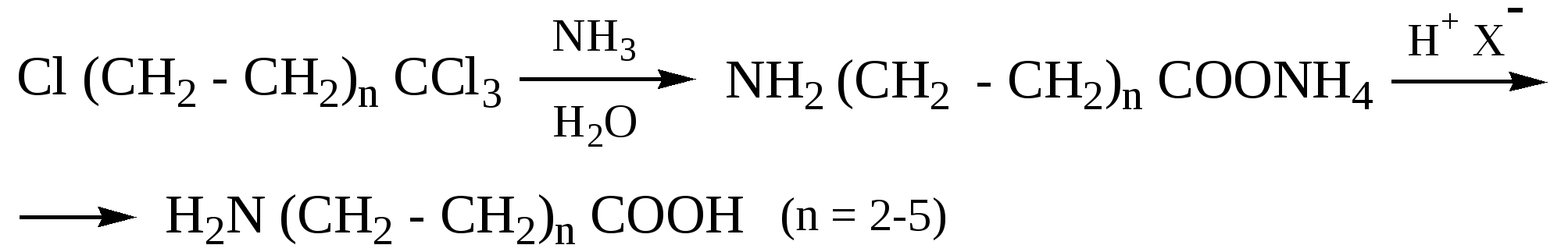1 Содержит остаток молочной кислоты.
2 Содержит сульфатные группы.
2. АМИНОКИСЛОТЫ
Аминокислоты– органические гетерофункциональные соединения, молекулы которых содержат одновременно амино- (–NH2) и карбоксильную (–COOH) группы. Общая формула:
(NH2)m R(COOH)n,
где m – число аминогрупп, а n – число карбоксильных групп. В более широком смысле к аминокислотам могут быть отнесены и соединения с иной кислотной функцией, например, аминосульфоновые кислоты.
Классификация аминокислот
По числу функциональных (амино и карбоксильных) групп:
моноаминомонокарбоновые;
диаминомонокарбоновые;
аминодикарбоновые и т. д.
От природы углеводородного радикала аминокислоты:
ароматические
гетероциклические
От взаимного расположения амино- и карбоксильной групп:
α-аминокислоты;
β-аминокислоты;
γ-аминокислоты и т. д.
По отношению к биологическим организмам:
Заменимые. Синтезируются в организме человека. К ним относятся глицин, аланин, глутаминовая кислота, серин, аспарагиновая кислота, тирозин, цистеин.
Незаменимые. Не синтезируются в организме человека в количествах, достаточных для того, чтобы удовлетворить физиологические потребности организма, поступают с пищей.
Номенклатура аминокислот. Простейшим соединением ряда аминокислот является глицинNH2–CH2–COOH.
Для названия аминокислот используют следующие номенклатуры:
тривиальная;
рациональная;
систематическая.
Тривиальная. Родоначальники гомологических рядов алифатических и ароматических аминокислот – глицин и аминобензойная кислота соответственно. Происхождение этих исторических названий связано со свойствами и названиями продуктов, из которых они впервые были выделены. Глицин имеет сладкий вкус, впервые был выделен из «животного клея» (от греч. glycos – сладкий и kolla – клей и произошло название гликокол). Цистин выделен из камней желчного пузыря (от греч. «цистис» – пузырь). Лейцин получен из молочного белка – казеина (от греч. «леукос» – белый). Аспарагиновая кислота изолирована от ростков спаржи (от греч. «аспарагус» – спаржа). Орнитин выделен из помёта птиц (от греч. «орнитус» – птица).
Рациональная.Производится путём прибавления к названию соответствующей карбоновой кислоты (название кислоты используется тривиальное), приставки амино-. Буквой греческого алфавита указывается положение аминогруппы по отношению к карбоксильной группе.
Систематическая номенклатура. Название производится от названия соответствующей карбоновой кислоты с указанием местоположения аминогруппы и заместителей при помощи локантов. В названиях алифатических аминокислот по заместительной номенклатуре аминогруппа обозначается префиксом амино-, а карбоксильная группа как старшая – суффиксом -овая кислота. В названиях ароматических аминокислот в качестве родоначальной структуры используется бензойная кислота. Для аминокислот, участвующих в построении белков, применяются в основном тривиальные названия. В природе встречается свыше 70 аминокислот, но только 20 из них играют важную роль в живых системах (таблица 1).
Все аминокислоты, за исключением пролина и оксипролина, имеют структуру R–CH(NΗ2)CO2H; различия между аминокислотами определяются природой радикала.
Таблица 1 – Названия аминокислот по различным номенклатурам
№
|
Формула
|
Название соединения
|
Тривиальное
|
Рациональное
|
Систематическое
|
1
|
NH2–CH2–COOH
|
Глицин (гликокол) (Gly)
|
аминоуксусная
|
аминоэтановая
|
2
|
CH3––CHNH2–COOH
|
Аланин (Ala)
|
α-амино-ропионовая
|
2-аминопропановая кислота
|
3
|
NH2–(CH2)2–COOH
|
β-Аланин (Ala)
|
β-амино-
пропионовая
|
3-аминопропановая кислота
|
4
|
(CH3)2–(CH)2NH2–COOH
|
Валин (Val)
|
α-амино-
изовалериановая
|
2-амино-3-метил-бутановая
|
5
|
CH3–CH2–CHNH2–COOH
|
–
|
α-амино-
масляная
|
2-аминобутановая
|
6
|
CH3–CHNH2–CH2–COOH
|
–
|
β-амино-
масляная
|
3-аминобутановая
|
7
|
NH2–(CH2)3–COOH
|
–
|
y-амино-
масляная
|
4-аминобутановая
|
8
|
NH2C–(CH3)2–COOH
|
–
|
α-амино-
изомасляная
|
2-амино-2-метил-пропановая
|
9
|
(CH3)2–CH–CH2–CH(NH2)–COOH
|
Лейцин (Leu)
|
α-амино-
изокапроновая
|
2-амино-4-метилпентановая
|
10
|
CH3–CH2–CH(CH3)–CH(NH2)–COOH
|
Изолейцин
(Ile, ileu)
|
α-амино-
β-метил-β-этил-
пропионовая
|
2-амино-3-метилгексановая
|
11
|
C6H5–CH2–CH(NH2)–COOH
|
Фенилаланин (Phe)
|
α-амино-β-фенил-
пропионовая
|
2-амино-3-фенилпропановая
|
12
|
HO–CH2–CH(NH2)–COOH
|
Серин (Ser)
|
α-амино-β-окси-пропионовая
|
2-амино-3-оксипропановая
|
13
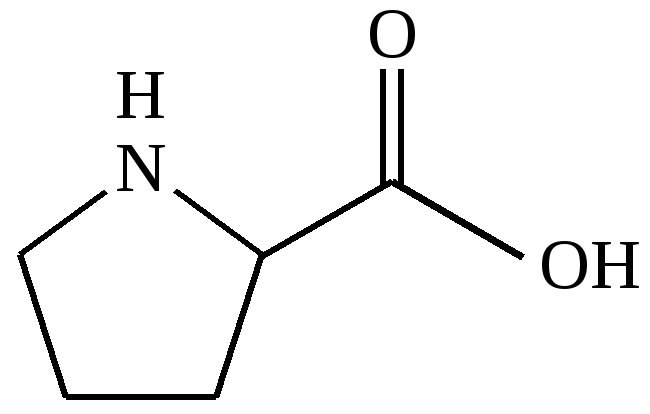
|
|
Пролин (Pro)
|
пирролидин-α-карбоновая
|
пирролидин-2-карбоновая
|
14
|
NH–OH–(CH2)2–(CH)2–COOH
|
Оксипролин (Hydro)
|
y-оксипирролидин-α-карбоновая
|
3-оксипирролидин-2-карбоновая
|
15
|
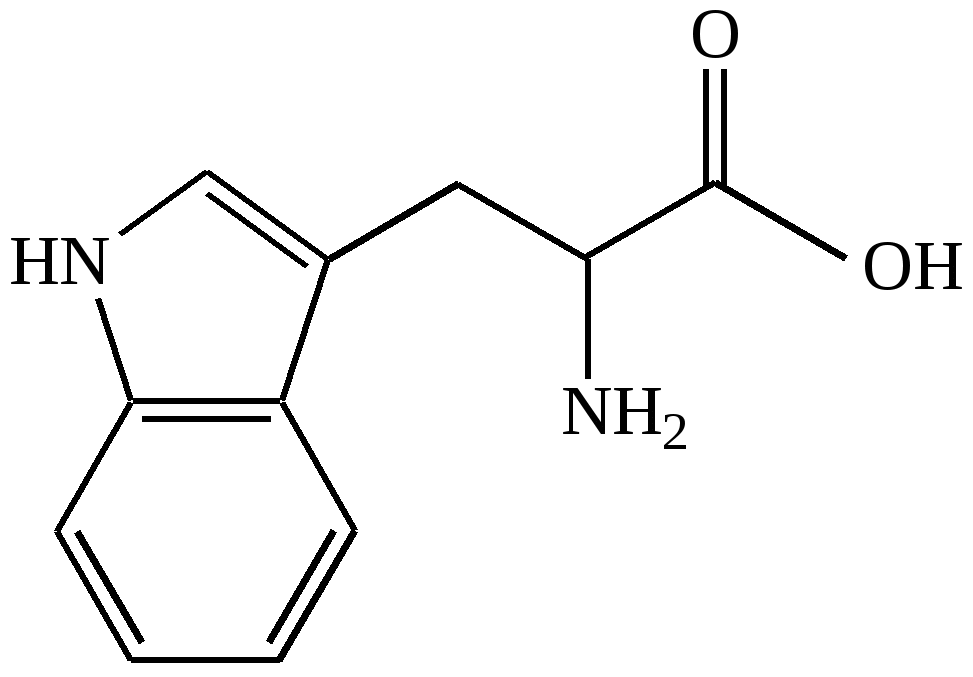
|
Триптофан (Try)
|
α-амино-β-индолил-пропионовая
|
2-амино-3-индолил-пропановая
|
16
|
CH3–S–(CH2)2–CH(NH2)–COOH
|
Метионин (Met)
|
α-амино-y-метил-тиомасляная
|
2-амино-4-метилтио-бутановая
|
17
|
COOH–CH2–CH(NH2)–COOH
|
Аспарагиновая кислота (Asp)
|
аминоянтарная
|
аминобутан-диовая
|
18
|
NH2–CO–CH2–CH(NH2)–COOH
|
Аспарагин [Asp(NH2) или asn]
|
|
|
19
|
COOH–(CH2)2–CH(NH2)–(COOH)2
|
Глутаминовая кислота (Glu)
|
α-аминоглутаровая
|
2-аминопентан-диовая
|
20
|
NH2–CO–(CH2)2–CH(NH2)–COOH
|
Глутамин [Glu(NH2)]
|
|
|
22
|
NH2–(CH2)4–CH(NH2)–COOH
|
Лизин (Lys)
|
α,ε-диамино-капроновая
|
2,6-диамино-гексановая
|
23
|
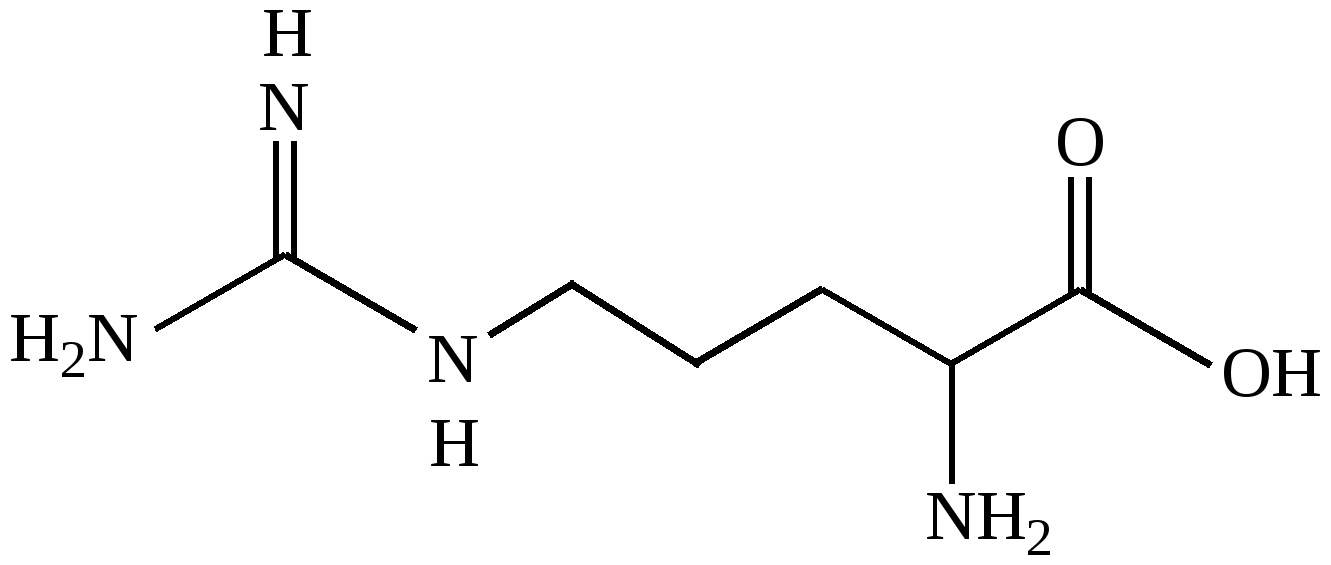
|
Аргинин (Arg)
|
α-амино-
δ-гуанидино-валериановая
|
2-амино-5-гуанидино-пентановая
|
24
|
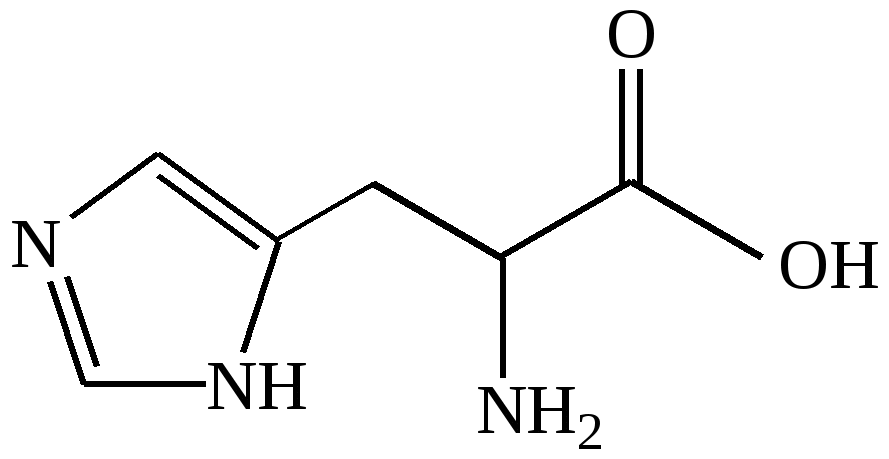
|
Гистидин (His)
|
α-амино-
β-имидазолил-пропионовая
|
2-амино-3-имидазолил-пропановая
|
25
|
CH3–CH(OH)–CH(NH2)–COOH
|
Треонин (Thr)
|
α-амино-β-окси-масляная
|
2-амино-3-оксибутановая
|
26
|
HO–(C6H4)–CH2–CH(NH2)–COOH
|
Тирозин (Tyr)
|
α-амино-β-(n-гидроксифенил)-пропионовая
|
2-амино-3-(n-гидроксифенил)-пропановая
|
27
|
HS–CH2–CH(NH2)–COOH
|
Цистеин (Cys)
|
α-амино-β-тио-пропионовая;
α-амино-
β-меркапто-пропионовая
|
2-амино-
3-меркапто-
пропановая
|
28
|
COOH–CH(NH2)–CH2–S2–CH2–CH(NH2)–COOH
|
Цистин
(Cys-scy)
|
β,β'-дитиоди-
α-амино-
пропионовая
|
3,3'-дитио-
2-амино-пропановая
|
Изомерия.
Структурная:
скелетная;
взаимного положения;
метамерия.
Пространственная:
Все природные аминокислоты (кроме глицина), являются оптически активными веществами в результате кислотного или щелочного гидролиза белков). Большинство из природных α-аминокислот принадлежит к L-стерическому ряду. D-аминокислоты встречаются в составе немногих белков микроорганизмов (например, в белках клеточной стенки бактерий сибирской язвы). С данной особенностью связывают устойчивость этих бактерий к расщепляющему действию ферментов человека и животных.
Согласно номенклатуре (R, S), большинство «природных» или L-амино- кислот имеет S-конфигурацию.
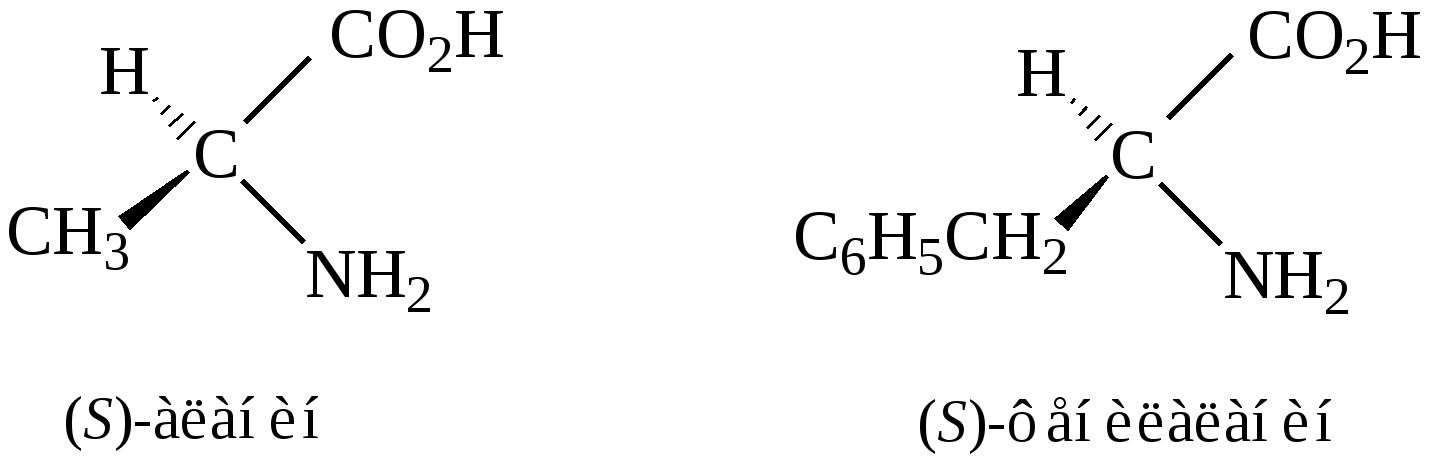
L-Изолейцип и L-треонин, содержащие по два хиральных центра в молекуле, могут быть любыми членами пары диастереомеров в зависимости от конфигурации при β-углеродном атоме.
Получение аминокислот
Получение α-аминокислот
Из природных веществ. Белки при гидролизе в водных растворах в присутствии кислоты дают смесь α-аминокислот, которые можно выделить и разделить. Все они оптически активны.
Получение из α-галогенкарбоновых кислотinvitro (аминирование или аммонолиз, реакция Геля–Фольгарда–Зелинского).Реакция протекает по механизму SN. Из галогенозамещенных кислот наиболее доступны α-галогенозамещенные кислоты, поэтому способ используется в основном для синтеза α-аминокислот.
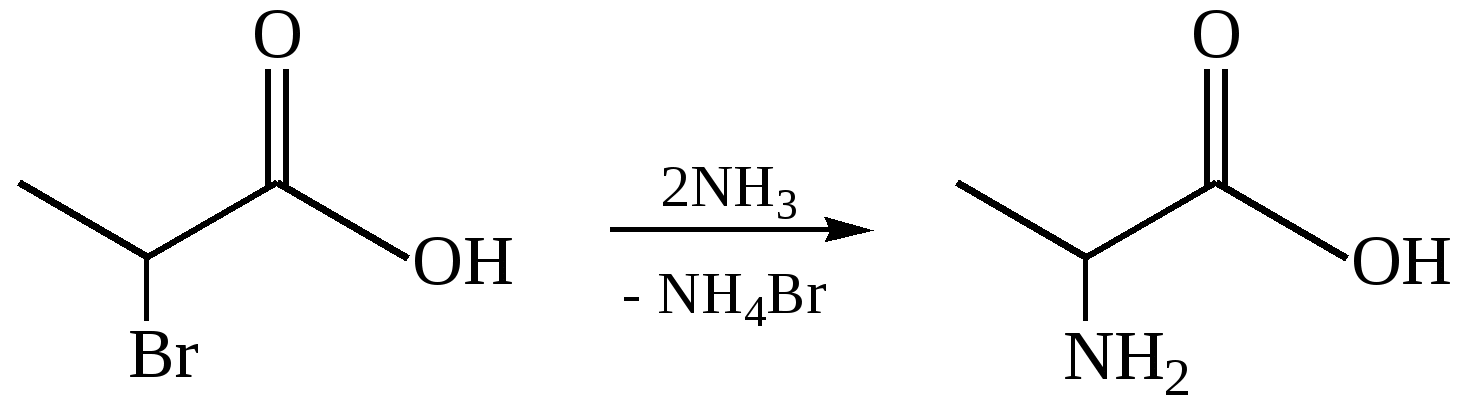
Модифицированный метод синтеза при помощи малонового эфира обычно применяется для синтеза незамещенных кислот:
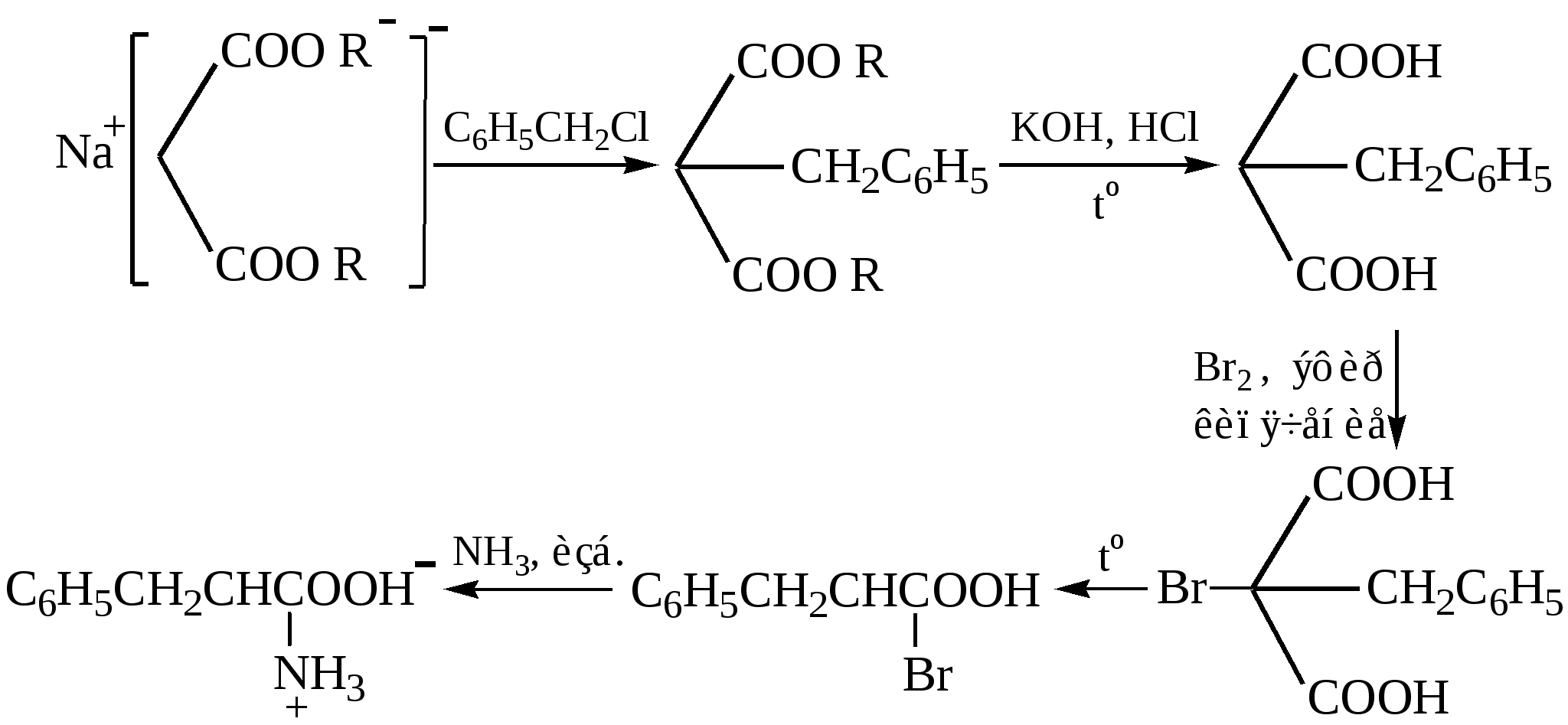
Галогенуглеводороды алкилирует ацетиламинмалоновый эфир:
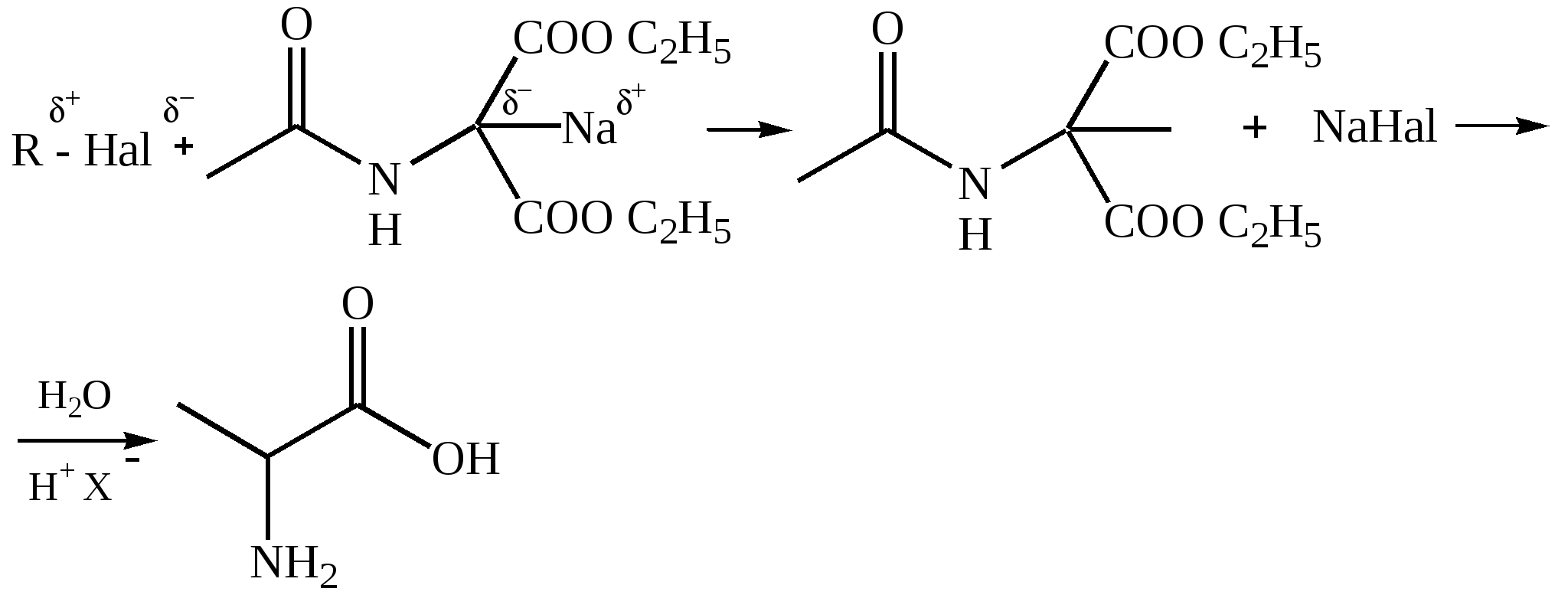
Аминирование эфиров α-галогензамещённых кислот (по Габриэлю)–фталимидный синтез:
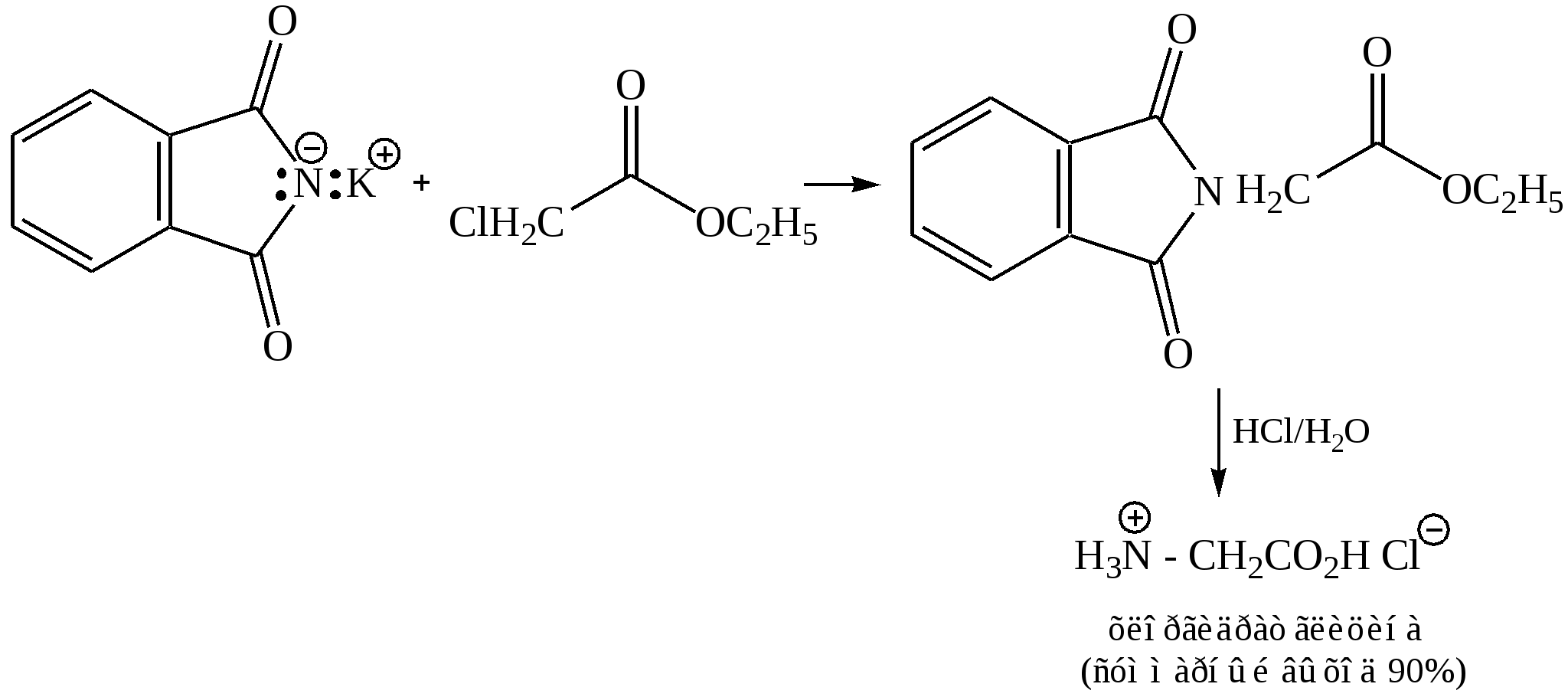
Синтез Штреккера-Зелинского. Получение α-аминокислот из альдегидов (кетонов) путём действия на них синильной кислоты (или её соли) и аммиака (или NH4Cl).Вначале из альдегида, циановодородной кислоты и аммиака образуется α-аминонитрил, который затем гидролизуется в аминокислоту:
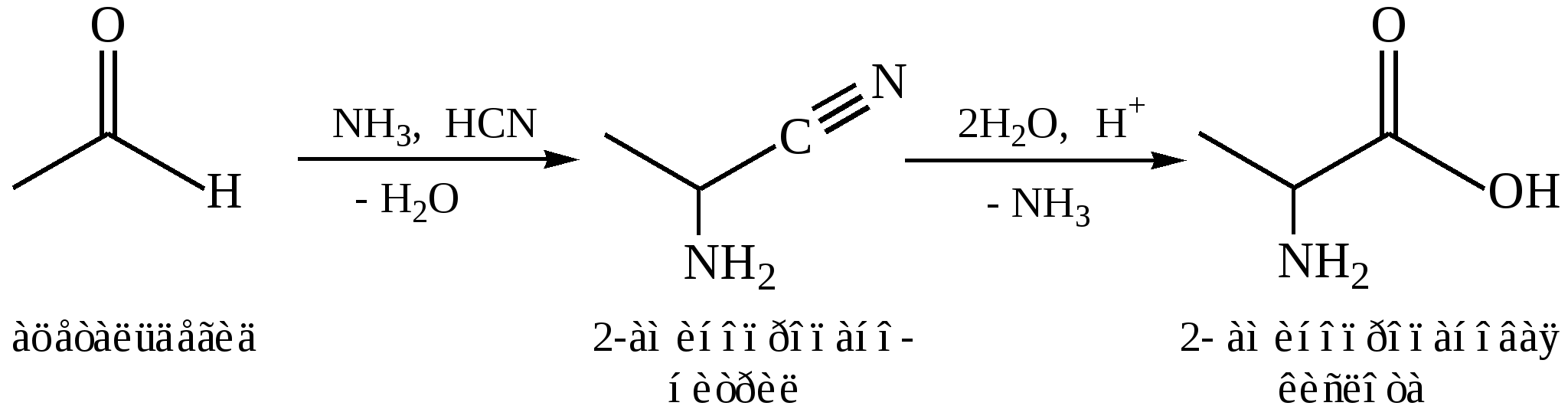
Синтез α-аминокислот по Штреккеру сводится к реакции карбонильного соединения со смесью хлорида аммония и цианистого натрия. Это усовершенствование метода Штреккера предложено Н.Д. Зелинским и Г.Л. Стадниковым. В результате реакции этих неорганических веществ образуются аммиак и цианистый водород — «активные компоненты» процесса.
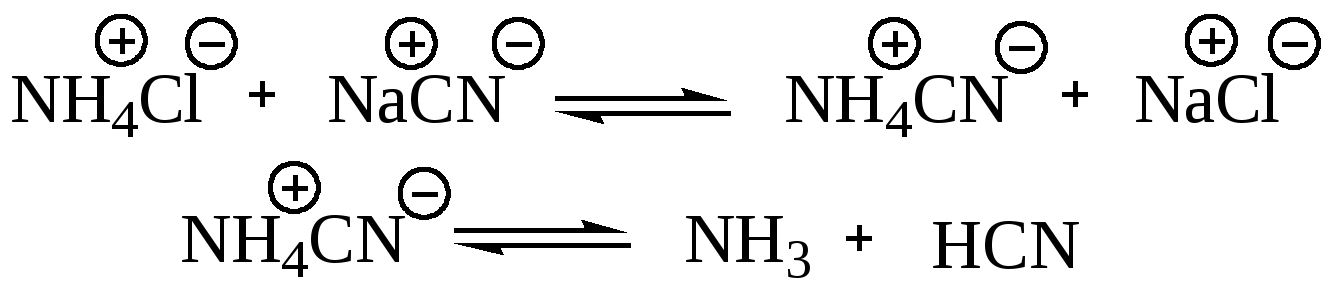
Восстановление оксимов, гидразонов и других азотсодержащих производных кислот:
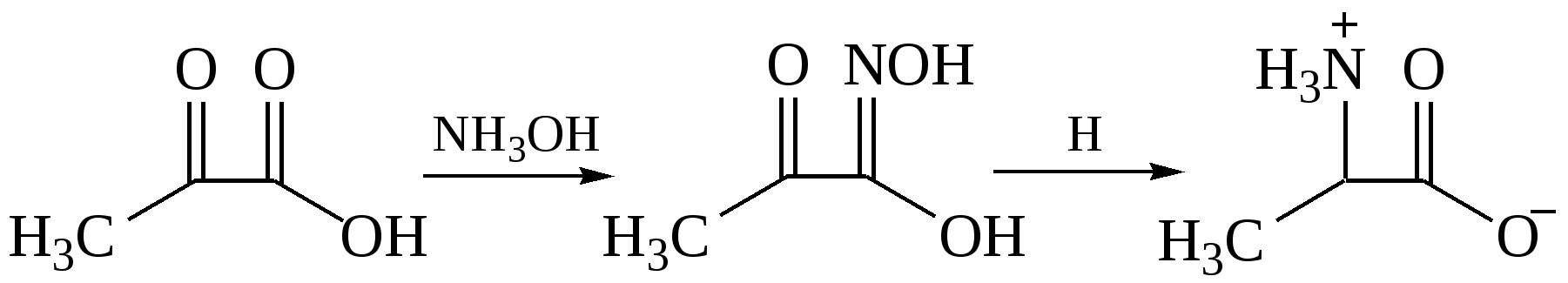
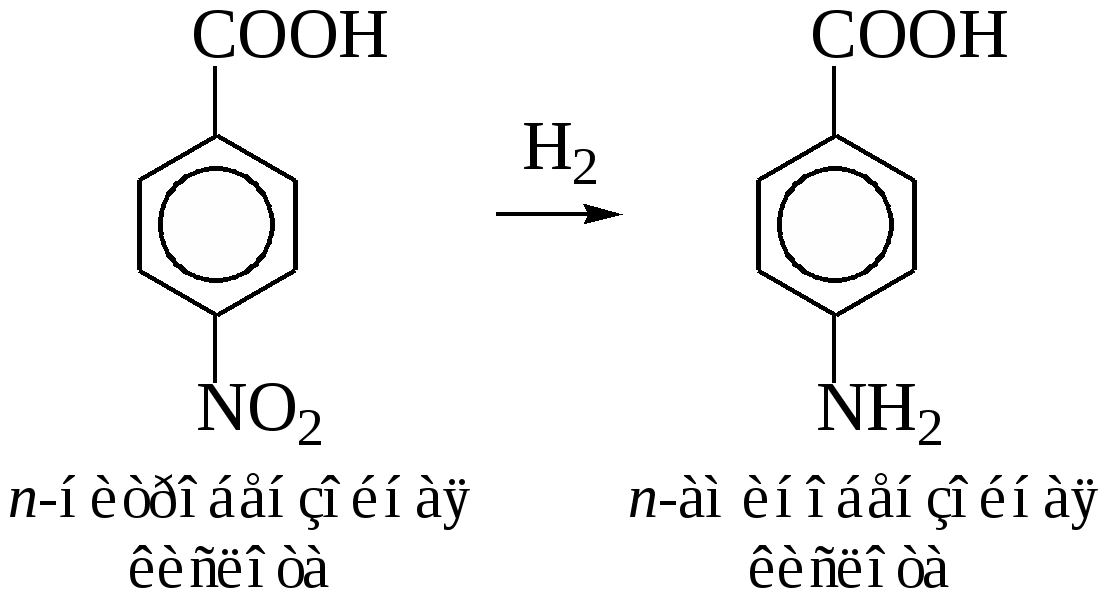
1.7 Получение из нитросоединений (реакция Зинина). Ароматические аминокислоты получаются при восстановлении нитропроизводных ароматических кислот:
Гидролиз белков. При гидролизе белков обычно образуются сложные смеси аминокислот, однако с помощью специальных хроматографических методов из этих смесей можно выделять отдельные чистые аминокислоты. Так из гидролизатов природных белковых продуктов получают пролин, цистин, аргинин, гистидин.
Микробиологический способ. Ввиду сложности химического синтеза и в связи с трудностями разделения оптических изомеров некоторые аминокислоты получают с помощью микроорганизмов. К таким аминокислотам относят лизин (пищевой), триптофан, треонин.
2. Получение β-аминокислот
2.1. Получение из непредельных кислот. При взаимодействии α, β-ненасыщенных кислот с аммиаком образуются β-аминокислоты:
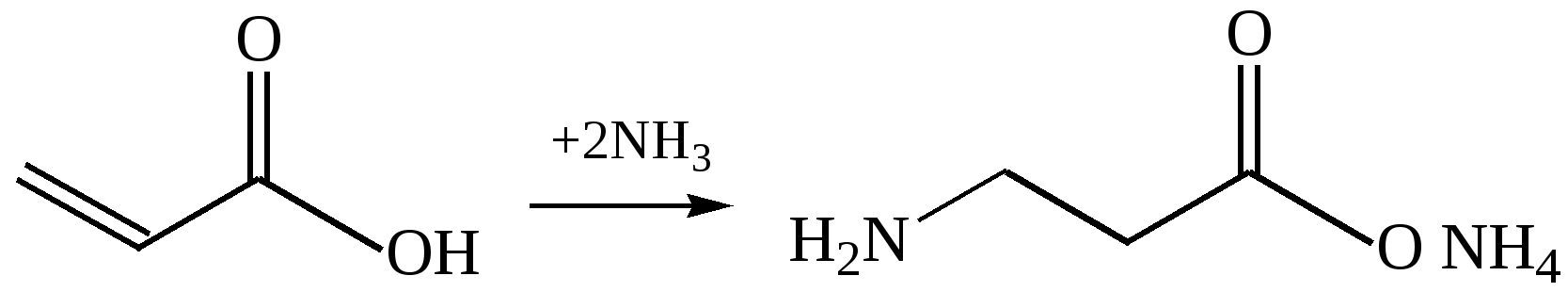
Способ Родионова В. М. Получение из малоновой кислоты и ацетата аммония, реакций с альдегидом:
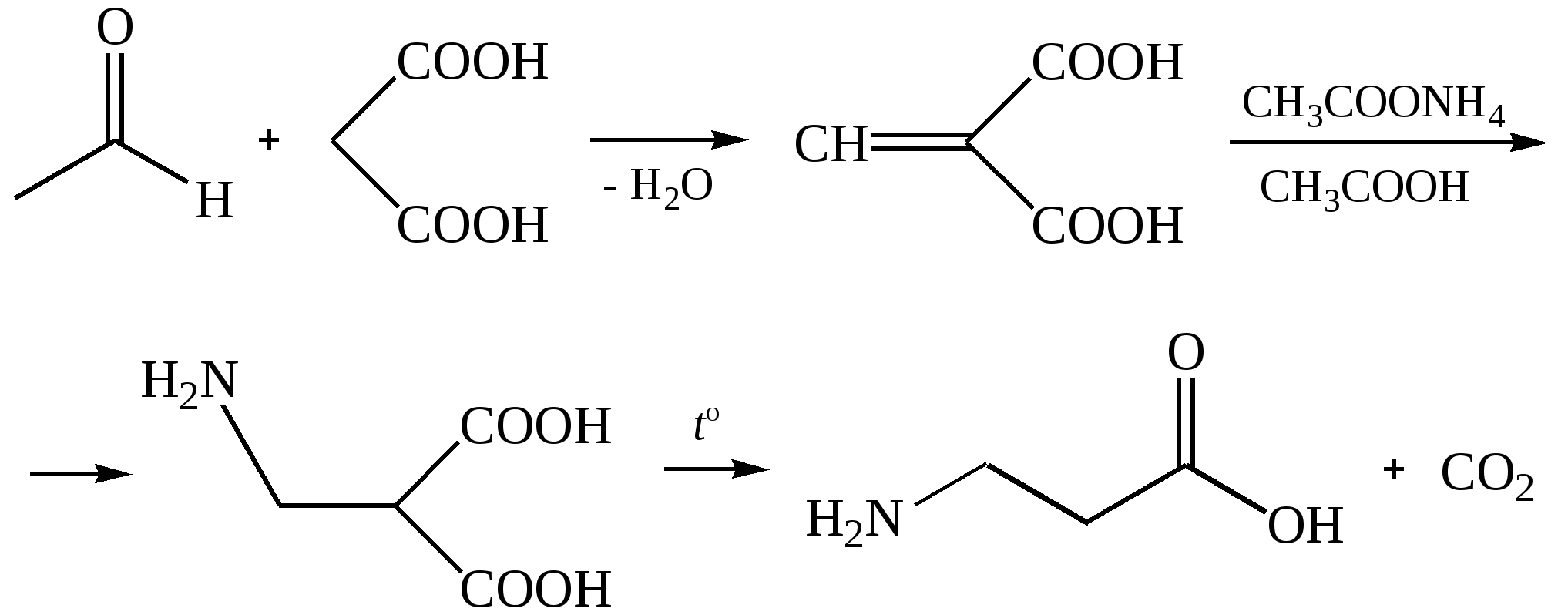
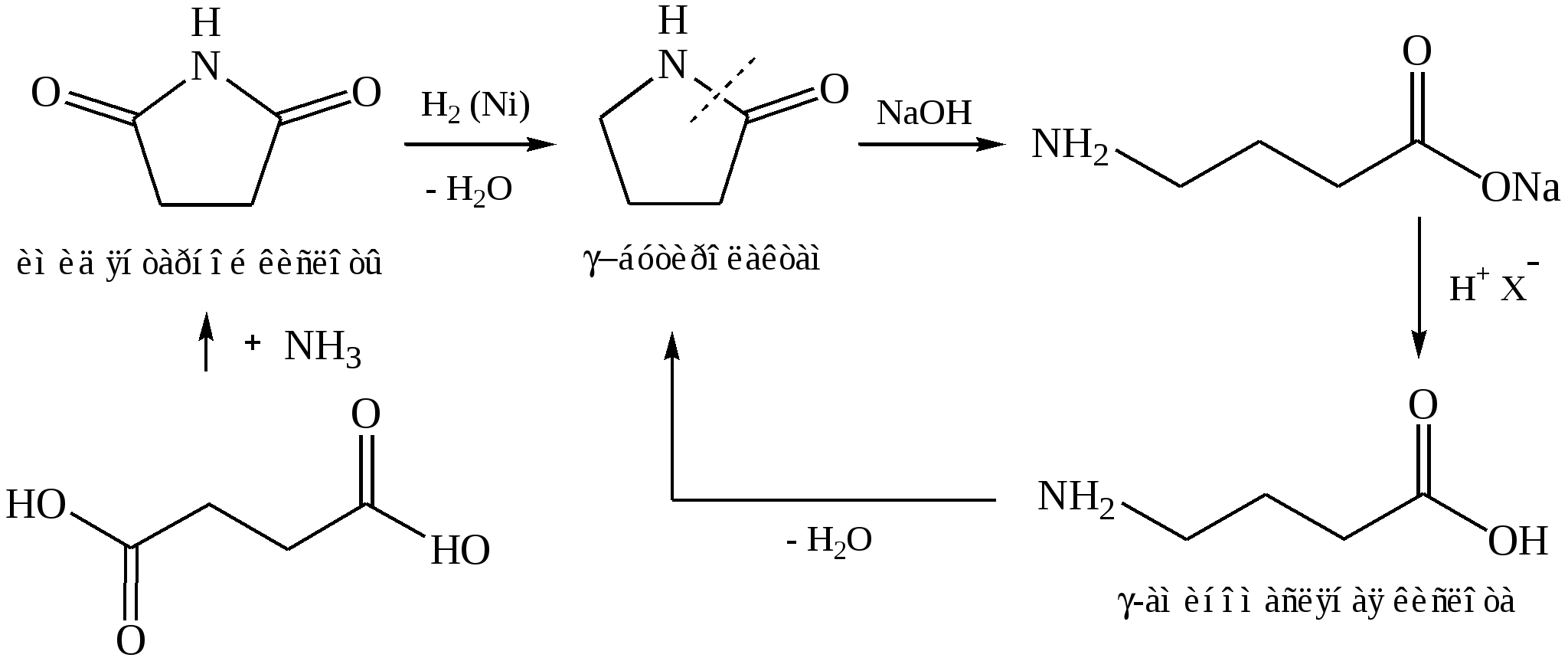
Получение γ-, δ-, ε-, ω-аминокислот (специфические методы)
3.1. Щелочной гидролиз лактамов:
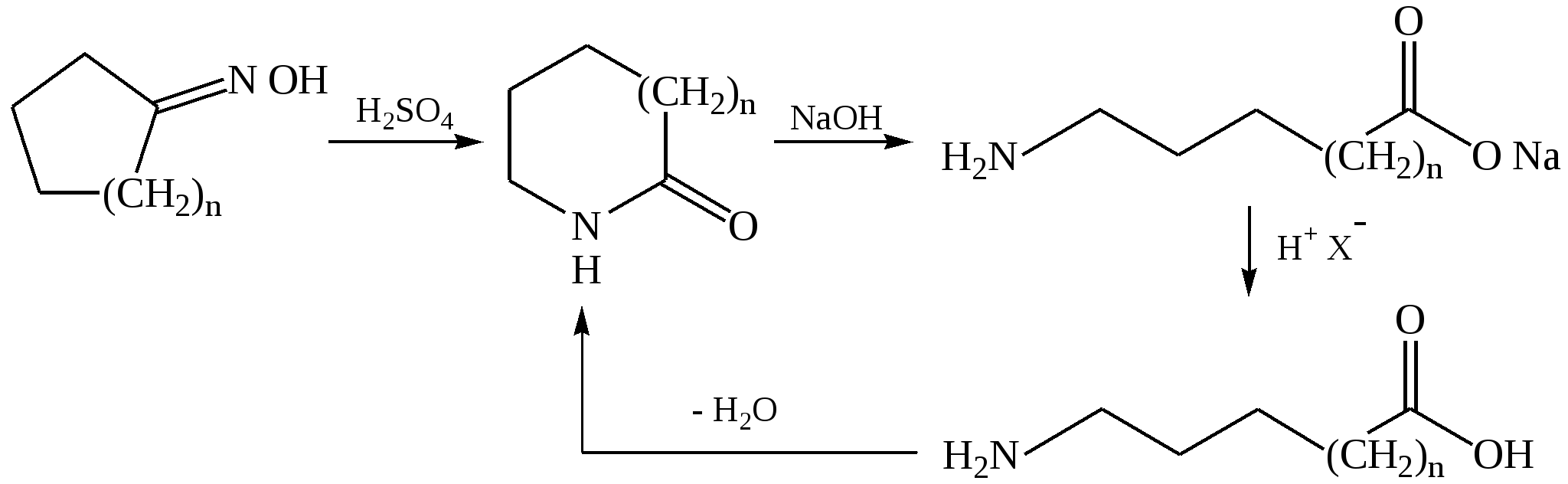
3.2. Перегруппировка оксимов (перегруппировка Бекмана):
3.3. Присоединение аммиака к продуктам теломеризации, (оборванная цепная полимеризация с участием других соединений, образуется смесь продуктов различной массы) этилена и ССl4:
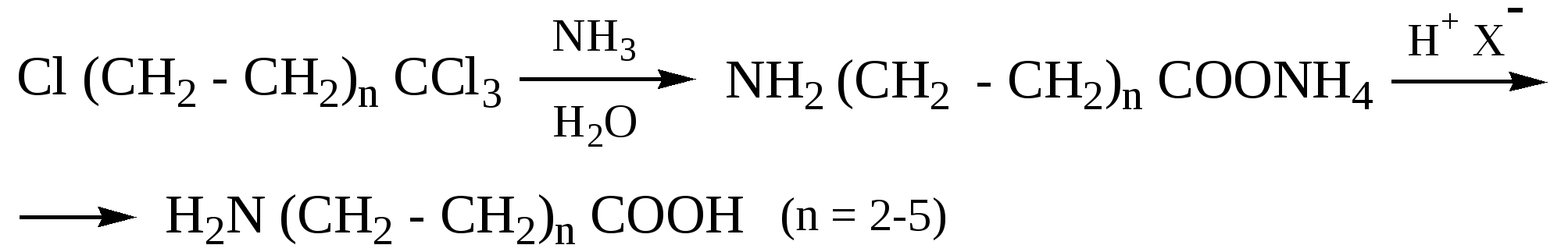
Получение аминоаренкарбоновых кислот:

Восстановление нитроаренкарбоновых кислот:
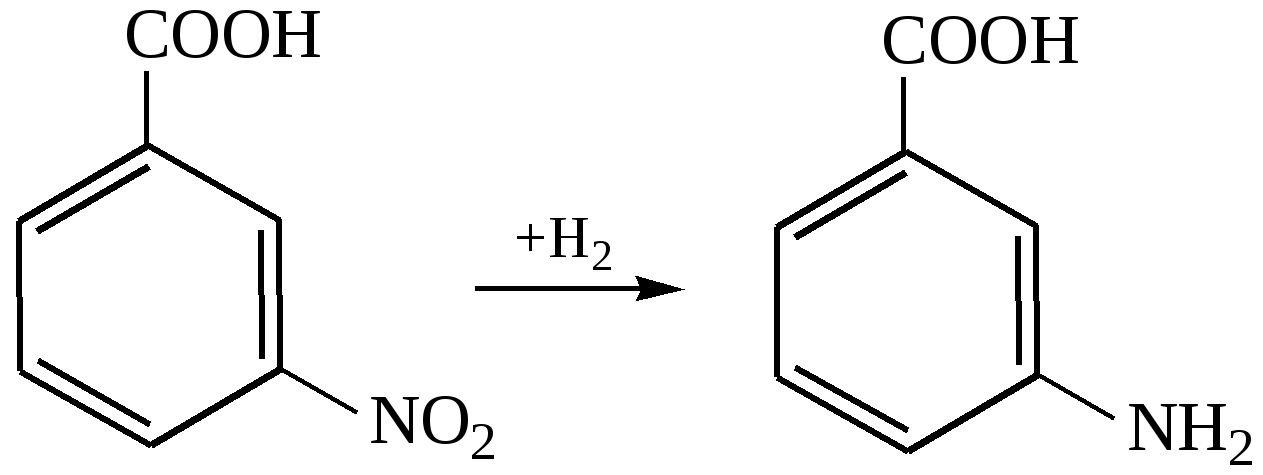
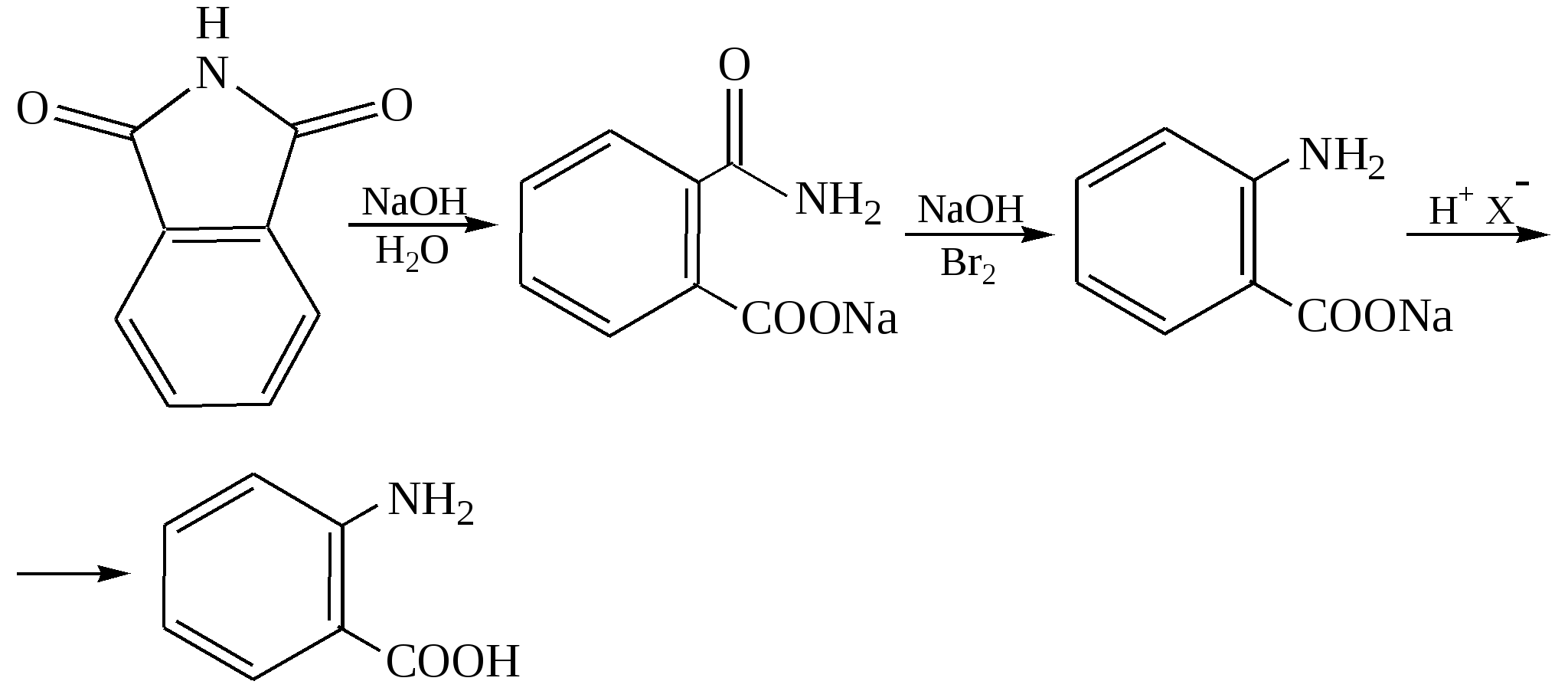
Метод Гоффмана, для получения о-аминоаренкарбоновых кислот используют расщепление имидов:
 |
 Скачать 6.9 Mb.
Скачать 6.9 Mb.