Программа блока гетерофункциональные углеводороды
 Скачать 6.9 Mb. Скачать 6.9 Mb.
|
|
Мутаротация.Кольчато-цепная таутомерия моносахаридов является причиной любопытного свойства простых углеводов. В кристаллическом состоянии моносахариды находятся только в циклической форме. В зависимости от условий кристаллизуется либо -, либо -форма. Так, при кристаллизации из воды глюкоза получается в виде -D-глюкопиранозы, а при кристаллизации из пиридина – в виде -D-глюкопиранозы. После растворения -D-глюкопиранозы в воде вначале наблюдается характерное для нее значение удельного вращения, равное [] = +112,2 0. Однако при стоянии раствора эта величина постепенно снижается и наконец достигает устойчивого значения +52,50. Это явление получило название мутаротации. Мутаротация – явление самопроизвольного изменения угла вращения плоскости поляризации или изменение оптической активности при стоянии свежеприготовленного раствора сахара, связаное с тем, что в растворе устанавливается равновесие между циклическими - и -пиранозными формами, которые переходят друг в друга в результате раскрытия пиранозного цикла с образованием открытой оксо-формы. Взаимопревращение - и -аномеров друг в друга через промежуточную оксо-форму называется аномеризацией. Способы получения моносахаридов 1. Гидролиз ди- и полисахаридов, который происходит под действием кислот или ферментов, водные растворы щелочей не способствуют гидролизу: 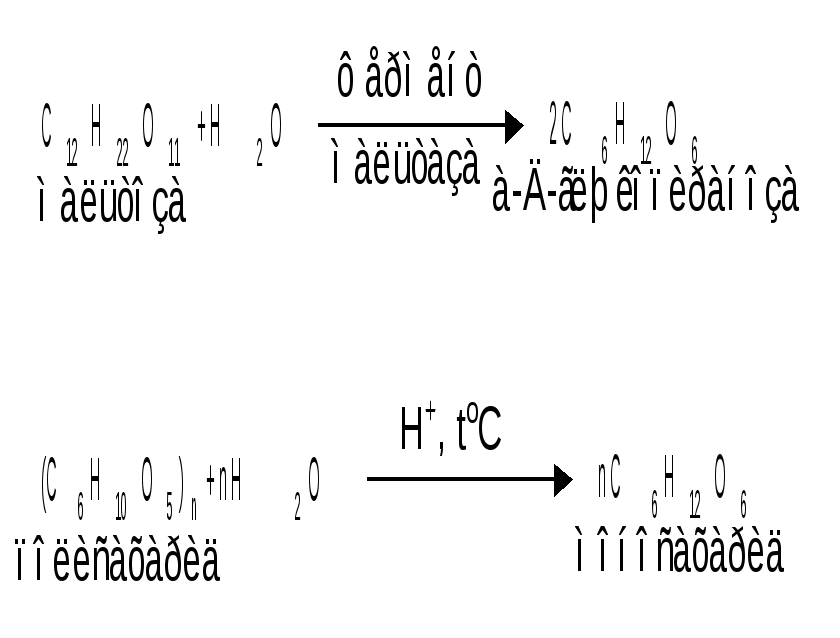 2. Альдольная конденсация формальдегида – первый синтез сахаров был произведен еще А.М. Бутлеровым, в качестве катализатора используют гидроксид кальция:  Полученная альдогексоза оптически недеятельна и представляет собой рацемическую смесь D- и L- альдогексоз. 3. Оксинитрильный синтез используется для удлинения цепи моносахаридов и перехода от низших моносахаридов к высшим. Этот метод был разработан более ста лет назад (Киллани, Фишер), но до сих пор остается важнейшим методом наращивания цепи моносахаридов, несмотря на свою многостадийность: 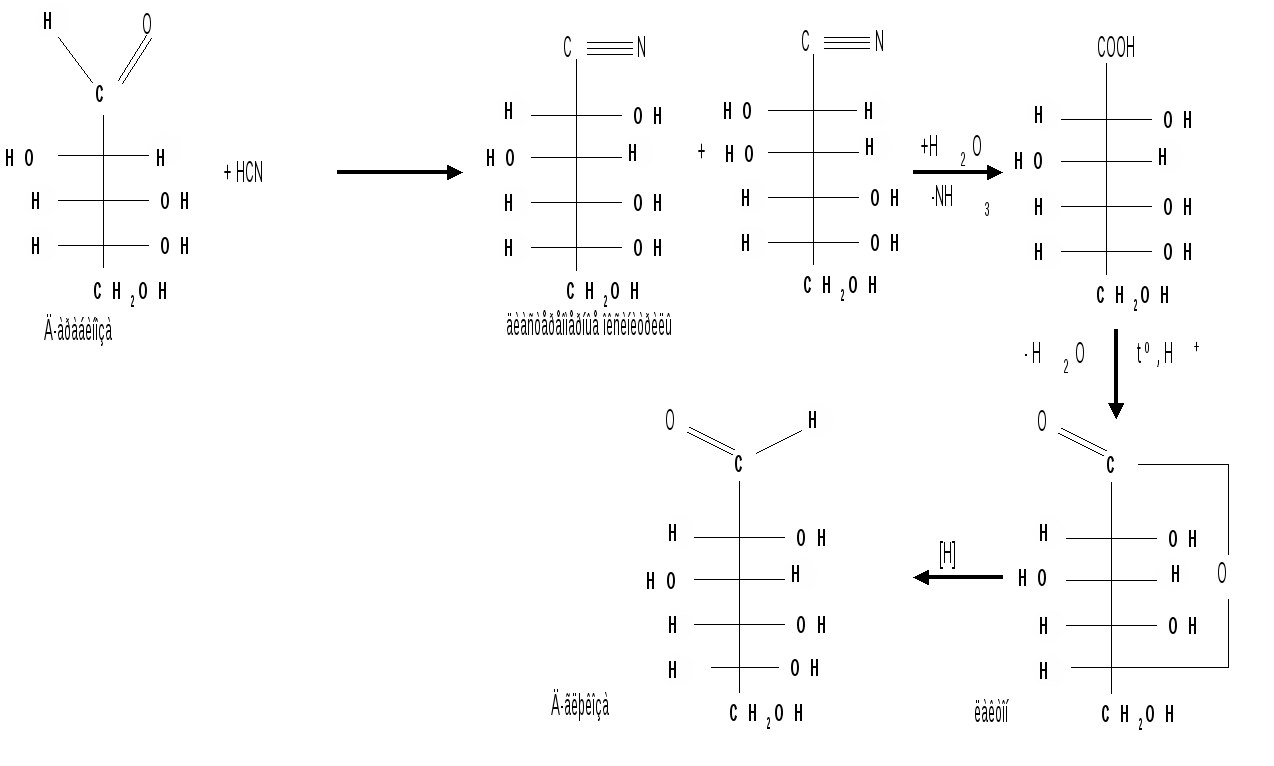 Первая стадия – получение оксинитрилов приводит к смеси диастереоизомеров. В результате гидролиза образуется смесь диастерео-изомерных амидов, которые омыляют затем Ba(OH)2 с образованием смеси диастереомерных солей. Разделение двух диастереомеров проводят на этой стадии методом дробной кристаллизации солей, после чего каждую соль переводят в кислоту. Кислоты нагреванием с разбавленной H2SO4 превращают в соответствующие -лактоны, которые восстанавливают амальгамой натрия в моносахариды : D-глюкозу и D-маннозу, содержащие на один углеродный атом больше, чем исходная D-арабиноза. 4. Метод укорачивания цепи основан на окислении моносахаридов, содержащих на один атом углерода больше, чем в нужном моносахариде. Например, при окислении альдогексозы H2O2 в присутствии ацетата железа(III) образуется альдоновая кислота, которая затем декарбоксилируется с образованием соответствующей альдопентозы: 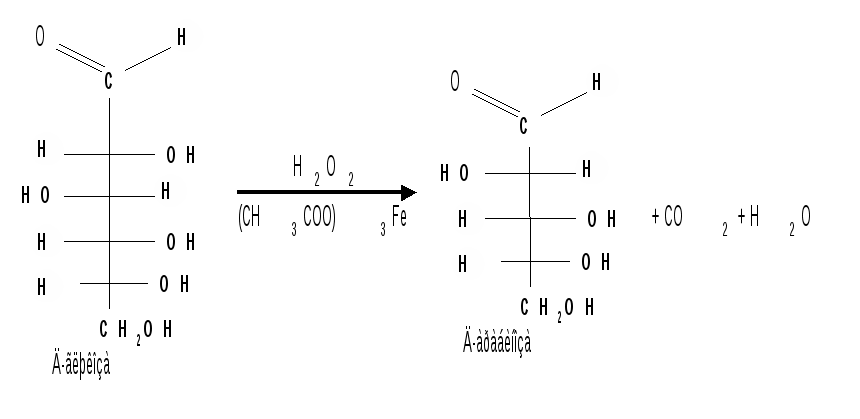 Механизм этой реакции, называемой распад по Руффу, остался невыясненным. Физические свойства моносахаридов. Моносахариды являются твердыми кристаллическими веществами. Все они гигроскопичны, хорошо растворимы в воде, легко образуют сиропы. Растворимость моноз в спирте низкая, в эфире они практически нерастворимы. Растворы моносахаридов имеют нейтральную реакцию по лакмусу и обычно обладают сладким вкусом. Сладость разных моноз различна. Например, фруктоза приблизительно в три раза слаще глюкозы. Растворы моносахаридов обладают оптической активностью, для них характерно явление мутаротации. Химические свойства моносахаридов. В соответствии с химическим строением моносахариды могут проявлять свойства карбонильных соединений, спиртов и полуацеталей. Поскольку циклические и открытые формы моносахаридов в растворе находятся в равновесии друг с другом, то расходование одной из них в ходе реакции сдвигает таутомерное равновесие в сторону реагирующей формы. Рассматривая различные реакции моносахаридов, будет приводиться формулу лишь той таутомерной формы, которая непосредственно участвует в данной реакции. 1. Реакции карбонильных форм моносахаридов 1.1 Окисление. Реакции окисления используют в структурных исследованиях и биохимических анализах для обнаружения моносахаридов. Монозы легко окисляются, причем в зависимости от условий окисления образуются различные продукты. Окисление альдоз без деструкции (разрушения) углеродного скелета проводят в нейтральной или кислой среде и получают различные кислоты. 1.1.1 При использовании мягких окислителей типа бромной воды, гипохлоритов, разбавленной азотной кислоты окисляется только альдегидная группа и образуются гликоновые (альдоновые) кислоты: 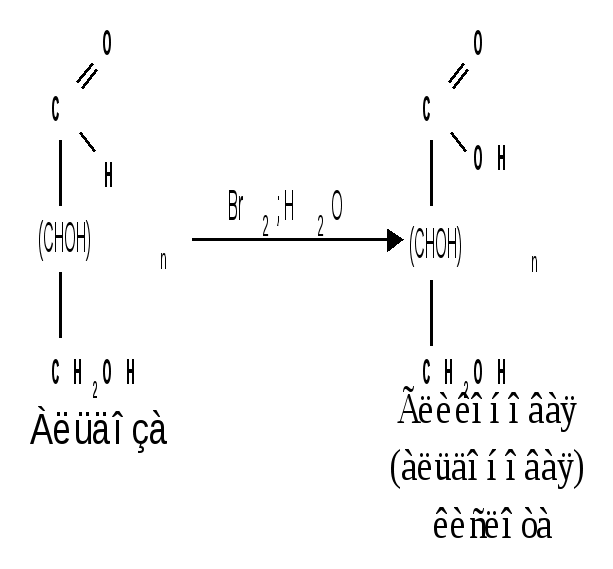 1.1.2 С помощью сильного окислителя – концентрированной азотной кислоты – концевые группы альдоз (альдегидная и первичноспиртовая) одновременно окисляются в карбоксильные группы, образуя гликаровые кислоты (называемые также сахарными): 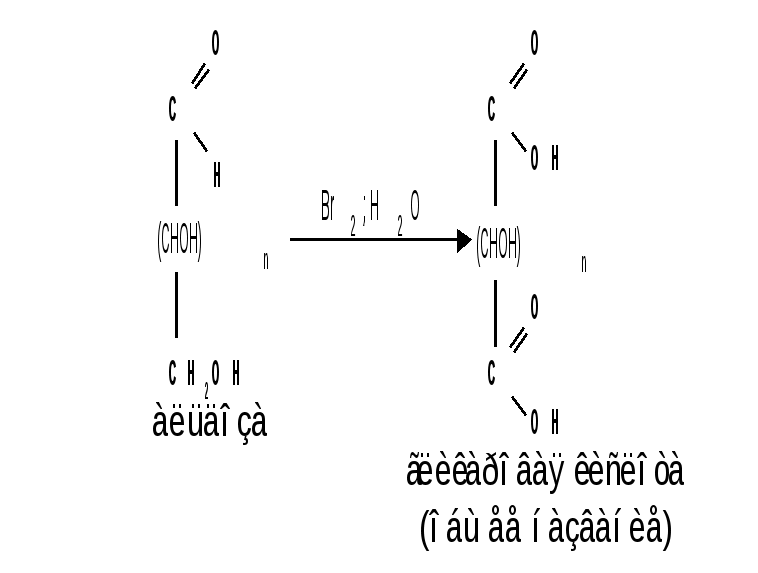 Получающаяся из D-галактозы галактаровая (слизевая) кислота трудно растворима в воде, что используется для обнаружения галактозы методом окисления ее азотной кислотой. 1.1.3 Избирательное окисление первичной спиртовой группы, если предварительно защитить склонную к окислению альдегидную группу (например, превращением альдозы в гликозид), то становится возможным избирательное окисление первичной спиртовой группы и образуются гликуроновые (уроновые) кислоты: 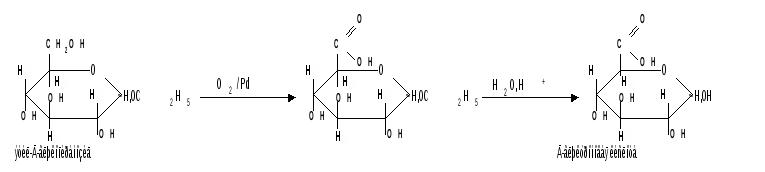 Уроновые кислоты при нагревании их солей с металлами (никель, магний) подвергаются декарбоксилированию. При этом из гексуроновых кислот образуются пентозы. В организме за счет ферментативной реакции декарбоксилирования D-глюкуроновой кислоты получается D-ксилоза: 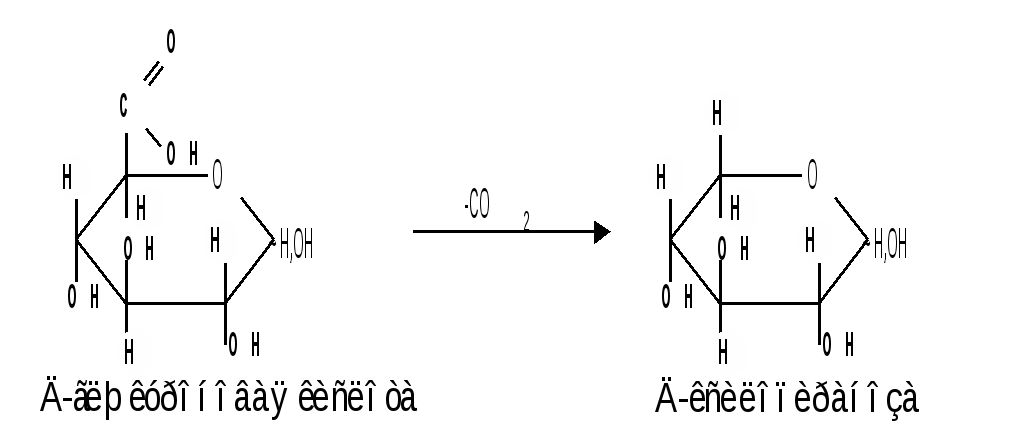 Приведенная реакция показывает генетическую связь пентоз с гексозами, являющимися продуктами фотосинтеза. Пектиновые вещества плодов и ягод представляют собой продукты поликонденсации D-галактуроновой кислоты. Уроновые кислоты выполняют в организме важную функцию – они образуют с лекарственными веществами, их метаболитами, токсичными веществами водорастворимые гликозиды и выводят их из организма. 1.1.4 Окисление кетоз. Кетозы не окисляются слабыми окислителями. При действии сильных окислителей происходит расщепление молекул. Так, например, при окислении фруктозы получаются винная и щавелевая кислоты: 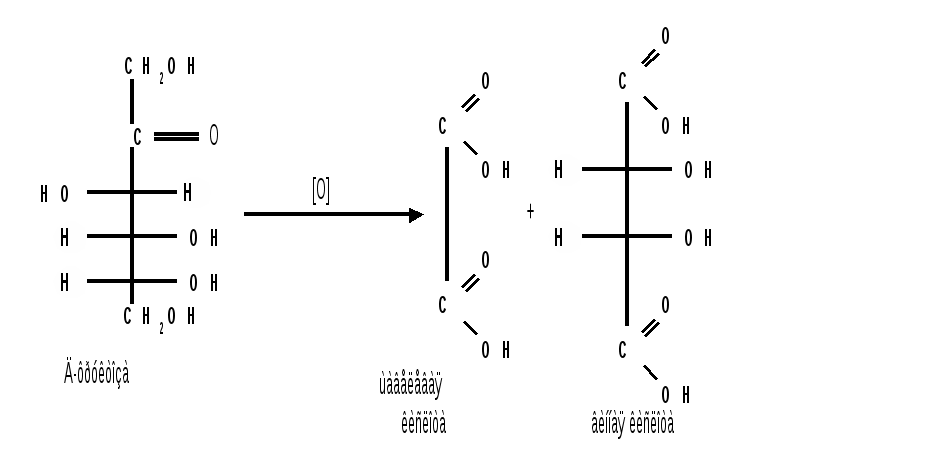 1.1.5 Реакция Толленса. Слабые окислители в щелочной среде (аммиачный раствор оксида серебра, соединения Сu2+) превращают монозы в сложную смесь продуктов окисления и служат для качественного и количественного определения альдоз и кетоз. Подобно обычным альдегидам, альдозы легко дают реакцию “серебряного зеркала” с аммиачным раствором оксида серебра (реактив Толленса):  1.1.6 Окисление реактивом Фелинга. При нагревании реактива Фелинга (смесь равных обьемов водного раствора сульфата меди и щелочного раствора натрий-калиевой соли винной кислоты) в присутствии альдозы выпадает красный осадок Сu2О. Реакцию используют для количественного определения сахаров: 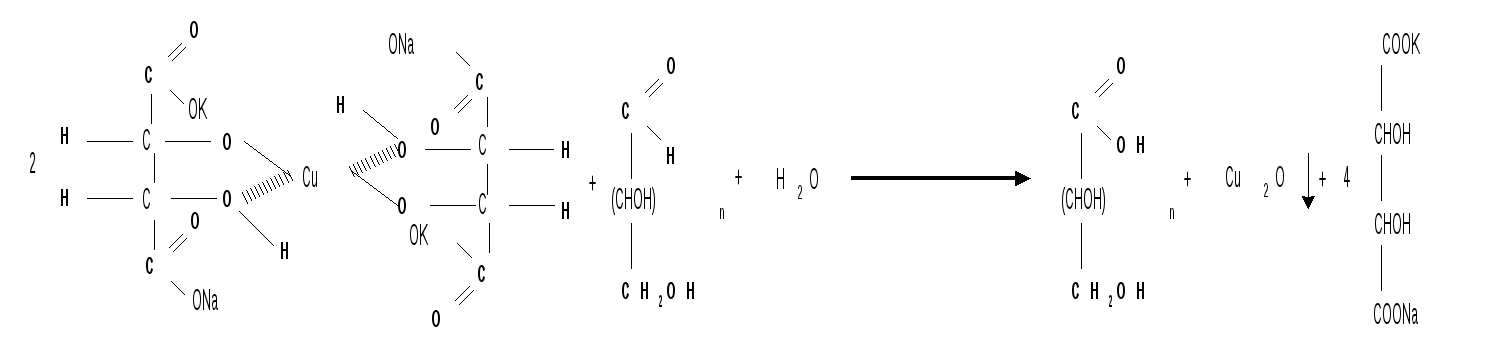 Кетозы тоже способны восстанавливать катионы металлов, так как они в щелочной среде изомеризуются в альдозы. 1.2 Восстановление. При восстановлении моноз образуются многоатомные спирты, называемые альдитами (глицитами). Эти кристаллические, легко растворимые в воде вещества обладают сладким вкусом и часто используются как заменители сахара (ксилит, сорбит): 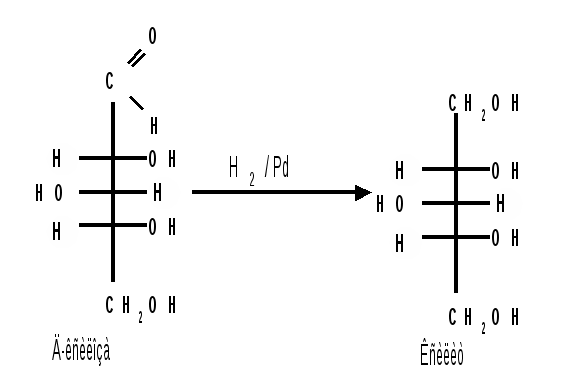 Восстановление моносахаридов проводят водородом в присутствии металлических катализаторов (Pd, Ni). Шестиатомные спирты – глюцит (сорбит), дульцит и маннит – получаются при восстановлении соответственно глюкозы, галактозы и маннозы. Восстановление глюкозы в сорбит является одной из стадий промышленного синтеза аскорбиновой кислоты. При восстановлении альдоз получается лишь один полиол, кетоз – смесь двух полиолов. Например, при восстановлении D-фруктозы борогидридом натрия NaBН4 образуются D-глюцит (сорбит) и D-маннит: 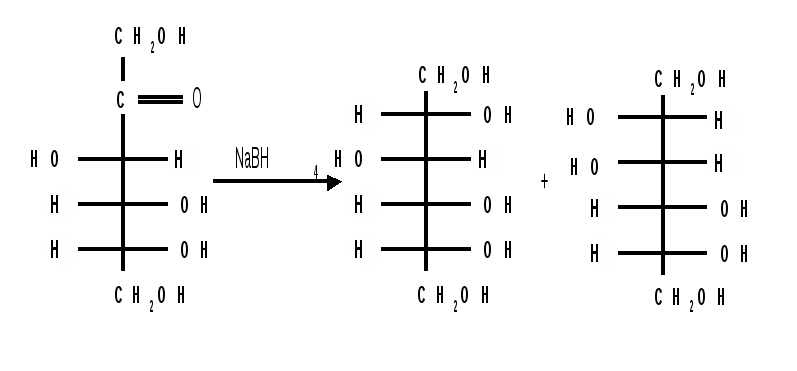
1.3 Присоединение синильной кислоты. Монозы присоединяют синильную кислоту, образуя нитрилы высших глюконовых кислот (Килиани, 1887): Этим методом можно удлинять углеродную цепь и переходить от низших моносахаридов к высшим (см. способы получения моноз). 1.4 Действие гидроксиламина. Реакция с гидроксиламином используется для установления строения сахаров и для перехода от высших моносахаридов к низшим: 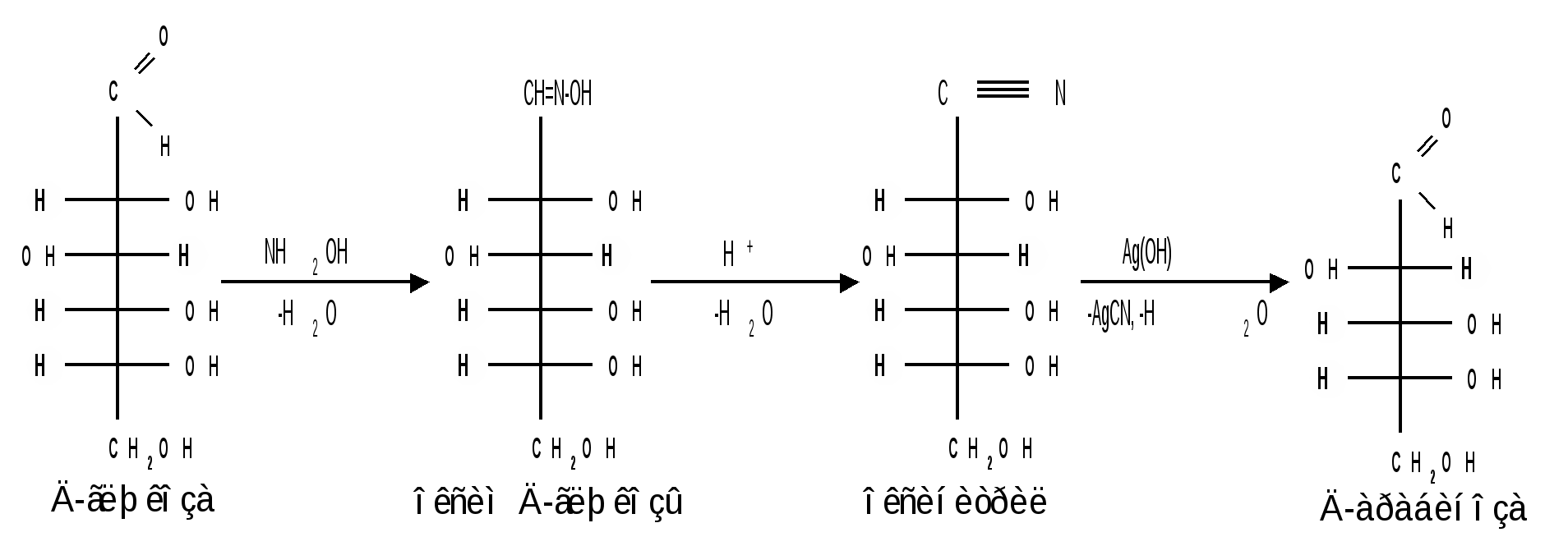 1.5 Действие фенилгидразина. Одной из наиболее важных реакций, которая позволяет выделять в чистом виде отдельные монозы, а также устанавливать тождество моноз различного происхождения, является взаимодействие моноз с фенилгидразином. Сначала фенилгидразин действует на монозы так же, как на простейшие альдегиды и кетоны, т. е. с выделением воды и образованием фенилгидразона: 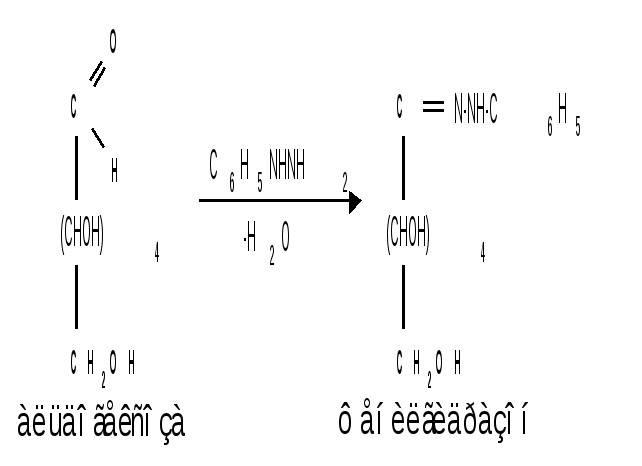 Затем при нагревании полученного гидразона с фенилгидразином соседняя с карбонильной группой первичная или вторичная спиртовая группа окисляется в карбонильную, причем фенилгидразин восстанав-ливается до анилина и аммиака. Вновь образовавшаяся карбонильная группа (для кетоз – альдегидная, а для альдоз – кетонная) вступает в реакцию с третьей молекулой фенилгидразина и получается озазон монозы: 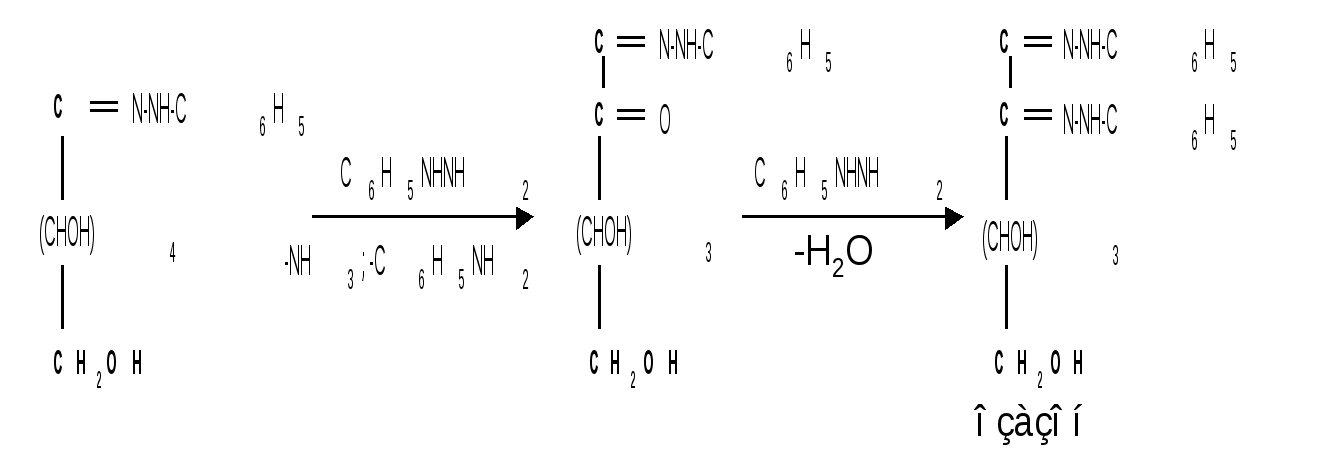 Из альдоз и кетоз могут получиться озазоны одинакового строения. Поскольку реакция образования озазона затрагивает только углероды С1 и С2 моносахаридов, то, следовательно, эпимерные альдозы и изомерные им кетозы дают один и тот же озазон. Озазоны представляют собой кристаллические вещества, трудно растворимые в воде, благодаря чему их легко выделить в кристаллическом виде из водных растворов моноз: 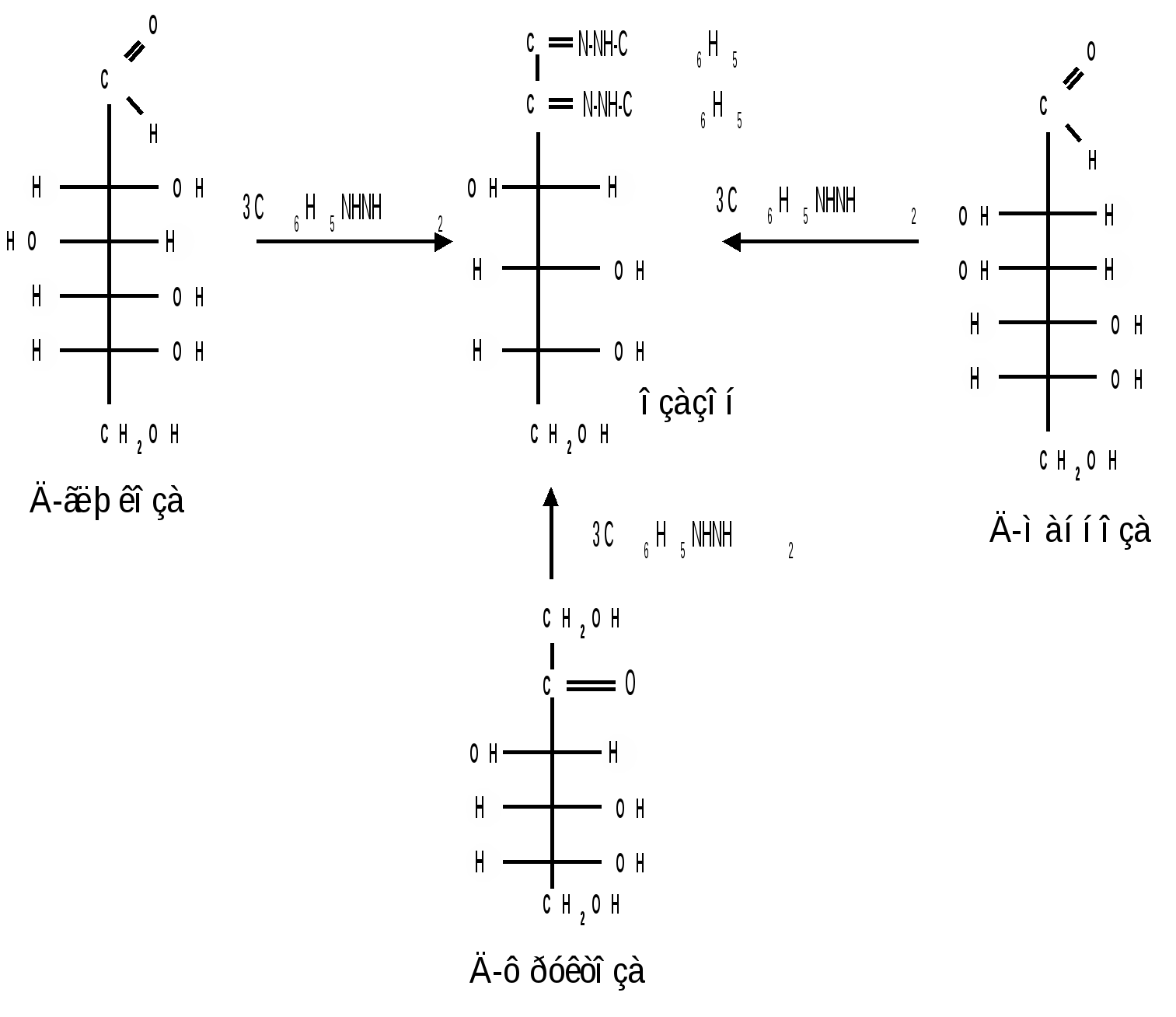 Озазоны при действии кислот гидролизуются в озоны: 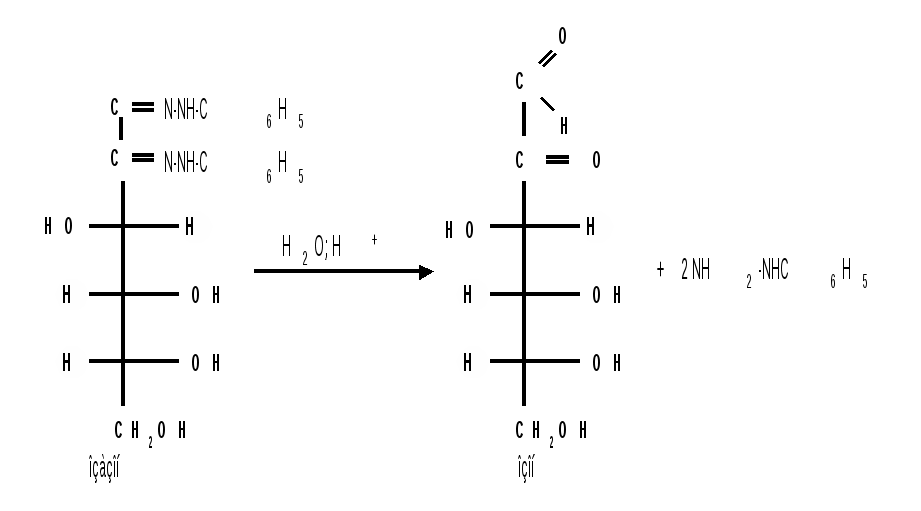 При восстановлении озонов амальгамой натрия в слабокислой среде происходит избирательное восстановление альдегидной группы до первичной спиртовой группы. Этим методом можно осуществлять переход от альдоз к кетозам через озазоны и озоны: 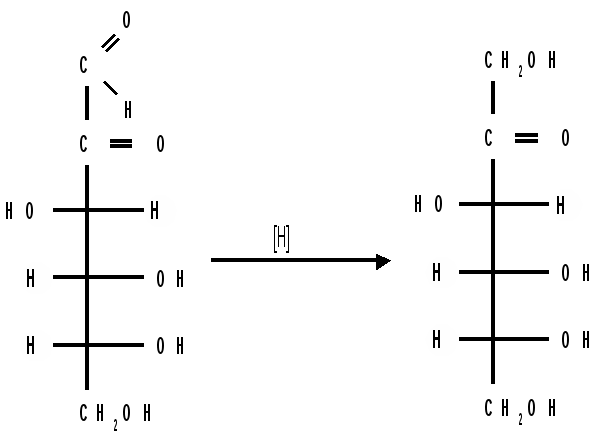
1.6 Действие щелочей. В разбавленных растворах щелочей при комнатной температуре происходит изомеризация моносахаридов, т. е. получение из одного моносахарида равновесной смеси моноз, отличающихся конфигурацией первого и второго атомов углерода. Процесс изомеризации проходит через стадию образования промежуточного продукта – ендиола, который для глюкозы, маннозы и фруктозы является общим: 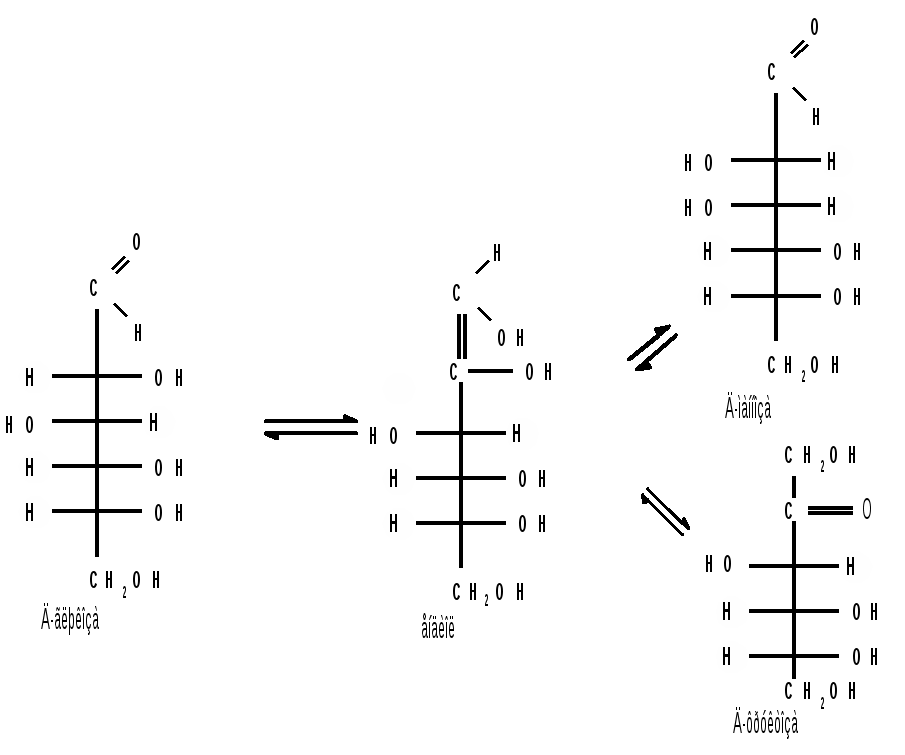 Происходящие при этих превращениях изменения конфигурации у второго углеродного атома альдоз носит название эпимеризации, а альдозы, отличающиеся лишь конфигурацией второго углеродного атома, называются эпимерами. Способностью альдоз и кетоз к взаимному переходу друг в друга в слабощелочной среде обьясняются некоторые необычные свойства фруктозы, в частности – способность к положительным реакциям с реактивом Толленса и фелинговой жидкостью. Превращение 6-фосфата-D-глюкопиранозы в 6-фосфат-D-фруктозы протекает в организме под действием фермента фосфоглюкоизомеразы и является одной из стадий катаболизма глюкозы. 2. Реакции с участием гидроксильных групп. Гидроксильные группы имеются в открытых и циклических формах моноз, но содержание циклических форм значительно выше, поэтому реакции идут в циклических ( полуацетальных ) формах:  Гидроксилы отличаются по реакционной способности: при С1 –гликозидный (наиболее реакционноспособный); при С6 – первичный; при С2-С4 – вторичные. 2.1 Реакции с участием гликозидного гидроксила. При взаимодействии моносахаридов с гидроксилсодержащими соединениями (спиртами, фенолами и др.) в условиях кислотного катализа образуются производные только по гликозидной ОН-группе – циклические ацетали, называемые гликозидами. Cпиртовые гидроксилы моноз в этих условиях не реагируют. В зависимости от размера оксидного цикла гликозиды делятся на пиранозиды и фуранозиды. Ацетали глюкозы называют глюкозидами, рибозы – рибозидами, фруктозы – фруктозидами и т.п. (окончание «оза» монозы заменяется на «озид»). Растворы гликозидов не мутаротируют. Удобным способом получения гликозидов является пропускание газообразного хлороводорода ( катализатор ) через раствор моносахарида в спиртах, например, этаноле, метаноле и т. д. При этом соответственно получаются этил- или метилгликозиды. В названии гликозидов указываются сначала наименования введенного радикала, затем конфигурация аномерного центра и название углеводного остатка с суффиксом «озид». 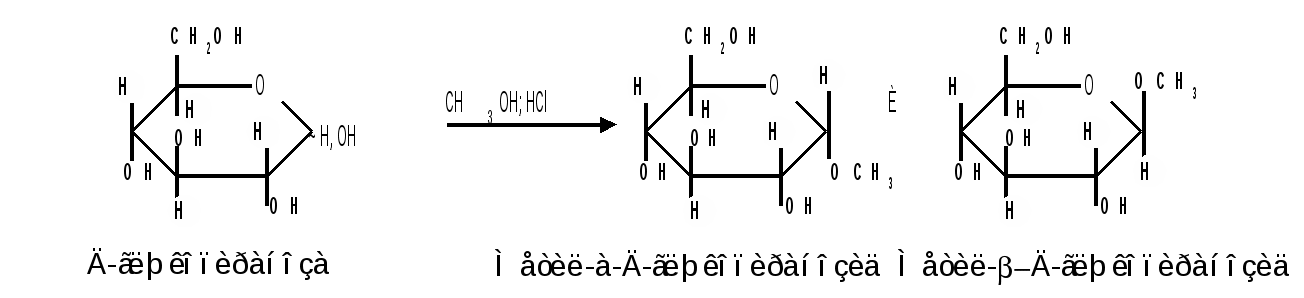 Вследствие таутомерии и обратимости реакции образования гликозида в растворе в равновесии в общем случае могут находиться таутомерные формы исходного моносахарида и соответственно 4 диастереомерных гликозида (- и -аномеры фуранозидов и пиранозидов). Гликозиды легко гидрализуются разбавленными кислотами, но проявляют устойчивость к гидролизу в слабощелочной среде. Более напряженные пятичленные циклы фуранозидов расщепляются гидролитическим путем быстрее пиранозидов. Гидролиз гликозидов в кислой среде приводит к соответствующим спиртам и моносахаридам и представляет собой реакцию, обратную их образованию. Для гидролитического расщепления гликозидов широко применяется ферментативный гидролиз, преимущество которого заключается в его специфичности. Например, фермент -глюкозидаза из дрожжей расщепляет только -глюкозидную связь. На этом основании ферментативный гидролиз часто применяется в целях установления конфигурации аномерного атома углерода. Гидролиз гликозидов лежит в основе гидролитического расщепления полисахаридов, осуществляемого в организме, а также используется во многих промышленных процессах. Молекулу гликозида формально можно представить состоящей из двух частей – углеводной и агликоновой. В роли гидроксилсодержащих агликонов могут выступать и сами моносахариды. Гликозиды, образованные с ОН- содержащими агликонами, называют О-гликозидами. В свою очередь гликозиды, образованные с NH-содержащими соединениями (например, аминами), называют N-гликозидами. К ним принадлежат нуклеозиды, имеющие важное значение в химии нуклеиновых кислот. 2.2 Реакции с участием всех гидроксильных групп 2.2.1 Алкилирование. При действии на моносахариды более сильных алкилирующих агентов, например алкилгалогенидов, наряду с гликозидным гидроксилом в реакцию вступают все спиртовые гидроксилы монозы с образованием простых эфиров. Простые эфиры не гидролизуются, а гликозидная связь легко подвергается гидролитическому расщеплению в кислой среде: 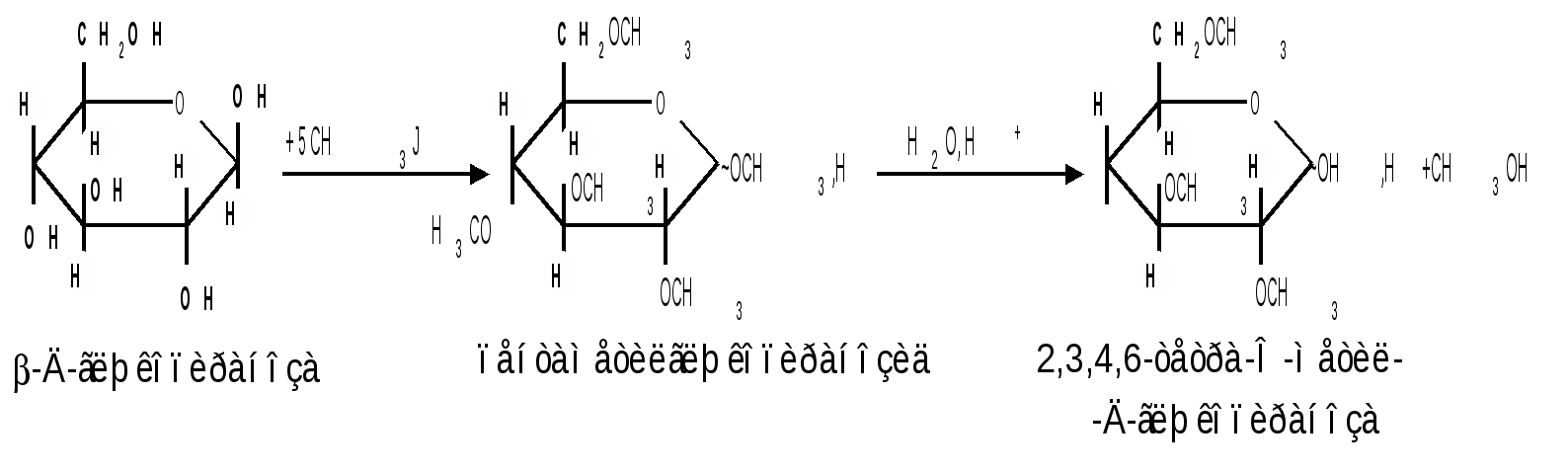 Большое практическое значение имеют триметилсилиловые эфиры моносахаридов (ТМС-эфиры). Моносахариды – нелетучие соединения, поэтому для анализа методами ГЖХ или масс-спектрометрии их необходимо перевести в летучие производные, например ТМС-эфиры, путем взаимодействия с триметилхлорсиланом (СН3)3SiCl: 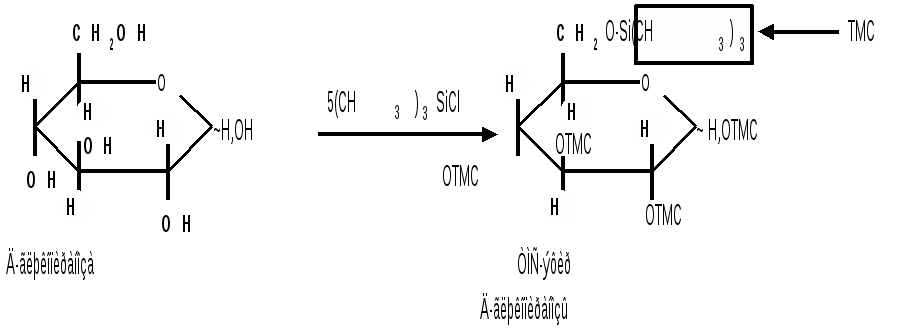 2.2.2 Образование сложных эфиров. Моносахариды легко ацилируются ангидридами и галогенангидридами органических кислот, образуя сложные эфиры с участием всех гидроксильных групп. Например, при действии с уксусным ангидридом получаются ацетильные производные моносахаридов: 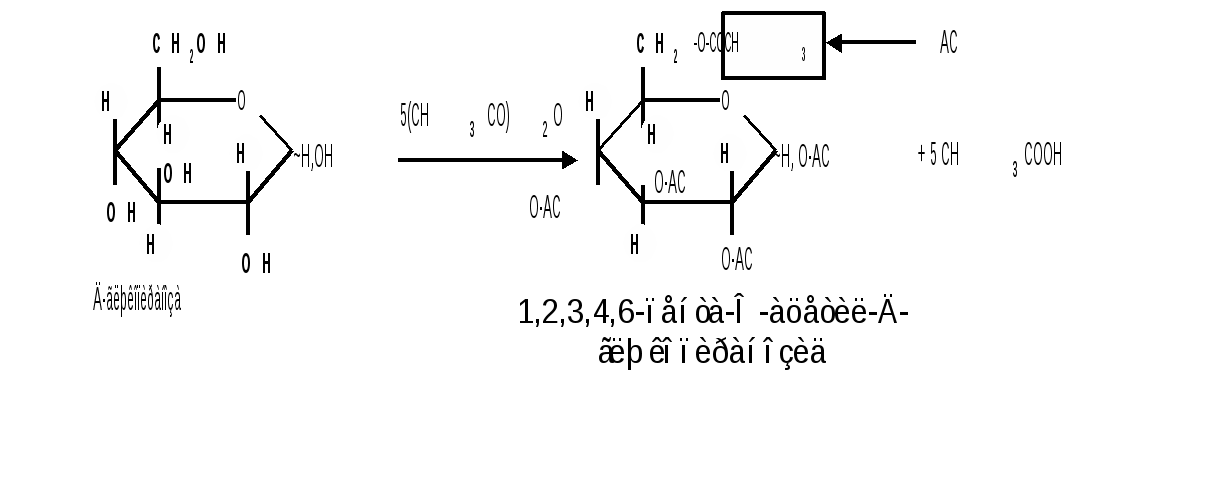 Сложные эфиры моноз гидролизуются как в кислой, так и щелочной средах. Большое значение имеют эфиры неорганических кислот, в частности, эфиры фосфорной кислоты – фосфаты. Они содержатся во всех растительных и животных организмах и представляют собой метаболически активные формы моносахаридов. К ним прежде всего относят фосфаты D-глюкозы и D-фруктозы: 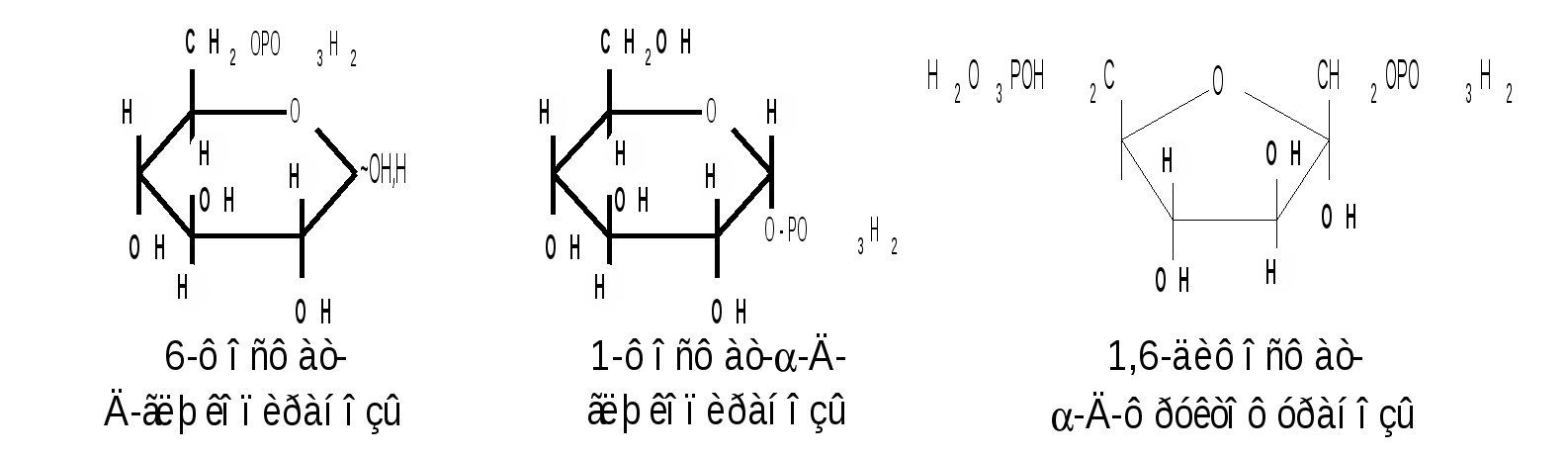 Фосфаты D-рибозы и 2-дезокси-D-рибозы служат структурными элементами нуклеиновых кислот и ряда коферментов. 2.2.3 Действие кислот. Действие кислот на пентозы и гексозы может быть использовано для их распознования, а именно: при нагревании пентоз с разбавленными кислотами легко происходит их дегидратация (отщепление трех молекул воды ) и образуется летучий гетероциклический альдегид – фурфурол: 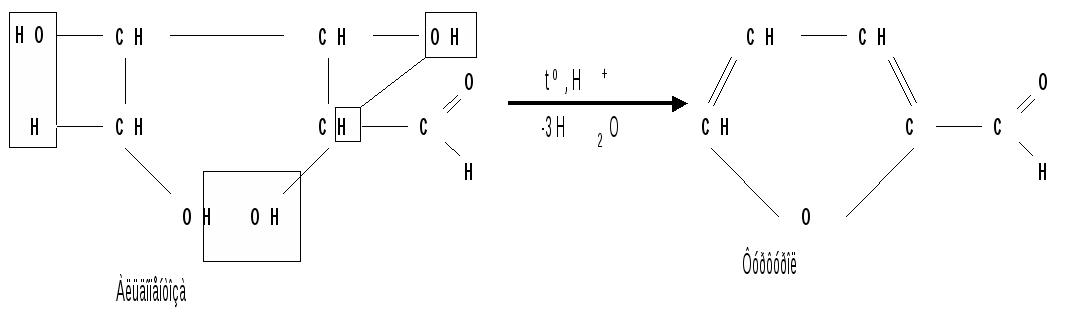 Действие кислот на гексозы ведет сначала к образованию 5-гидроксиметилфурфурола, который при кипячении с разбавленными кислотами разлагается с образованием левулиновой и муравьиной кислот: 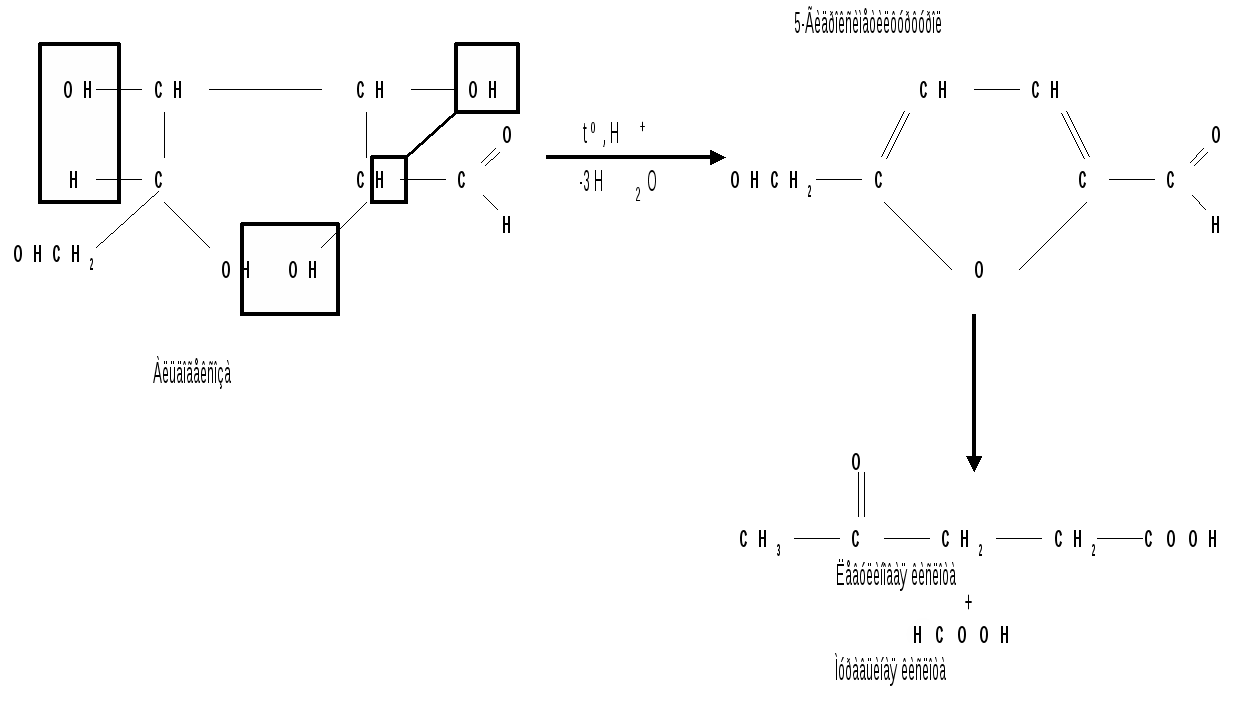 Фурфурол и 5-гидроксиметилфурфурол способны вступать в реакции конденсации с фенолами (-нафтол, резорцин, флороглюцин) и ароматическими аминами (анилин, дефиниламин) с образованием окрашенных продуктов. Фурфурол дает красное окрашивание с анилином (качественная реакция на пентозы); 5-гидроксиметилфурфурол – красное окрашивание с резорцином (реакция Селиванова). Некоторые цветные качественные реакции используются в количественном (колориметрическом) определении сахаров, а также хроматографии для обнаружения моносахаридов. 2.2.4 Брожение сахаровэто сложный процесс расщепления моносахаридов с выделением СО2 под действием ферментов. Брожению подвергаются сахара, у которых число атомов углерода кратно трем (гексозы). Брожение гексоз различной конфигурации происходит с неодинаковой легкостью. Различают разные виды брожения: 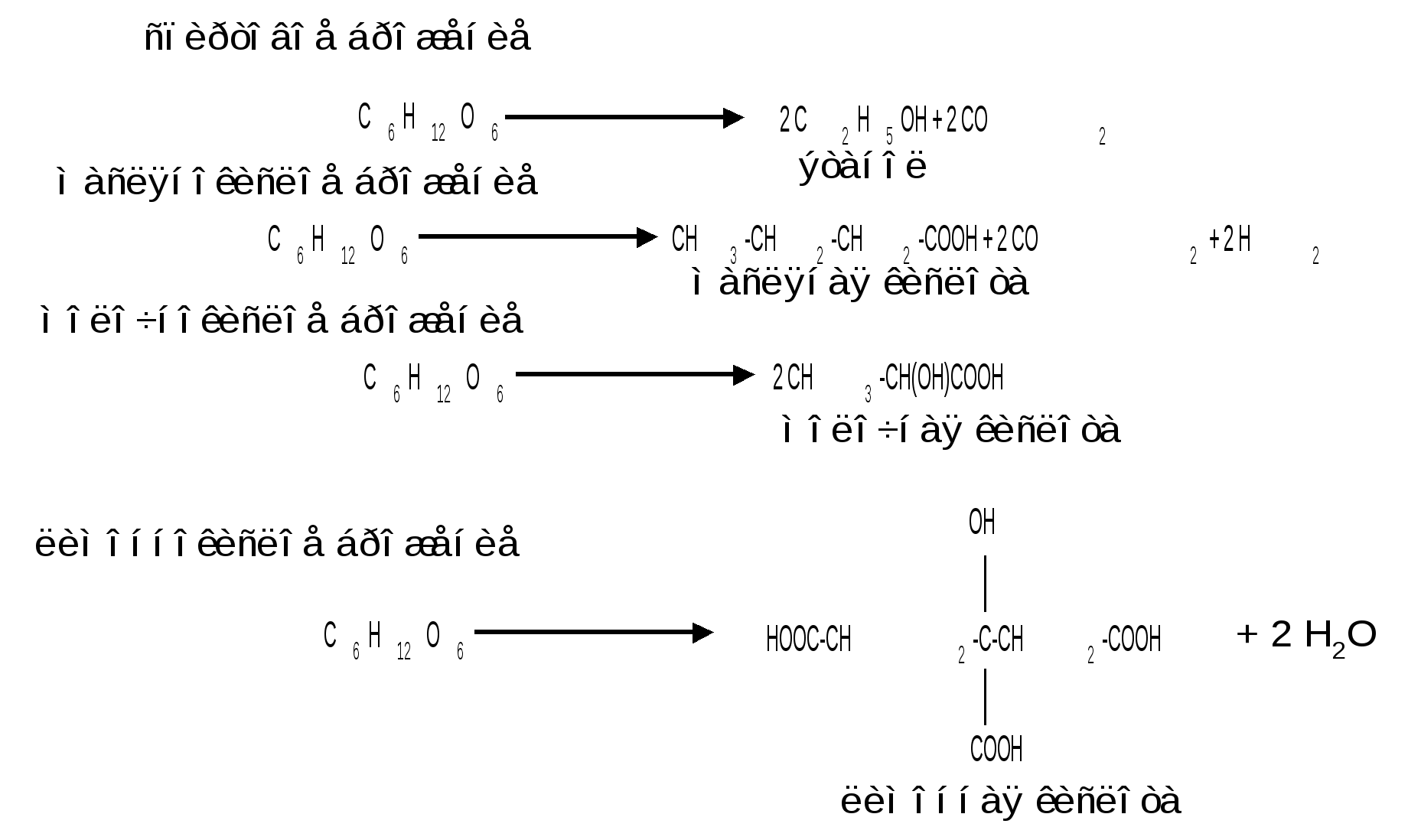 Существуют и другие виды брожения. Процессы брожения сахаров играют важную роль и широко используются в промышленности. |
