Программа блока гетерофункциональные углеводороды
 Скачать 6.9 Mb. Скачать 6.9 Mb.
|
|
Электронное строение. Электронная структура тиофена, как пиррола и фурана, основана на ароматическом секстете электронов, состоящем из 4 π-электронов, двух двойных углерод-углеродных связей и двух p-электронов атома серы. Однако в отличие от атомов азота и кислорода атом серы обладает еще и свободными d-орбиталями, которые, как показали исследования, также могут участвовать в образовании тиофенового кольца. Современные электронные модели тиофена и строятся либо с учетом s-орбиталей, либо без учета их. В последнем случае тиофеновый цикл отличается по электронной структуре от фуранового или пиррольного цикла лишь меньшей электроотрицательностью атома серы по сравнению с атомами кислорода или азота. Уменьшение электроотрицательности атома серы связано с увеличением электронной оболочки атома серы и появлением экранирующего электронного «пояса» между ядром атома и внешними электронами. Поэтому неподеленная электронная пара атома серы, входящая в кольцевую сопряженную систему тиофена, более делокализована, чем соответствующие неподеленные пары электронов у атомов кислорода или азота в фуране и пирроле. Этим обстоятельством объясняется большая ароматичность молекулы тиофена по сравнению с фураном и пирролом. По значению энергии делокализации 130,2 кДж/моль тиофен заметно приближается к бензолу. Химические свойства 1. Реакция галогенирования. Для галогенирования тиофена можно использовать бром или хлор при низкой температуре, при этом могут образовываться как моно-, так и полигалогентиофены. Более избирательно действует сульфурилхлорид (SO2Cl2): 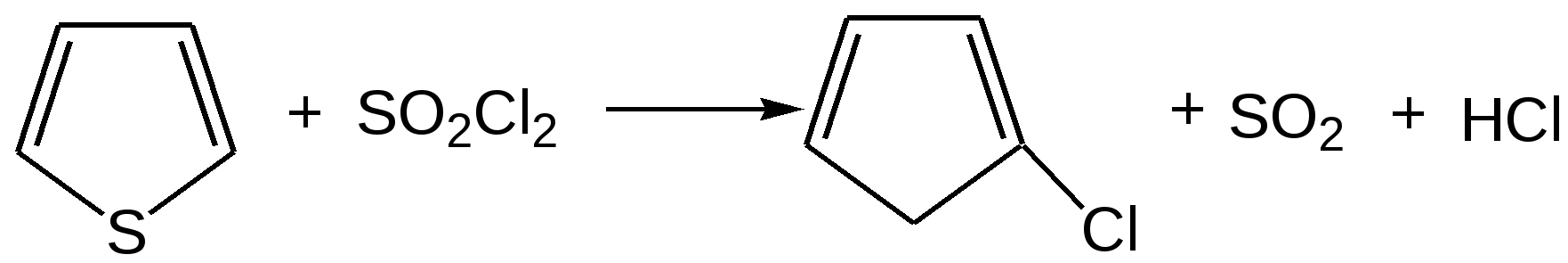 2. Реакция сульфирования. Повышенная устойчивость тиофена позволяет сульфировать его серной кислотой, причем, в отличие от бензола, тиофен сульфируется на холоде, что используется для очистки бензола от примесей тиофена:  3. Реакция нитрования. Хотя тиофен значительно устойчивее к действию минеральных кислот, чем фуран и пиррол, но и он окисляется азотной кислотой с разрушением молекулы. Поэтому для нитрования вышеназванных гетероциклов используют «мягкий» нитрующий агент – ацетилнитрит (смесь уксусного ангидрида с азотной кислотой) в пиридине, при этом образуются -нитропроизводные: 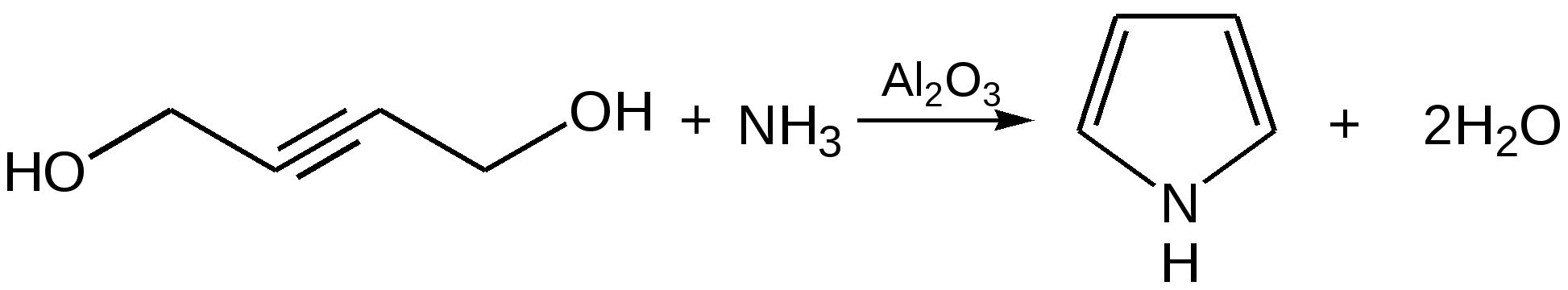 4. Реакция ацилирования. Реакцию ацилирования по Фриделю-Крафтсу проводят (подобно бензолу) в более жестких условиях:  5. Реакция гидрирования. Восстанавливается действием металлического натрия в спирте в присутствии аммиака, так как никелевые или платиновые катализаторы при гидрировании отравляются тиофеном и конечным продуктом гидрирования – тиофаном, который содержится в сернистых нефтях: 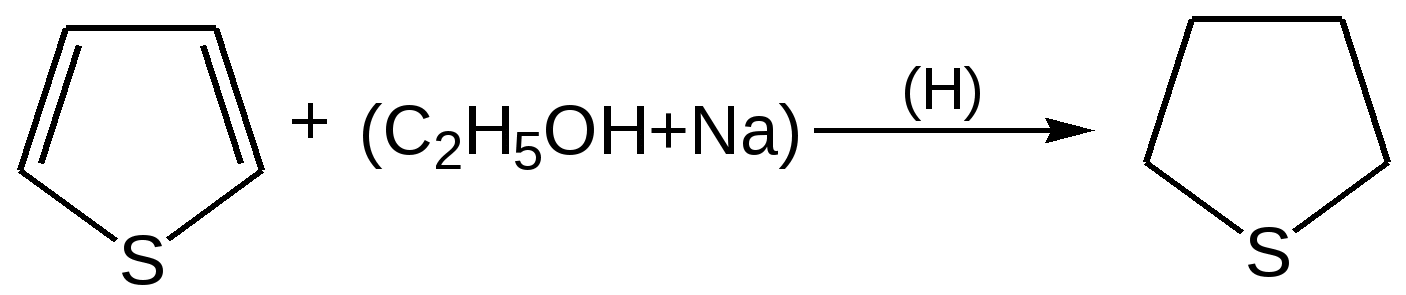 6. Реакция окисления. Тиофен в обычных условиях не окисляется. О термической устойчивости тиофена говорит сам факт его образования при температуре коксования угля (1000С). Получение тиофена 1. В промышленности тиофен получают из бутана и паров серы или диоксида серы (SO2) при высокой температуре: 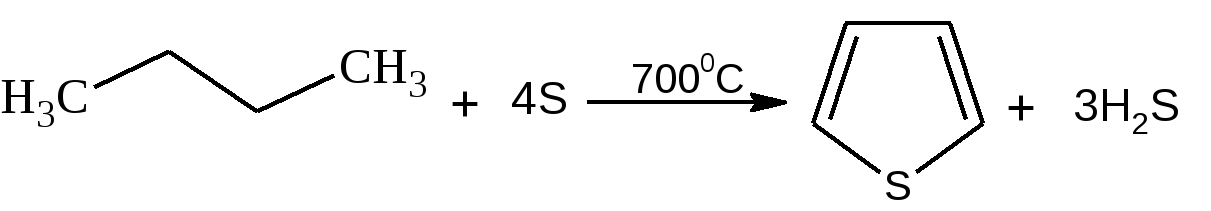 2. Пиролизом: 2.1 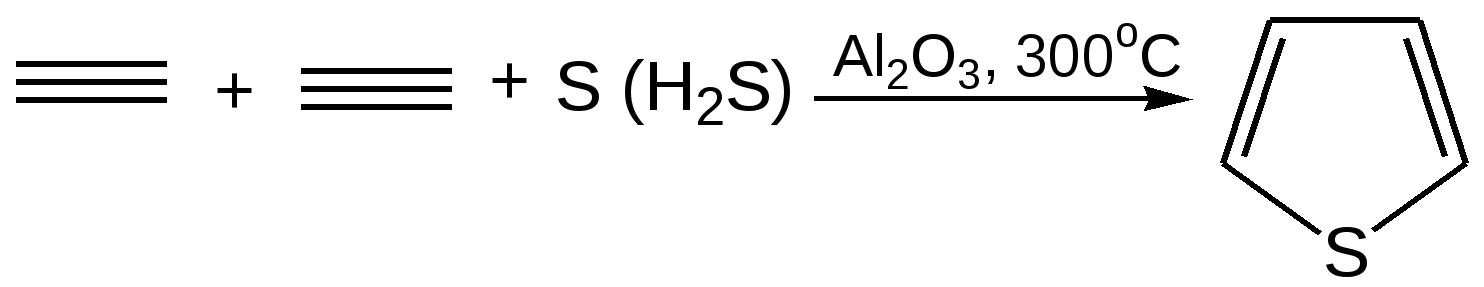 2.2 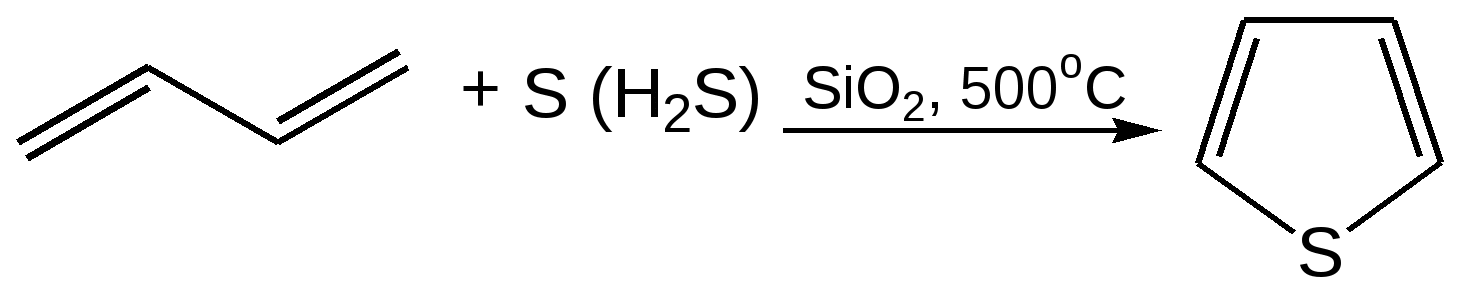 2.3 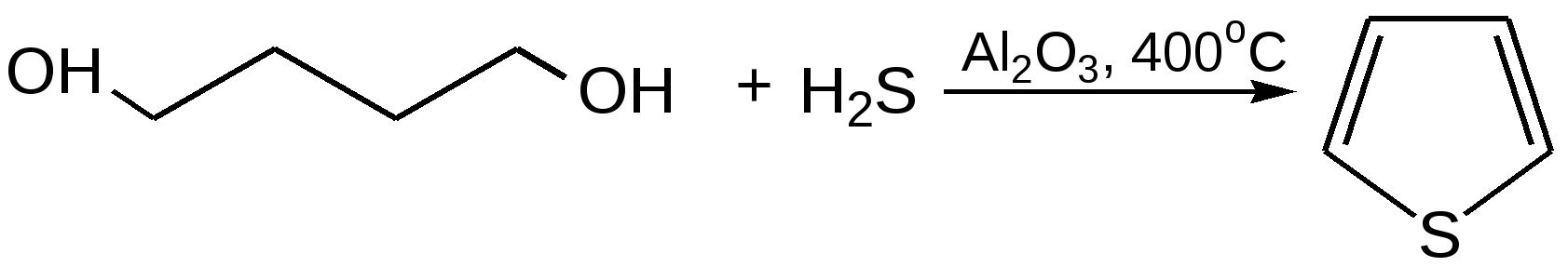 Практическое применение тиофена и его производных Циклическая система тиофена встречается в природе в некоторых продуктах растительного происхождения, но гораздо большее значение имеет это соединение в составе синтетических лекарственных препаратов и красителей. Производные тиофена находят практическое применение в производстве различных красителей, пластификаторов, пластмасс, аналитических реагентов, инсектицидов. Уже давно начала успешно развиваться и приобрела большое промышленное значение химия тиоиндигоидных красителей. В основе этого класса красителей лежит сернистый аналог индиго – тиоиндиго. Тиоиндиго – кубовый краситель красного цвета. Синтез тиоиндиго проводится по методам, очень близким к методам синтеза самого индиго. Класс тиоиндигоидных красителей включает красители разнообразных цветов и оттенков. На примере этих красителей изучается зависимость глубины окраски и изменения цвета от электронного взаимодействия тиоиндигоидного скелета с различными заместителями. Используют тиофен в органическом синтезе. Пиррол. Важнейший представитель пятичленных гетероциклов с одним гетероатомом. Он является родоначальником важных природных соединений, к которым принадлежат гем (компонент гемоглобина крови) и хлорофилл. 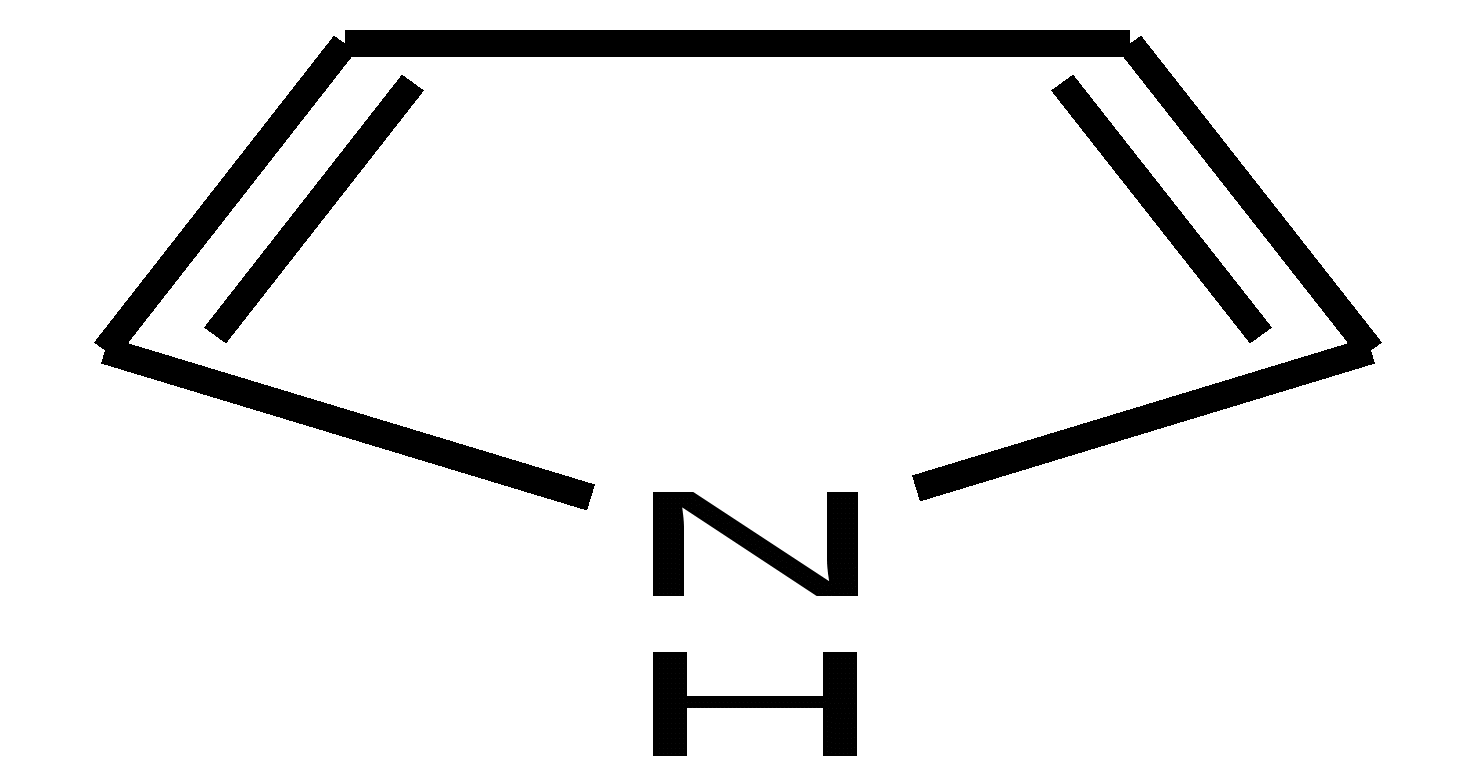 История открытия пиррола. Пиррола был обнаружен в костяном масле (продукт сухой перегонки костей) и в небольшом количестве в каменноугольной смоле (Рунге, 1834 г.). Строение его установлено А. Байером в 1870 г. Электронное строение. Молекула пиррола плоская, что свидетельствует о гибридизации как атомов углерода, так и гетероатома азота. Причем три гибридизованные орбитали атома азота, принимающие участие в образовании σ-связей, лежат в плоскости кольца. Негибридизованная р-орбиталь гетероатома, расположенная перпендикулярно плоскости кольца, несет неподеленную пару электронов. При перекрывании p-орбитали кольцевого азота с негибридизованными ρ-орбиталями четырех атомов углерода кольца, несущих по одному электрону, образуется единая молекулярная система, содержащая в общей сложности шесть электронов (ароматический секстет): 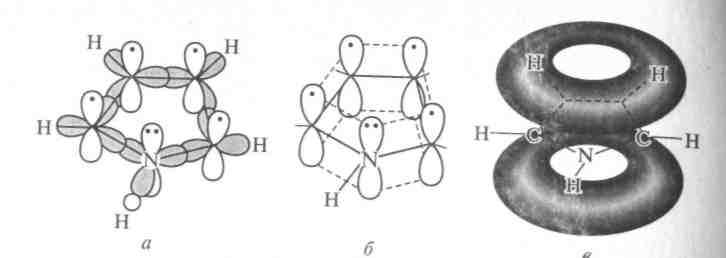 Рисунок 2 – Строение молекулы пиррола Таким образом, пиррол, как и бензол, и пиридин, подчиняется правилу ароматичности Хюккеля для п = 1. Рассчитанное π-электронное распределение в молекуле пиррола показывает, что рассматриваемая система электроноизбыточна (шесть электронов перераспределены между пятью атомами кольца) и четыре атома углерода обладают большей π-электронной плотностью, чем атомы углерода бензола, хотя наибольшая электронная плотность сосредоточена на азоте. Физические свойства. Пиррол легко растворяется в большинстве органических растворителей; на воздухе темнеет и постепенно осмоляется. При действии на пиррол минеральных кислот образуется полимерная масса темного цвета, не имеющая практического применения. Такая неустойчивость пиррола в сильнокислой среде называется ацидофобностью (что означает «кислотобоязнь»). Эту особенность следует учитывать при экспериментальной работе с пирролом.
Прототропная таутомерия пиролла – изомеризация, сопровождаю-щаяся миграцией протонизированного атома водорода от одного атома молекулы к другому (нуклеофильному) атому молекулы с одновременным перемещением кратной связи: 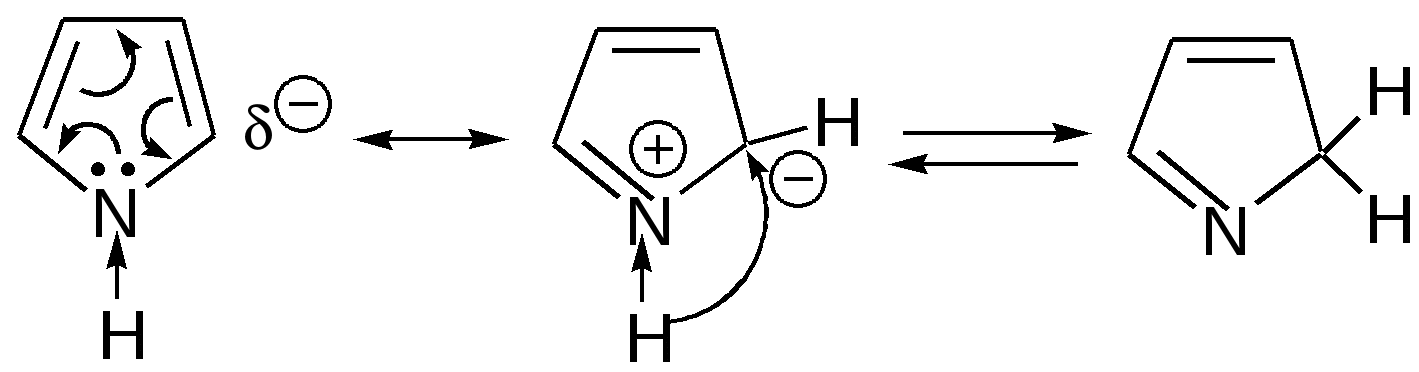 Основные способы получения 1. Сухой перегонкой аммонийной соли слизевой кислоты или действием аммиака на фуран в присутствии оксида алюминия: 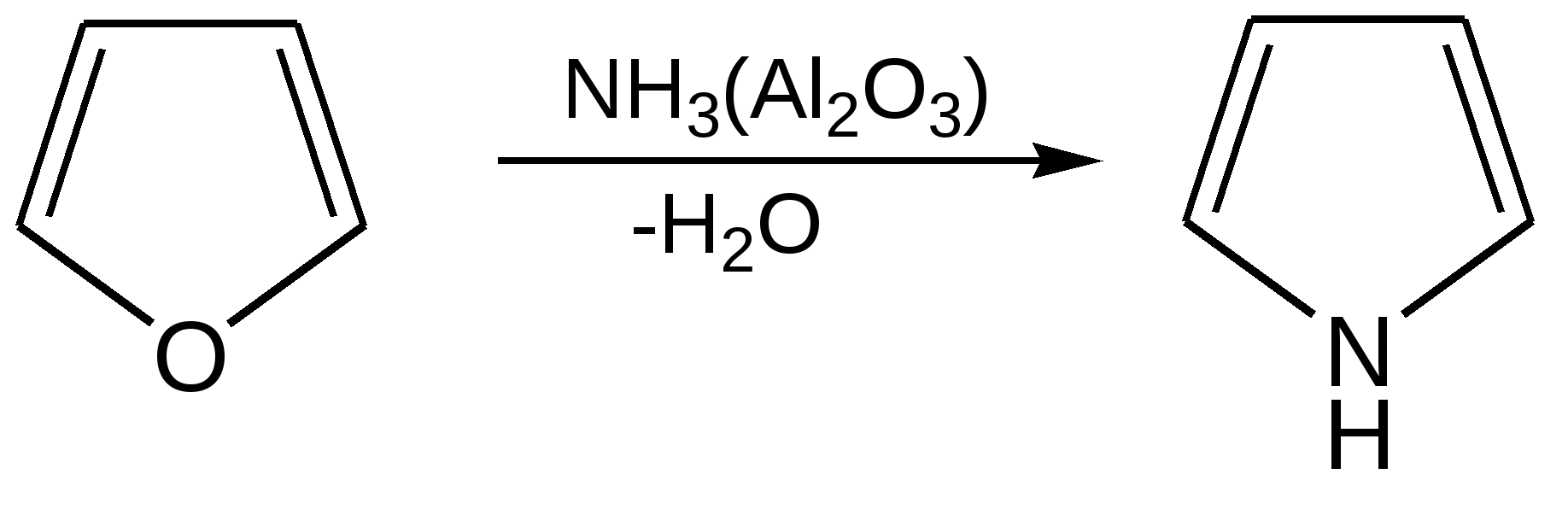 2. Из ацетилена: 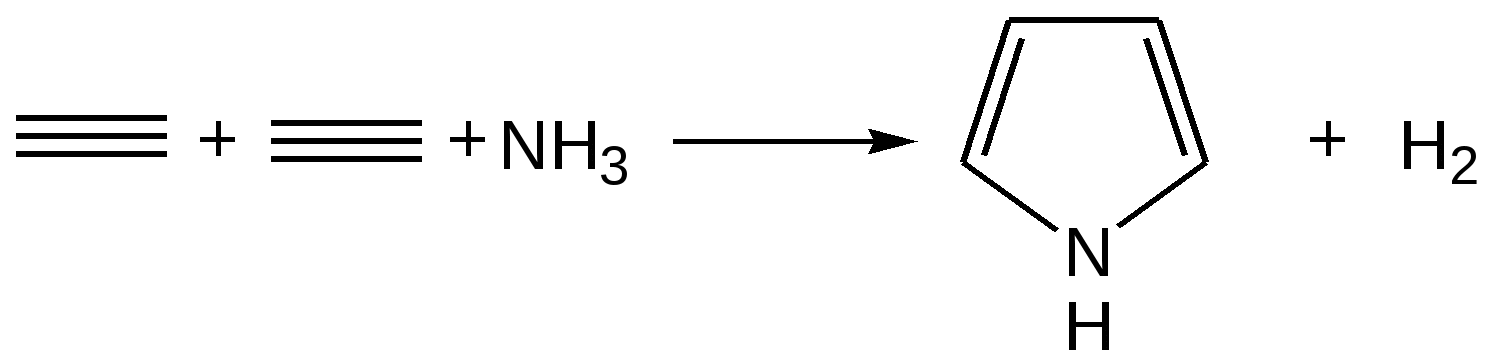 3. Получают при пропускании аммиака и паров бутиндиола-1,4 над катализатором при 300С: 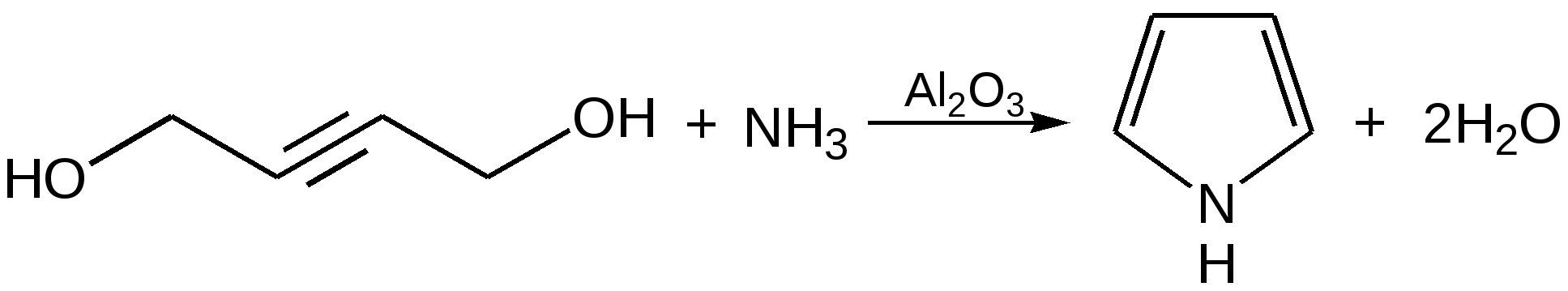 4. При перегонке сукцинимида с цинковой пылью: 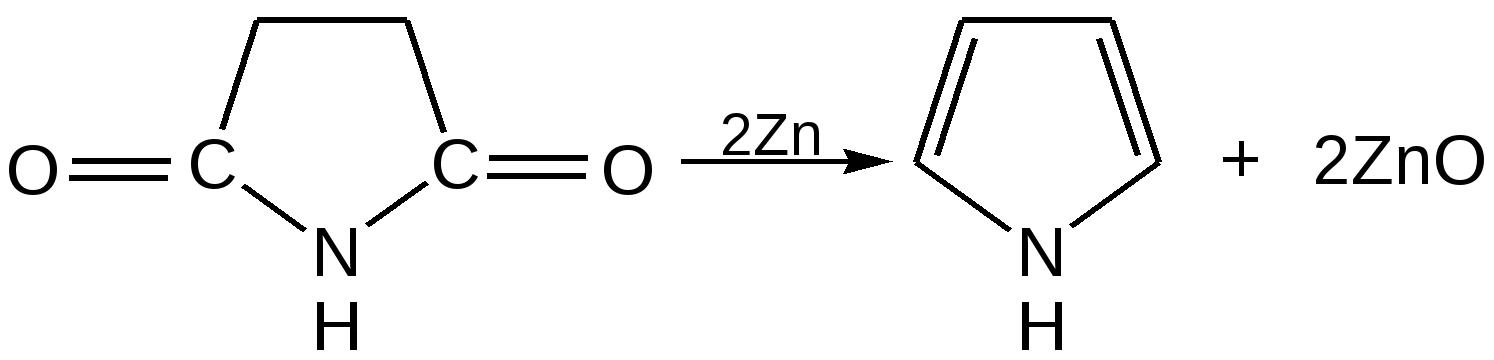 5. Восстановление смеси кетона с изонитрозокетона даёт гомологи или замещенные пирролы: 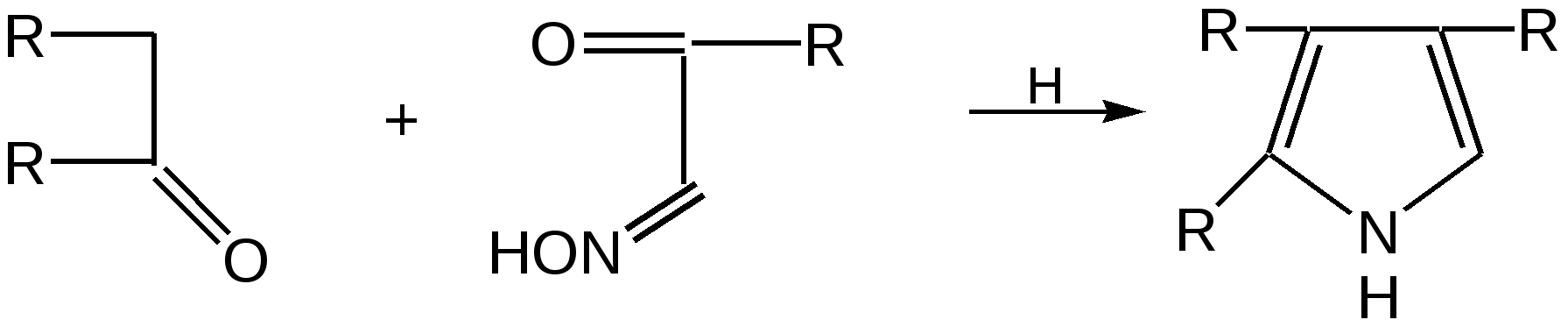 6. Взаимодейсвие фурана с аммиаком. Пропускание паров фурана с аммиаком над окисью алюминия при 400оС дает пиррол (Ю.К. Юрьев): 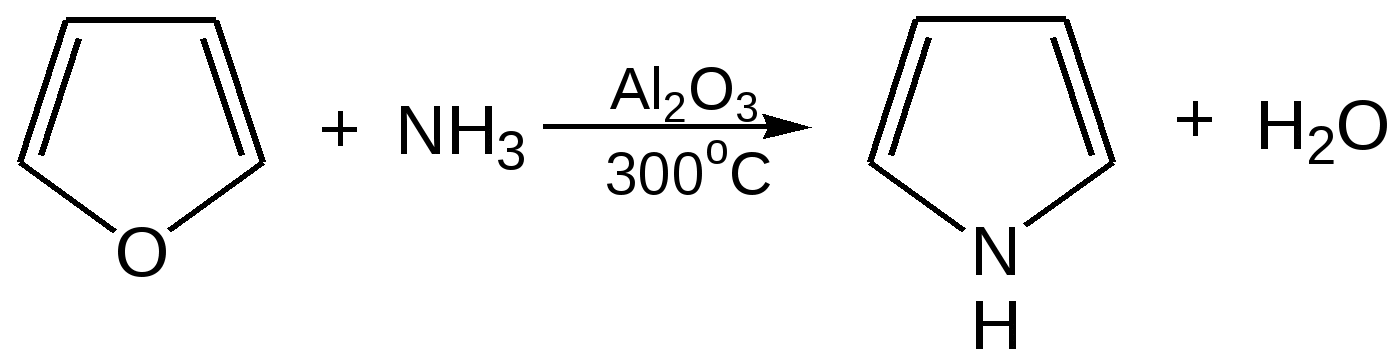 Химические свойства 1. Галогенирование. Осуществляется с помощью хлористого сульфурила, брома в спиртовом растворе и триодид-иона (йод в растворе иодида калия), причем в результате иодирования образуется тетраиодпиррол-иодол, являющийся хорошим антисептиком: 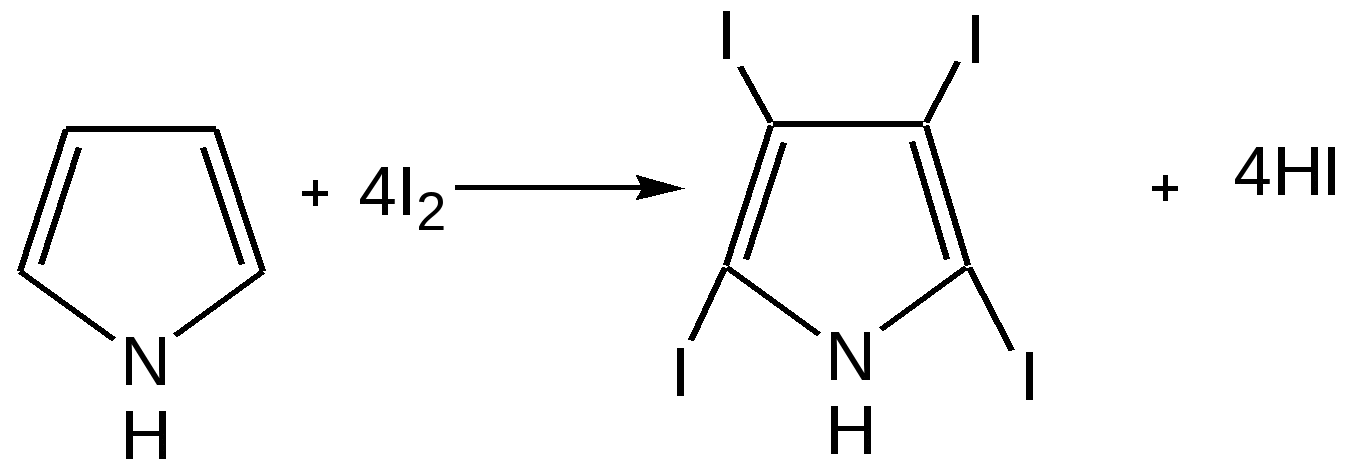 2. Сульфирование. Пиррол осмоляются при действии минеральных кислот (проявляют ацидофобные свойства), т.е. в кислой среде протон связывает неподеленную пару электронов кислорода или азота, образуется оксониевый или аммониевый ион, обладающий свойствами диена с сопряженными двойными связями, который легко полимеризуется и осмоляется: 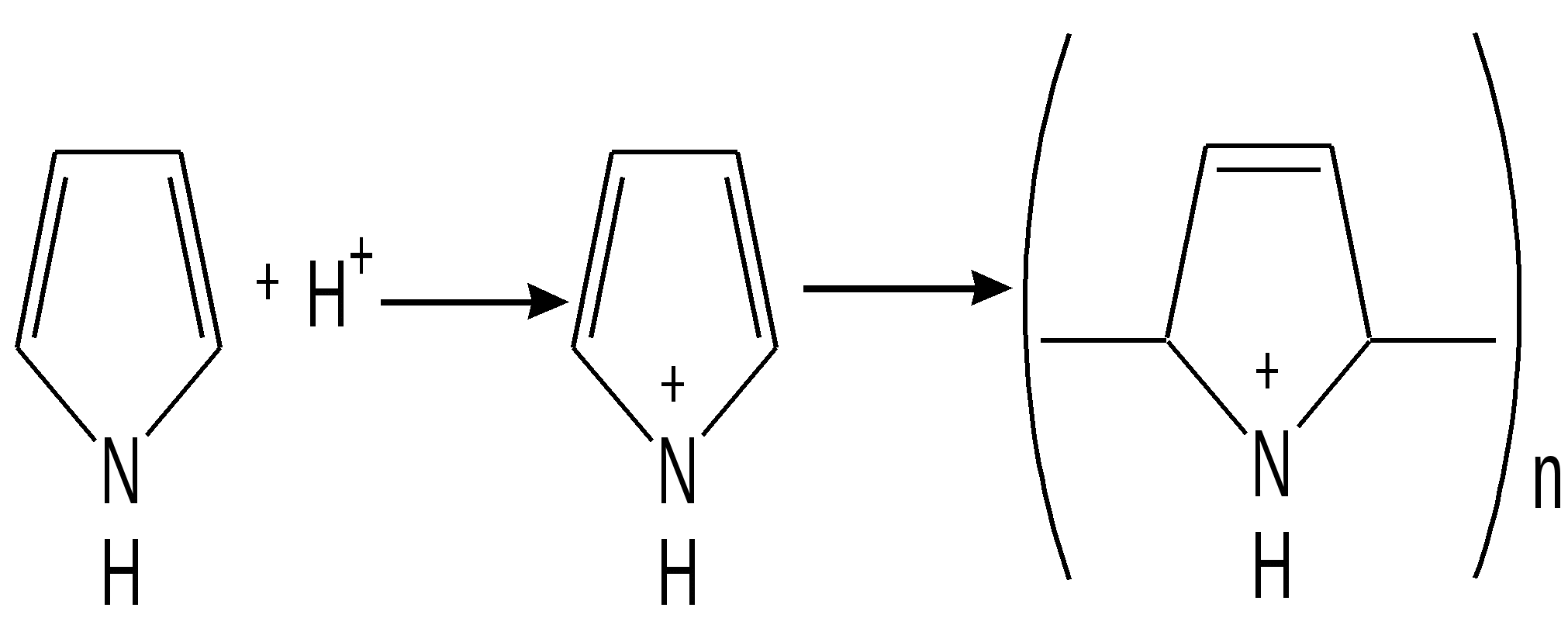 Поэтому сульфируют пиррол с помощью пиридинсульфотриоксида – комплекс пиридина с оксидом серы (VI) C6H5NSO3: 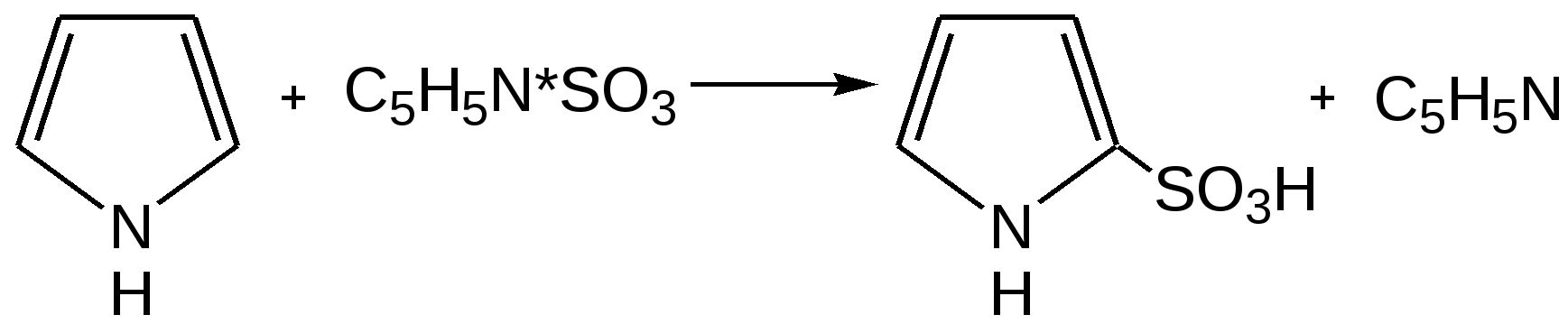 3. Реакция электрофильного замещения (механизм и ориентация замещения): 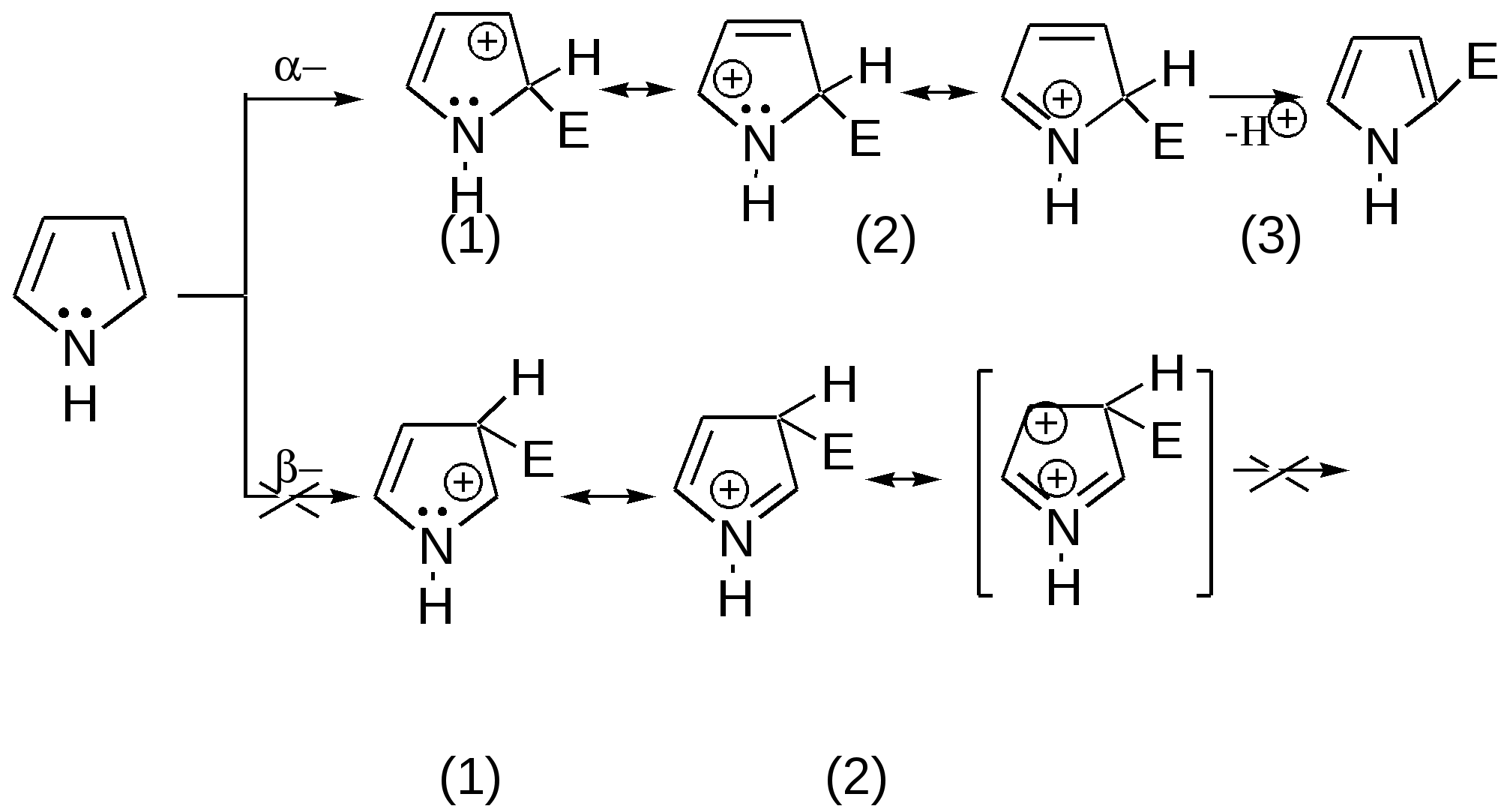 Пирролидин (тетрагидропиррол, тетраметиленимин) – бесцветная жидкость с резким аммиачным запахом, Ткип. = 86,6 °С. Он дымит на воздухе, хорошо растворим в воде и многих органических растворителях. Пирролидин является сильным основанием (рКа = 11,27), поэтому легко образует соли с сильными минеральными и органическими кислотами. Это соединение обладает всеми химическими свойствами вторичных аминов. Пирролидин возбуждающе действует на ЦНС, при длительном воздействии снижает уровень гемоглобина в крови, усиливает диурез. ПДКвозд 0,1 мг/м3. Кольцо пирролидина является структурным элементом многих биологически активных соединений, например никотина, алкалоидов группы тропана, алкалоида гигрина. В небольших количествах пирролидин содержится в листьях табака и опии. Тетрапирролы представляют собой соединения, структурными элементами которых являются четыре пиррольных кольца. Многие из этих соединений содержат в молекуле особую группировку их четырех пиррольных ядер, соединенных между собой с помощью четырех метиновых (=СН–) мостиков в 16-членное кольцо – ядро порфина. В молекуле порфина (и порфиринов) имеется непрерывное сопряжение -связей (многоконтурная сопряженная -система), при этом максимальное -электронное взаимодействие охватывает 16-членный (С12N4) цикл, в котором порядок связей С=С и С=N достигает 1,5, а в ряде случаев и превышает его. Таким образом, 16-членный макроцикл (порфина) является ароматическим с повышенной термической устойчивостью, способным к реакциям электрофильного замещения. Сам порфин, как таковой, в природе не встречается и получен лишь синтетически. Он представляет собой высокоплавкое кристаллическое вещество темно-красного цвета: 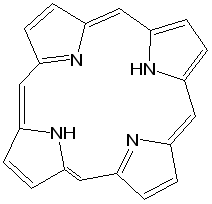 При замещении атомов водорода в -положении пиррольных колец порфина на радикалы образуются порфирины. Многие важные природные соединения являются металлическими производными порфиринов. Следует отметить, что атомы азота в ядре порфина и в порфиринах неравноценны – два из них являются пиррольными (имеют кислотный характер), а два – пирролиновыми (имеют основной характер). Такое строение является исключительно благоприятным для образования комплексов с металлами (для «хелатизации»), что существенно для проявления этими соединениями физиологической активности. Биологическое значение этих природных соединений определяется природой ионов металлов и заместителями в ядре порфина. Если комплекс образован с помощью иона железа (Fe3+), то при определенных заместителях в порфине мы получаем гемин – красное вещество крови (основная часть гемоглобина). 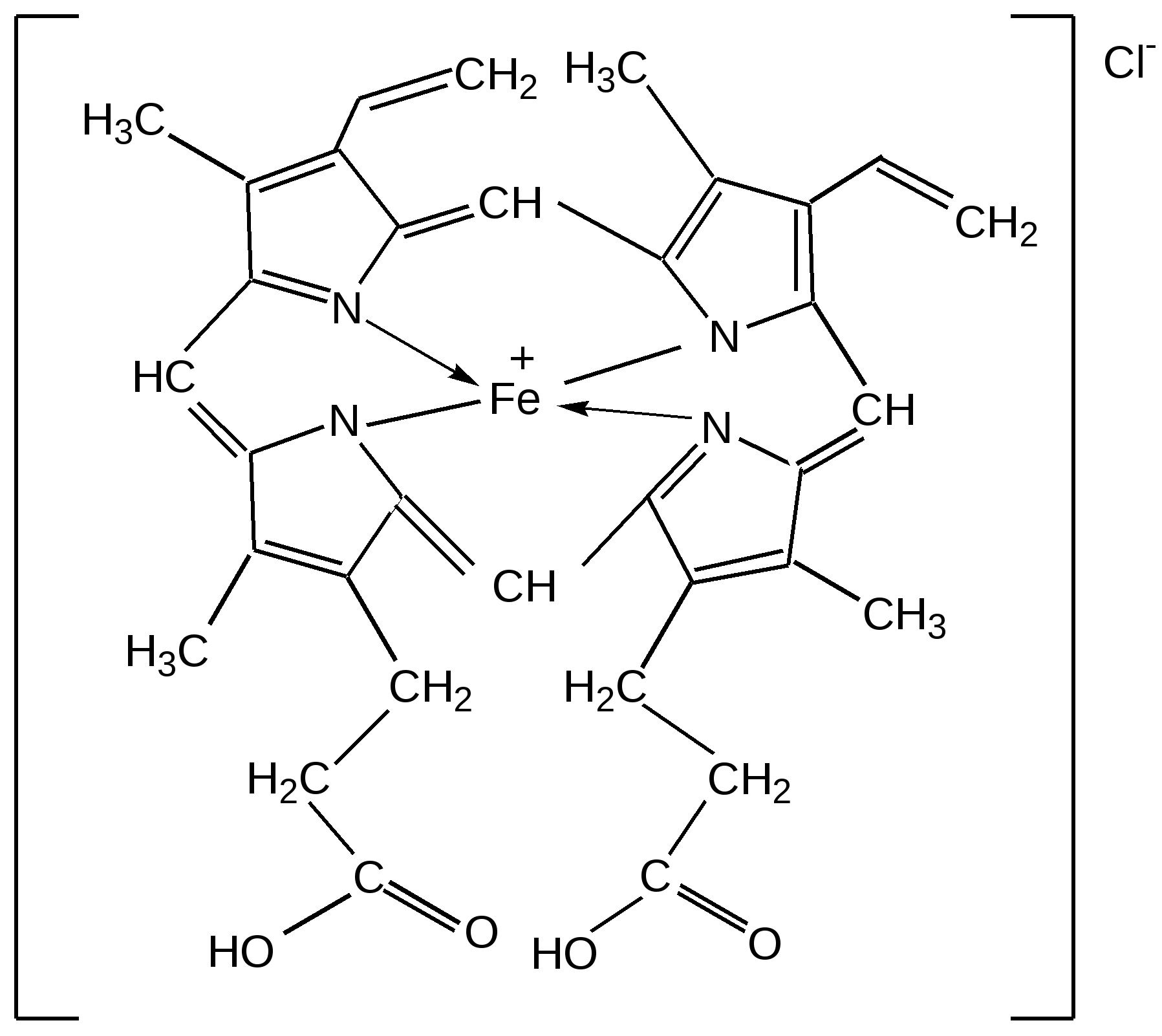 Порфин является устойчивой ароматической системой. Величина энергии сопряжения порфина (840 кДж/моль) также свидетельствует о его высокой стабильности. Применение пиррола и его производных Пиррол содержится в каменноугольной смоле. Цикл пиррола – структурный фрагмент природных пигментов (например, гема, хлорофиллов, желчи, витамина В12, некоторых антибиотиков), а также некоторых светостойких фталоцианиновых красителей. Пиррол умеренно токсичен; его пары вызывают стойкое и упорное повышение температуры тела, ЛД50 74 мг/кг (кролики, перорально). Пиррол используют для синтеза пирролидина и некоторых лекарственных средств. Он впервые был открыт Ф. Ф. Рунге в 1834 г. в каменноугольной смоле, в чистом виде получен Т. Андерсоном в 1858 г. при сухой перегонке рогов и копыт. Кольцо пиррольно структурного фрагмента содержит биологически активных соединения, например никотин, алкалоиды группы тропана (атропина, кокаина, экгонина и другие), алкалоида гигрина, в небольших количествахвах пиррол содержится в листьях табака и в опии. Важнейшие производные пирролидина – пролин, 2-пирролидо, 1-винил-2-пирролидон, сукцинимид. Пирролидин возбуждает центральную нервную систему, снижает (при длительном воздействии) содержание гемоглобина в крови, усиливает диурез ЛД50 0,3 г/кг (белые крысы, перорально), ПДК 0,1 мг/м. Пирролидин и его производные – сырье для синтеза некоторых лекарственных средств. Пирролизиновые алкалоиды, содержат в молекуле остаток пирролизидина. Обнаружены в 14 семействах, а также в животных организмах. Наиболее богаты этими алкалоидами растения родов бузутьник (Ligulana) и крестовник (Senecio) семейства сложноцветных, чернокорень (Cynoglossum), гелиотроп (Heliotropium) и трахелантус (Trachelanthus) семейства бурачниковых, кротолярия (Crotolana) семейства бобовых включает около 250 представителей. Пирролизиновые алкалоиды обладают широким спектром биологической активности. Попадание в пищу растений, содержащих пирролизиновые алкалоиды, может вызвать массовые отравления людей и животных. Ряд пирролизиновые алкалоиды гепатотоксичны, оказывают канцерогенное действие, некоторые проявляют противоопухолевую активность (триходесмин, N-оксидиндицина), обнаруживают гипотензивные свойства. Есть пирролизиновые алкалоиды применяемые в медицине. Наибольшее, значение среди них имеют платифиллин и саррацин, содержащиеся в растениях рода крестовник (Senecio). Гемоглобин Строение и функции гемоглобина. Гемоглобин вляется переносчиком кислорода от легких к тканям тела, представляет собою белок глобин, координационно связанный с гемом (гем – порфирин, содержащий в центре молекулы атом двухвалентного железа – Fe2+). Таким образом, гемин отличается от гема наличием трехвалентного железа (Fe3+) и аниона хлора (Cl–).  Хлорофилл, его физиологическая функция. Зеленые пигменты растений – хлорофиллы являются магнийпроизводными порфирина, в их молекуле атомы азота связаны с магнием, при этом имеются другие заместители в ядре порфирина, например, хлорофилл – сложный эфир фитола – высокомолекулярного спирта, обладающего полиизопреноидным скелетом. 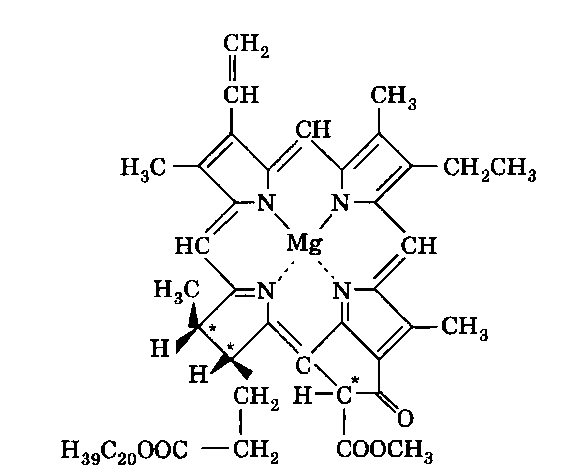 Хлорофиллу принадлежит выдающаяся роль в фотосинтезе – усвоении углекислого газа зелеными растениями за счет световой энергии с образованием органического вещества. Значительно более сложная порфириновая структура, включающая в себя ион кобальта и соединенная с гетероциклическим соединением – замещенным бензимидазолом, лежит в основе витамина В12, который участвует в работе кроветворных органов (костный мозг), а также применяется для лечения ряда заболеваний. Известны также ферментные системы, в составе которых в качестве проететической группы участвуют так называемые В12-коферменты, или кобамидные коферменты. Порфириновые структуры играют огромную роль в окислительно-восстановительных реакциях в живых организмах, входят в состав ферментов каталазы, пероксидазы и цитохромов, участвующих в переносе электронов при окислительных процессах в клетках. Порфириновые структуры не исчерпывают всего многообразия природных соединений, в состав которых входят производные пиррола. |
