Программа блока гетерофункциональные углеводороды
 Скачать 6.9 Mb. Скачать 6.9 Mb.
|
|
Индол. Одним из важнейших бензопроизводных пятичленных гетероциклов с одним гетероатомом является бензопиррол, или индол. Он сам и его производные являются биологически важными природными соединениями. Свое название индол получил в связи с тем, что впервые был получен из природного синего красителя индиго. Он найден также в каменноугольной смоле, образуется при гниении белков. Содержится в цветах жасмина, белой акации и апельсина. Способы получения индола 1. Реакция А.Е.Чичибабина пропускание смеси анилина и ацетилена через нагретые трубы при 700 С: 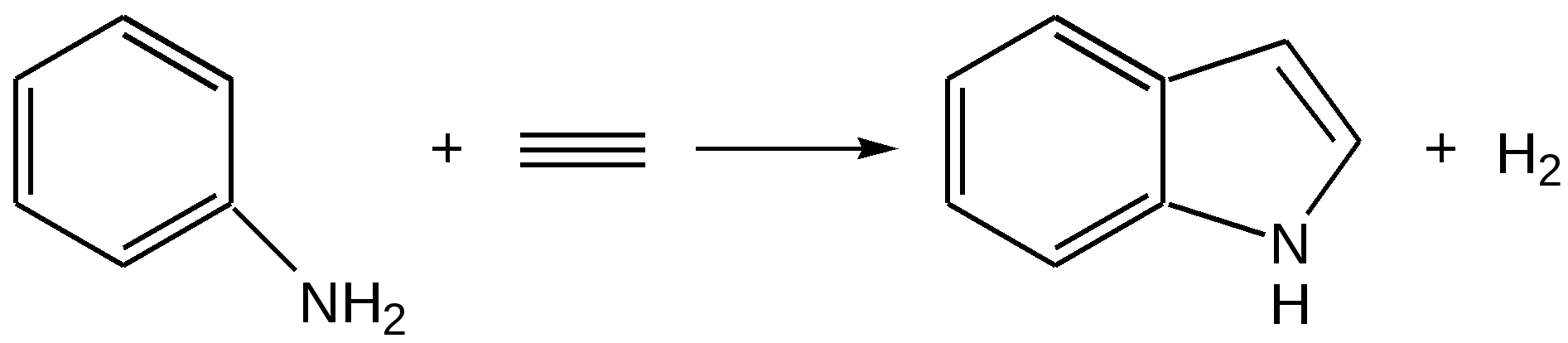 2.Реакция Э.Фишера нагревание фенилгидразонов с хлоридом цинка, серной или фосфорной кислотами: 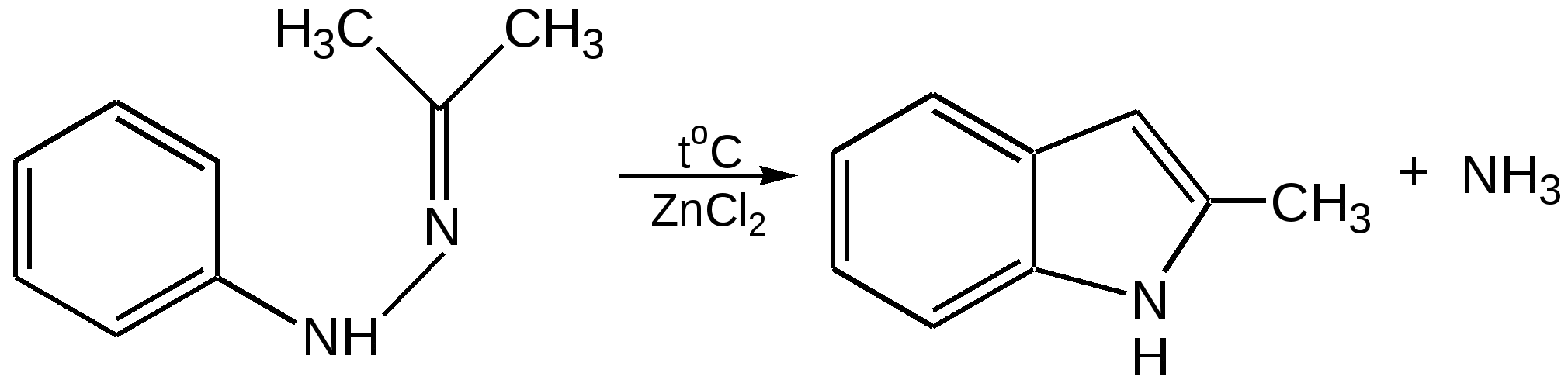 Химические свойства Реакции индола и его простых производных сходны с реакциями пиррола. 1. Индол обладает слабоосновными свойствами и в то же время слабокислыми, образует металлические производные – индол-калий, индол-натрий: 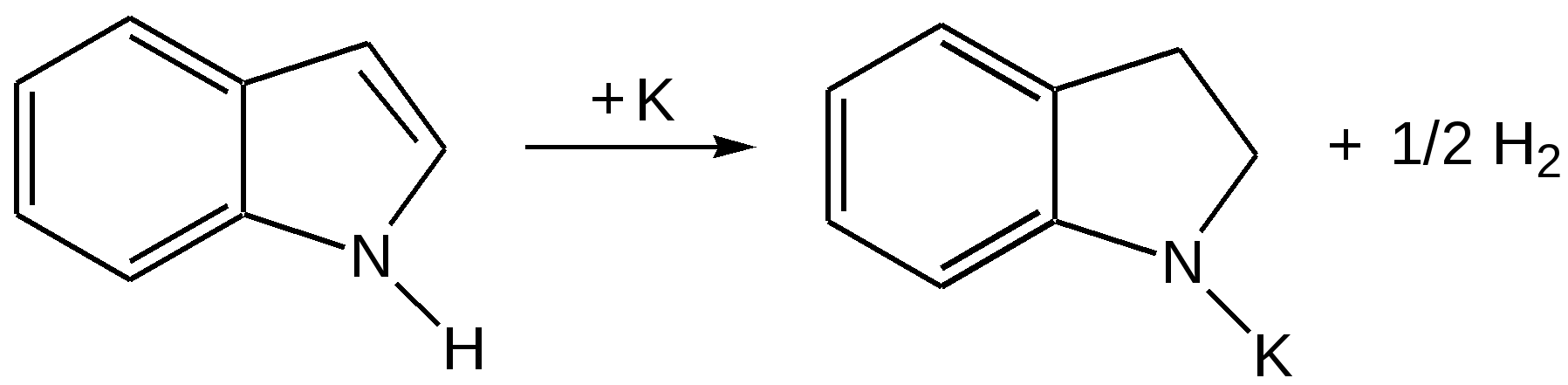 Следует отметить, что кислотные свойства у индола выше, чем у пиррола. Это объясняется влиянием бензольного кольца, являющегося как бы акцептором электронов -электронной системы гетероцикла. Благодаря этому электроны связи NH в большей мере смещаются в сторону азота, что способствует большей протонизации (подвижности) водорода. 2. Реакция электрофильного замещения индола. Реакция преимущественно протекает по 3 положению (-положение), если оно занято, то заместитель направляется в положение 2 (-положение). И только при сульфировании образуется 2-индолсульфокислота: 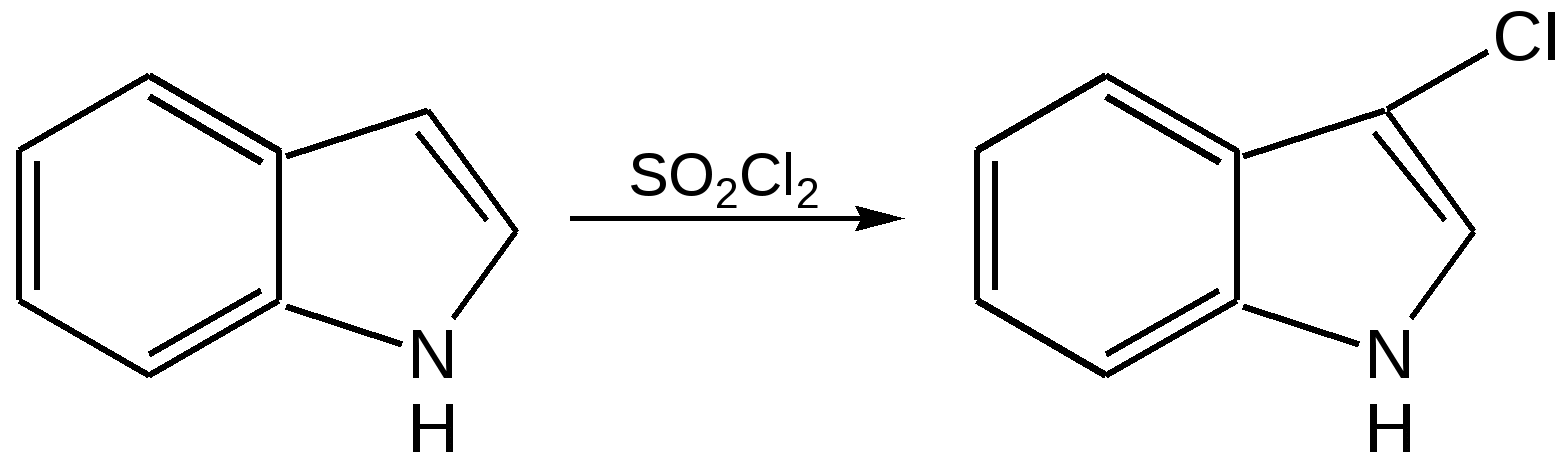 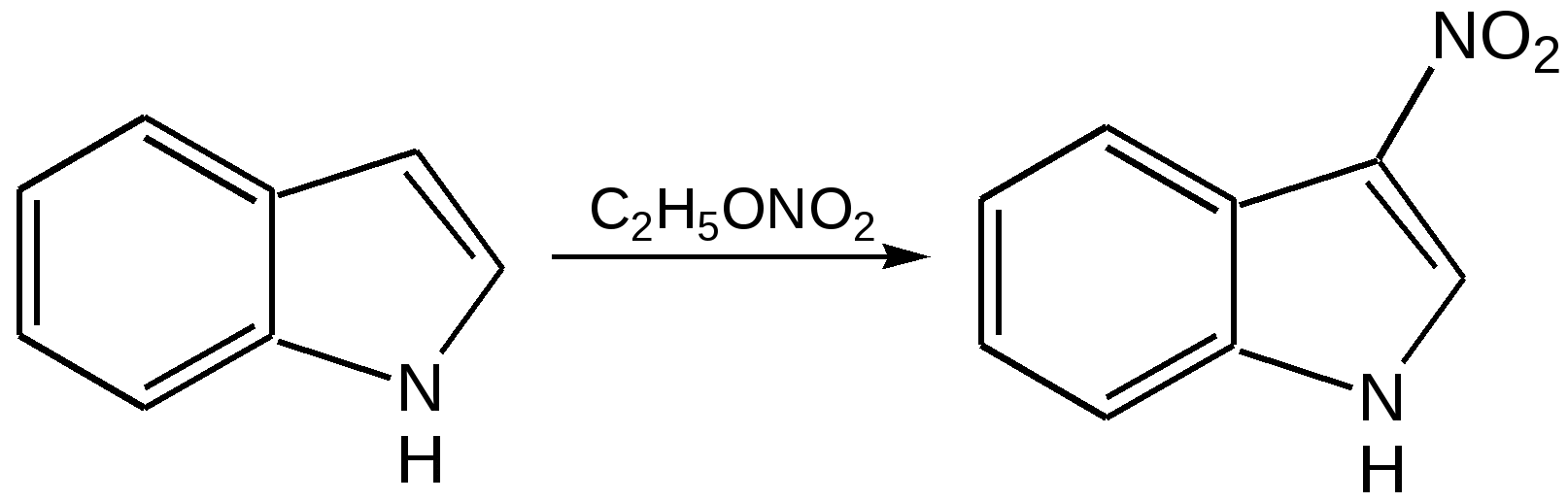 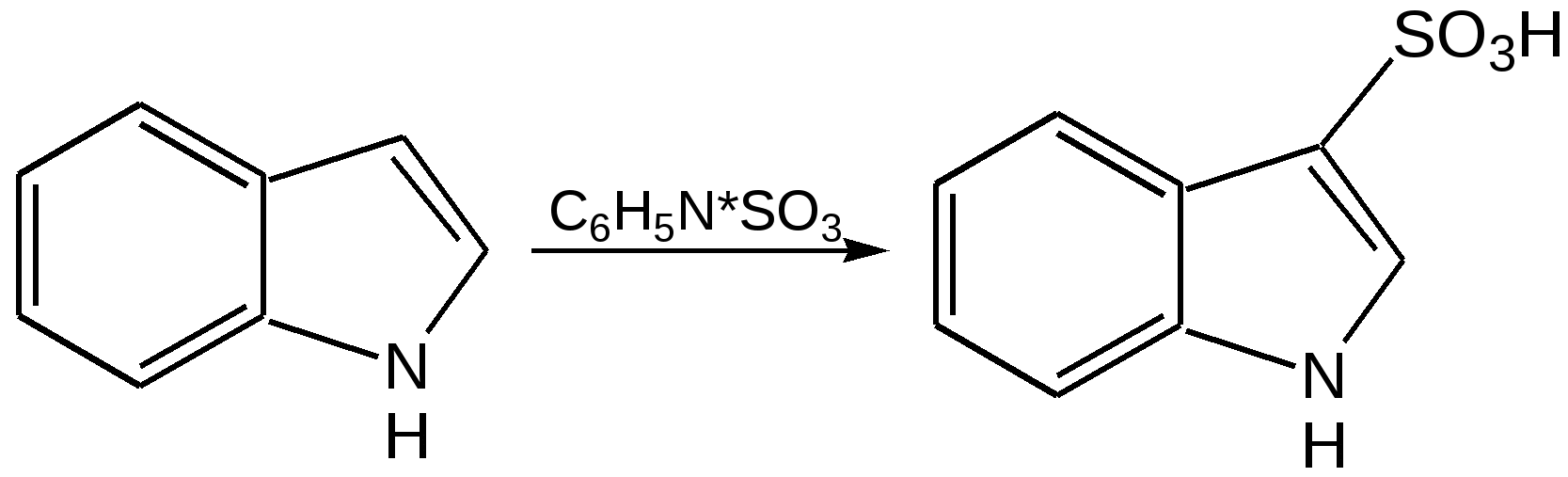 2. Получение N-магнийорганических соединений индола, из которых затем образуются -замещенные индола, в отличие от -производных пиррола. 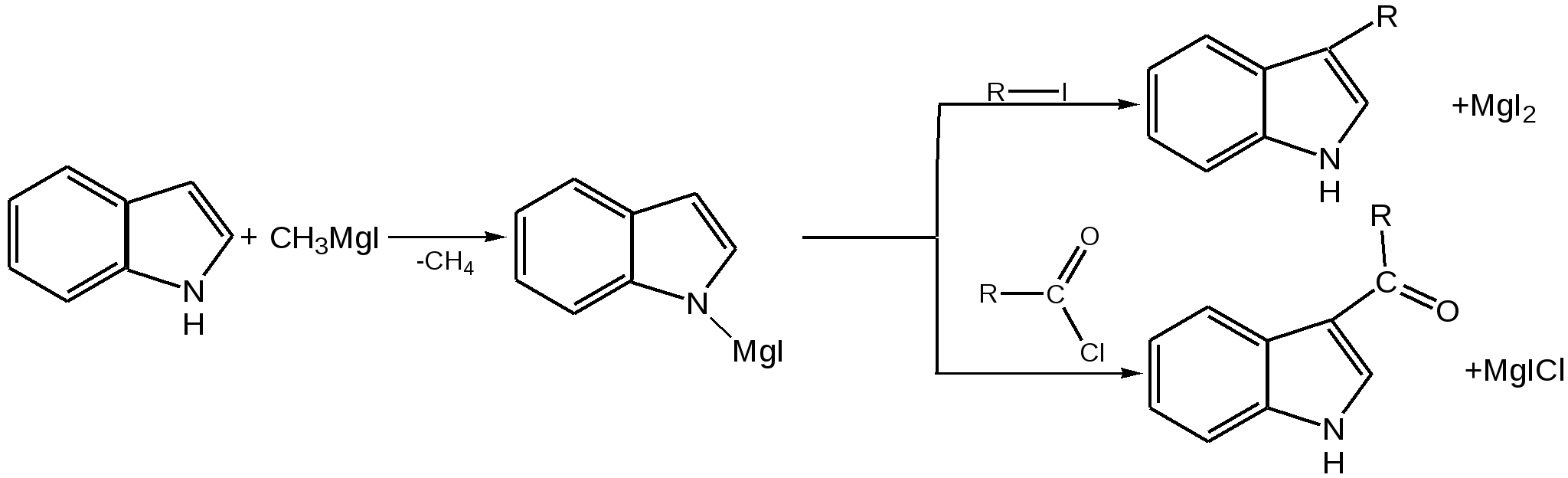 Используя N-магнийиндол, можно синтезировать 3-индолилуксусную кислоту (гетероауксин), которая стимулирует рост корней растений – гормон роста: 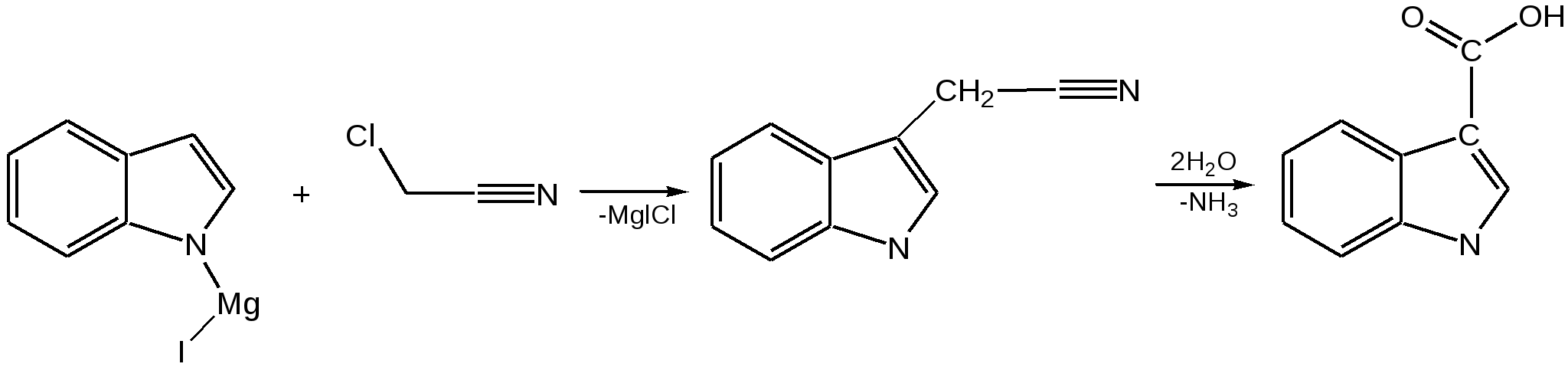 Производные индола Гетероауксин или 3-индолилуксусная кислота получают используя N-магнийиндол. Он стимулирует рост корней растений и является гормоном роста: 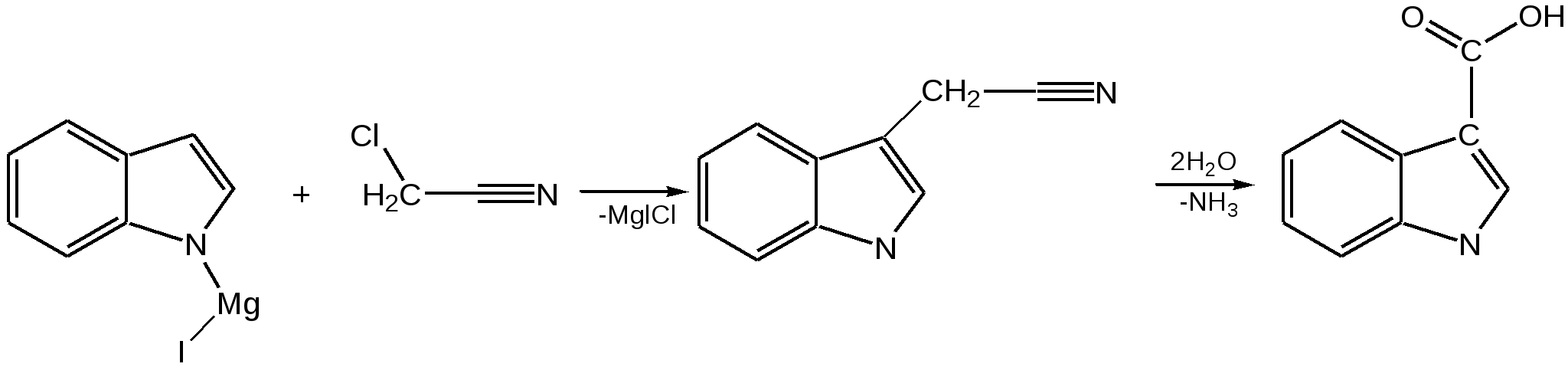 Триптофан. Триптофан[2-амино-3-(3'-индолил)-пропионовая кислота] — бесцветное кристаллическое вещество, Тш =283–285 °С, растворим в воде, плохо растворим в этаноле и не растворим в диэтиловом эфире. Триптофан является незаменимой аминокислотой, входящей в состав большинства белков животного и растительного происхождения. Наибольшее его количество содержится в фибриногене и в глобулинах крови. Из триптофана в организме животных образуются два родственных по химическому строению биологически активных вещества – мелатонин и серотонин. В результате биохимического декарбоксилирования (при гниении белков) образуются триптамин и -метилиндол (скатол). Скатол обладает отвратительным запахом, напоминающим запах фекалий. 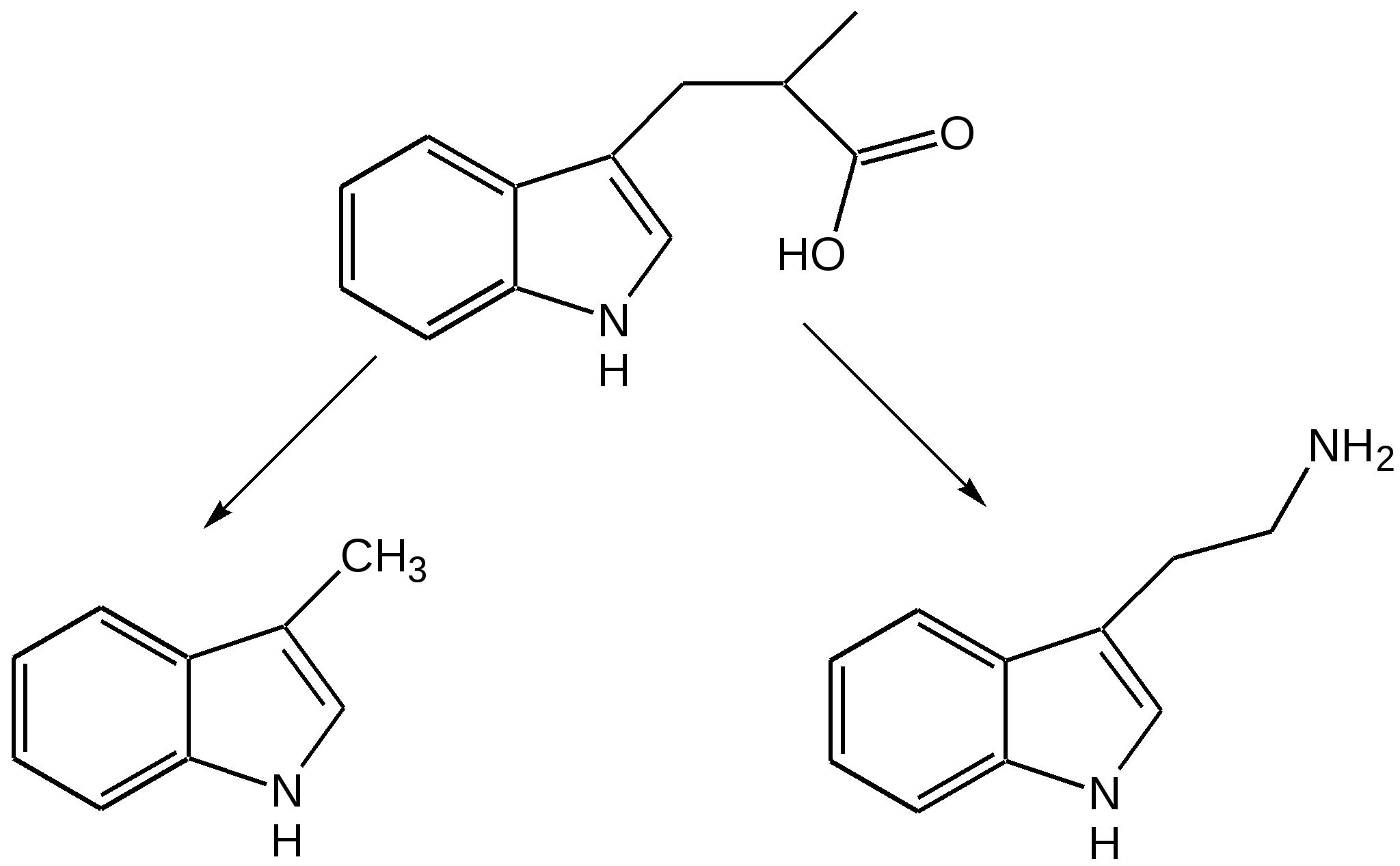 Окислением оксипроизводного индола – индоксила образуется индиго – прочный краситель синего цвета, известный с глубокой древности. Индоксил существует в виде двух таутомерных форм (оксо-окси таутомерия и кето-енольная таутомерия):  Индиго (индиготин) – прочное вещество, плавится с разложением только при 390 С, почти нерастворимое в обычных растворителях, в кислотах и щелочах. Перед применением индиго в крашении его восстанавливают в щелочных растворах в диенол – белое индиго: 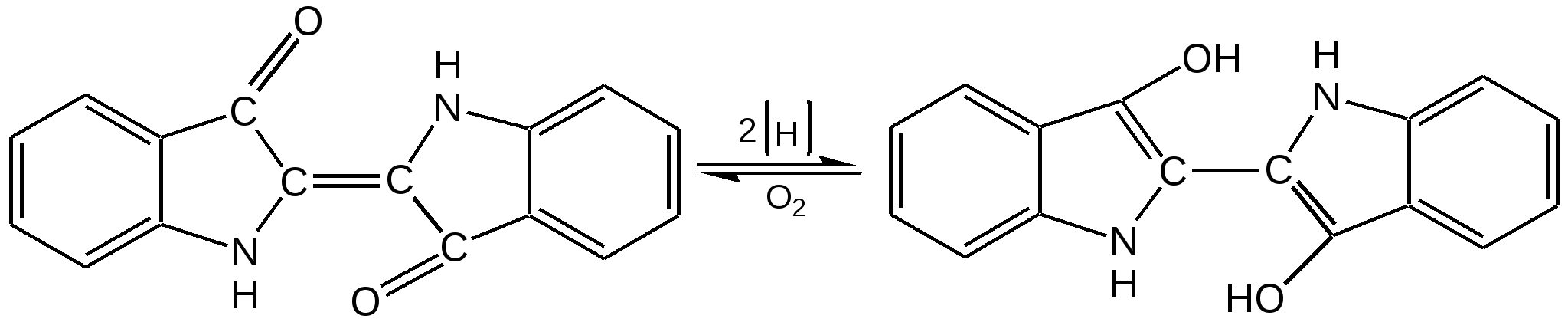 Белое индиго благодаря наличию двух енольных гидроксилов хорошо растворимо в щелочах. Окрашиваемую ткань погружают в бак (куб) со щелочным раствором белого индиго, а затем вынимают: кислород воздуха окисляет белое индиго в синее, которое прочно удерживается на волокне. Такой метод крашения получил название кубового. Производные индола растительного происхождения входят в состав биологически активных веществ – алкалоидов. К ним относятся: серотонин, грамин, кокаин, резерпин, бруцин, стрихнин и др. Серотонин играет большую роль в процессах психической деятельности человека как медиатор. Серотонин и грамин: 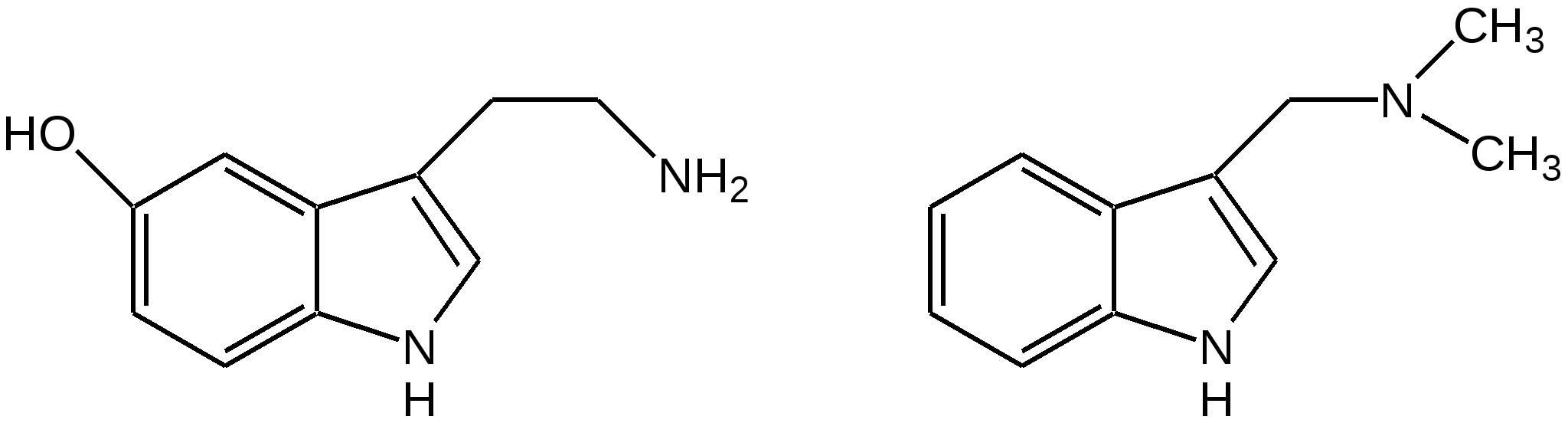 При значительном изменении концентрации серотонина в мозге у людей наблюдается психические расстройства (например, шизофрения). 4.2 ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ С НЕСКОЛЬКИМИ ГЕТЕРОАТОМАМИ Среди гетероциклических соединений наиболее многочисленна и разнообразна группа пятичленных гетероциклов, содержащих более одного гетероатома. Большинство этих циклических систем можно формально получить из фурана, пиррола и тиофена заменой одной или более групп — СН на гетероатом азота. Возможность варьирования числа и расположения атомов азота в кольце приводит к структурному многообразию гетероциклов. Имидазол – более сильное основание, чем пиразол, что проявляется в образовании межмолекулярных водородных связей, а, следовательно, и в более высокой температуре его кипения по сравнению с пиразолом: 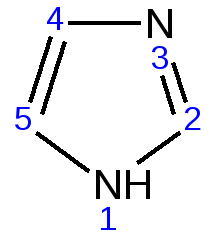 Оба атома азота в имидазоле (как и в пиразоле), эквивалентны и атом водорода легко мигрирует между ними. Имидазол образует соли как с сильными кислотами, так и со щелочными и щелочноземельными металлами. Водородные связи имидазола: 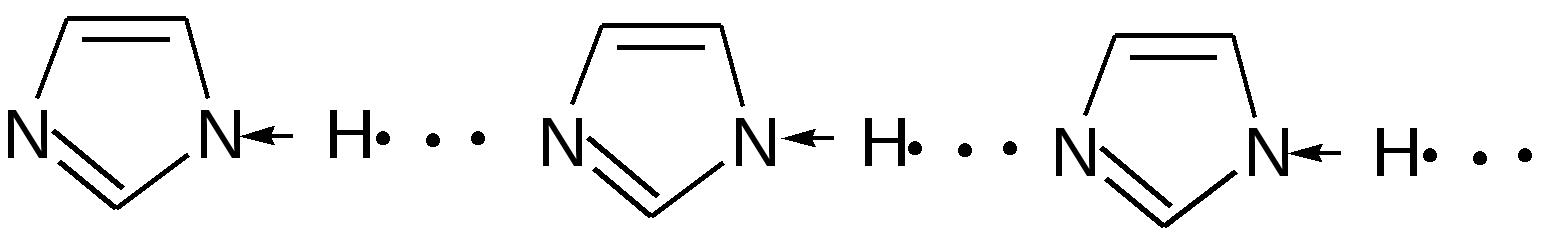 Ароматическая -электронная система имидазола (как и пиразола), образована за счет трех электронов атомов углерода и трех электронов атомов азота. Однако следует отметить, что в 6 -электронном сопряжении атомы азота участвуют неодинаково: один из атомов азота отдает в -электронную систему электрон (пиридиновый азот), а другой атом азота – два электрона (пиррольный азот). Реакции электрофильного замещения в ряду имидазола могут протекать либо по атомам азота (алкилирование и ацилирование), либо по атомам углерода в положения 4 и 5 по месту наибольшей электронной плотности: нитрование, сульфирование, галогенирование. Механизм и ориентация реакции электрофильного замещения: 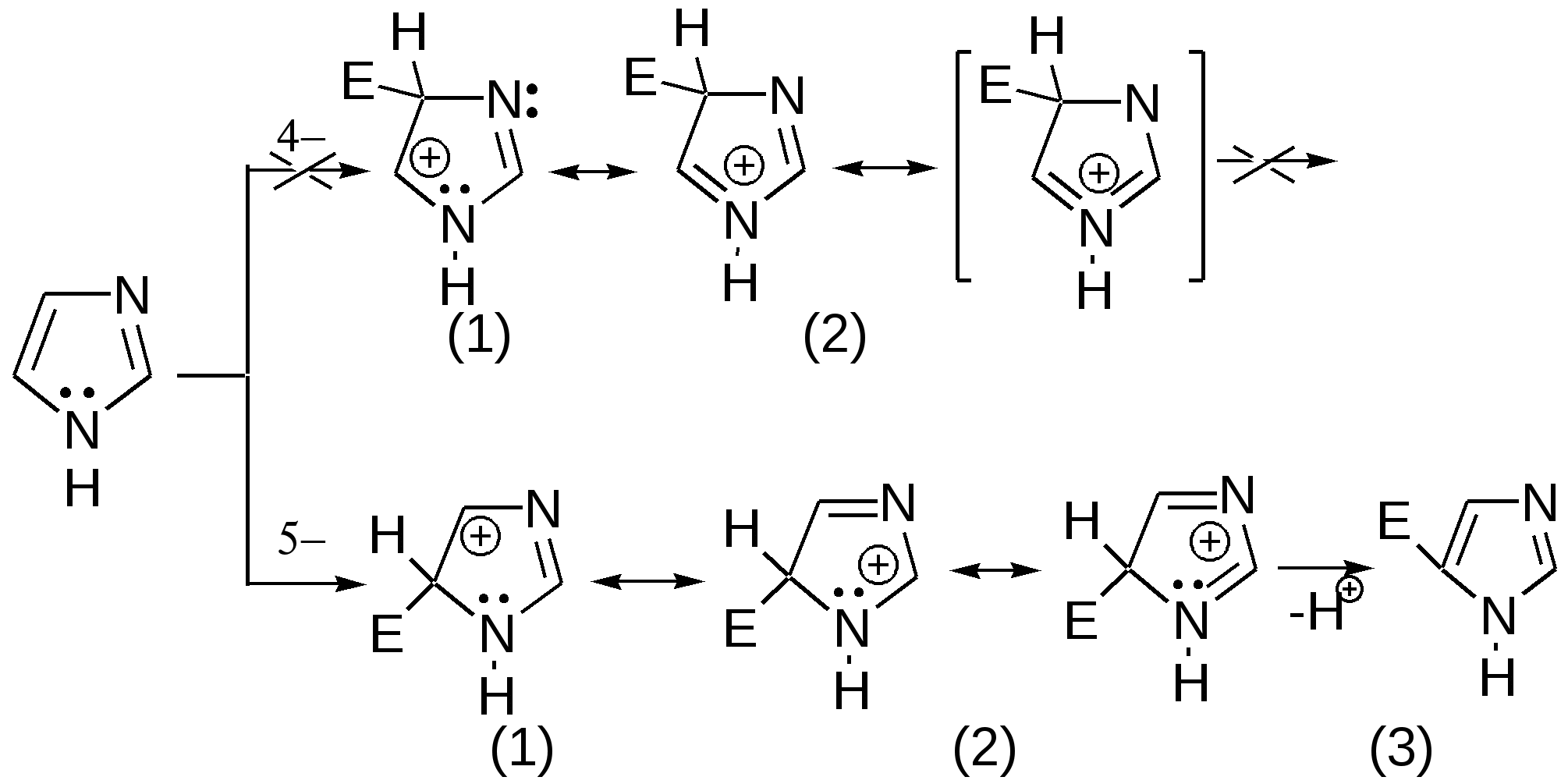 Замещенный 4,5-диметилимидазол не вступает в реакцию нитрования: 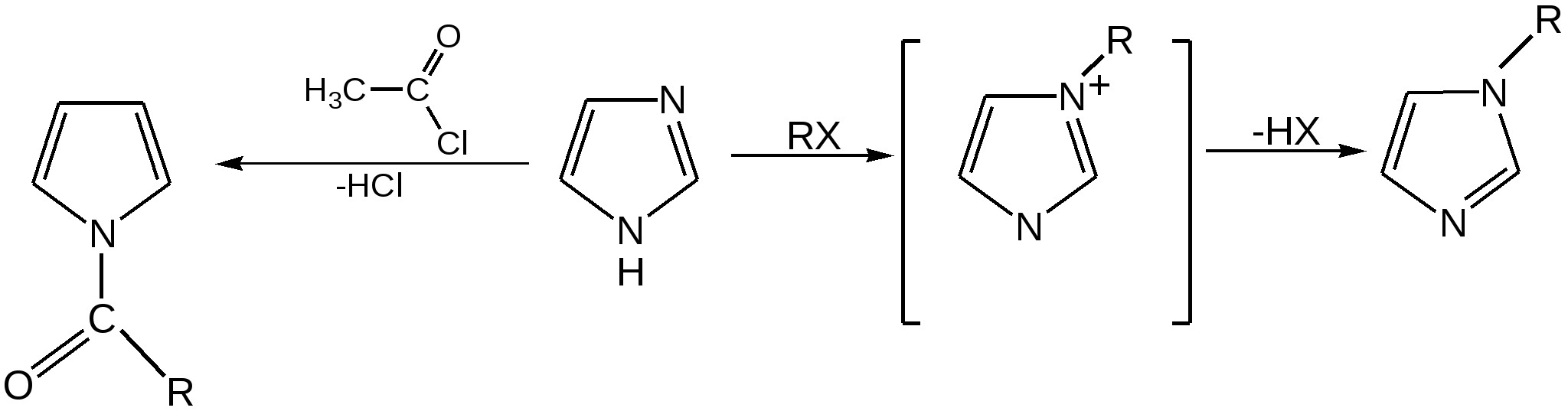 Ацилирование имидазола имеет большое биологическое значение: с помощью N-ацилимидазолов осуществляются реакции ферментативного переацилирования. Пиразол. Введение второго атома азота в пиррол сильно стабилизирует молекулу, понижая электронную плотность в цикле, поэтому пиразол вступает в реакции электрофильного замещения намного труднее, чем пиррол: 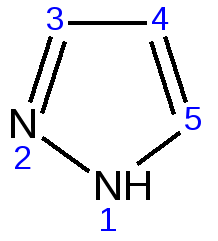 Ароматическая природа пиразола связана с наличием сопряженной 6 -электронной системы, в которую входят три электрона от атомов углерода и три электрона от атомов азота и имеют равную принадлежность протона каждому из этих атомов. Расположенные рядом два атома азота в силу своей электро-отрицательности являются источником сильного –I эффекта. Соседние с атомами азота углеродные атомы вследствие этого несут некоторый избыток положительного заряда. Поэтому реакции электрофильного замещения в пиразоле идут в положении 4, как наиболее удаленном от атомов азота: 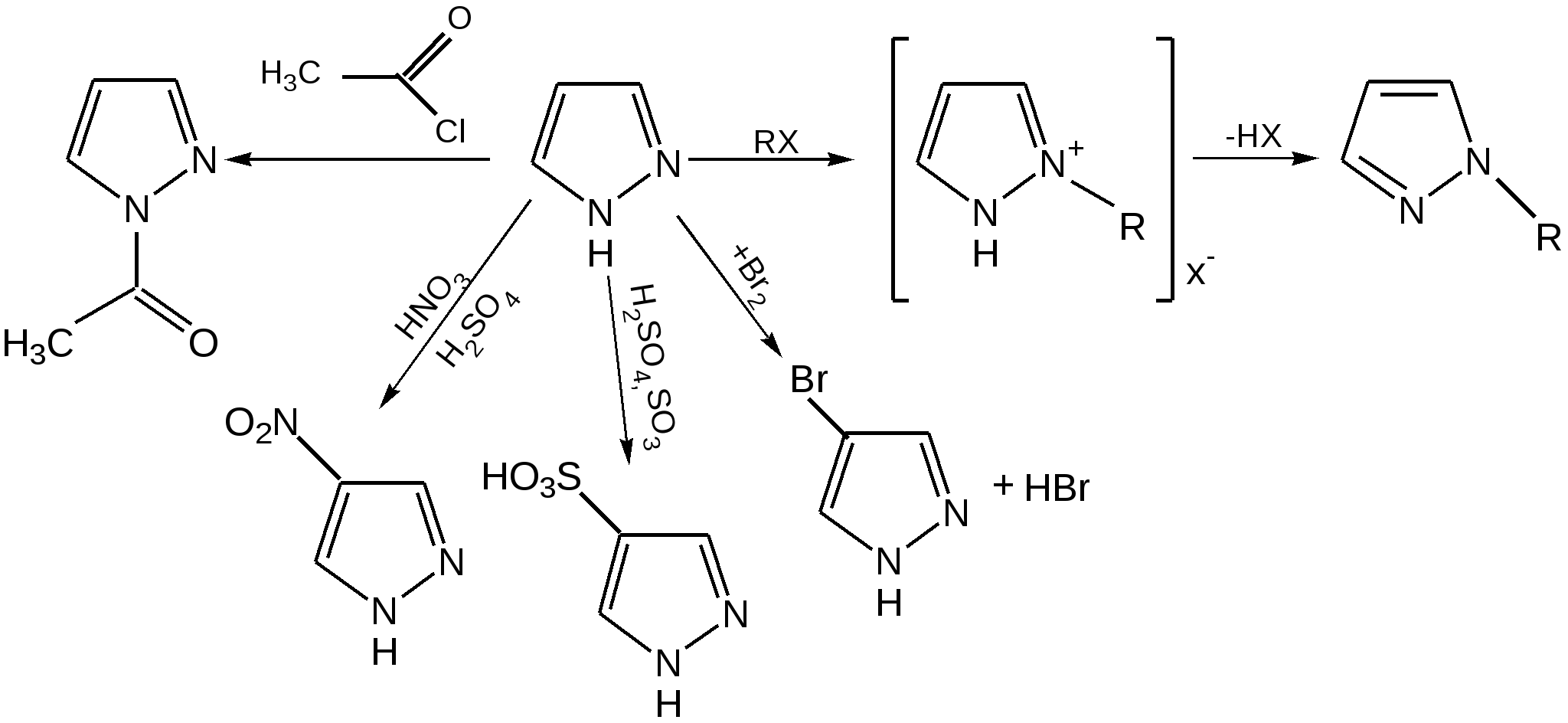 Пиразол является слабым основанием и слабой кислотой. Атом водорода при азоте довольно легко замещается на щелочные металлы, магний, серебро. Ряд производных пиразола применяются как лекарственные препараты, красители, люминесцентные вещества и др. Среди фармацевтических препаратов это - антипирин, пирамидон, анальгин: 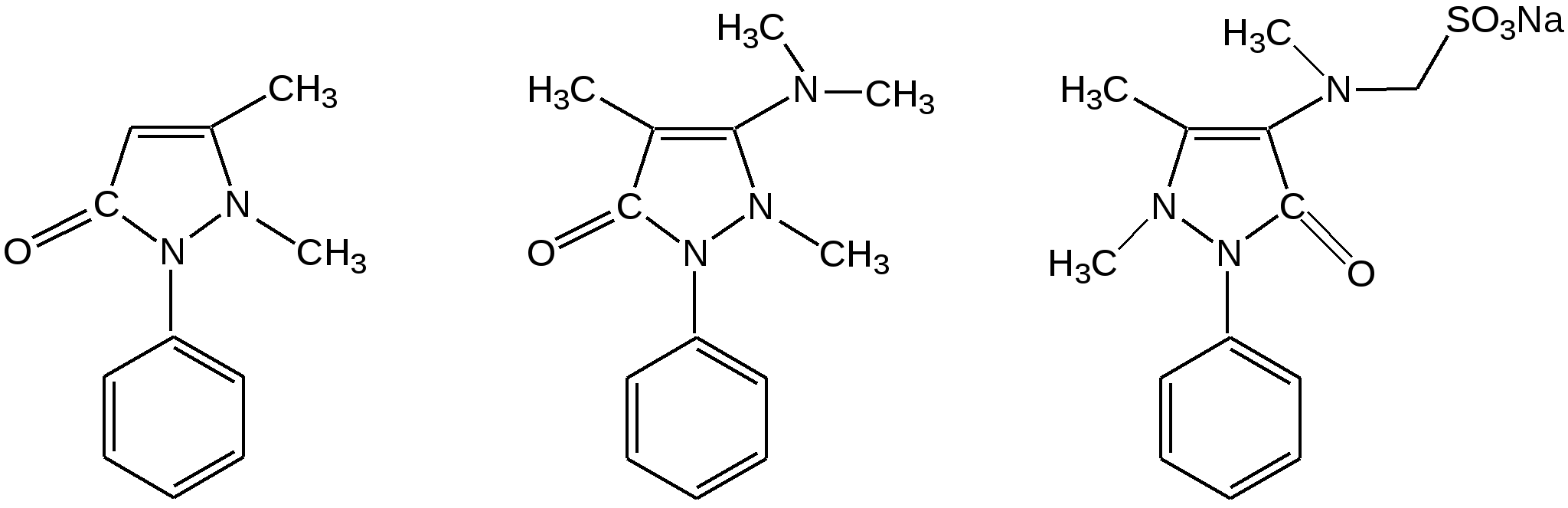 Оксазол Электронное строение. Ароматические свойства оксазола связаны с наличием циклической сопряженной π-электронной системы, построенной из двух π-электронов связи С=С, двух π-электронов связи N=C и неподеленной пары π-электронов атома кислорода. Избыток положительного заряда на атоме кислорода объясняется тем, что кислород отдает НЭП в кольцевую систему электронов оксазола; положительный заряд на атоме С2 вызывается I-эффектом находящихся рядом электроотрицательных атомов азота и кислорода, причем преимущество в этом отношении одного из последних трудно определить. Наличие избытка отрицательного заряда на атоме азота связано с наличием НЭП, относительно свободной от влияния кольцевого сопряжения. Почти нейтральный заряд на С4 можно объяснить индуктивным действием соседнего атома азота; небольшой избыток электронной плотности на С5 вызывается действием нескольких факторов. Присутствие рядом электроотрицательного атома кислорода индуктивно вызывает появление положительного заряда на С5, но это влияние кислорода ослаблено вследствие его участия в кольцевом сопряжении; с другой стороны, атом С5 испытывает на себе сильный М-эффект, возникающий благодаря мета-ориентирующему влиянию атома азота. На М-эффект в оксазольном цикле накладывается сильный I-эффект атомов кислорода и азота. Только суммируя действие этих двух эффектов на каждый из атомов кольца, можно говорить о приблизительном распределении электронной плотности в оксазоле. Химические свойства. Оксазолы являются очень слабыми основаниями. По-видимому, замена атома азота на атом кислорода в кольце увеличивает индуктивный эффект, локализующий НЭП атома N и тем самым уменьшающий основность оксазола. Соли оксазола обычно устойчивы только в кислой среде. Наличие азота пиридинового типа придает некоторую устойчивость оксазолу при кислотном гидролизе (ароматичность кольца сохраняется), но возможность образования оксониевого соединения, наоборот, снижает эту устойчивость, так как при этом нарушается ароматичность кольца. Один из механизмов кислотного гидролиза оксазолов предполагает присоединение протона по атому азота с последующей атакой нуклеофила по С2 или С5: 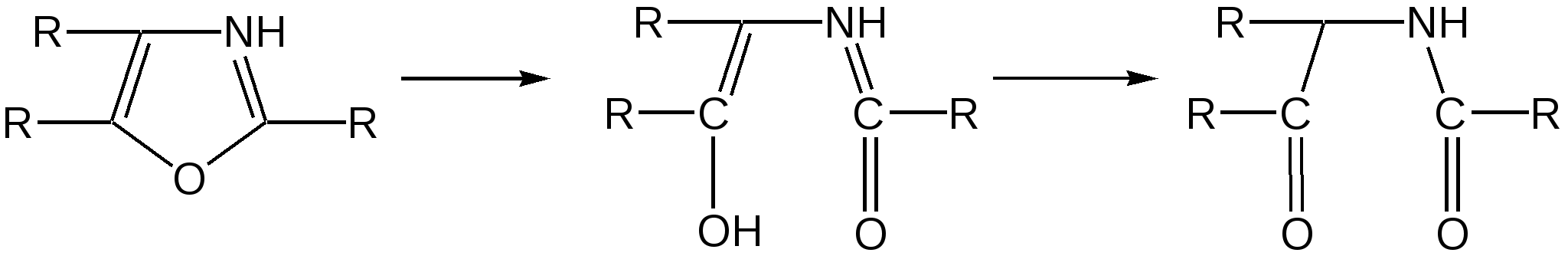 В щелочной среде оксазолы обычно устойчивы даже в очень жестких условиях. Реакция электрофильного замещения для оксазола не характерна, и даже электрофильная атака по атому азота, обладающему НЭП, протекает с трудом. Метилирование по азоту возможно лишь при наличии в кольце электроноакцепторных заместителей, стабилизирующих цикл. Некоторые реакции электрофильного замещения были проведены с 2,5-дифенильными и 2,4,5-трифенильными производными оксазола. При нитровании этих соединений электрофильное замещение осуществляется, как правило, в пара-положении бензольного ядра. Заместители в положении 2 оксазола вследствии электрононена-сыщенности атома углерода довольно активны в реакциях с нуклео-фильными реагентами. Метальная группа может отщеплять протон с образованием аниона оксазола, который реагирует с электрофильными реагентами по обычной схеме: 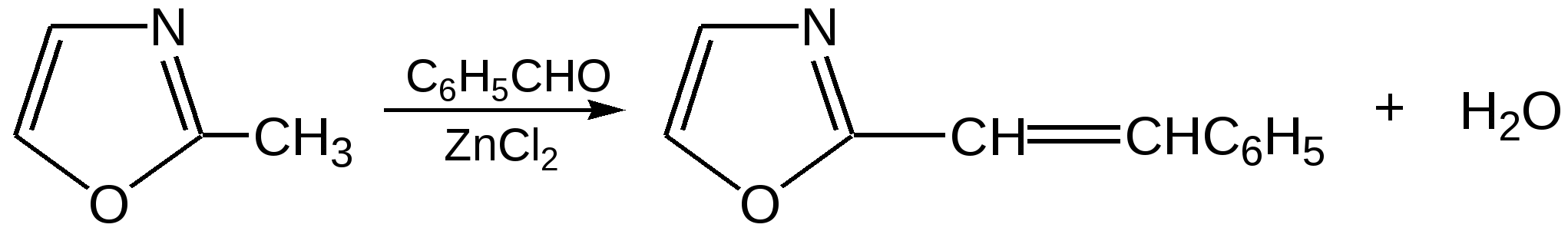 Галогены в положении 2оксазольного цикла легко замещаются нуклеофилами, например группами NHR, OR, SH, ОН. Заместители в положениях 4 и 5 менее активны и их поведение напоминает поведение некоторых заместителей в бензольном кольце. Метальные группы в этих положениях не вступают в конденсацию с карбонильными соединениями. 4-Аминопроизводные оксазола являются неустойчивыми соединениями и изучены меньше. Для некоторых производных оксазола известны интересные превращения. Одно из них сопровождает реакцию оксазолов с аммиаком при нагревании. При этом оксазольные производные превращаются в имидазольные. Реакция начинается с нуклеофильной атаки по атому Практическое использование и значение оксазола, тиофена и имидазола. Оксазолы и их производные находят пока небольшое практическое применение. 4-Алкилиден-5-оксазолоны используются в синтетической химии для получения α-аминокислот. Сделаны попытки синтезировать антибиотик пенициллинового ряда, используя в качестве одного из исходных веществ 4-алкоксиметилен-5-оксазолон. Некоторые производные оксазолонов представляют интерес для иммуно-химических реакций при аллергических заболеваниях. Отдельные представители 2-анилидооксазолинов являются эффективными местными анестезирующими средствами. Весьма перспективна реакция полимеризации. Тиазольный цикл входит в состав витамина - тиамина, пенициллина, фермента карбоксилазы и других природных веществ. Производные тиазола используются для приготовления лекарственных веществ. Известны сульфамидные препараты, содержащие тиазольное кольцо. Бензотиазолы пока не нашли столь широкого применения в биохимии и фармакологии. Но зато они оказались важными соединениями в производстве цианиновых красителей. Цианиновые красители бензотиазольного ряда являются красителями – фотосенсибилизаторами, часто употребляемыми в цветной и инфракрасной фотографии. Действие таких фотосенсибилизаторов состоит в том, что они активируют светочувствительный слой на пленке или пластинке, делая его более чувствительным к облучению. Бензотиазолиевые красители, будучи внесены в эмульсию пленки, не только увеличивают ее чувствительность, но и поглощают падающий свет с определенной длиной волны, придают пленке желтый и красный цвет. За последнее время они почти заменили красители – сенсибилизаторы хинолинового ряда, действие которых в этом отношении менее эффективно. Замена водорода средней метиновой группы на метиловую дает окраску от зеленого до красного цвета (панхром). Увеличение числа метиновых групп до 11 дает возможность делать снимки почти в темноте (инфракрасная фотография). К тиазолиниевым солям относится также витамин – аневрин,сведения о котором даны при рассмотрении пиримидина, поскольку его молекула включает и пиримидиновый цикл. Производными тиазолидина (т. е. тетрагидротиазола) является группа антибиотиков пенициллинов, открытие которых в годы второй мировой войны ознаменовало вступление медицины в эпоху антибиотиков и победу человека над бактериальными болезнями. Известно пять пенициллинов, которые близки по антибиотическому действию и отличаются друг от друга ацилирующим аминогруппу ацилом. Эта группа антибиотиков была открыта Флемингом и Флори, а строение установлено химиками Оксфордского университета под руководством Р. Робинсона и рентгенографически уточнено Дороти Ходжкин-Кроуфут. Самым трудным оказалось установление наличия в пенициллине необычного лабильного и легко изомеризующегося Р-лактамного цикла. В результате щелочного гидролиза раскрывается один из гетероциклов (именно азотистый) бицикла бензилпенициллина, а меркуролиз сулемой (атака по связи S–С) разрывает второй сульфидный цикл и приводит к образованию двух осколков - пенальдовой кислоты и пеницилламина, содержащего первичную аминогруппу, тиольную и карбоксильную группы при изобутановом скелете. Пенальдовая кислота – α-фенилацетиламиномалоновый полуальдегид. Малоновое расположение карбоксила и альдегидной группы следует из легкого декарбоксилирования пенальдовой кислоты уже в растворе с превращением в фенилацетилглицин. То обстоятельство, что пеницилламин и пенальдовая кислота представляют собой действительно два фрагмента пенициллоиновой кислоты, образовавшиеся без глубоких нарушений структуры, доказывается ресинтезом пенициллоиновой кислоты из этих половинок (пенальдовая кислота взята в виде эфира). 4.3 ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ С ОДНИМ ГЕТЕРОАТОМОМ Пиридин Способы получения пиридина и пиридиновых оснований. В небольших количествах пиридин и его метил- и этилпроизводные получают из каменноугольной смолы, которая содержит около 0,2 % смеси различных пиридиновых оснований. Пиридиновые основания извлекают также из каменноугольной смолы путем обработки разбавленной серной кислотой легкого (Ткип. до 160 °С) и среднего масел (Ткип. 160–230 °С). Свободные основания выделяют из кислого раствора нейтрализацией и перегонкой. Разделение пиридиновых оснований, выделяемых из легкого масла, требует применения очень совершенных установок для перегонки. Вследствие этого содержащиеся в легком масле пиридин и α-пиколин стали получать в чистом виде лишь в последнее время. Следующая фракция не может быть разделена на три входящих в ее состав компонента: ф-пиколин, f-пиколин и 2,6-лутидин даже при фракционировании на эффективных колонках. Кроме того, смесь пиридина и его метилпроизводных может быть получена в результате парофазной реакции ацетальдегида, формальдегида и аммиака на кремниево-алюминиевом оксидном катализаторе. В качестве исходных соединений для этой реакции используются также акролеин и аммиак или бутадиен, формальдегид и аммиак. Синтез пиридинового цикла. Рамзай (1877 г.) получил пиридин измененным синтезом Бертло, пропуская смесь ацетилена с синильной кислотой через раскаленную трубку: 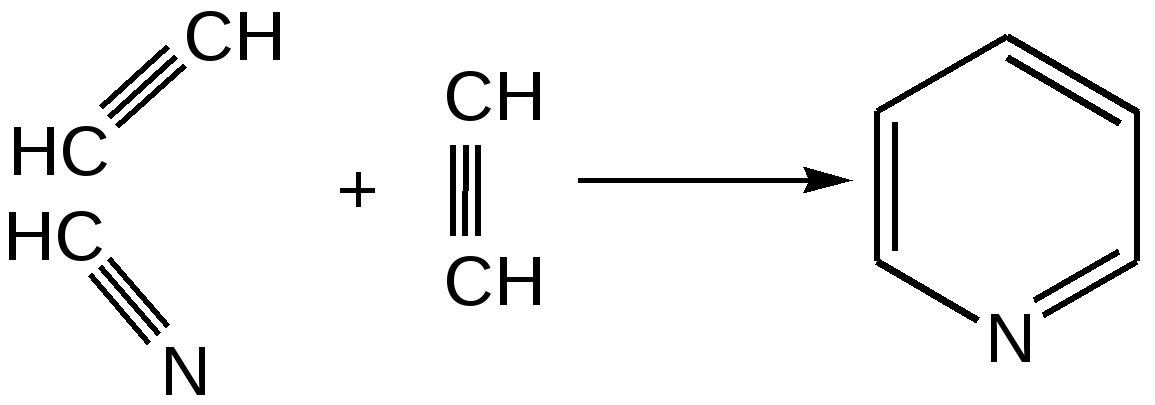 Пропуская через бензол азот, возбужденный электромагнитным полем высокой частоты, Б.М. Михайлов констатировал образование пиридина. Атом азота в этом случае заместил группу СН. При всей наглядности этих синтезов они не имеют препаративного значения и дают ничтожный выход продукта. Для подтверждения строения пиридинового цикла важен синтез Ганча, первая стадия которого состоит во взаимодействии ацетоуксусного эфира с альдегидом и аммиаком (берут альдегидаммиак) и приводит к этиловому эфиру 2,4,6-триметил-1,4-дигидропиридин-3,5-дикарбоновой кислоты. Образовавшийся эфир окисляют HNО3, удаляя два лишних водородных атома, что приводит к ароматической системе пиридина. Затем гидролизуют сложноэфирные группы и декарбоксилируют. Ясное подтверждение такой структуры дает и действие оснований на продукты N-присоединения к пиридину галоидных алкилов или арилов (Цинке) или веществ типа хлорангидридов, подобных хлорциану или эфиру хлорсульфоновой кислоты. Азот пиридина располагает свободной парой электронов и в связи с этим обладает основными свойствами. Поэтому он легко присоединяет, как все амины, йодистый метил, а также упомянутые галоидпроизводные. Во всех подобных случаях получаются производные глутаконового альдегида или его таутомерной енольной формы:  Синтез диалилпиридинмонокарбоновых кислот из β-хлоранилкетонов, ацетоуксусного эфира и аммиака (А.Н. Несмеянов, Н.К. Кочетков): 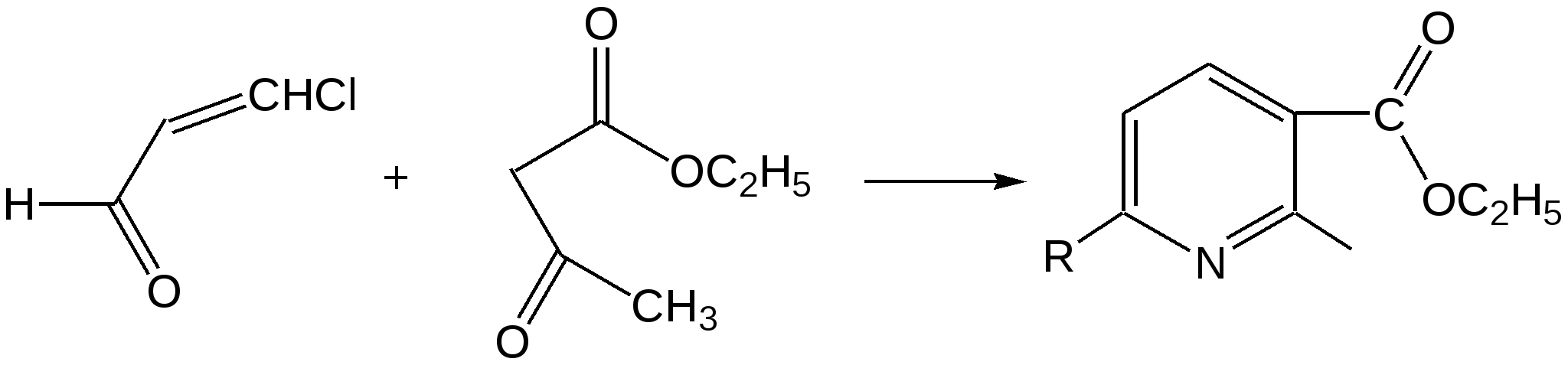 Реакция Янца и Мак-Келлога. При нагревании смеси нитрида и диенового углеводорода до 400 оС гладко образуются замещенные пиридины: 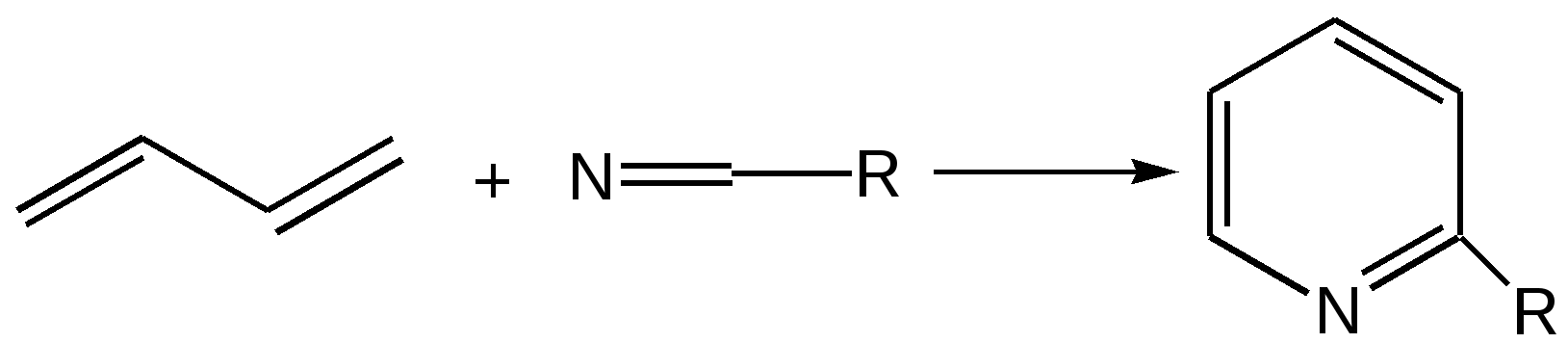 |
