Программа блока гетерофункциональные углеводороды
 Скачать 6.9 Mb. Скачать 6.9 Mb.
|
|
Тимин, цитозин, урацил. При гидролизе нуклеиновых кислот получаются три важных производных пиримидина: цитозин (4-амино-2-гидроксипиримидин), тимин (2,4-дигидрокси-5-метилпиримидин) и урацил (2,4-дигидроксипиримидин), которые относятся к группе пиримидиновых оснований. Одним из важных свойств пиримидиновых азотистых оснований является возможность их существования в двух таутомерных формах – лактим-лактамной формах, в зависимости от значения рН среды, при рН 7,0 они находятся в лактамной форме, которая и является главной таутомерной формой. Лактимные и лактомные формы цитозина, тимина и урацила: 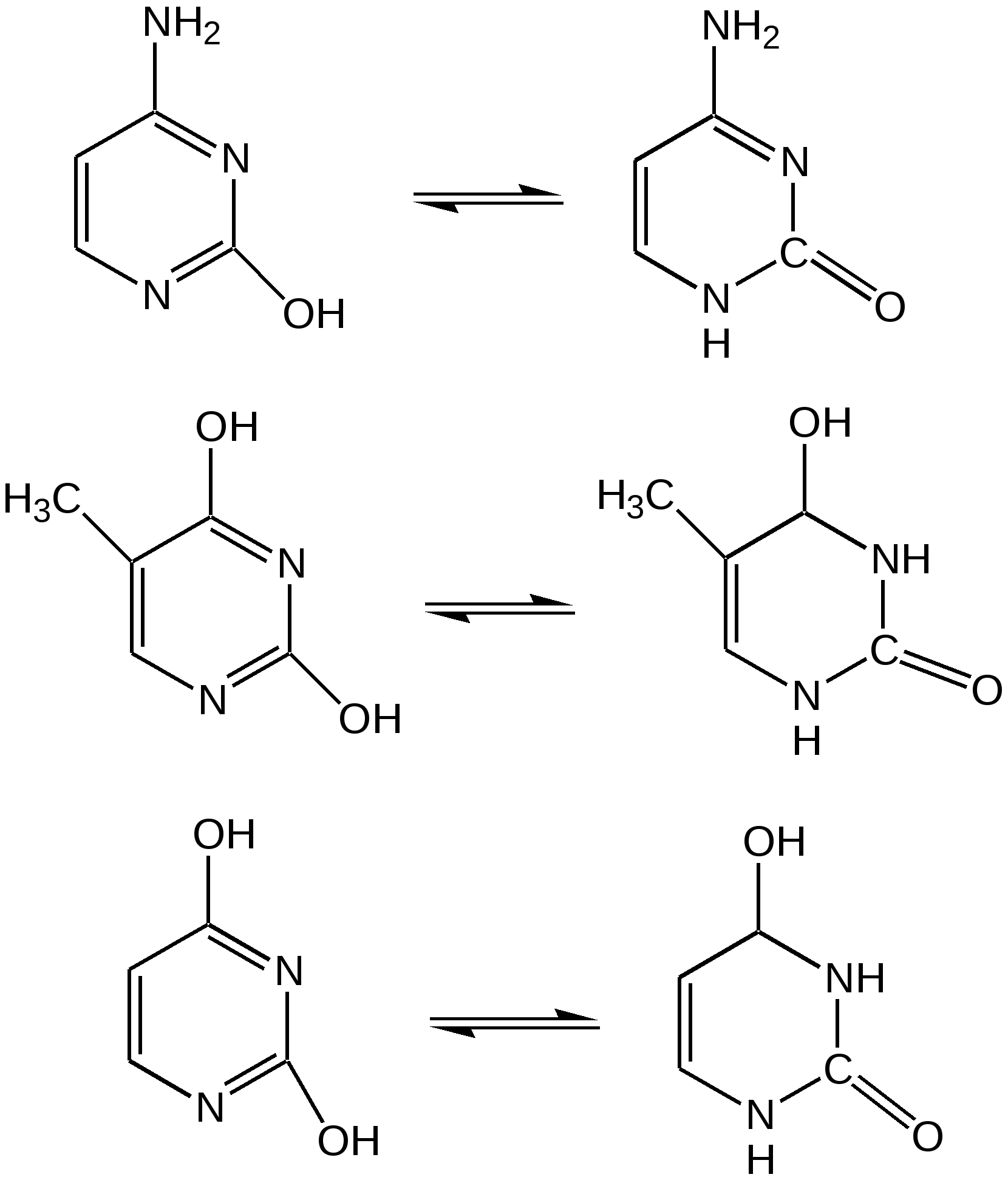 Лактимная форма присутствует только в растворах в кислой среде в весьма незначительном количестве. Помимо главных пиримидиновых оснований в составе нуклеиновых кислот открыты минорные пиримидиновые основания: 5-метил и 5-оксиметилцитозин, дигидроурацил, псевдоурацил, 1-метилурацил, 4-тиоурацил и др. На долю минорных оснований приходится до 10 % всех нуклеотидов транспортных рибонуклеиновых кислот (т-РНК), что имеет важный физиологический смысл – защита молекулы РНК от действия гидролитических ферментов. Витамин В1 (тиамин) тоже содержит пиримидиновый цикл, соединенный метиленовой связью с кольцом тиазола: 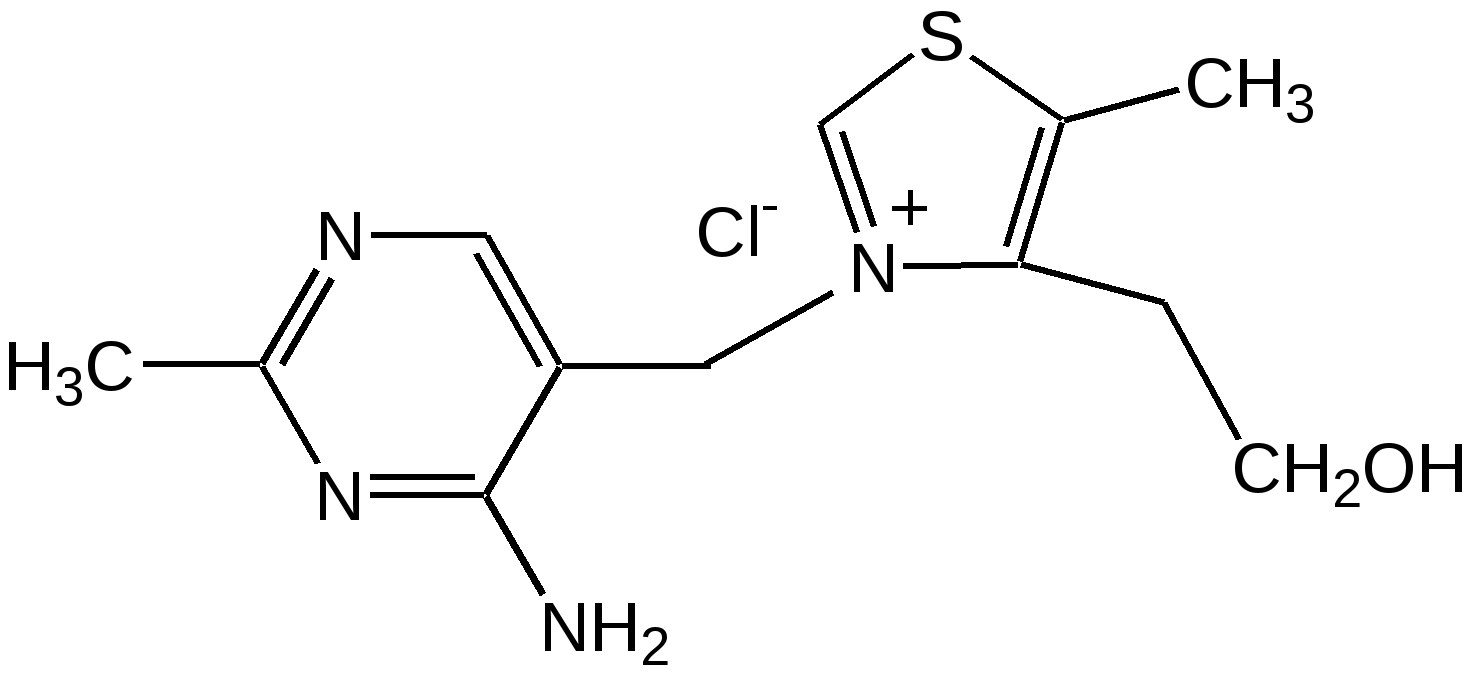 Отсутствие витамина В1 в пище, например, при питании ободранным рисом (он содержится в рисовых отрубях), вызывает известное на востоке нервное заболевание бери-бери. Суточная потребность в витамине В1 для человека – 4 мг. Необходимость в нем связана с тем, что витамин В1 в виде дифосфата ТДФ (тиаминдифосфат) входит в структуру двух сложных ферментных систем: пируват- и -кетоглутаратдегидрогеназных комплексов, катализирующих окислительное декарбоксилирование пировиноградной и -кетоглутаровой кислот и других оксокислот, образующихся при распаде аминокислот с разветвленной боковой цепью. Основное количество витамина В1 человек получает с растительной пищей, а также им богаты печень, почки, мозг. Диазины. Нуклеофильное замещение галогена в диазинах идет по механизму присоединения – элиминирования (А-Е). Однако существуют примеры нуклеофильного замещения с принципиально другим механизмом. Один из этих процессов – взаимодействие 2-хлоро-4-фенилпиримидина с амидом калия в жидком аммиаке, приводящее к 2-амино-4-фенилпиримидину. Очевидно, что нуклеофильное замещение в данном случае протекает через промежуточное раскрытие цикла. Нуклеофильная атака амид-ионом по положению 6 пиримидин ового кольца объясняет распределение меченых атомов азота в аминопроизводном. Все хлородиазины более активны, чем хлоропиридины, что обусловлено присутствием второго атома азота, причем факторы скоростей замещения лежат довольно в узком интервале. Наиболее быстро замещение хлора протекает в 2- и 4-хлоропиримидинах, тогда как атом хлора в положении 5 пиримидина наименее активен. Это согласуется с селективной активацией положений 2, 4 и 6 пиримидина, обсужденной выше. Нуклеофильное замещение при С4 в 4-хлоропиримидине протекает через интермедиат, в резонансной стабилизации которого принимают участие два гетероатома. Пурин. Бициклическая система пурина состоит из двух гетероциклов – пиримидина и имидазола, сконденсированных между собой. Открыл пурин немецкий химик Э. Фишер: 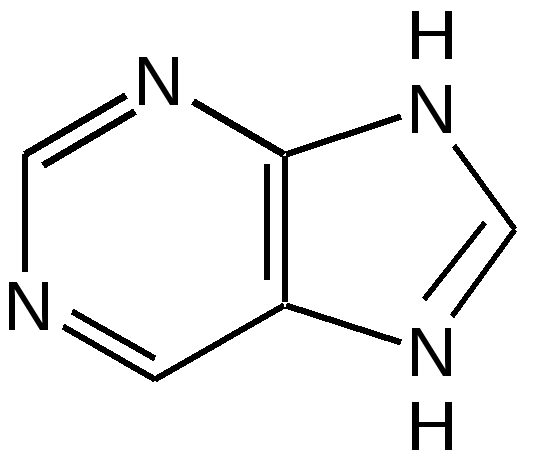 Производные пурина имеют исключительное биологическое значение прежде всего потому, что входят вместе с пиримидиновыми основаниями в структуру нуклеиновых кислот и имеют, таким образом, отношение к программированию синтеза белков и к явлениям наследственности. Пурин является ароматической системой с энергией делокализации, равной 243,6 кДж/моль (для бензола – 150,7 кДж/моль). Пиримидиновое кольцо в пурине в целом имеет дефицит электронов, а имидазольное кольцо – избыток электронов. Поскольку в пурине имеет место перекрывание -электронных облаков двух моноциклических систем, то электронная плотность в каждом цикле в определенной степени может изменяться в результате перехода электронов из имидазольного цикла в пиримидиновый. Таким образом, пурин – это ароматическая система сильно делокализованных -электронов, обладающая лабильной «переливающейся» электронной плотностью, в результате чего возможны таутомерные превращения. Кроме этого, эта система является прекрасным донором электронов вследствие низкой энергии высшей заполненной молекулярной орбитали. Электронно-донорные заместители в кольце пиримидина способствуют восстановлению электронной плотности в имидазольном цикле. Реакции нуклеофильного замещения в пурине идут в основном в положение 8 имидазольного кольца, но возможна атака нуклеофильными реагентами атомов углерода в положениях 2 и 6 пиримидинового цикла. Реакции электрофильного замещения возможны лишь при наличии электронодонорных заместителей в кольце пиримидина, и замещение происходит по углероду С8 имидазольного цикла. Все реакции пуриновых соединений можно разделить на две группы: реакции по атомам азота и реакции по атомам углерода кольца. Пуриновые основания – сравнительно слабые основания, но электрофильная атака по атому азота весьма распространена, причем выбор атома азота при электрофильной атаке определяется степенью основности того или иного атома азота. В незамещенном пурине таким является N1, в мочевой кислоте алкилированию сначала подвергается N9, а затем N3 и N1; в кислой среде алкилирование замещенных пуринов происходит в основном в положение 9. Аденин, единственный их всех пуринов, показывает небольшую реакционную способность в положении 3. Аденин (6-аминопурин) является одним из наиболее распространенных пуриновых оснований (амино- и имино-форма): 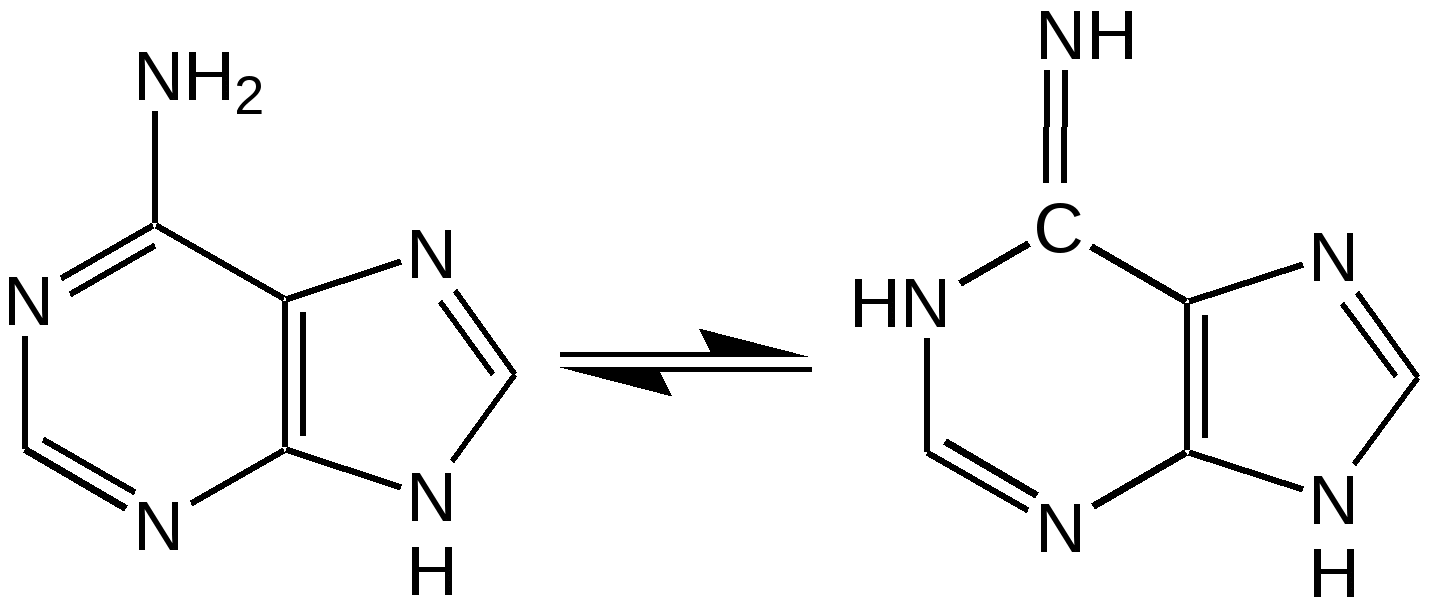 Аденин существует практически в амино-форме, т. к. энергия делокализации для амино-формы наибольшая. В связанном виде аденин содержится в нуклеиновых кислотах и легко получается при их гидролизе. В свободном состоянии встречается в некоторых растениях (чай, сахарная свекла, хмель), в грибах, дрожжах, бактериях и т. д. Аденин является наиболее устойчивым в термодинамическом отношении соединением среди природных пуриновых и пиримидиновых оснований. Гуанин (2-амино-6-гидроксипурин) вместе с аденином и пиримидиновыми основаниями входит в состав нуклеиновых кислот (лактимная и лактамная формы): 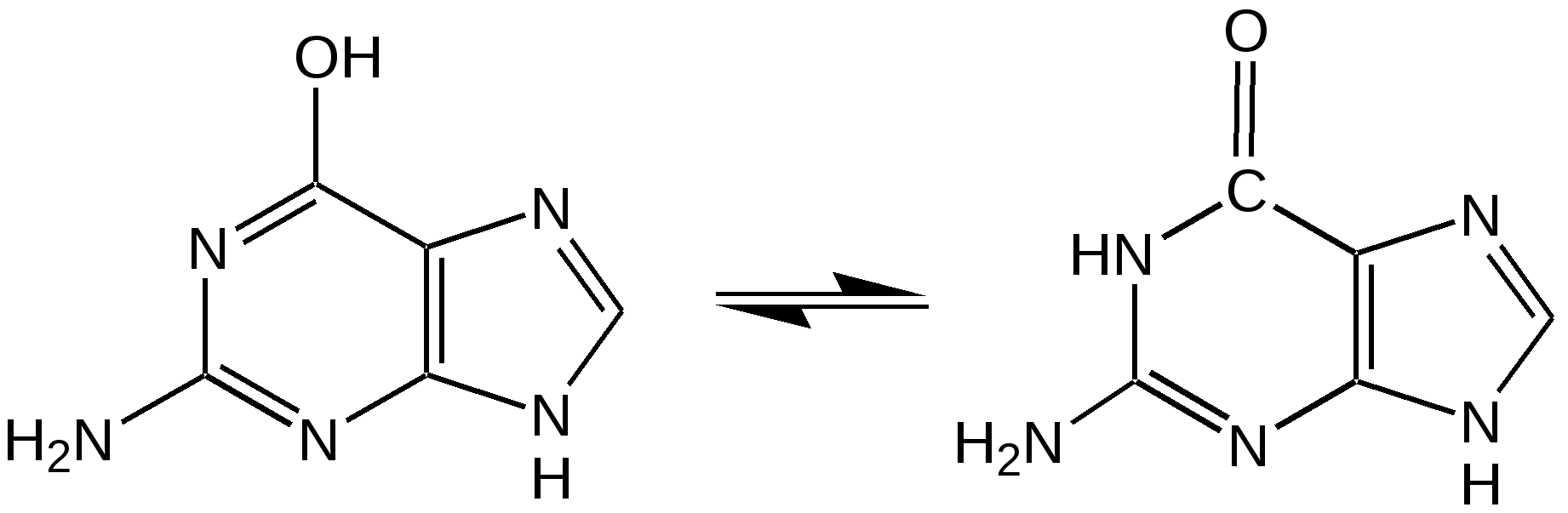 Наиболее устойчивой является лактамная форма, в которой гуанин и находится в природных нуклеиновых кислотах. Значительные количества гуанина содержатся в чешуе и коже рыб, пресмыкающихся и амфибий, от чего зависит их блеск. К таким соединениям относится аденозинтрифосфат (АТФ) – переносчик энергии в биохимических реакциях и фосфорилирующий агент. Мочевая кислота. Мочевая кислота является первым соединением пуринового ряда, открытым Шееле еще в 1776 г. Однако прошло более ста лет, пока строение ее было точно установлено. В настоящее время принято считать, что мочевая кислота существует в оксоформе. Она является одним из ключевых соединений в синтезе пуриновых оснований служит мочевая кислота (2, 6, 8-тригидроксипурин), играющая у птиц и рептилий роль вещества, выводящего из организма избыток азота (как мочевина у млекопитающих). Соли мочевой кислоты (ураты) откладывается при неправильной работе организма в суставах и в виде почечных камней. Мочевая кислота (окси- и оксо-форма): 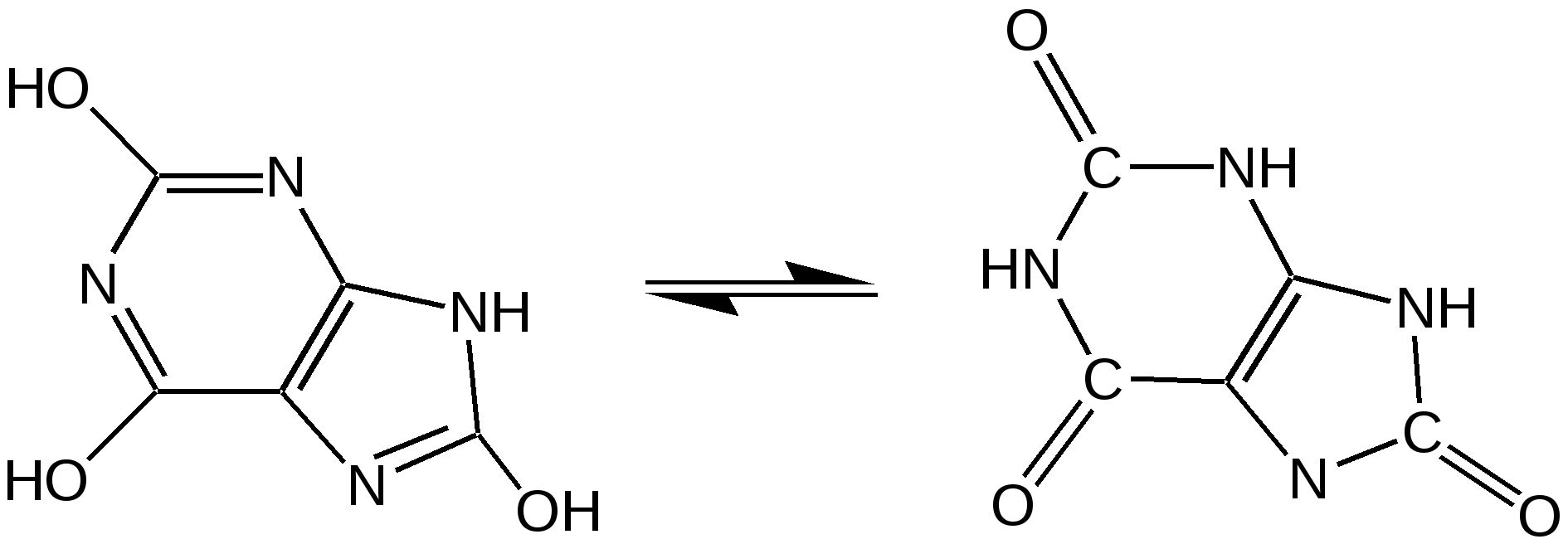 Алкалоиды. Представляют собой азотистые основания природного происхождения с сильным биологическим действием. Физические свойства. Алкалоиды – основания нерастворимы в воде (кроме кофеина, никотина), но растворимы в органических растворителях. Соли алкалоидов растворимы в воде, но нерастворимы органических растворителях (исключение – хинин HBr растворим в CHCl3). Химические свойства 1. Основные свойства: Образование солей:
2. Свойства, обусловленные функциональными группами, в том числе групповые реакции:
Мурексидная реакция: 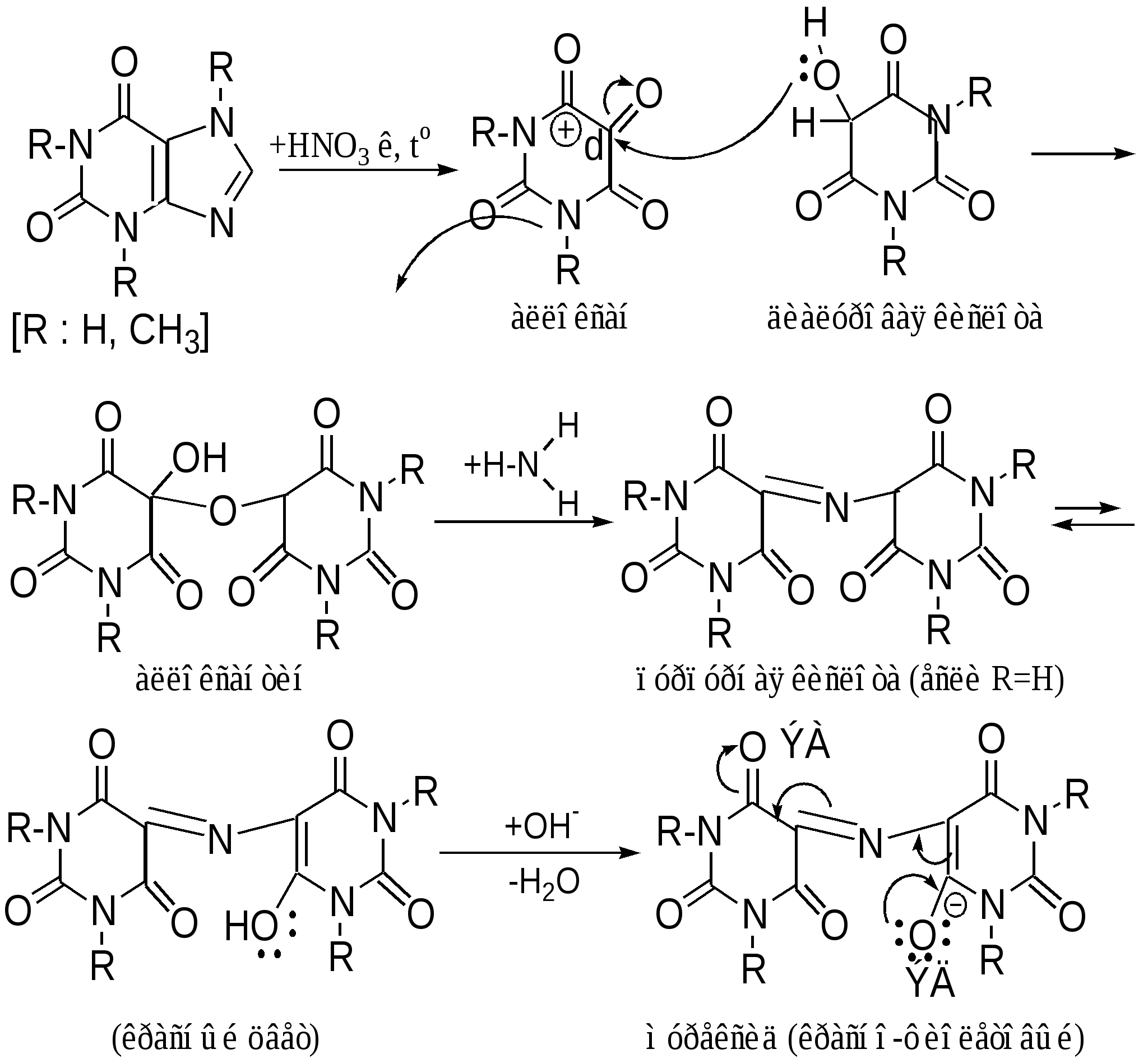 Талейохинная реакция: 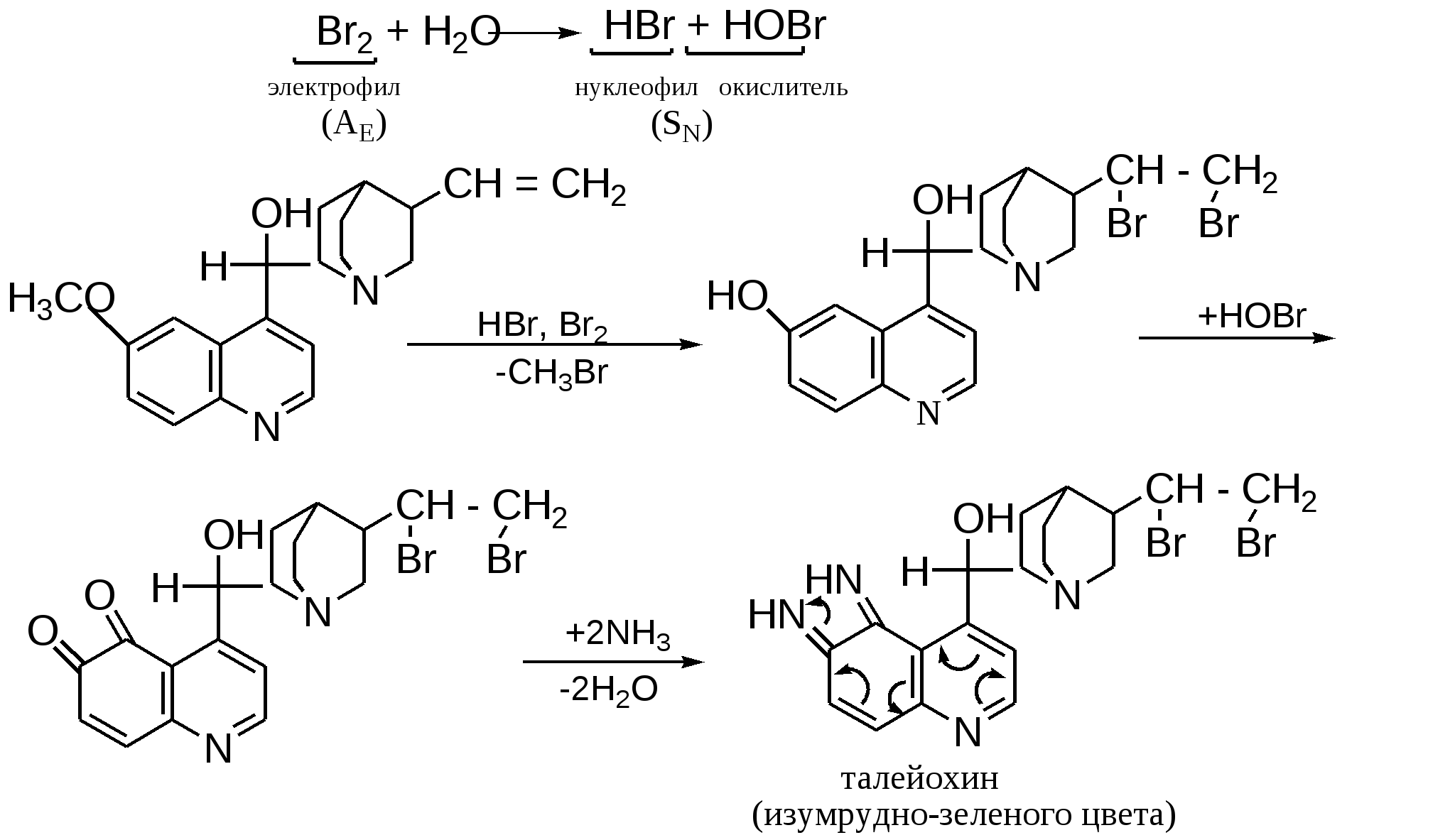 Кофеин. Химическое строение молекулы кофеина выражается формулой: 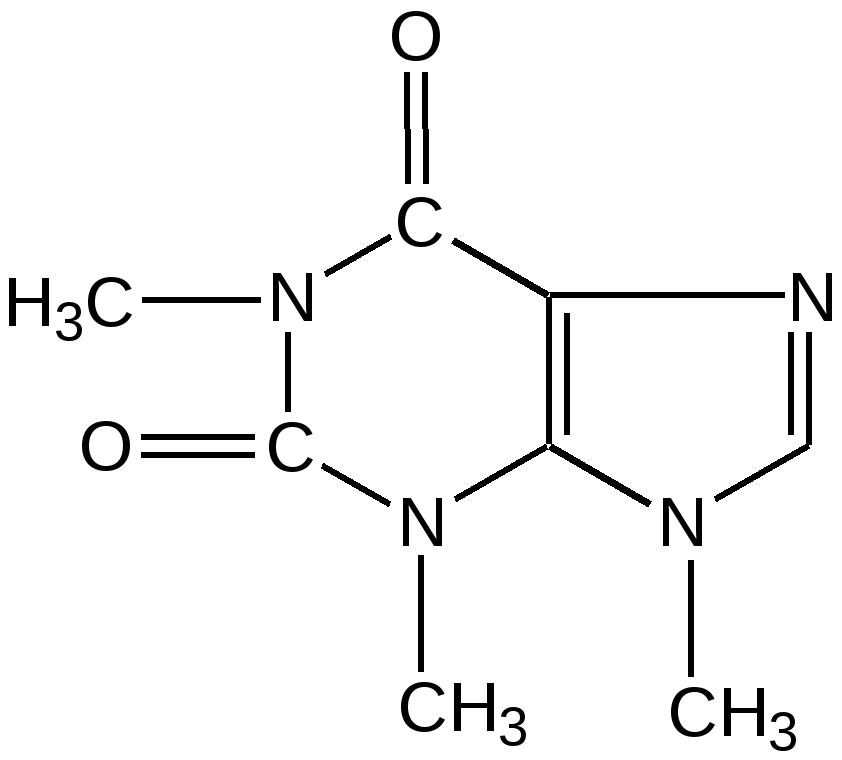 Кофеин вступает во все реакции, свойственные пуриновым соединениям. Известны два структурных аналога кофеина — теобромин и теофиллин, имеющие также важное биологическое значение: 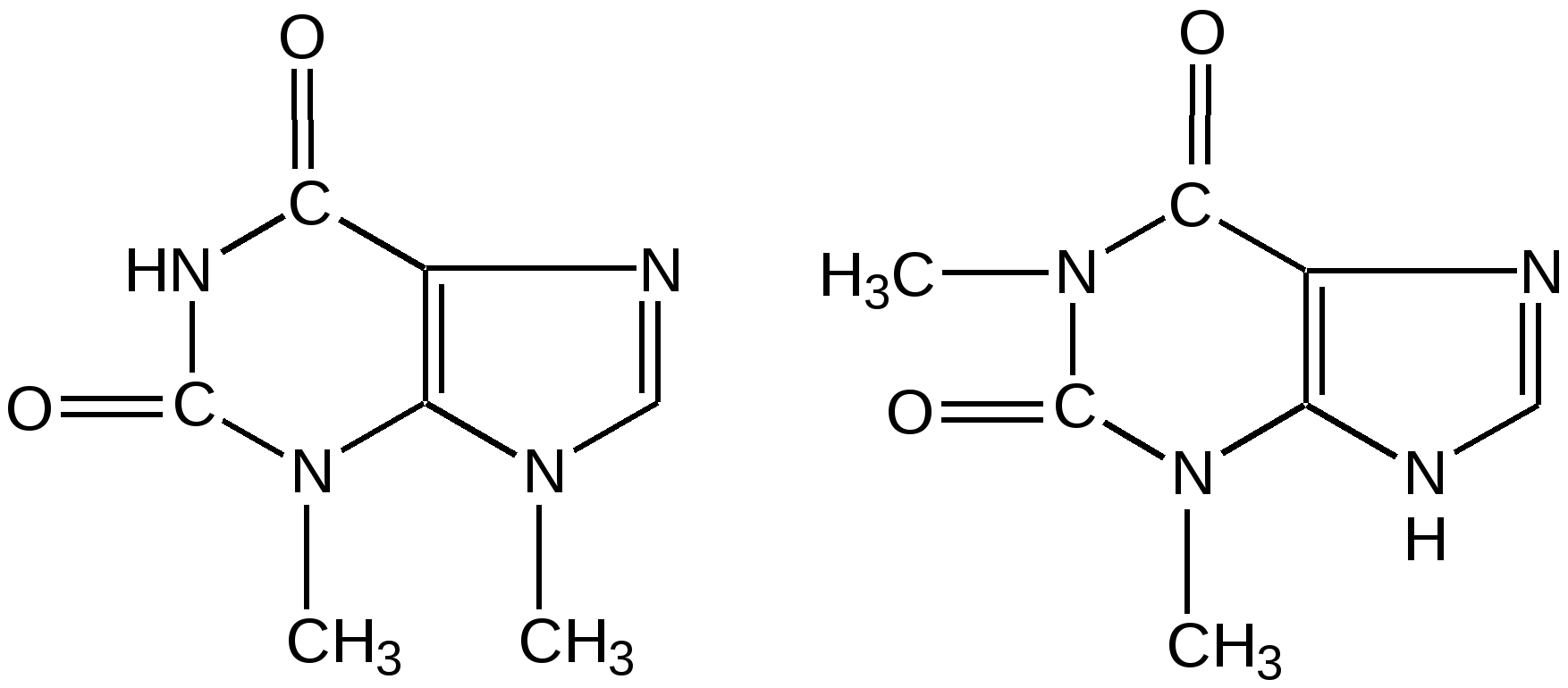 Биологическое и медицинское значение синтетических природных пуринов.Особый интерес вызвали пуриновые соединения в связи с их возможной противоопухолевой активностью после того, как была выявленная первостепенная важность нуклеиновых кислот в процессе воспроизведения роста клеток. Если раковая опухоль есть результат патологического, ненормального роста «искаженных» клеток какой-либо биологической ткани, то естественно сделать вывод, что «главный конструктор» новых клеток – нуклеиновая кислота – сама претерпела в своей конфигурации какие-либо микроизменения, отразившиеся потом в белковом синтезе. Изменения в структуре нуклеиновой кислоты одна из основных причин возникновения злокачественных опухолей. Возможно, если измененная структура нуклеиновой кислоты вызывает нарушения в белковом синтезе, ведущие к росту необычных, возможно упрощенных клеток, то другое направленное изменение в структуре нуклеиновой кислоты может вызвать прекращение воспроизводства таких клеток. Эта мысль и привела к исследованию на противоопухолевую активность так называемых пуриновых антиметаболитов. Пуриновые антиметаболиты – соединения со структурой похожей на структуру природных пуриновых оснований в нуклеиновых кислотах. Они могут конкурировать с последними по своей функциональной направленности и в участии в белковом синтезе. Различия в структуре природных пуринов и антиметаболитов должны быть незначительными. Степень противоопухолевой активности сильно зависит от некоторых определенных структурных узлов в молекуле антиметаболитов. Известно также, что адениновая структура антиметаболитов придает им особо активные свойства. Люстиг и Вахтель обнаружили, что различные пурины, содержащие метальную группу в положении 7, обладают способностью продлевать жизнь подопытных животных, пораженных раковой опухолью. Наибольшее число работ посвящено изучению противоопухолевой активности 6-меркаптопурина. Предполагается, что это соединение взаимодействует с никотинамидадениннуклеотидной коферментной системой и контролирует нормальный биосинтез пуринов. Однако более конкретные сведения о механизме действия 6-меркаптопурина на раковые опухоли пока отсутствуют. К антиметаболитам, обладающим противоопухолевой активностью, следует также отнести 6-хлор-9-метилпурин, 2-амино-6-меркаптопурин, 2-амино-6-меркапто-9-π-пропил-пурин, 9-(2'-тетрагидрофурфурил)-6-меркаптопурин. Другие производные этого соединения применялись для лечения лейкемии. Шестичленные гетероциклы с атомом кислорода. С точки зрения обычных валентных представлений шестичленный цикл, содержащий атом кислорода, может быть представлен в виде пирановых структур или их производных – пиронов: 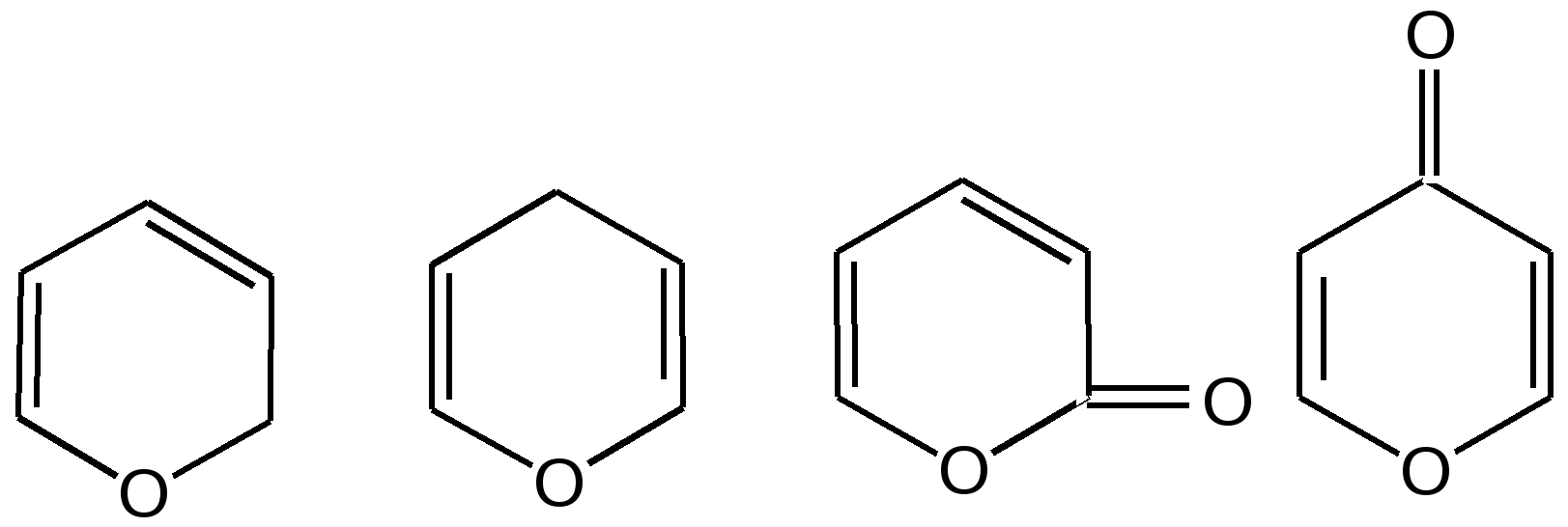 γ-Пиран является также очень неустойчивым соединением:  Кроме упомянутых структур известна катионная форма шестичленного гетероцикла с одним атомом кислорода – катион пирилия который входит в состав пирилиевых солей. Вывод о существовании таких солей сделали Колли и Тикле еще в 1899 г. Производные пирана:  I – Катехины, гидроксипроизводные флавана. Катехин – 3, 5, 7, 3`, 4` - пентагидроксифлаван. II – Флавонолы, гидроксипроизводные флавона. Кверцетин – 3, 5, 7, 3`, 4` - пентагидроксифлавон. III – Антоцианидины – гидроксипроизводные флавилия-катиона. Цианидин – 3, 5, 7, 3`, 4` - пентагидроксифлавилия хлорид. Цианидииовая проба: 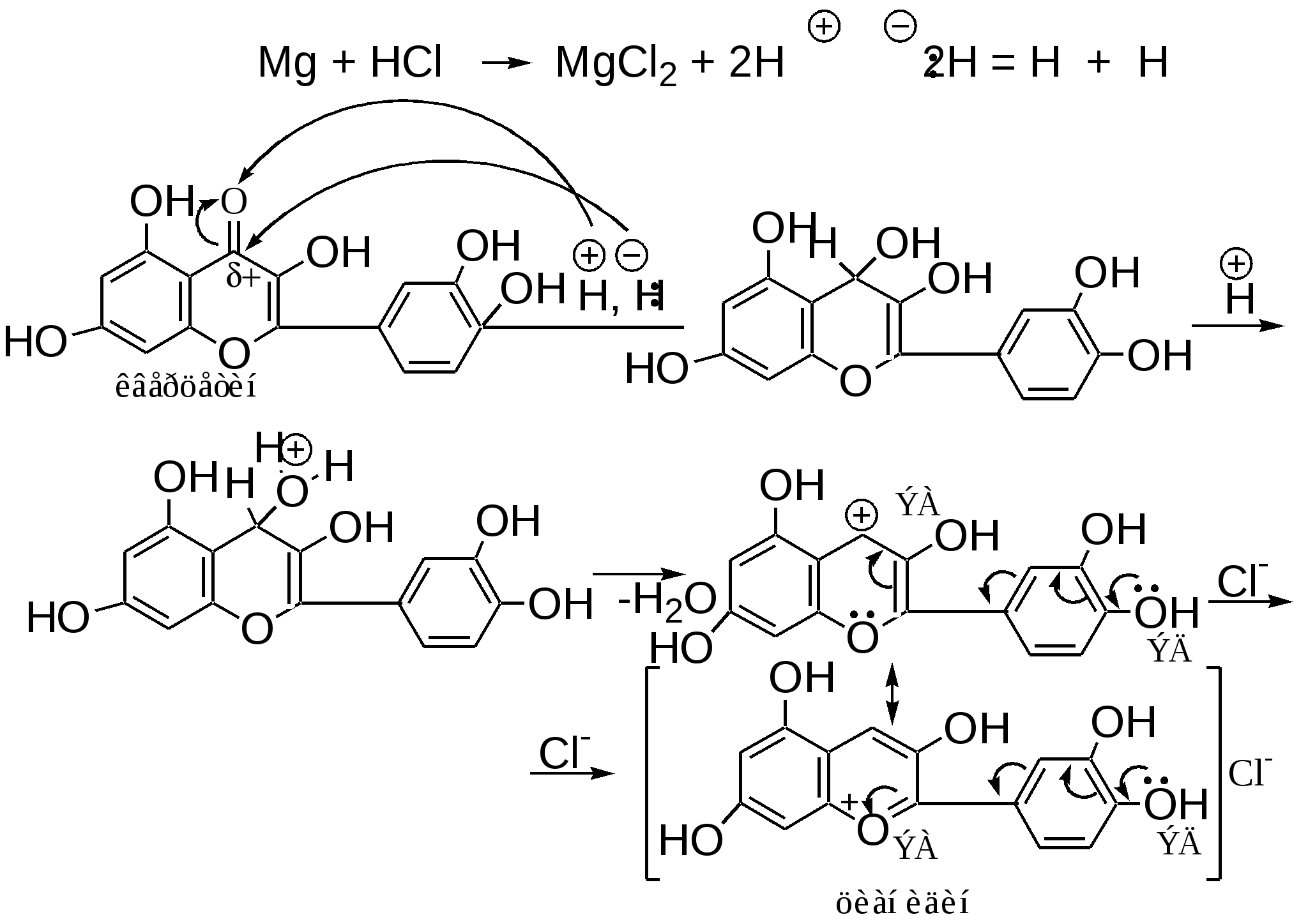 Кумарин (α-бензопирон) и его производные широко распространены в природе. Кумарин имеет запах сена, он – пахучее начало цветов донника. В растениях он находится в виде гликозида и запах кумарина появляется лишь при высыхании растений, которое сопровождается гидролизом: 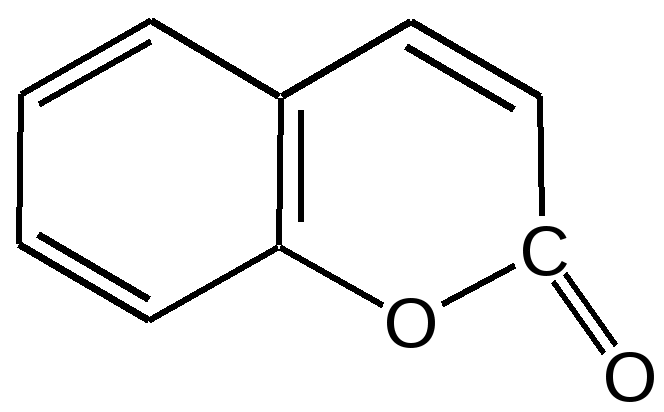 В промышленности кумарин получают по реакции Перкина – конденсацией салицилового альдегида с уксусным ангидридом в присутствии ацетата натрия: 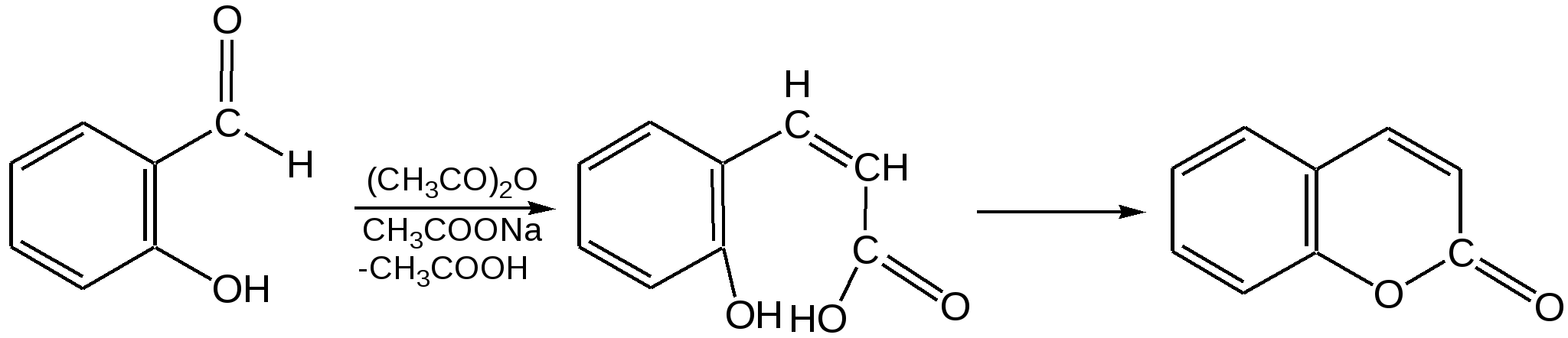 Кумарин применяется в качестве отдушки для печенья, лимонадов, мыла и табака, а также компонента фруктовых эссенций. Оксипроизводные кумарина – 7-оксикумарин и 7,8-диоксикумарин также широко распространены в растительном мире. Хромон (γ-бензопирон). Скелет хромона лежит в основе витаминов Е (токоферолов), необходимых для размножения животных. 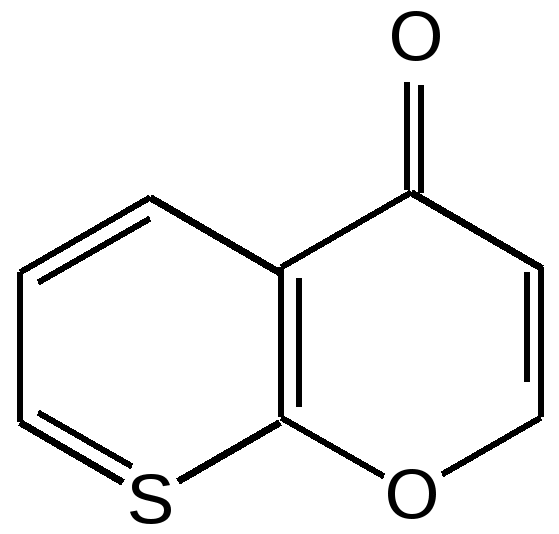 Известно семь веществ, обладающих действием изомерных друг другу. 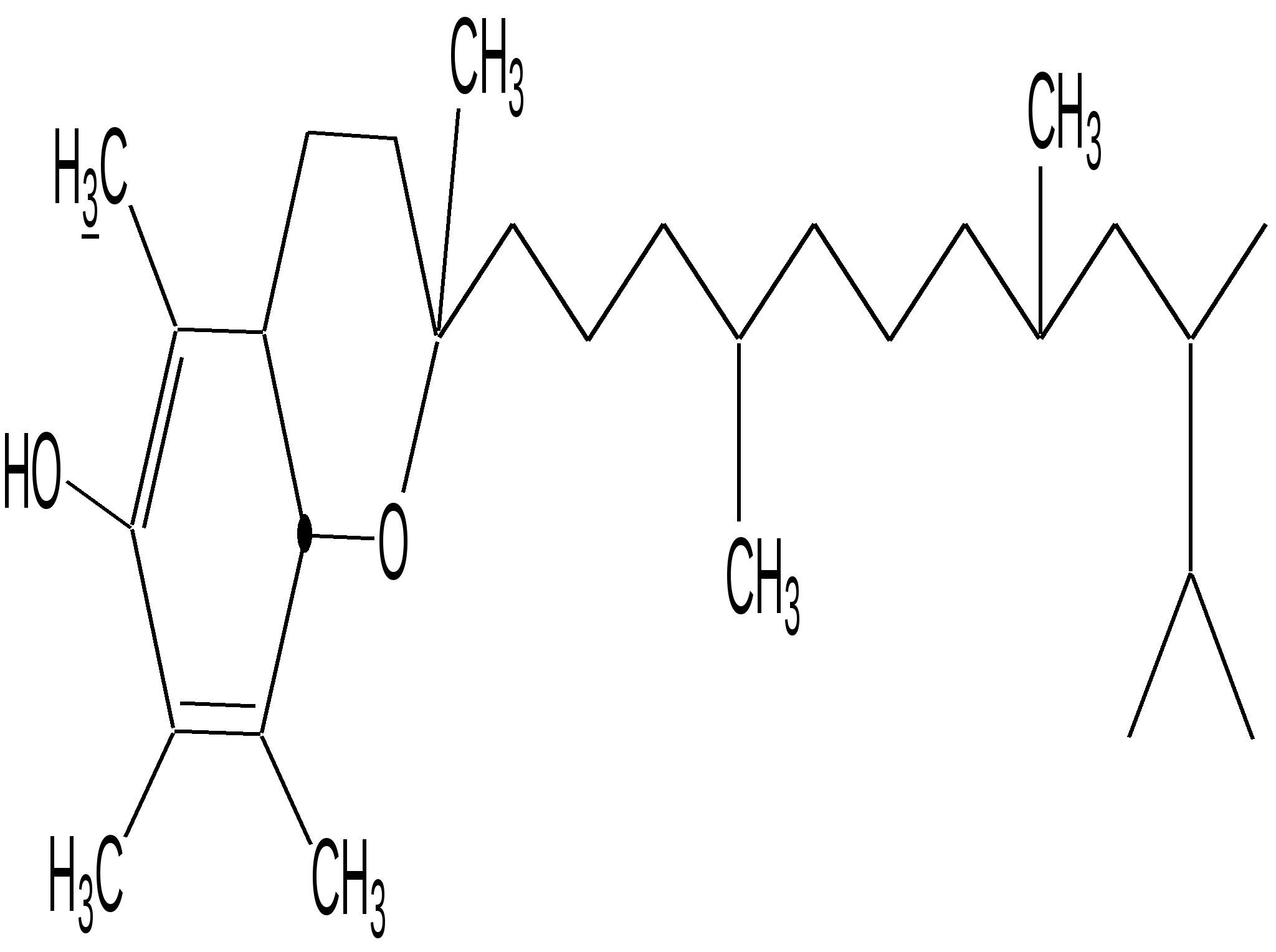 Биологическая активность витамина Е проявляется в способности образовывать устойчивые свободные радикалы в результате отделения атома водорода от гидроксильной группы. Эти радикалы могут вступать во взаимодействие со свободными радикалами, образующимися при распаде органических пероксидов и гидропероксидов. Тем самым витамин Е предотвращает окисление ненасыщенных липидов и предохраняет биологические мембраны от разрушения. В качестве антиоксиданта он добавляется в пищевые жировые продукты, предохраняя их от окислительного прогоркания. Из пищевых продуктов витамином Е наиболее богаты растительные масла, содержится он также в масле из пшеничных зародышей. Флавоны окрашивают в желтый, красный и синий цвет цветки, почки и ягоды:  Например, природные оксипроизводные флавона лутеолин и кверцетин – это природные красители, окрашенные в желтый цвет, содержащиеся в желтых цветах: 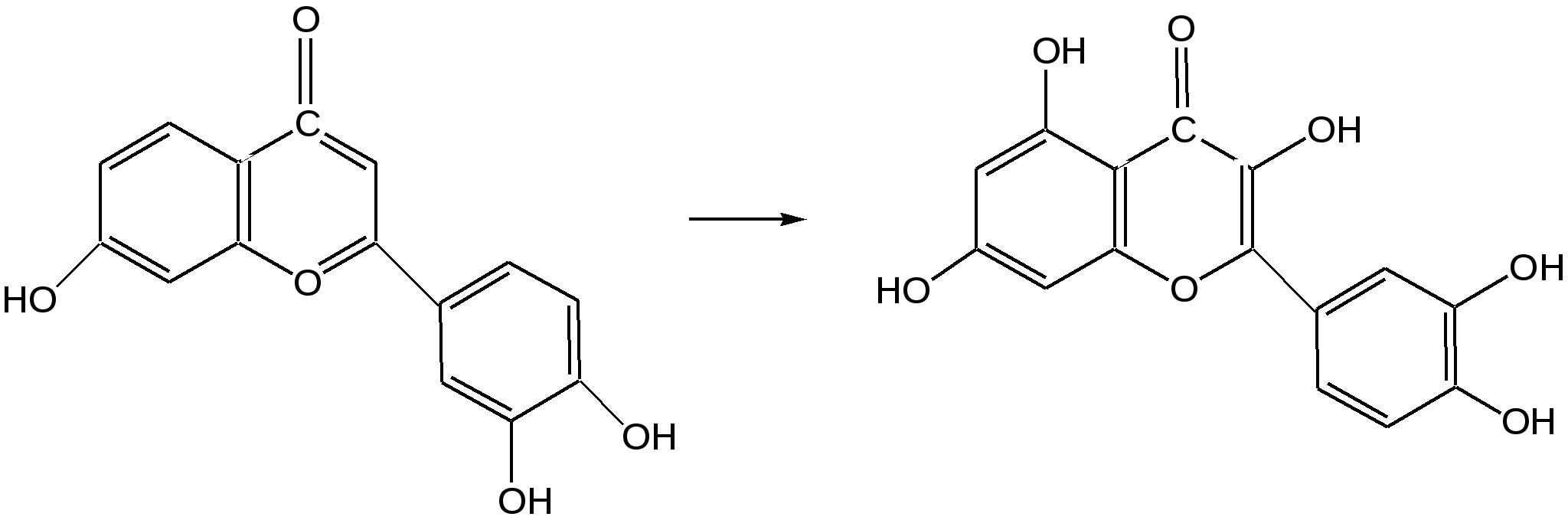 В растениях они находятся в виде гликозидов. Один из гликозидов кверцетина с дисахаридом, состоящим из рамнозы и глюкозы, называется рутином. Это – одно из веществ, относящихся к группе витаминов Р (бифлаваноидов), при отсутствии которых в пище увеличивается проницаемость кровеносных сосудов, что ведет к «пурпуровой болезни» – множественным точечным кровоизлияниям. 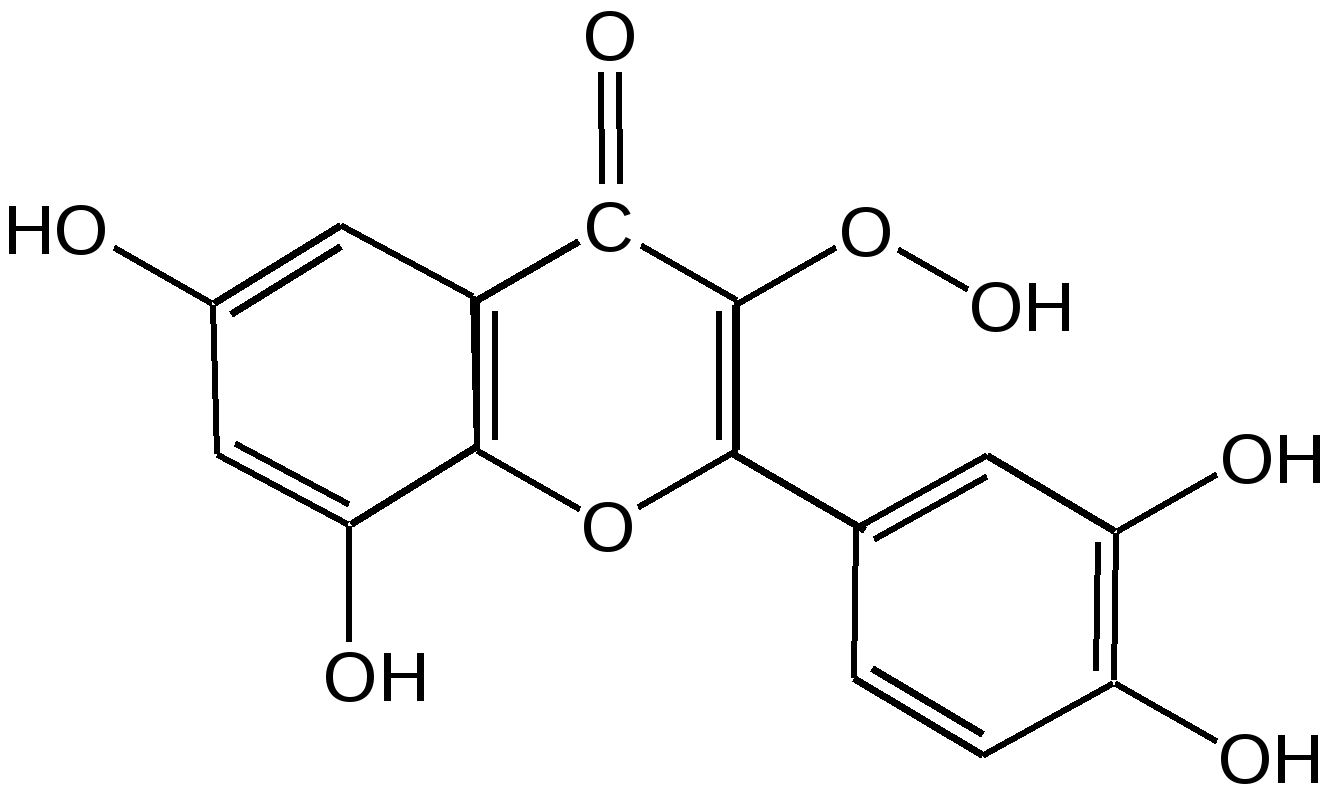 Следует указать на тесную функциональную связь витаминов С (аскорбиновая кислота) и Р (рутин) в окислительно-восстановительных процессах организма, образующих единую систему. Об этом свидетельствует лечебный эффект, оказываемый комплексом аскорбиновой кислоты и бифлаваноидов, названный аскорутином. Основные источники витамина Р для человека – это растительные продукты питания (в частности, овощи и фрукты), в которых также содержится много витамина С. При восстановлении оксифлавонов можно получить антоцианидины, содержащие оксониевый кислород, входящий в ароматический цикл. так, кверцетин дает при этом цианидин, дальнейшее гидрирование которго приводит к катехину (дубители), содержащемуся в чае и обладающем Р-витаминной активностью. 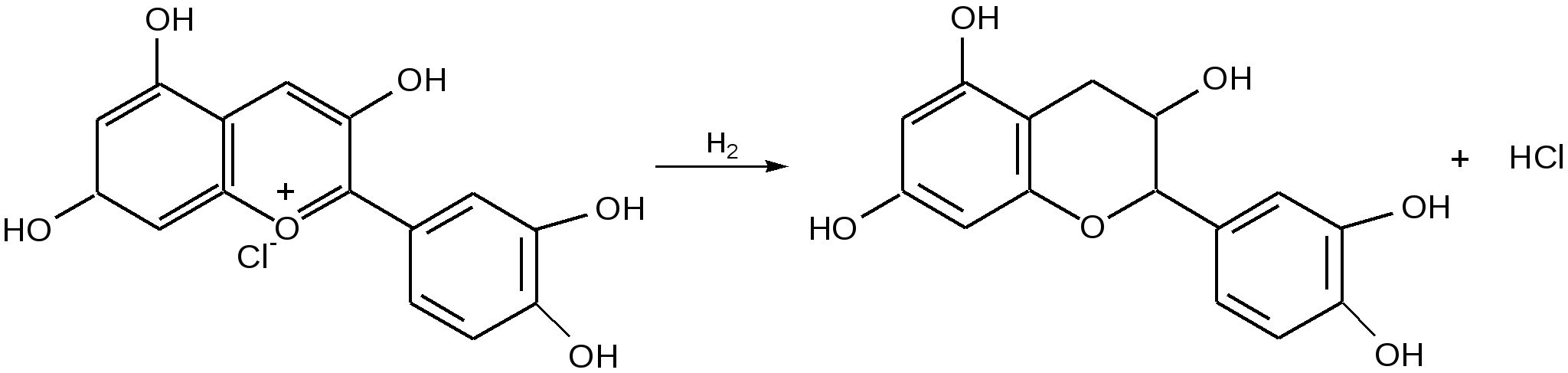 Антоцианидины – относительно прочные твердые соли, интенсивно окрашенные. В виде гликозидов они являются антоциановыми красителями, окрашивающими цветы, ягоды и овощи (по-гречески антоциан – краска цветов). Все антоцианы – кислотно-основные индикаторы, т. е. их окраска зависит от рН среды. В кислой среде их окраска сдвигается в сторону красной, в щелочной – в сторону синей (или сине-зеленой), в нейтральной она фиолетовая. Так, краситель цианидин окрашивает васильки в синий цвет (щелочная среда в лепестках), а розу – в красный цвет (кислая среда). Другие представители антоцианидинов – пеларгонидин (лежит в основе окраски цветов пеларгонии), дельфинидин (окраска синих цветов дельфиниума, а также красного винограда и вина). Первый содержит в фенильном ядре на один гидроксил меньше, а второй – на один гидрокисл больше, чем цианидин. На этих трех антоцианидинах построено великое множество оттенков сине-красной гаммы. Отдельные антоциановые красители отличаются тем, что один или два гидроксила в фенильном ядре метилированы, а гликозиды образованы разнообразными сахарами. |
