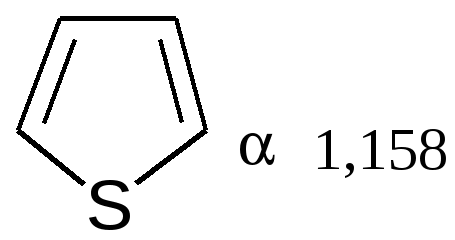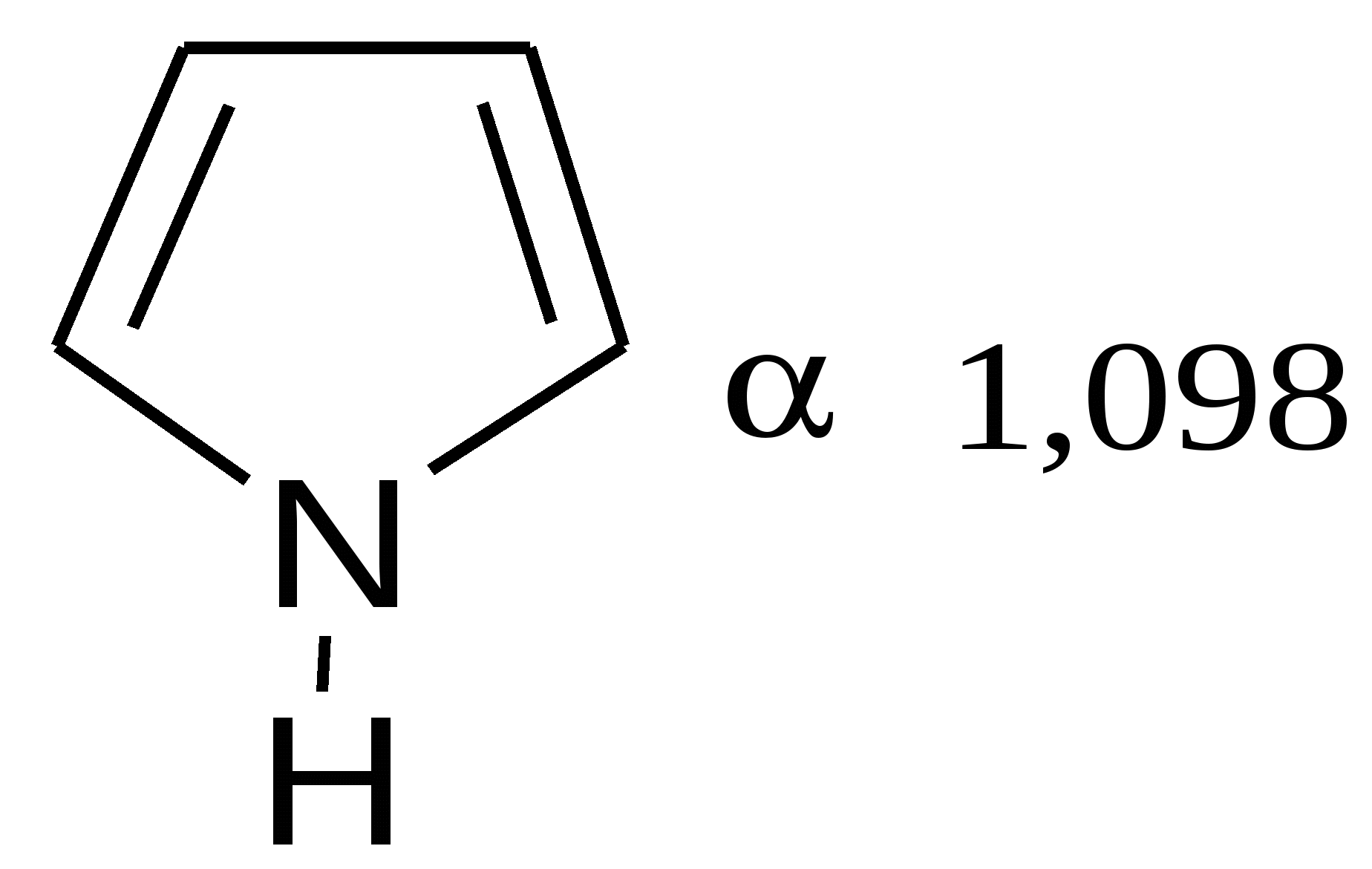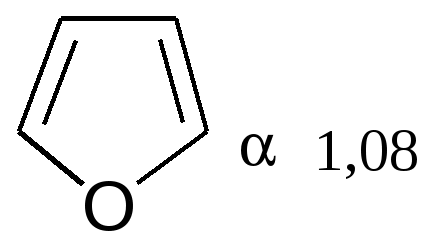Программа блока гетерофункциональные углеводороды
 Скачать 6.9 Mb. Скачать 6.9 Mb.
|
|
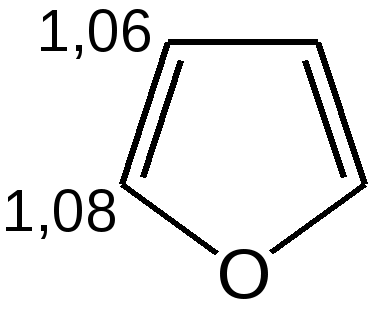
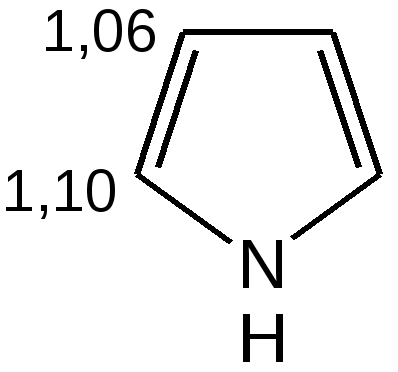
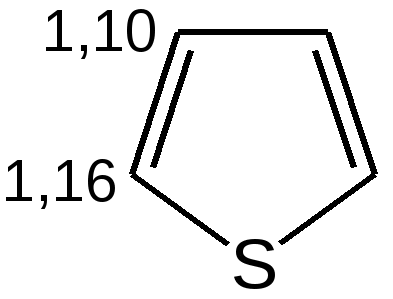
Степень ароматичности, рассматриваемых гетероциклов, можно выразить с помощью энергии сопряжения:
увеличение ароматичности  увеличение диеновой природы  Таблица 4 – Величина энергии резонанса ER.
Таблица 5 – Температура кипения гетероциклов:
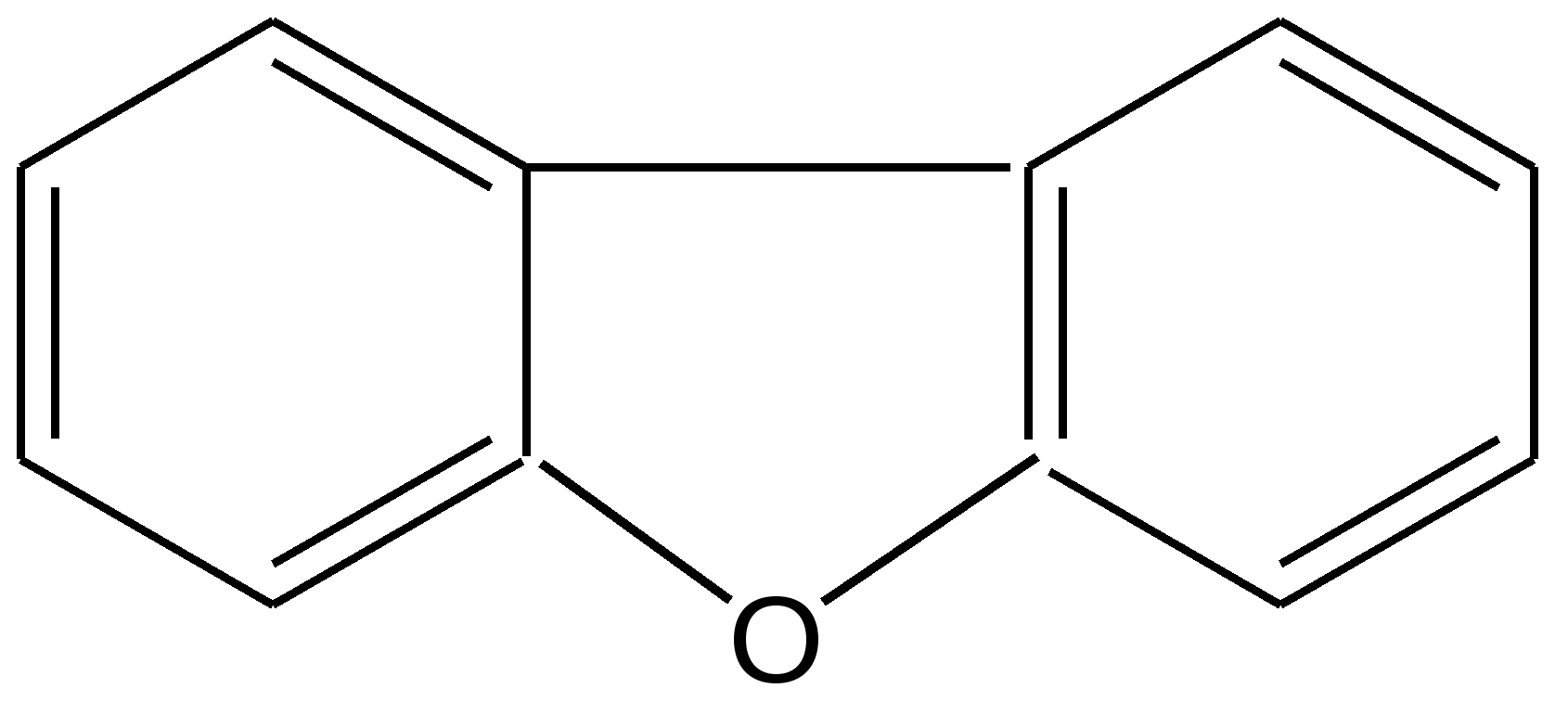
Гетероатом (O, S, N) в пятичленных гетероциклах, как правило, не участвует в образовании координационных соединений, поскольку свободная пара р-электронов поставляется для образования ароматического секстета. Так, фуран, тиофен и пиррол не образуют оксониевых соединений, сульфоксидов, сульфонов, четвертичных аммонийных оснований, N-окисей. Пятичленные гетероциклы отличаются от бензола и его производных меньшей устойчивостью к агрессивным воздействиям. Химические свойства. Для пятичленных гетероциклических соединений с одним гетероатомом характерны следующие реакции замещения, присоединения, раскрытия цикла и обмена гетероатома, обусловленные химическим строением данных соединений. Наиболее характерными реакциями фурана, тиофена и пиррола, как и других ароматических соединений, являются реакции электрофильного замещения. Эти соединения подвергаются галогенированию, сульфированию, нитрованию, ацилированию и т.д. В реакциях электрофильного замещения пятичленные гетероциклы ведут себя активнее бензола, аналогично ароматическим аминам и фенолам. Электрофильное замещение происходит в положения 2,5 (-положения), т. е. по месту наибольшей электронной плотности. 1. Нитрование. Используют «мягкий» нитрующий агент – ацетилнитрит (смесь уксусного ангидрида с азотной кислотой) в пиридине, при этом образуются α-нитропроизводные: 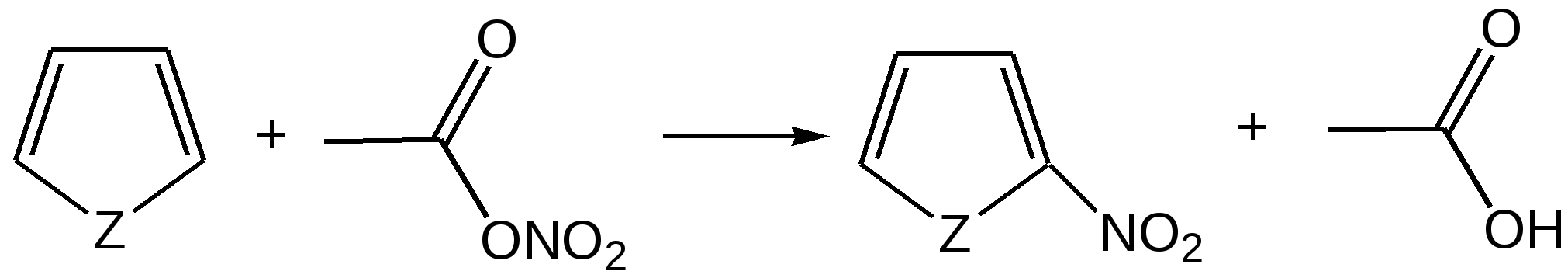 где Z = О, NH, S 2. Сульфирование. Фуран и пиррол осмоляются при действии минеральных кислот (проявляют ацидофобные свойства), т.е. в кислой среде протон связывает неподеленную пару электронов кислорода или азота, образуется оксониевый или аммониевый ион, обладающий свойствами диена с сопряженными двойными связями, который легко полимеризуется и осмоляется: 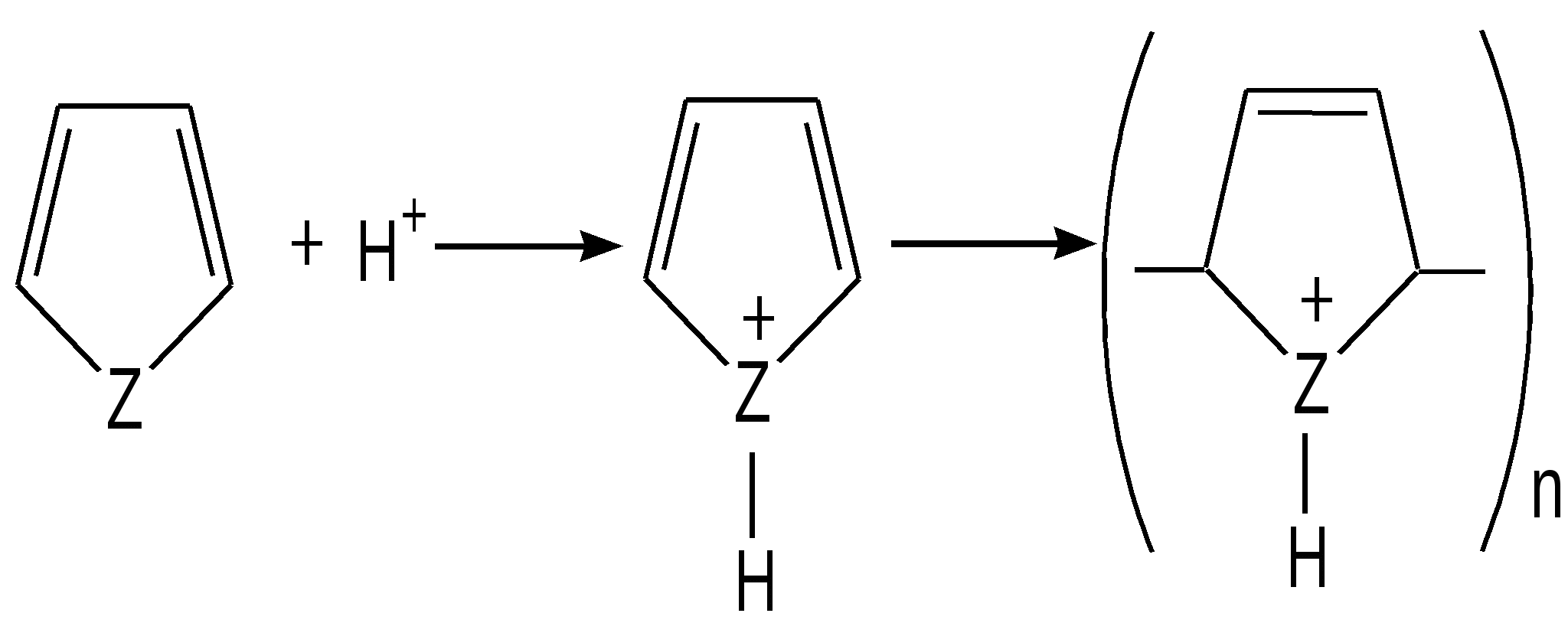 где Z = О, NH Поэтому сульфируют фуран и пиррол с помощью пиридинсульфотриоксида – комплекс пиридина с оксидом серы (VI) C6H5NSO3:  где Z = О, NH 3. Основность ацидофобных гетероциклов (ацидофобность от лат. acidum – кислота, гр. phobos – боязнь). 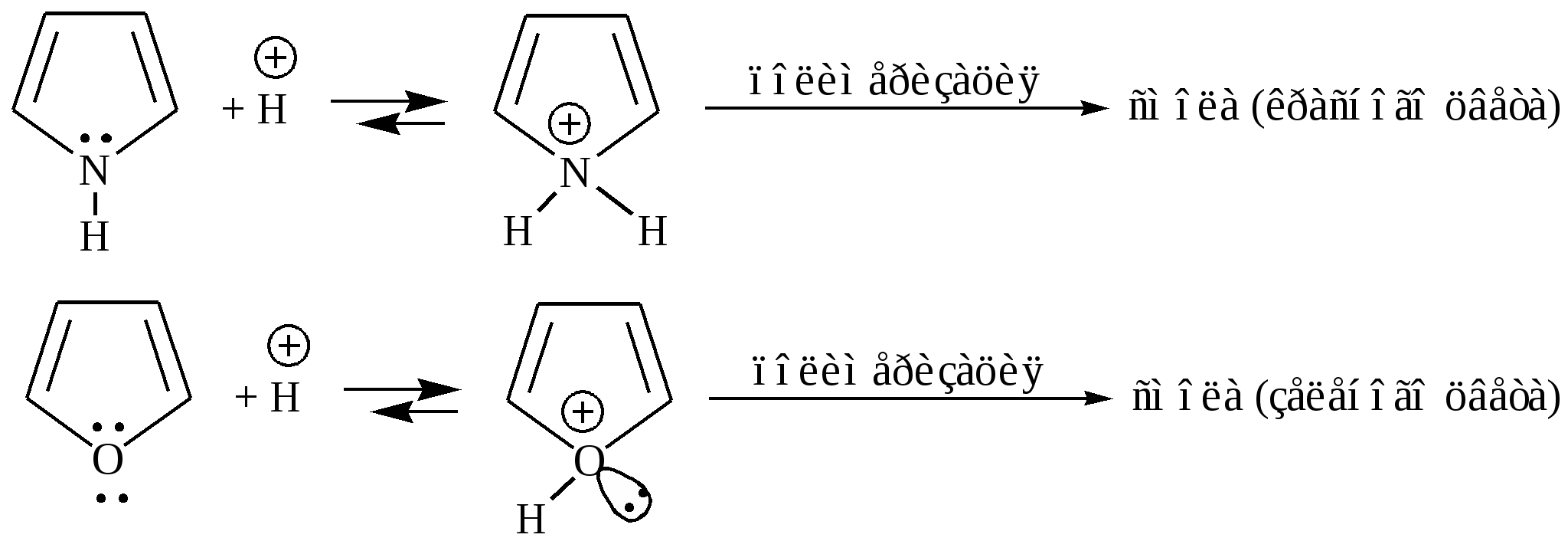 Тиофен неацидофобен, т.к. у него практически отсутствуют основные свойства. Представители пятичленных гетероциклических соединений с одним гетероатомом Фуран представляет собой пятичленный ароматический гетероцикл с атомом кислорода в кольце: 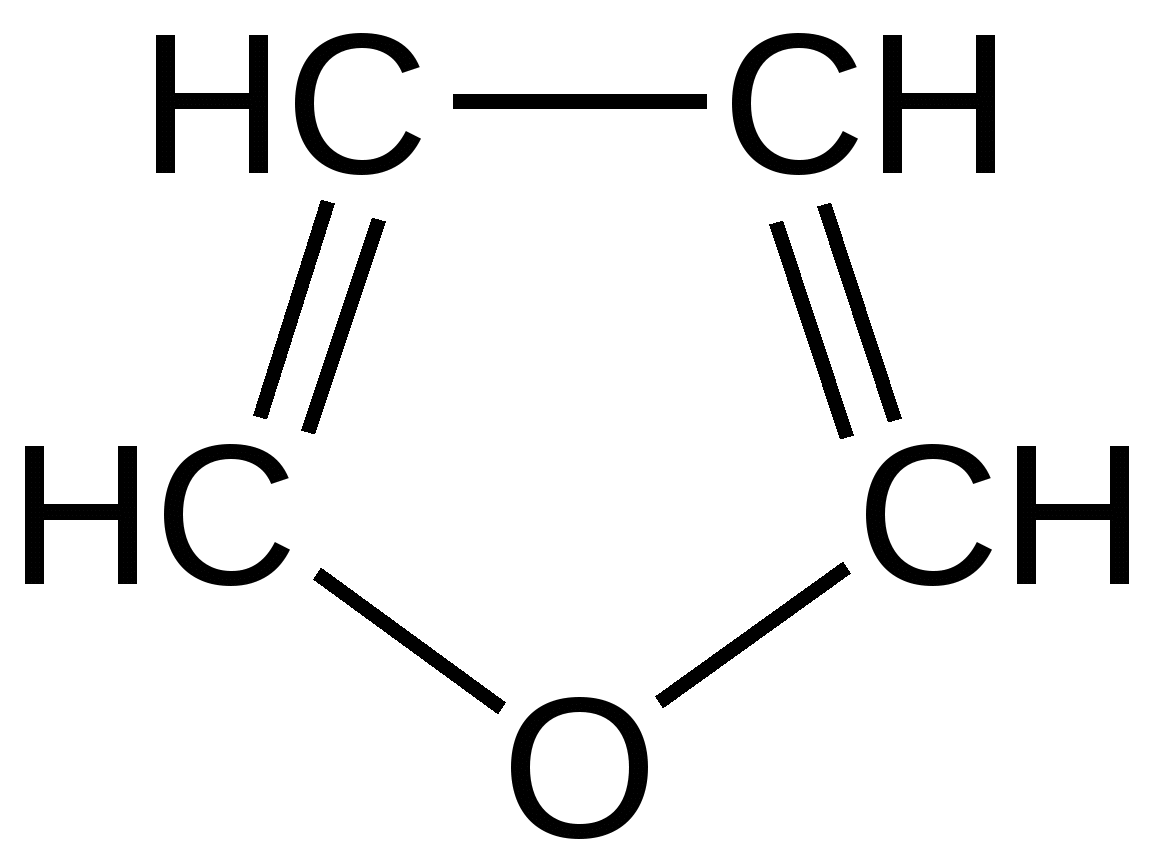 Важное место в ряду фурана занимают бензофуран и дибензофуран – соединения, в которых фурановое кольцо сконденсировано с одним или двумя бензольными кольцами:
Электронная структура фурана.Фуран является ароматическим соединением с энергией делокализации, равной 92,4 кДж/моль. Ароматические свойства фурана определяются наличием кольцевого секстета π-электронов. Секстет электронов образуется за счет 4 π-электронов двух двойных углерод-углеродных связей и неподеленной пары электронов, поставляемой атомом кислорода. Другая неподеленная пара электронов кислорода остается свободной и в определенных условиях может участвовать в образовании оксониевых соединений. Состояние электронов в атоме кислорода при вхождении его в фурановый цикл соответствует состоянию sp2-гибридизации. Две тригональные гибридные орбитали образуют две δ-связи с соседними атомами углерода. На третьей тригональной орбитали располагается первая неподеленная пара электронов. Все три тригональные орбитали согласно представлениям о sр2-гибридизации лежат в одной плоскости, совпадающей с плоскостью фуранового цикла. Вторая неподеленная пара электронов кислорода находится на чистой р-орбитали, перпендикулярной к плоскости фуранового кольца. Эта неподеленная пара электронов и участвует в сопряжении с π-электронами двойных связей фурана, образуя ароматический секстет электронов. Таким образом, атом кислорода предоставляет для образования фуранового кольца два электрона и одну атомную орбиталь: 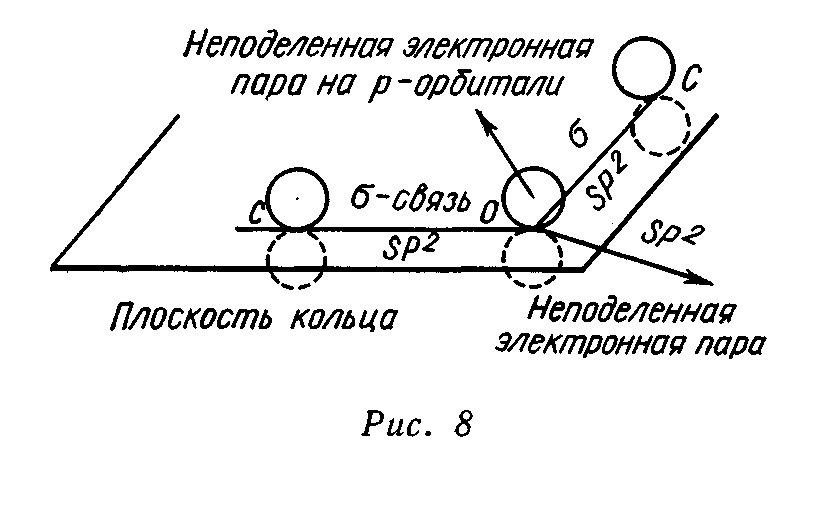 Физические свойства. Фуран представляет собой дважды ненасыщенное гетероциклическое соединение, содержащее 4 атома углерода и 1 атом кислорода, значение которых все более возрастает. Это соединение упоминалось ранее под названием фурфуран, но впоследствии за ним твердо укоренилось наименование фуран. Таблица 6 – Основные физические характеристики
Основные методы получения фурана. В настоящее время известно большое число методов получения фурана и его производных. 1. Замыкание в цикл диенольной формы 1,4-дикарбонильных соединений с выделением молекулы воды: 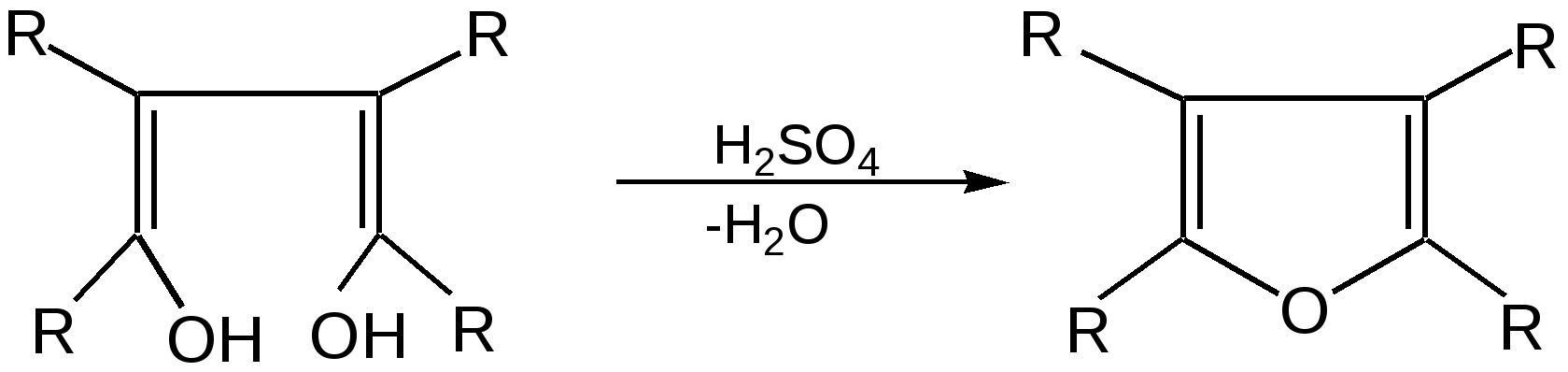 Значение этого метода ограничивается доступностью исходных дикарбонильных соединений. 2. Получение фурана из углеводов. Промышленным сырьем для получения фурана и его производных являются природные углеводы – пентозы, которые могут быть выделены при переработке растительного сырья в различных сельскохозяйственных и текстильных производствах. Первым продуктом фуранового ряда, получаемым из пентоз, является фурфурол – простейший фурановый альдегид. Фурфурол с хорошим выходом получается при действии разбавленной минеральной кислоты (H2SО4 или Н3РО4) на пентозы: при действии разбавленной минеральной кислоты (H2SО4 или Н3РО4) на пентозы: 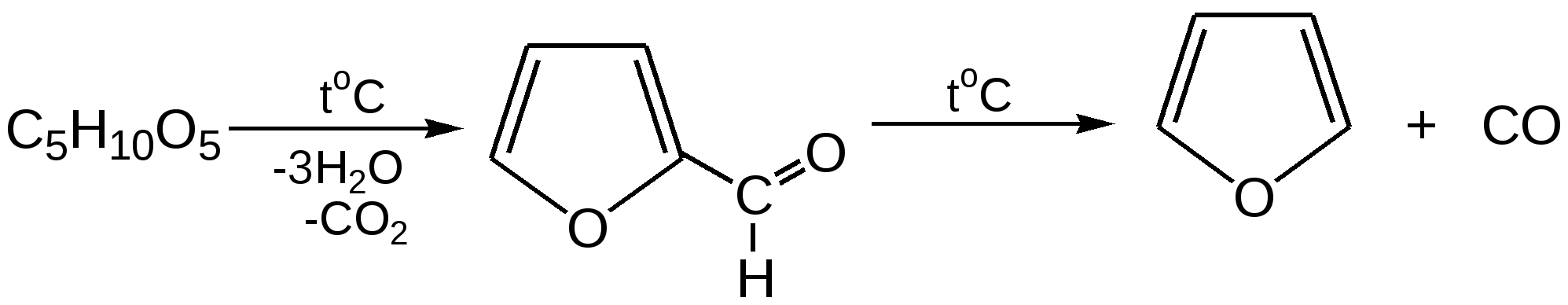 Следующая стадия заключается в декарбонилировании фурфурола. Эта реакция протекает также с хорошим выходом в условиях гетерогенного катализа при температуре 440–460 °С. В качестве катализаторов обычно используются хромит цинка и железа, окись марганца, окись кальция: 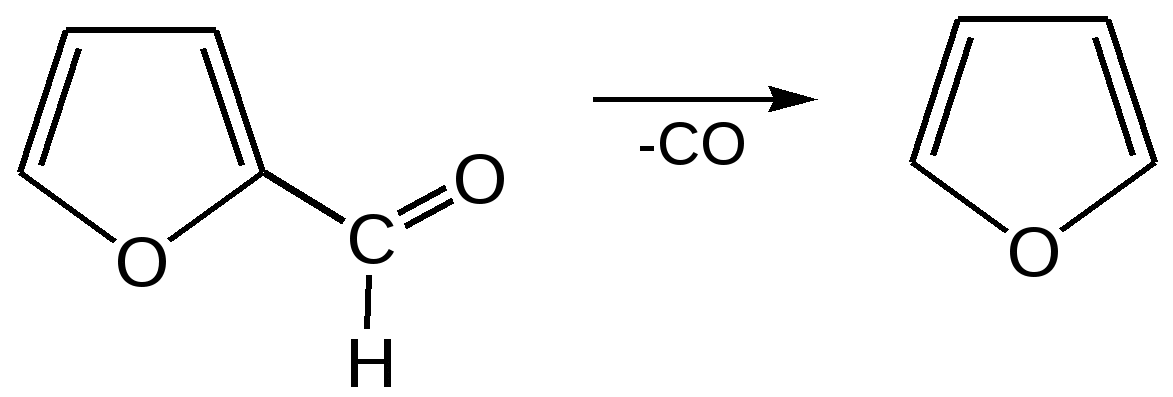 3. Сухая перегонка пирослизевой кислоты. При сухой перегонке слизевой кислоты (2,3,4,5-тетрагидроксигександиовой) образуется пирослизевая кислота, при декарбоксилировании которой (при нагревании в запаянной трубке) получается фуран: 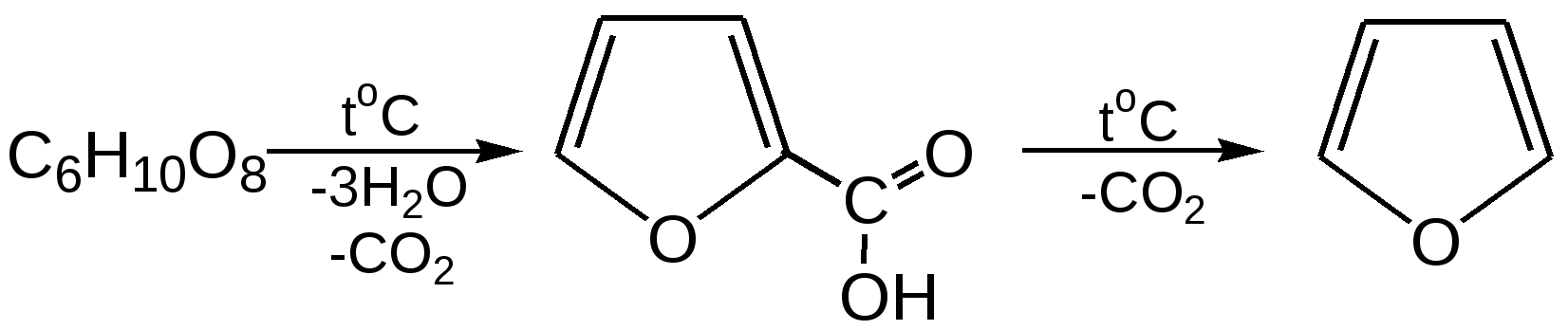 Химические свойства фурана. Наиболее характерными реакциями фурана являются реакции электрофильного замещения. Для фурана характерны реакции галогенирования, сульфирования, нитрования, ацилирования и т.д. Во всех этих реакциях фуран ведёт себя активнее бензола, аналогично ароматическим аминам и фенолам. Электрофильное замещение происходит в положения 2, 5 (-положения), т. е. по месту наибольшей электронной плотности. 1. Реакция галогенирования. Взаимодействие фурана с галогенами при низкой температуре происходит через промежуточную стадию присоединения молекулы галогена в положения 2, 5 фуранового кольца. Образующиеся продукты присоединения отщепляют галогеноводород и дают -галогенфураны. При повышенных температурах для галогенирования используют комплексы галогенов с пиридином или диоксаном. 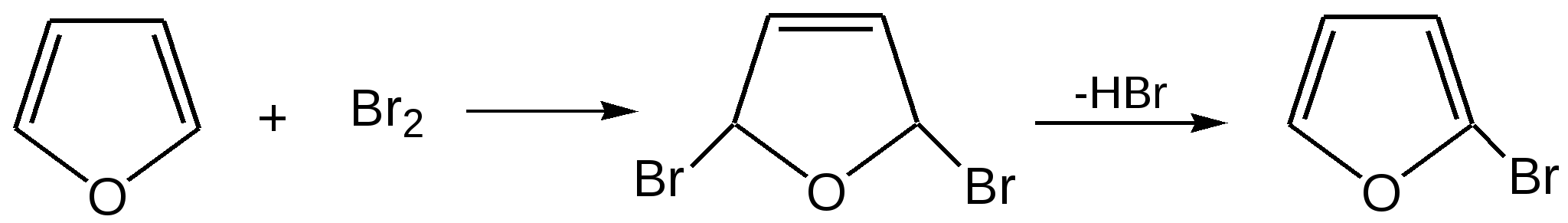 2. Реакция нитрования. Для нитрования используют «мягкий» нитрующий агент – ацетилнитрит (смесь уксусного ангидрида с азотной кислотой) в пиридине, при этом образуются -нитропроизводные: 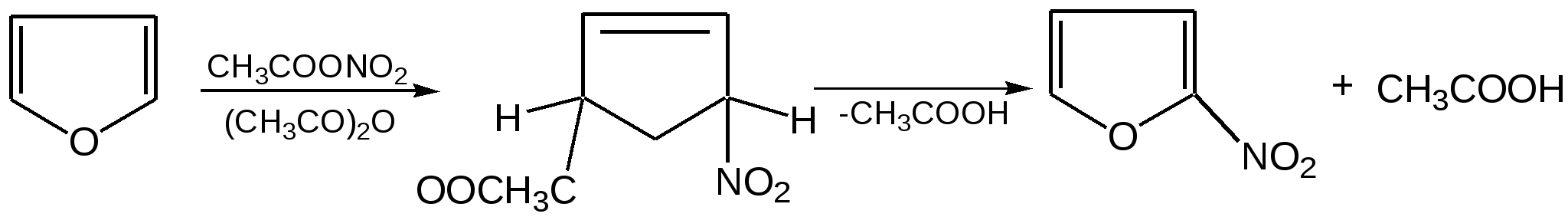 3.Реакция ацилирования. Реакцию ацилирования по Фриделю-Крафтсу проводят используя более «мягкие» катализаторы (SnCl2, SnCl4, ZnCl2, BF3) и с помощью ангидридов кислот: 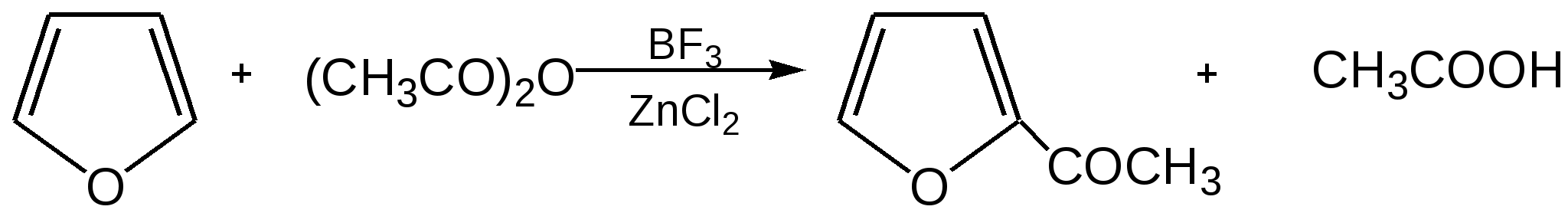 4. Реакция сульфирования. В качестве «мягкого» сульфирующего агента в ряду фурана применяется пиридинсульфотриоксид. Методика применения этого реагента была тщательно разработана А.П. Терентьевым с сотрудниками. При наличии в фурановом кольце электроноакцепторного заместителя можно осуществить сульфирование, применяя непосредственно концентрированную серную кислоту. Фуран-2-карбоновая кислота сульфируется таким образом до фуран-2-карбоновой-5-сульфокислоты с хорошим выходом. 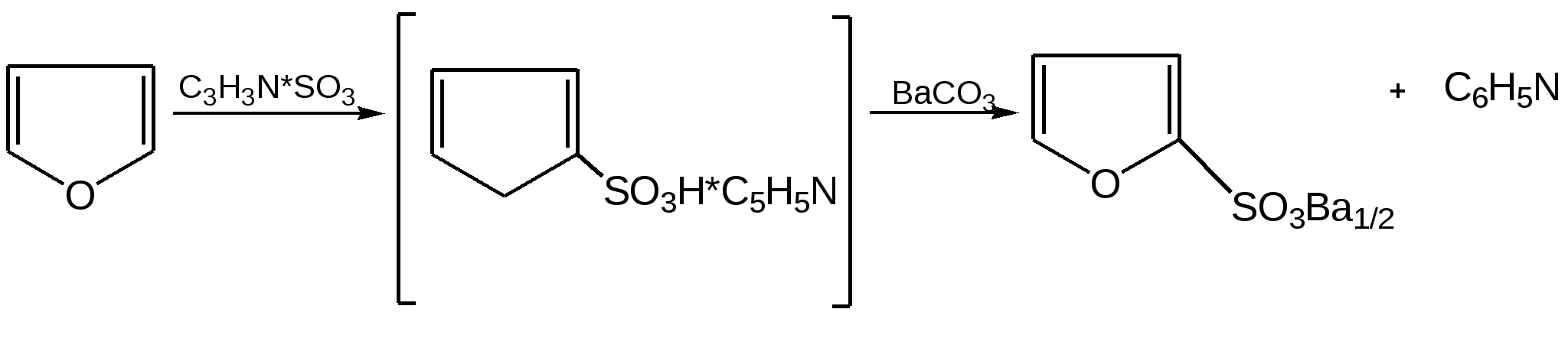 4. Реакция гидрирования. Гидрирование фурана приводит к насыщенным гетероциклическим системам, лишенным ароматических свойств. Фуран гидрируется над никелевым или платиновым катализатором до тетрагидрофурана (ТГФ): 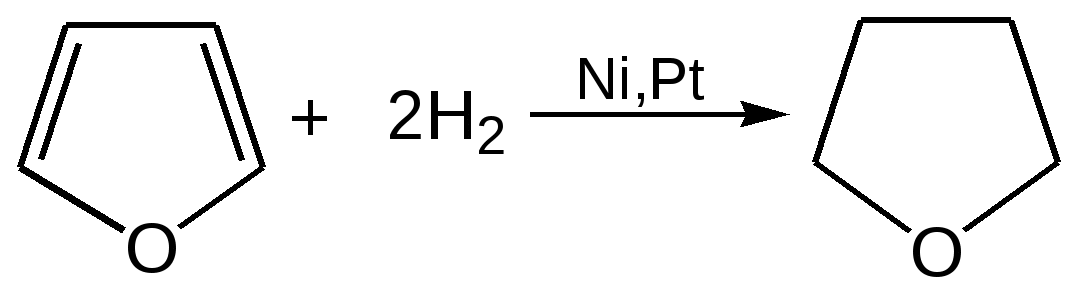 5. Реакция окисления. Фурановое кольцо чувствительно к действию окислителей. Уже на воздухе фуран самоокисляется, одновременно полимеризуясь. В условиях каталитического окисления он с хорошим выходом превращается в малеиновый ангидрид: 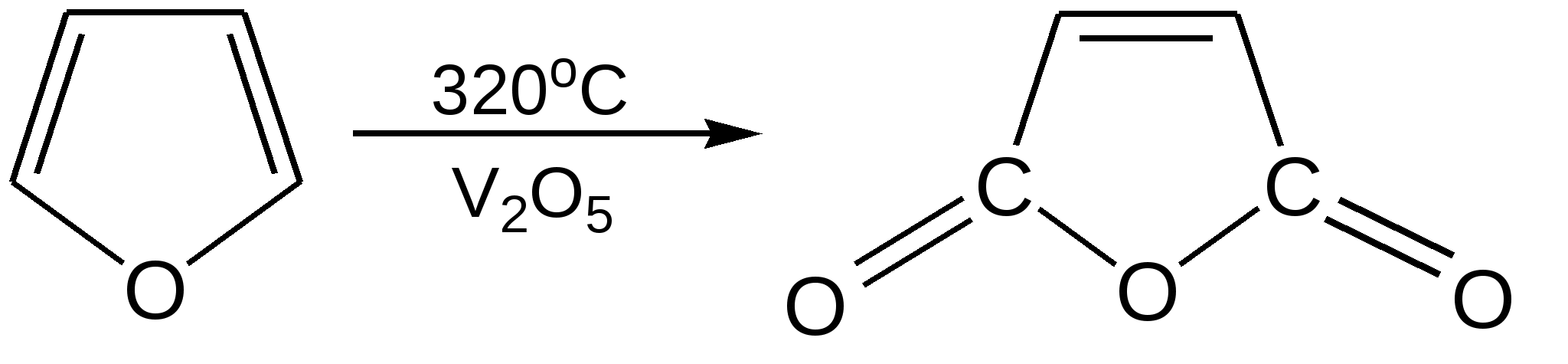 6. Реакция диенового синтеза с малеиновым ангидридом 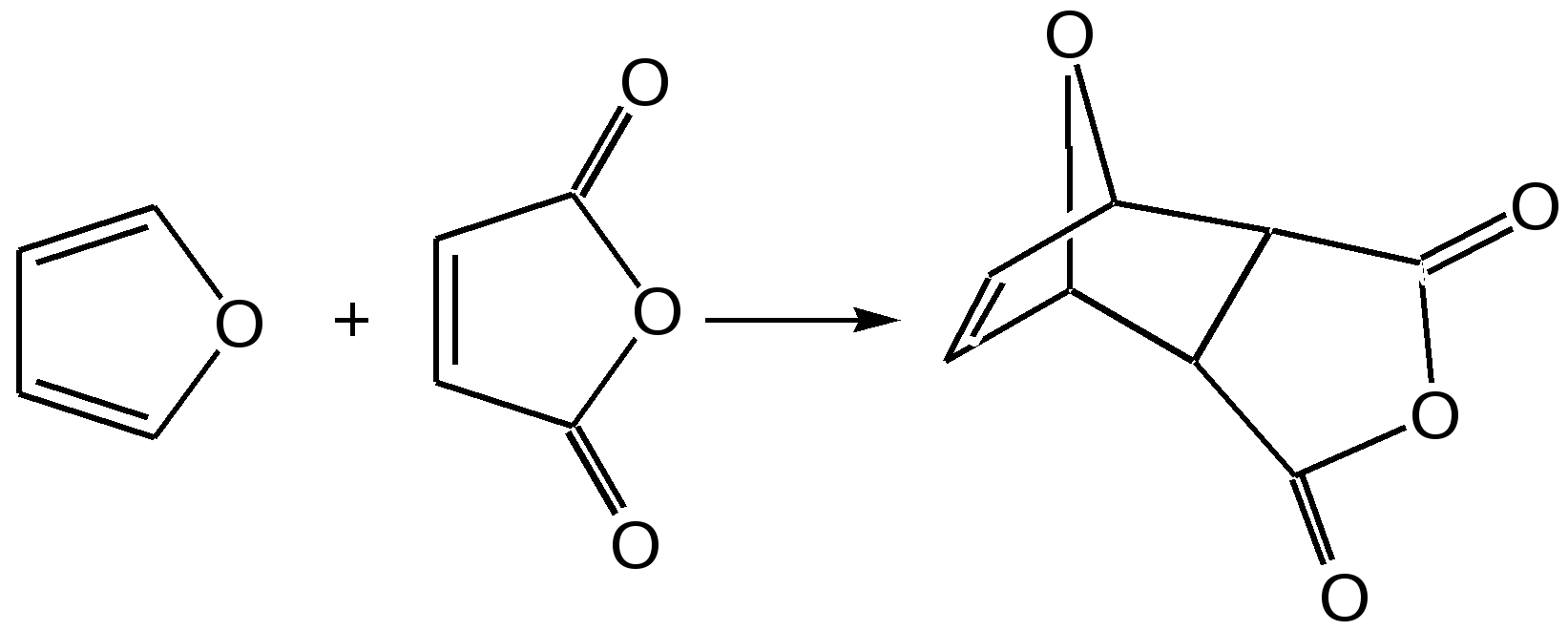 Производные фурана Тетрагидрофуран. Тетрагидрофуран получается гидрированием фурана в присутствии никелевого катализатора. 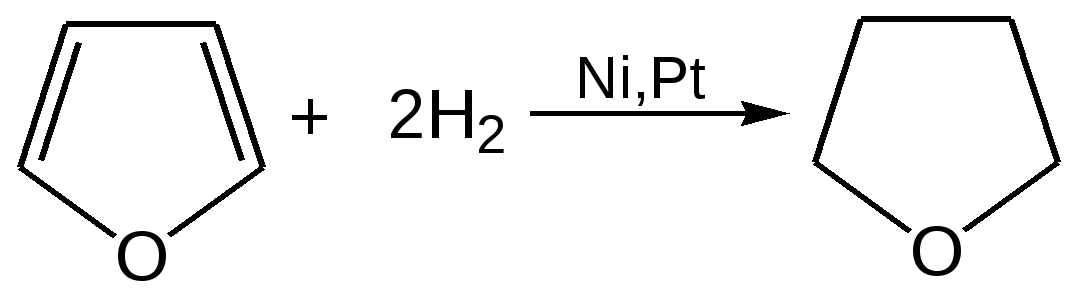 Другой метод получения тетрагидрофурана заключается в нагревании бутандиола-1,4 в присутствии дегидратирующих реагентов. 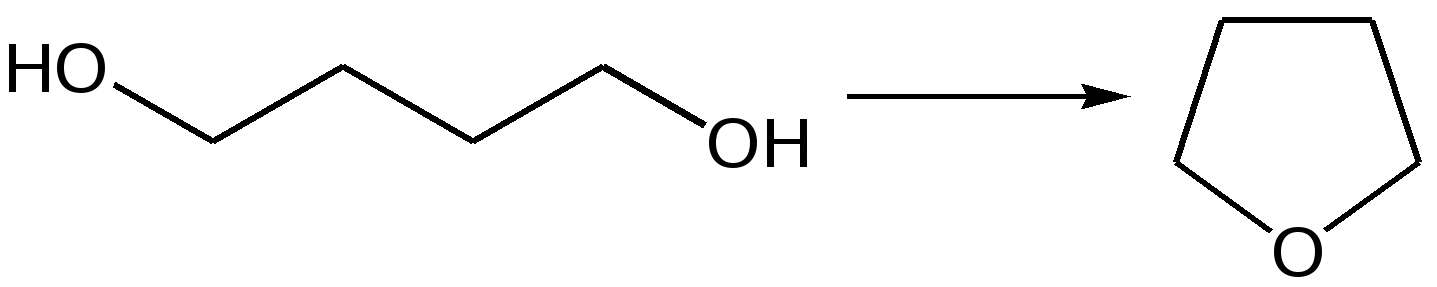 Кислородсодержащие предельные гетероциклы, не стабилизированные резонансом (энергией делокализации), ведут себя как простые циклические эфиры. Фурфурол. Одним из важнейших производных фурана является фурановый альдегид фурфурол. Он же служит исходным веществом для получения самого фурана. Фурфурол получают дегидратацией пентоз, которые образуются в результате кислотного гидролиза полисахаридов – пентозанов, содержащихся в отходах сельско-хозяйственного производства: кукурузных початках, соломе, отрубях, шелухе подсолнечника и др.: 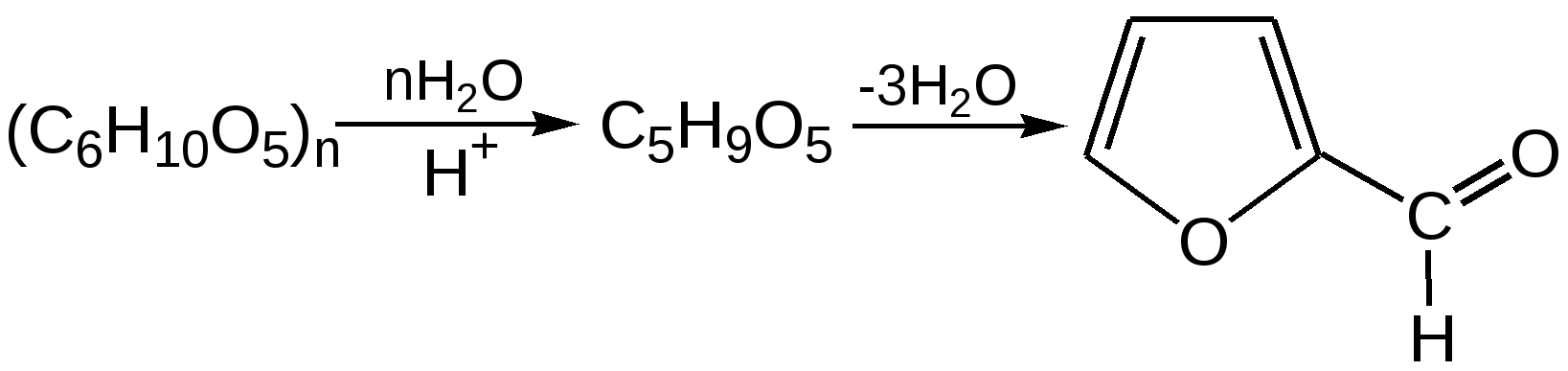 Физические свойства: фурфурол представляет собой бесцветную или слегка желтоватую жидкость с приятным запахом свежеиспеченного ржаного хлеба; температура кипения 162оС, умеренно растворим в воде. Химические свойства. Химические свойства фурфурола напоминают химические свойства типичного ароматического альдегида – бензальдегида. Подобно бензальдегиду фурфурол вступает в реакцию самоокисления-самовосстановления (С. Канниццаро): 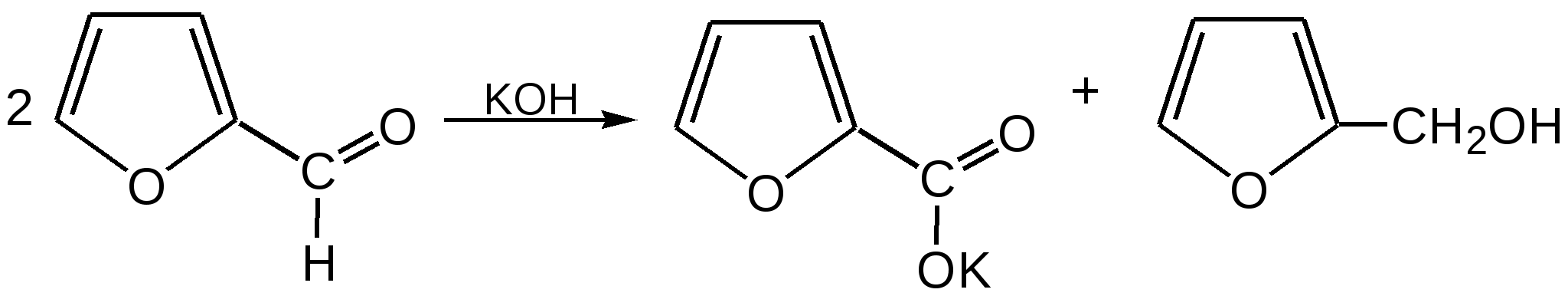 Химические свойства фурфурола можно отразить следующей схемой: 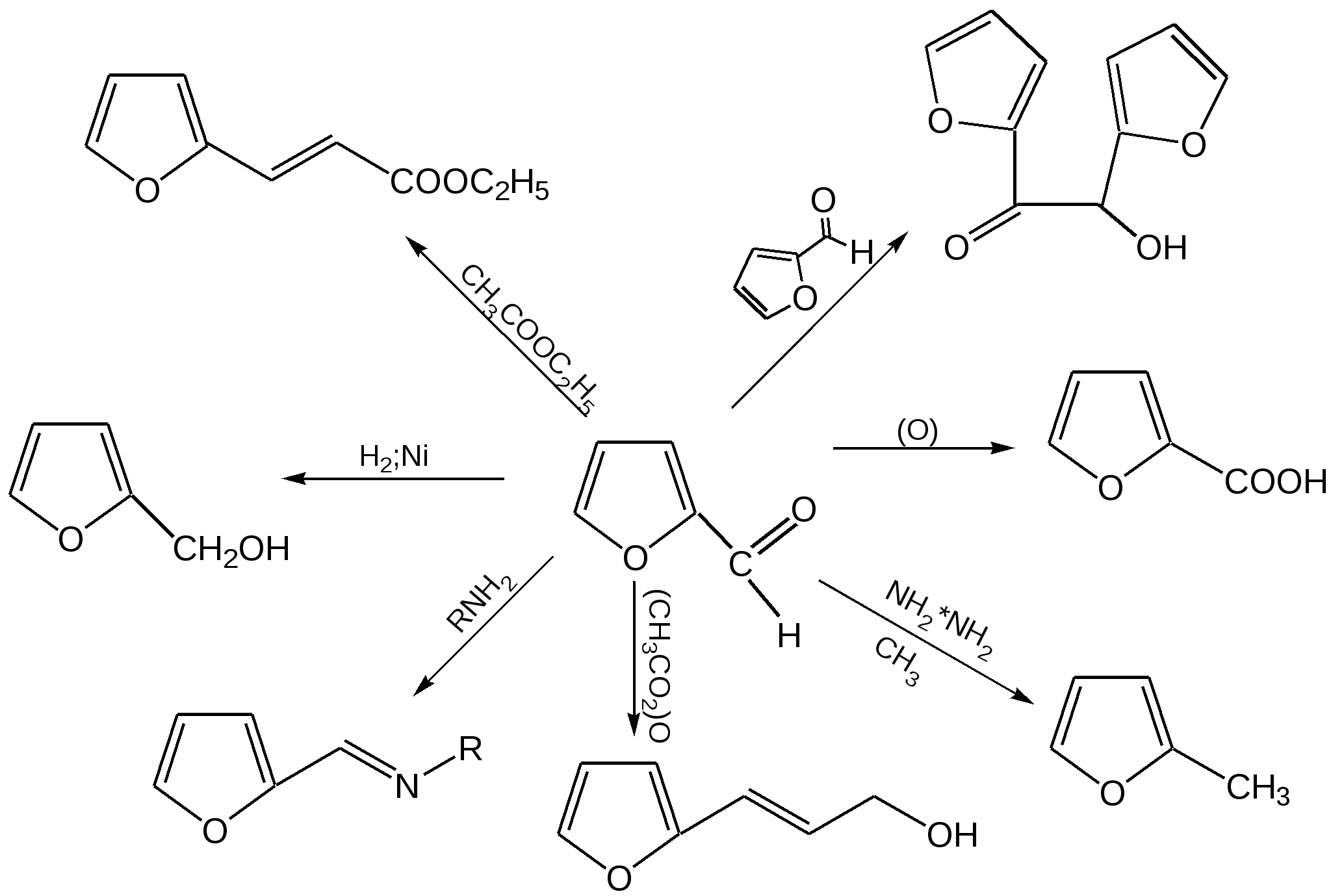 Применением фурфурола: Фурфурол широко используется в промышленности в качестве растворителя при очистке нефтяных фракций, для получения пластмасс (фенолфурфурольные смолы), фумаровой кислоты и многих соединений с фурановым кольцом, в частности, лекарственных препаратов. Например, семикарбазон 5-нитрофурфурола под названием «фурацилин» широко применяется в медицинской практике как противобактериальное средство: 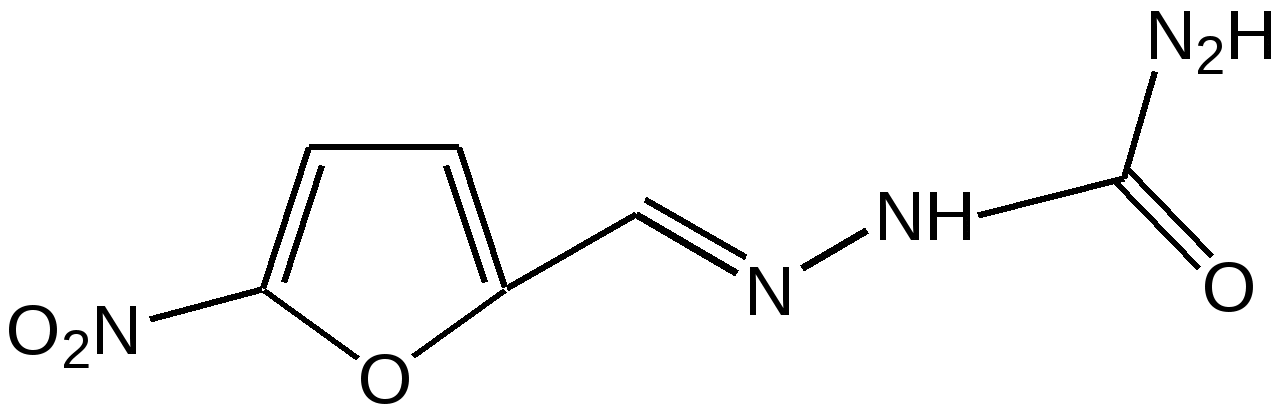 Тиофен История открытия. В. Мейер утверждал, что открытие им тиофена в 1883 г. было делом случая. В ходе лекции ему понадобилось показать образование индофенина – вещества темно-голубого цвета, которое образуется при смешивании бензола, выделенного из каменноугольной смолы, с изатином и концентрированной серной кислотой. До этого времени образование голубого вещества считалось характерной пробой на бензол. Мейер, который был осторожным и искусным экспериментатором, получил индофенин из каменноугольного бензола как раз перед началом лекции. Естественно, что он был весьма удивлен, когда оказался не в состоянии получить голубое вещество при демонстрации во время лекции. После того как его ассистент Зандмейер сообщил ему, что для лекционной демонстрации был взят другой образец бензола, а именно полученный декарбоксилированием бензойной кислоты. Мейер сразу же принялся за исследование обычного бензола, получаемого из каменноугольной смолы, и обнаружил, что он содержит небольшое количество органического сернистого соединения; оказалось, что индофенин образуется не из бензола, а из этого вещества. Было установлено, что оно является новым родоначальным соединением, которое хотя и весьма отличается от бензола по своему строению, однако поразительно сходно с ним по некоторым физическим и химическим свойствам, включая значительное число типичных реакций бензола, и во многих случаях дает производные, подобные производным бензола. Желая подчеркнуть это сходство, а также отразить наличие серы, Мейер назвал новое соединение тиофеном и немедленно начал изучение его свойств. В 1888 г. Мейер опубликовал монографию по тиофену и его производным, которая содержала огромное число сведений относительно химии этого уникального гетероциклического соединения. |