Программа блока гетерофункциональные углеводороды
 Скачать 6.9 Mb. Скачать 6.9 Mb.
|
|
Электронное строение.Высокое значение энергии делокализации пиридинового цикла – 134,4 кДж/моль – говорит о его сильных ароматических свойствах и близко к величине энергии делокализации бензола. Как и молекула последнего, молекула пиридина имеет плоскостное строение. Однако в отличие от бензола длины связей в пиридине не все одинаковые: межатомные расстояния С–С равняются 0,1394 нм, а межатомные расстояния С–N 0,1340 нм. Поэтому молекула пиридина не является правильным шестиугольником, что влечет за собой неравномерное распределение электрических зарядов и возникновение дипольного момента в молекуле. С неравномерным распределением электронной плотности мы уже встречались при изучении пятичленного азотсодержащего гетероцикла - пиррола. Однако между пирролом и пиридином в этом отношении существуют принципиальные различия, связанные с различной ролью азота в этих соединениях. 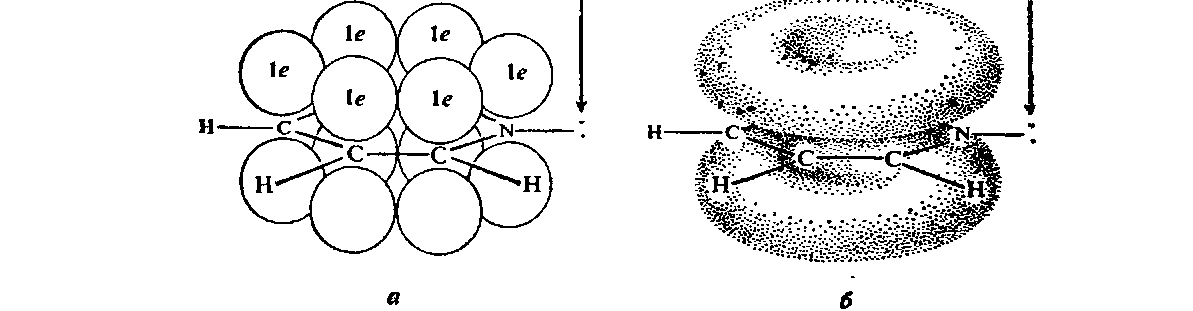 Рисунок – 2 – Молекула пиридина: а) по одному электрону на каждой р-орбитали и два электрона на sp2 орбитали азота; б) р-орбитали перекрываются с образованием π-облаков, расположенных выше и ниже плоскости кольца: два свободных электрона находятся на sp2-орбитали атома азота. Как уже упоминалось, атом азота в пиридине обладает электроноакцепторными свойствами и «стягивает» на себя всю электронную плотность цикла, в то время как атом азота в пирроле обладает электроно-донорными свойствами и отдает избыток электронного заряда в сопряженную π-электронную систему цикла. 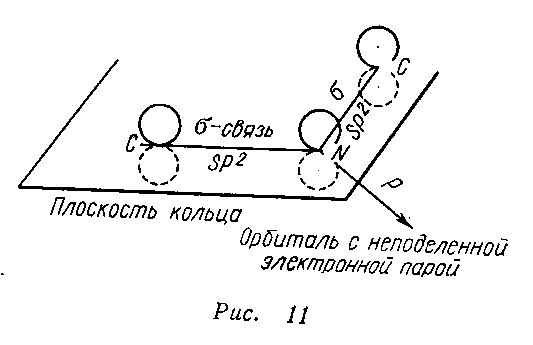 При рассмотрении электронного строения пиридина следует отметить, что не только внесение атома азота в цикл означает изменение свойств углеводородного скелета этого гетероцикла. Дополнительное взаимодействие внешней неподеленной электронной пары атома азота с циклической π-электронной системой приводит к уменьшению основности пиридина. Тем не менее, благодаря наличию НЭП у азота, пиридин легко образует комплексы с кислотами Льюиса и многими металлами. Стабильность многих таких комплексов зависит от степени сопряжения с ароматическим ядром пиридина. Физические свойства. Пиридин имеет сильный неприятный запах. Кипит при температуре 115 оС, плавится при температуре 38 оС; смешивается во всех соотношениях с водой, дипольный момент равен 2,20 D; энергия резонанса 37 ккал/моль. Водный раствор его – щелочной. С более или менее сильными кислотами он образует соли. Очень устойчив к окислению. Гомологи пиридина при окислении хромовой смесью образуют соответствующие пиридинкарбоновые кислоты. Химические свойства 1. Восстановление водородом. При восстановлении водородом в момент выделения (действуя натрием на спиртовой раствор пиридина А.Н. Вешнеградский) или над катализатором пиридин превращается в пиперидин: 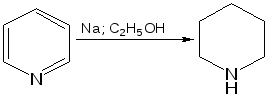 Гофмановская деструкция азотистых гетероциклов состоит в серии последовательных метилирований йодистым метилом до стадии образования четвертичной аммониевой соли, замены аниона иода на гидроксил и пиролиза аммониевого основания. При этом отщепляется вода и образуется непредельный амин, а на последней стадии – триметиламин и диеновый или полиеновый углеводород, имеющий ту же последовательность связей углеродных атомов, что и в исходном гетероцикле (последняя фаза – превращение 1,4-пентадиена в 1,3-пентадиен вызвана большей устойчивостью системы с сопряженными π-связями). Метод и применяется для установления последовательности С-С-связей в гетероцикле. В данном случае это – неразветвленная цепь из пяти углеродных атомов. Подобным образом может быть установлено строение и гомологов пиридина. Переходя в пиперидин (гексагидропиридин), пиридин присоединяет шесть водородных атомов, следовательно, он имеет три двойные связи. Ароматические свойства пиридина доказывают бензоидность этих связей. 2. Взаимодействие пиридина с эфиром хлорсульфоновой кислоты и затем со щелочью: в результатеобразуется натриевый енолят глутаконового альдегида: 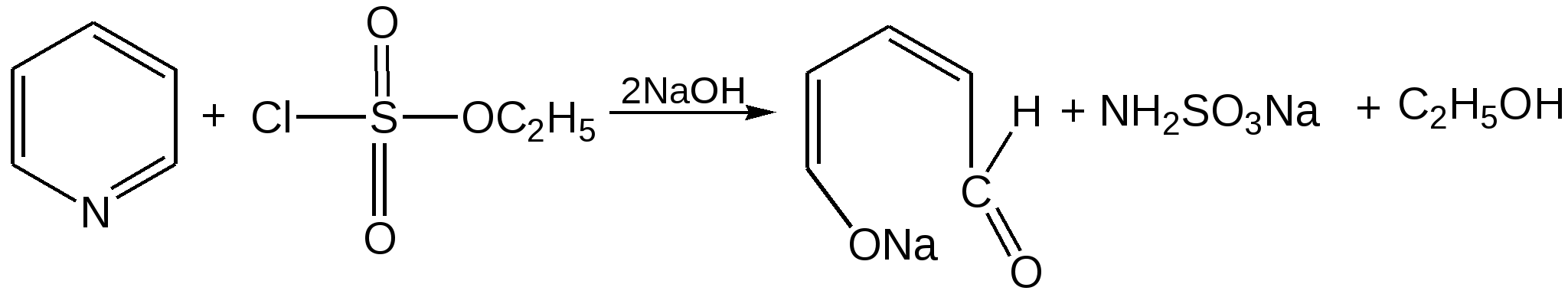 3. Нуклеофильные замещения в пиридине. А.Е. Чичибабин и О.А. Зейде нашли, что при нагревании пиридина примерно до 130° С в растворе ксилола с амидом натрия образуется с хорошим выходом α-аминопиридин. Реакция представляет собой типичную нуклеофильную атаку на ароматическое ядро: 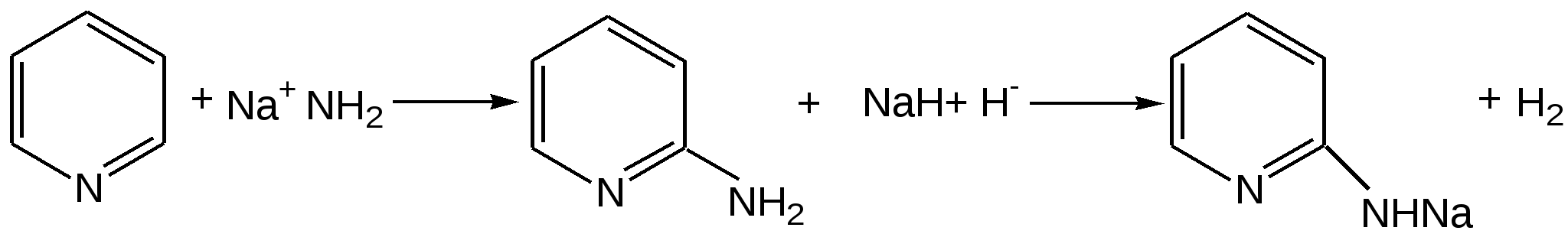 При значительно более высокой температуре (400 оС) подобная реакция происходит и между пиридином и твердым едким кали: 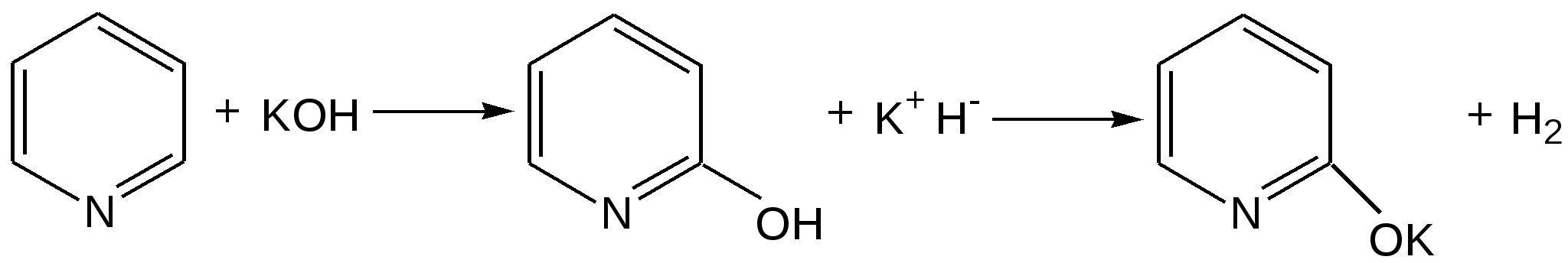 Аналогично, но в мягких условиях, на пиридин действуют такие еще более сильные нуклеофилы, как металлорганические соединения щелочных металлов: 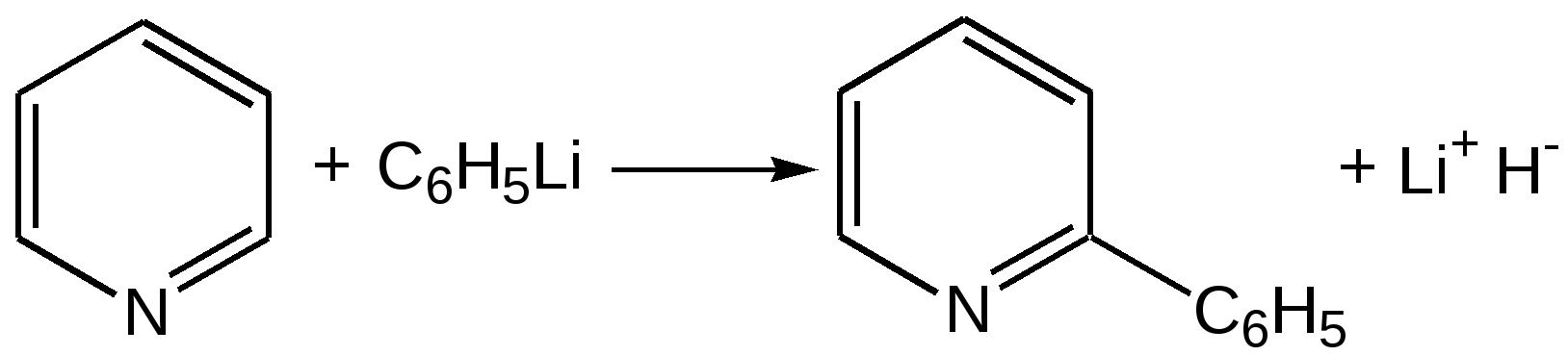 При взаимодействии с галоидным альдегидом и вслед за этим – с анилином получается енольная форма дианила глутаконового альдегида: 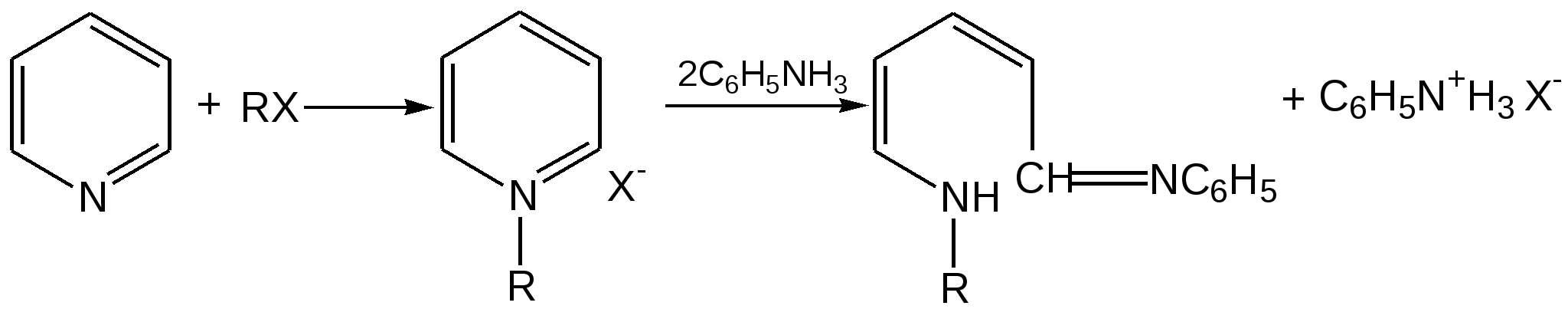 Такого рода размыкания пиридинового цикла применяются в синтезе открытых систем с сопряженными двойными связями. Таким образом, этот синтез дает смесь изомеров, подлежащую разделению. 4. Меркурирование. Пиридин и многие его производные легко подвергаются меркурированию при взаимодействии с ацетатом ртути, давая 3-пиридилмеркурацетат и его производные. При добавлении ацетата ртути к пиридинупри комнатной температуре образуется продукт присоединения, растворимый в избытке пиридина. Если продукт присоединения нагревать при 155 °С в сухом виде в присутствии воды, то происходит замещение в ядре и образуется 3-пиридилмеркурацетат с выходом 35–50 %. 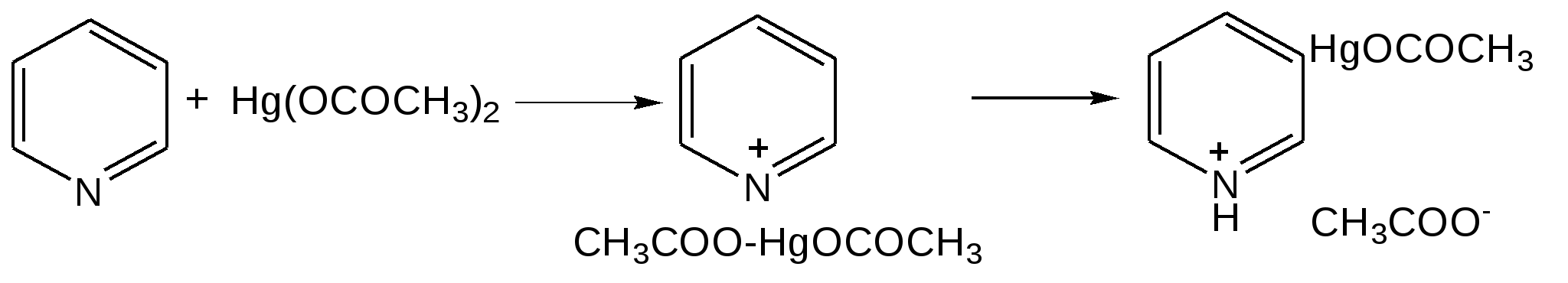 5. Алкил- и арипиридиниевые соединения. Соли пиридиния. Среди продуктов присоединения пиридинового ряда наиболее важными являются четвертичные алкил- и арилпиридиниевые соли. При добавлении йодистого метила к пиридину реакция идет настолько энергично, что необходимо охлаждение. Обычно эту реакцию проводят в инертном растворителе, например в бензоле, из которого йодистый N-метилпиридиний (часто называемый иодметилатом пиридина) выделяется в виде бесцветных кристаллов с выходом, близким к количественному: 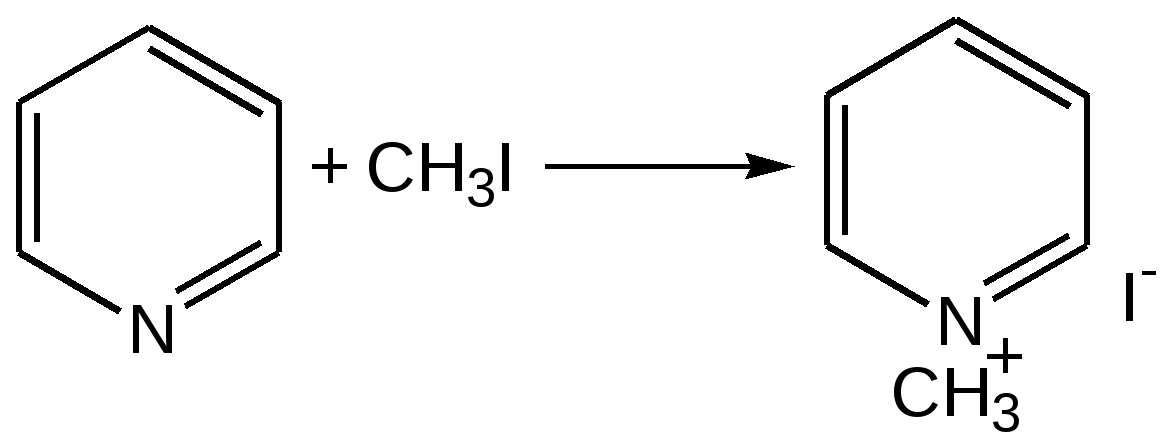 6. Восстановительное расщепление. Частично или полностью восстановленные производные пиридина теряют устойчивость цикла, присущую самому пиридину, и вследствие этого восстановление их в некоторых условиях приводит к разрыву шестичленного кольца. Конечно, и продукт восстановления самого пиридина – пиперидин может быть подвергнут специальным реакциям расщепления, например исчерпывающему метилированию или расщеплению его N-бензоильного производного по методу Брауна. Известно, например, что каталитическое гидрирование пиридина над никелевыми катализаторами, особенно при высокой температуре, дает π-амил-амин, π-пентан и аммиак .Вероятно, они образуются при гидрогенолизе первоначального продукта восстановления - пиперидина. Пиперидин. Химия пиридина обусловлена ароматическим характером последнего в то время как химия пиперидина обусловлена прежде всего свойствами пиперидина как вторичного амина. Так как шестичленное пиперидиновое кольцо насыщено, то здесь существуют все те возможности оптической и геометрической изомерии, которые установлены в ряду циклогексана. Вследствие неполной симметричности пиперидинового цикла важную роль в определении числа таких изомеров играют положения групп в цикле. Дегидрирование пиперидинов. Хорошо известно, что пиперидины могут быть дегидрированы до пиридинов. Однако практическое значение этого метода невелико. При дегидрировании производных пиперидина имеет место иногда аномальный ход реакции: 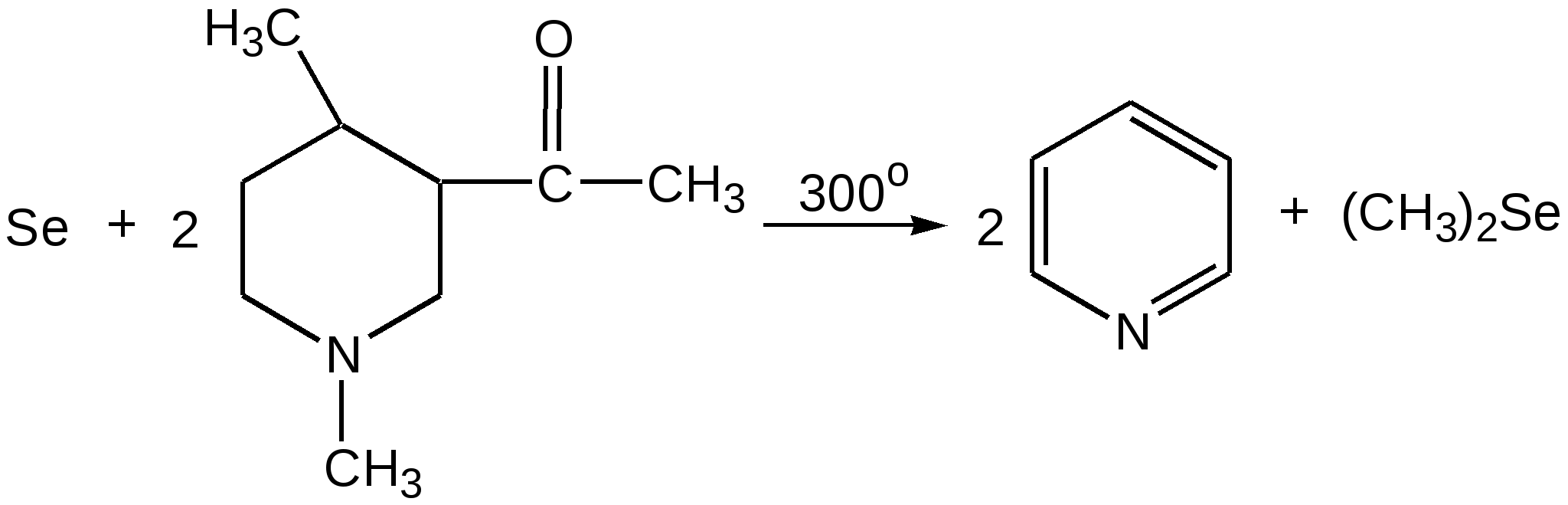 Производные пиридина и пиперидина, их биологическая активность. Многие производные пиридина обладают ярко выраженной биологической активностью. Ядро пиридина содержится в молекуле витамина РР, являющегося амидом никотиновой (-пиридинкарбоновой) кислоты: 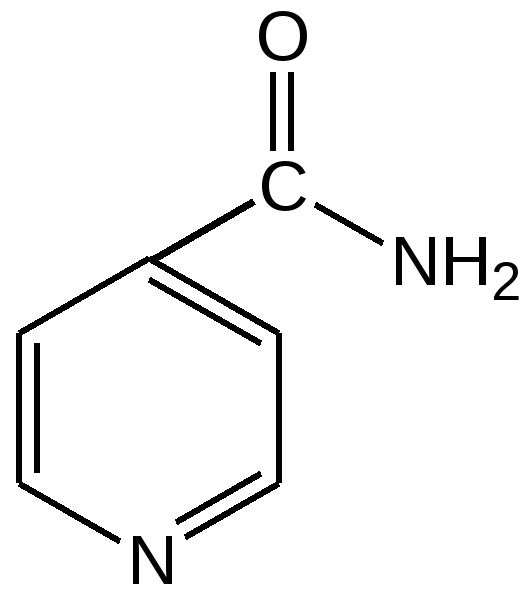 Витамин РР применяется для лечения пеллагры и других заболеваний, а также входит в состав никотинамидадениндинуклеотида (НАД+) и никотинамидадениндинуклеотидфосфата (НАДФ+), являющихся коферментами большого числа ферментов оксидоредуктаз, катализирую-щих ОВР, лежащие в основе биологического окисления. Пиридиновый цикл является также основным структурным элементом молекул многих алкалоидов. Алкалоиды – это группа азотистых соединений, обладающих основными свойствами и встречающихся в основном в растениях. Очень часто алкалоиды обладают сильным физиологическим или фармакологическим действием. Ряд известных алкалоидов содержит ядро пиридина и пиперидина. К ним относятся никотин, анабазин, кониин и др. Никотинв виде солей лимонной и яблочной кислот (является сильным основанием) в большом количестве (до 3 %) содержится в листьях и корнях табака. Это один из наиболее ядовитых алкалоидов, 40 мг никотина является смертельной дозой для человека. В небольших дозах он возбуждает центральную и периферическую нервные системы, повышает кровяное давление. Структурные формулы никотинамидадениндинуклеотид (НАД+) и никотинамидадениндинуклеотидфосфат: 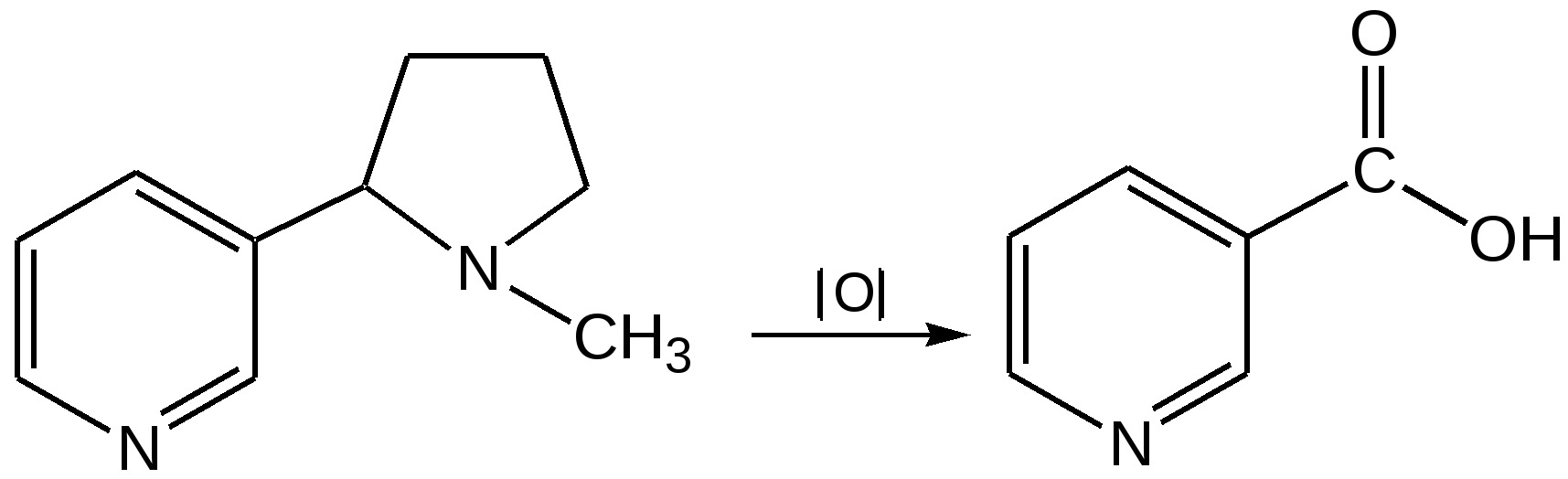 Анабазин– изомер никотина, содержится в листьях табака: 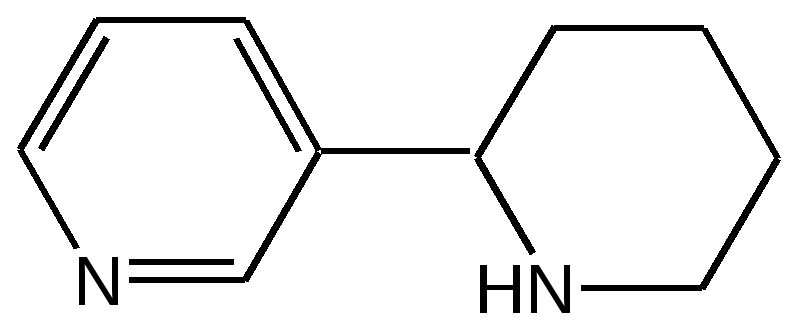 Являясь сильным ядом для насекомых, анабазин вместе с никотином применяется в сельском хозяйстве в качестве инсектицида. Кониин – сильный яд, содержащийся в соке болиголова, вызывающий паралич двигательных центров, а в больших дозах – паралич дыхательного центра. 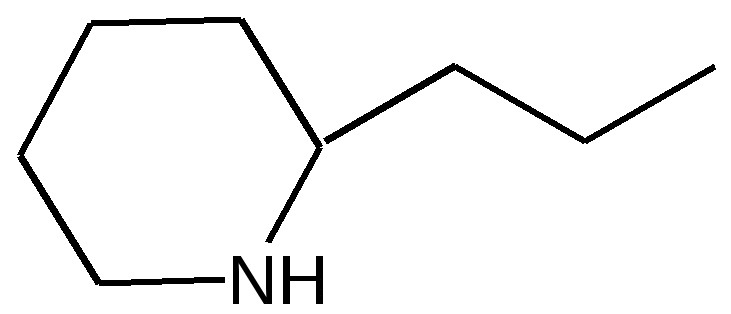 Витамин В6 представляет собой смесь трех веществ – пиридоксаля I, пиродоксола II и пиродоксамина III, которые являются производными 3-гидроксипиридина и отличаются друг от друга природой замещающей группы в положении 4 пиридинового кольца: 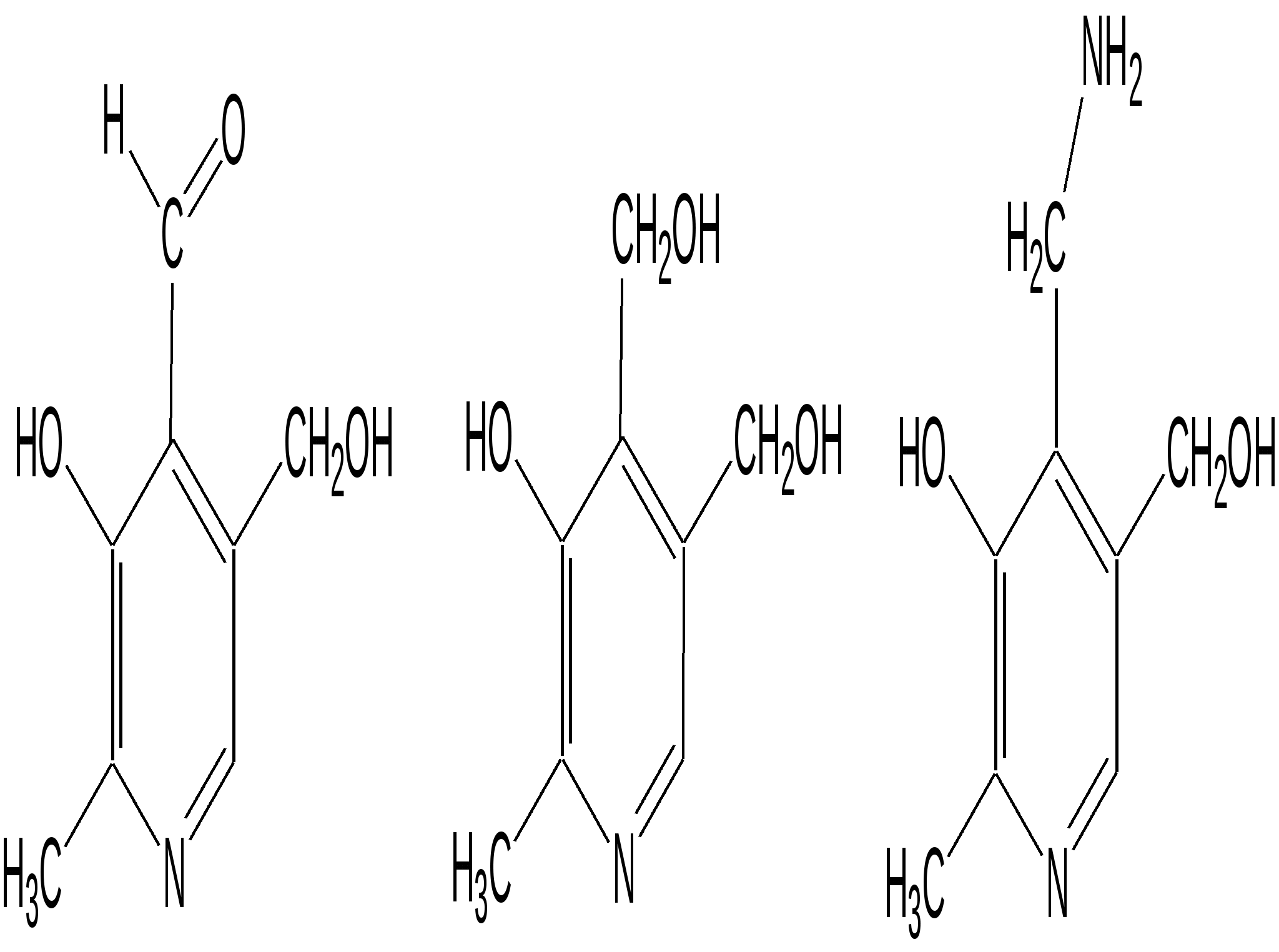 Эти витамины входят в структуру ферментов, регулирующих белковый обмен и катализирующих, в частности, реакции переаминирования и декарбоксилирования аминокислот. Оказалось, что коферментные функции выполняют только фосфорилированные производные пиродоксаля и пиридоксамина: 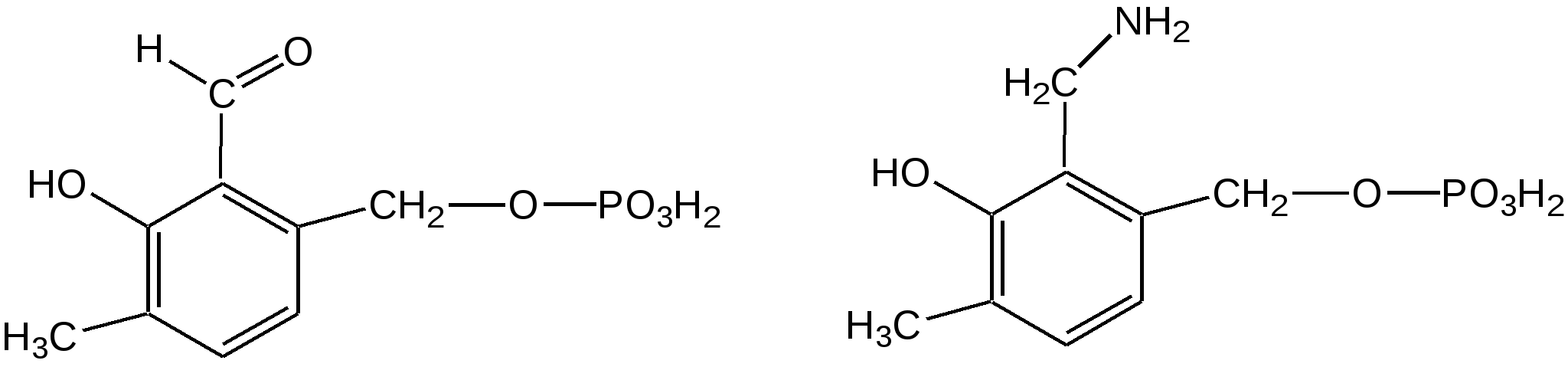 Доказано, что пиридоксальфосфат является простетической группой ферментов аминотрансфераз, катализирующих обратимый перенос аминогруппы от аминокислот на -кетокислоту, и декарбоксилаз аминокислот, осуществляющих необратимое отщепление СО2 от карбоксильной группы аминокислот с образованием биогенных аминов. Хинолин содержит бензольное и пиридиновое кольца, соединенные, как показано в формуле: 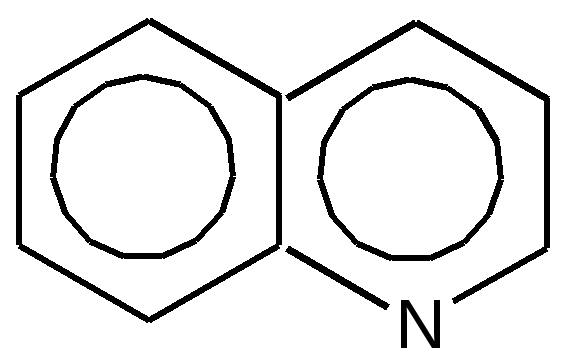 В целом свойства хинолина вполне соответствуют тому, что можно было ожидать на основании свойств уже изученных пиридина и нафталина. Хинолин и его гомологи содержатся в каменноугольной смоле, а также в некоторых нефтях, откуда их и получают. Кроме этого, разработаны синтетические методы получения этих соединений. Из них наиболее широко используется синтез Скраупа, который заключается в нагревании анилина с глицерином и концентрированной серной кислотой в присутствии нитробензола в качестве окислителя. В результате дегидратации серной кислотой глицерин превращается в акролеин, который конденсируется с анилином в дигидрохинолин, окисляющийся в хинолин нитробензолом: 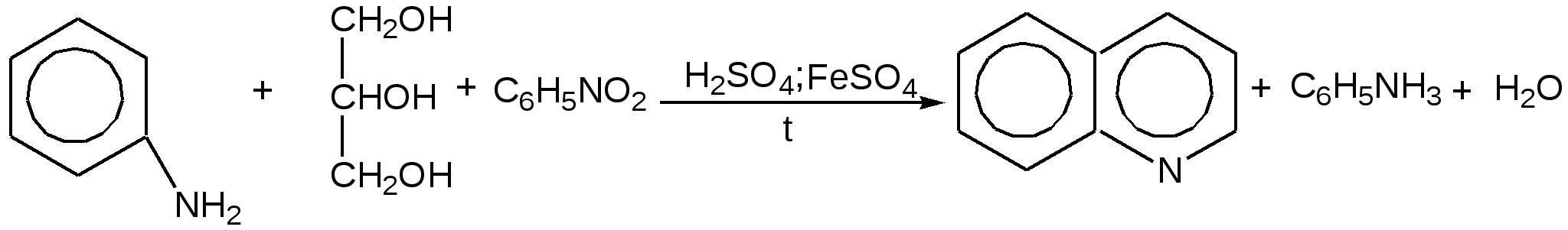 Этот синтез включает следующие стадии: 1. Дегидратация глицерина действием горячей серной кислоты, дающую непредельный альдегид – акролеин: 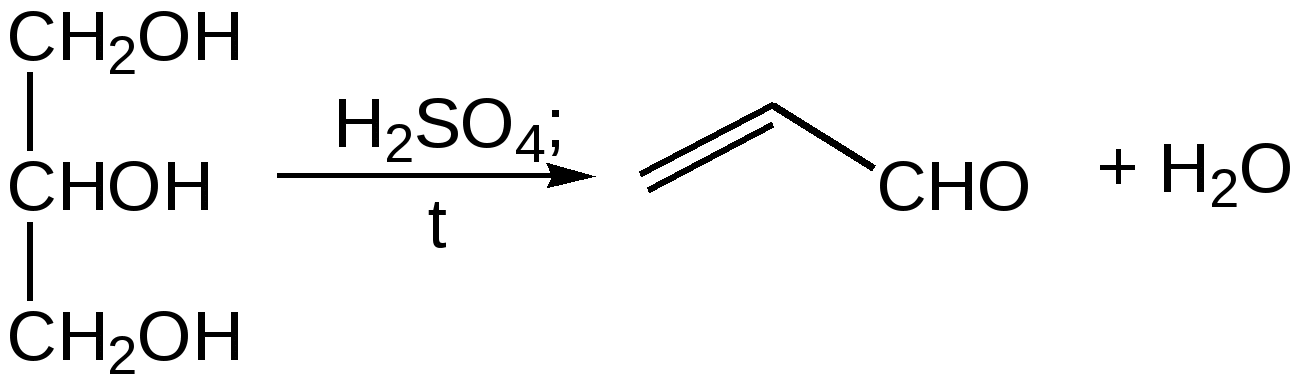 2. Нуклеофильное присоединение анилина к акролеину, приводящее к β-пропионовому альдегиду: 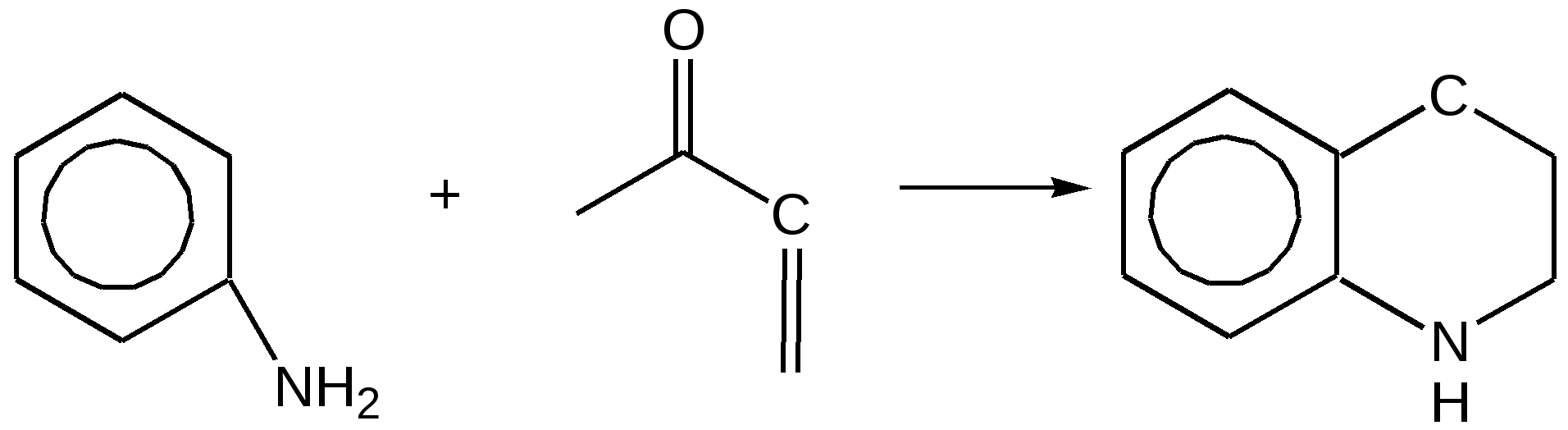 Хинолин подобен пиридину как по физическим свойствам, так и по химическим превращениям. Основные свойства у хинолина менее выражены, что является результатом влияния бензольного кольца, в сторону которого и смещена электронная плотность. Но как и пиридин, хинолин образует соли хинолиния с кислотами: соляной, серной, азотной; легко окисляется в N-окись: 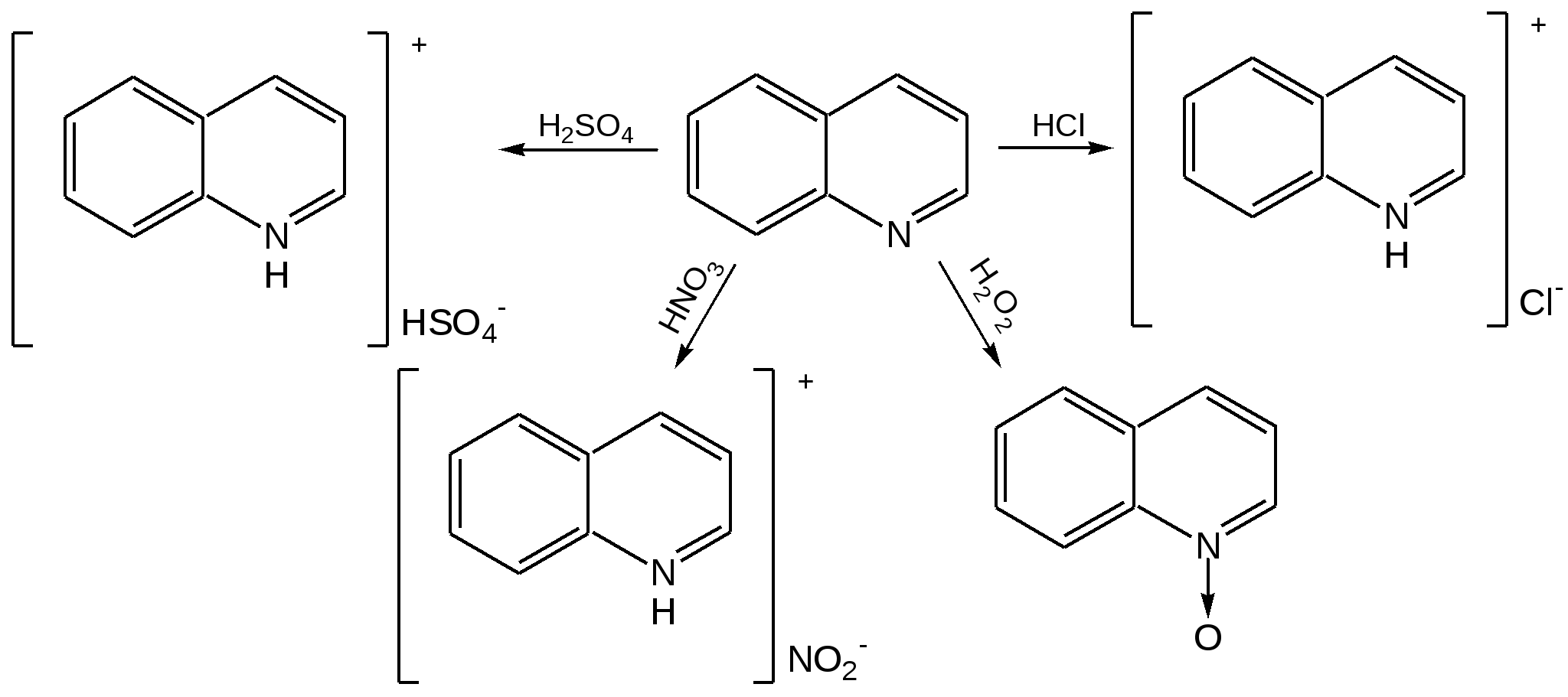 Являясь ароматической системой, содержащей децет -электронов, хинолин вступает в реакции электрофильного и нуклеофильного замещения. Электрофильные реагенты атакуют бензольную половину молекулы хинолина в положения 5 и 8, причем реакции протекают легче, чем для пиридина: 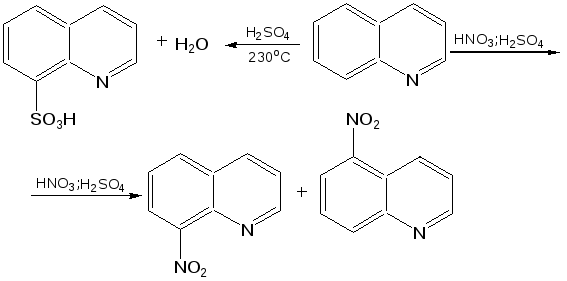 Реакции нуклеофильного замещения протекают по пиридиновому кольцу в положения 2 и 4, причем для 2- и 4-оксихинолинов возможна окси-оксо-таутомерия (оксо-форма более устойчива): 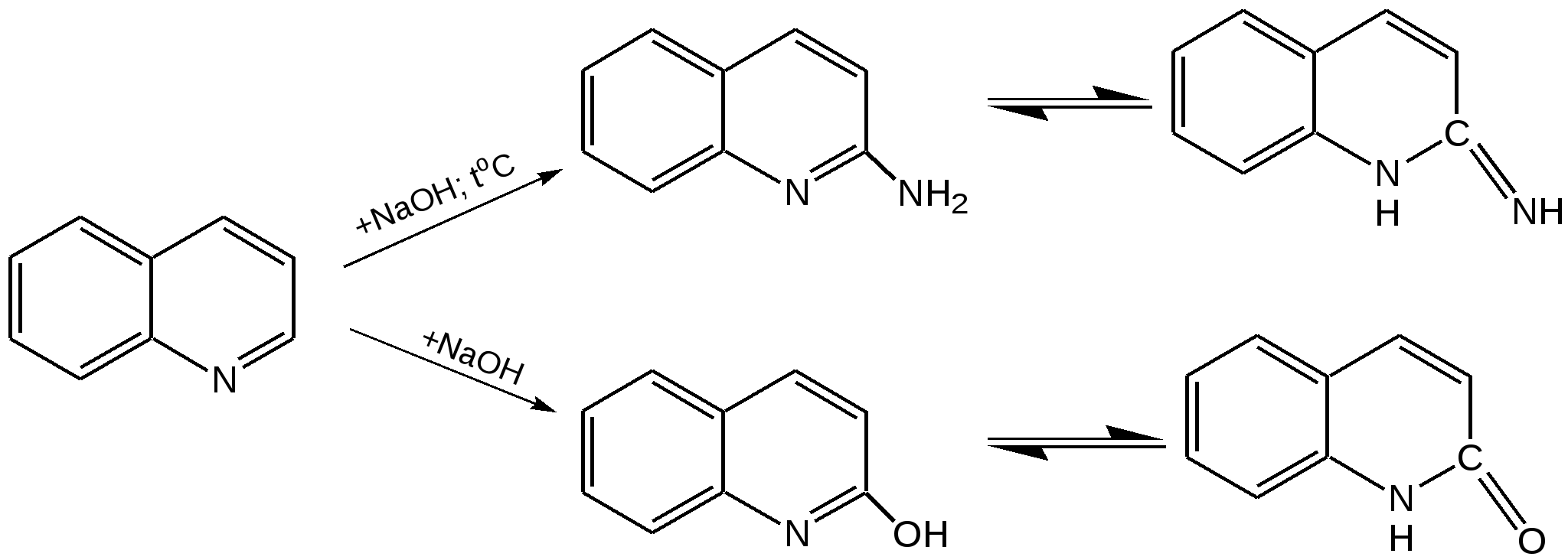 При окислении хинолина образуется 2,3-пиридиндикарбоновая (хинолиновая) кислота, т. е. окисляется бензольное кольцо. Восстановлению, наоборот, поддается пиридиновый цикл: 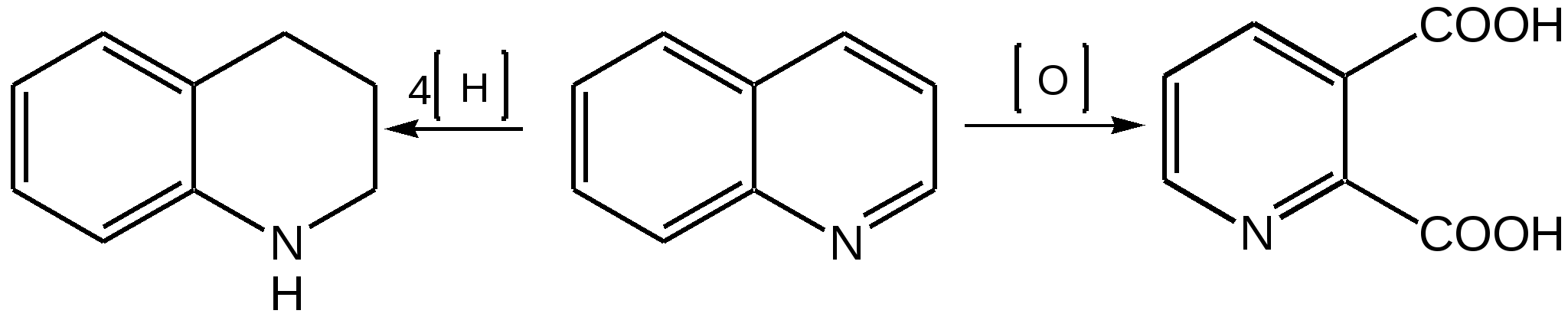 Ряд замещенных хинолина используется в синтезе лекарственных препаратов и красителей. 8-оксихинолин (оксин) широко применяется в качестве реагента в аналитической химии. В природе хинолиновое и изохинолиновое ядра встречаются в молекулах алкалоидов (хинин, папаверин), наркотиков (морфин, кодеин, героин и т.д.). 4.4 ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ С НЕСКОЛЬКИМИ ГЕТЕРОАТОМАМИ Пиримидин. Является важнейшим из шестичленных гетероциклов с двумя атомами азота. Пиримидиновый цикл входит в многочисленные природные соединения: нуклеиновые кислоты, витамины, коферменты, является составной частью кольца пуринов, например мочевой кислоты:  Сопряженная кольцевая система молекулы пиримидина состоит из шести -электронов (4 электрона от атомов углерода и 2 электрона от двух атомов азота) и обеспечивает его высокую ароматичность, энергия сопряжения 109,2 кДж/моль (для бензола 150,7 кДж/моль). Наличие двух электроотрицательных атомов азота в цикле приводит к еще более неравномерному распределению электронной плотности, чем в пиридине. Здесь наблюдается сильное наложение мезомерного и индуктивного эффектов. В положениях 2,4 и 6, где влияние–I эффекта атомов азота проявляется особенно сильно, будет наибольший положительный электронный заряд, т. е. наименьшая электронная плотность, в то же время положение 5 испытывает наименьшую потерю электронов, где и будет наибольшая электронная плотность. Нуклеофильные реагенты атакуют положения 2, 4, 6, а электрофильные – положение 5 в соответствии с поляризацией этих положений. Взаимодействие НЭП атомов азота с -электронами в ароматической системе приводит к уменьшению основности атомов азота пиримидина и поэтому она значительно ниже, чем у пиридина. Вследствие этого протонирование по атомам азота пиримидина протекает лишь в очень сильных кислотах и приводит к образованию соли только по одному атому азота. Сам пиримидин инертен к электрофильной атаке. И только введение электронодонорных заместителей (–NH2, –OH, –SH) в положения 2, 4, 6 делает возможным электрофильную атаку положения 5 кольца пиримидина. Пиримидин с двумя электронодонорными заместителями вступает в электрофильное замещение как бензол, а с тремя электронодонорными заместителями в кольце реагирует легко, подобно фенолу. Например, нитрование требует двух электронодонорных групп (при взаимодействии 2 амино-4-гидроксипиримидина с азотной кислотой получается 2-амино-4-гидрокси-5-нитропиримидин): 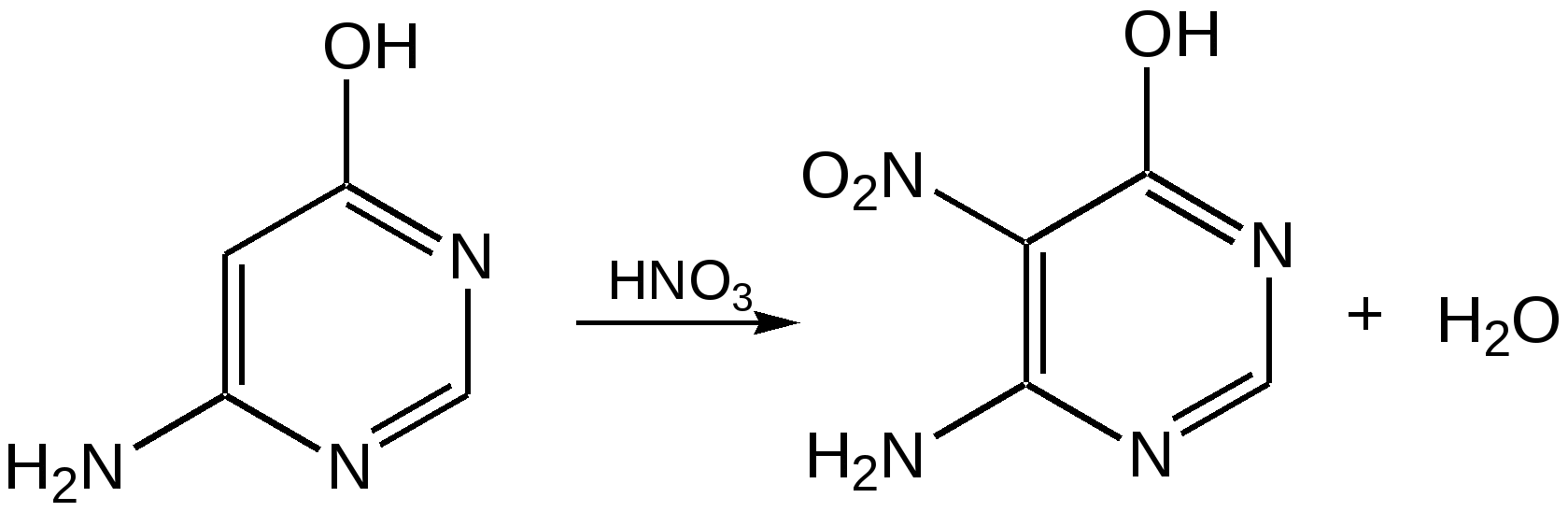 Для галогенирования достаточно одной электронно-донорной группы. Так, 2-аминопиримидин хлорируется и бромируется в положение 5: 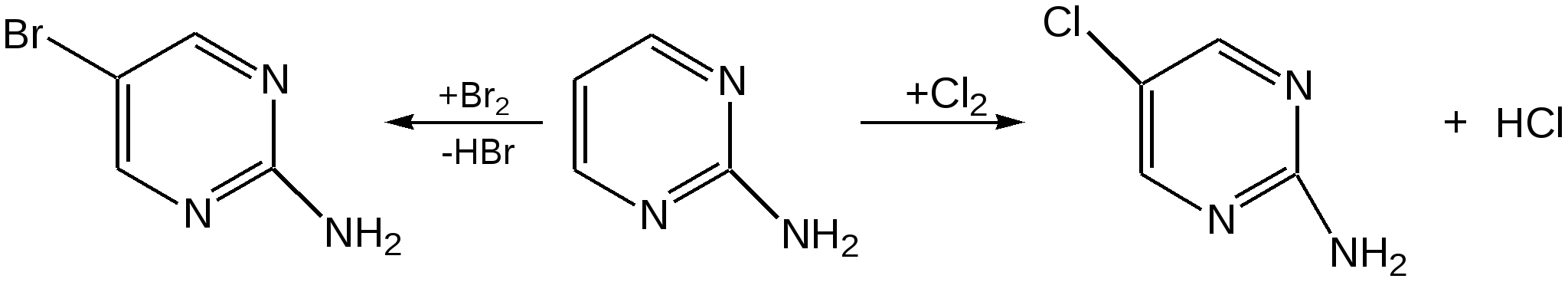 Значительно больше распространены в ряду пиримидина реакции нуклеофильного замещения. При этом речь идет о нуклеофильном замещении различных групп, находящихся в положениях 2, 4, 6. Так, при действии амида натрия на 6-метилпиридин образуются 2-амино- и 2,4-диамино-6-метилпиримидин: 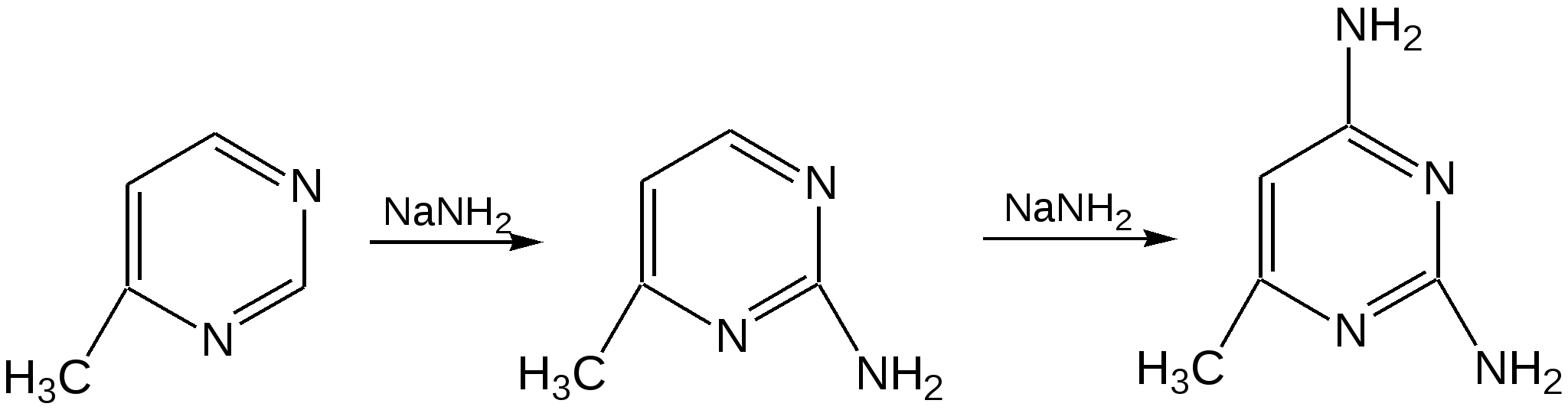 Следует отметить, что алкильные группы в положениях 2, 4 и 6 пиримидина обладают повышенной активностью: легко вступают в конденсацию с альдегидами и в реакцию азосочетания. |
