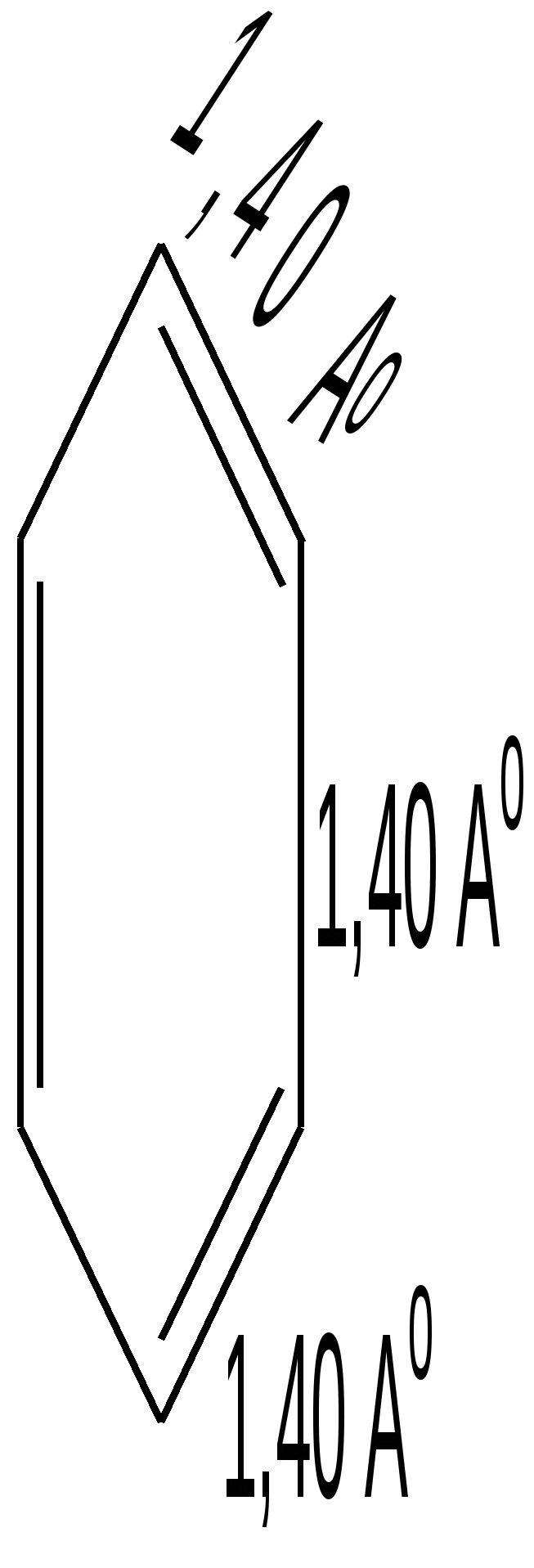Программа блока гетерофункциональные углеводороды
 Скачать 6.9 Mb. Скачать 6.9 Mb.
|
|
Номенклатура гетероциклических соединений.
Тривиальная номенклатура. Тривиальные названия сохраняются для многих гетероциклических соединений. Например, пиррол (гр. pirol – огненно-красный). Полутривиальная номенклатура сохраняется и в наше время, имеет сходство с тривиальной номенклатурой. «а»-Номенклатура. По правилам «а»-номенклатуры первая составная часть названий обозначает гетероатом, а вторая – название углеводорода, которое может быть образовано, если считать, что в формуле гетероциклических соединений все гетероатомы заменены на атомы С, группы СН или СН2. Систематическая номенклатура гетероциклических соединений. Основу названия гетероциклических соединений по систематической номенклатуре составляет:
Таблица 1 – Префиксы гетероциклов, содержащих О, S, N, Р, Si, As(система Ганча – Видмана)
Примечание: перед гласным звуком окончание «а» опускается. Несколько разных гетероатомов обозначают комбинацией описанных выше приставок в указанном порядке (т. е. О, S, N). В таблице 2 систематизированы окончания основных гетероциклических систем в зависимости от размеров кольца и степени ненасыщенности. Таблица 2 – Окончания гетероциклических систем
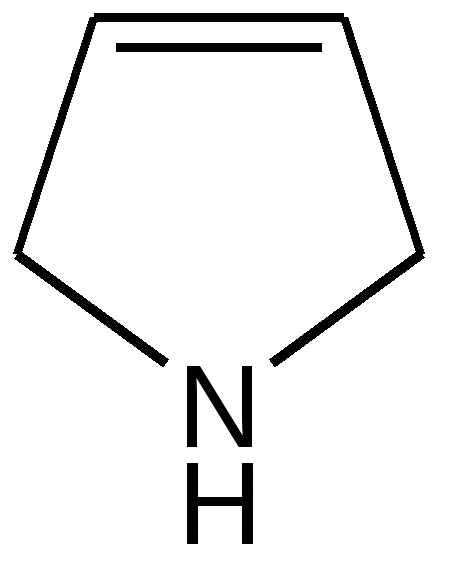
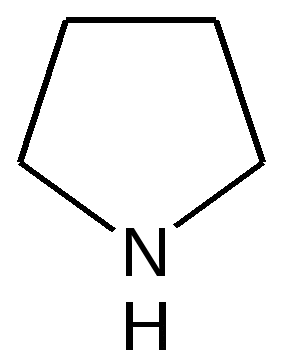
Для обозначения размера кольца и числа двойных связей используются различные окончания. Например, для пиррола с одной гидрированной двойной связью принято название пирролин, для полностью гидрированного пиррола – пирролидин:
Иногда частично или полностью насыщенные кольца обозначаются приставками дигидро-, тетрагидро- и т. д. Нумерацию в кольце начинают с наиболее электроотрицательного гетероатома и продолжают в сторону наименьших номеров, обозначающих либо другие гетероатомы, либо двойную связь, либо функциональную группу. Если имеются два одинаковых гетероатома, то нумерацию начинают с гетероатома, связанного с атомом водорода или радикалом:
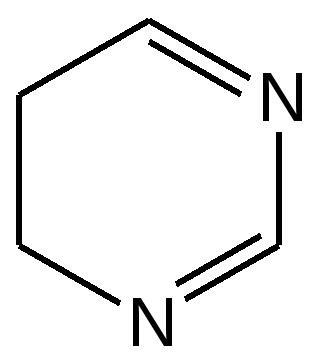
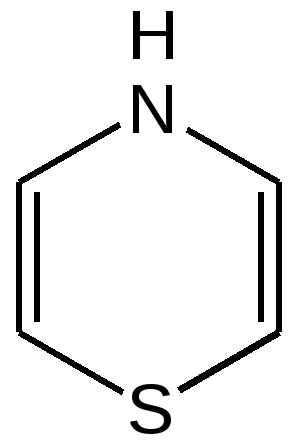
Ниже приводятся наиболее важные гетероциклические системы (гетероциклы), содержащие один или два гетероатома – моно- или бициклические (то есть состоящие из гетероциклического и конденсированного с ним бензольного или другого гетероциклического ядра): Таблица 3 – Гетероциклические системы
Гетероциклические соединения – самый многочисленный класс органических соединений, включающий около 2/3 всех известных природных и синтетических органических веществ. Классификация гетероциклических соединений. Гетероциклы классифицируют по следующим признакам: по числу атомов цикла:
Термодинамически наиболее устойчивыми являются пяти- и шестичленные гетероциклы, поэтому они чаще всего присутствуют в составе природных соединений. по природе и числу гетероатомов в цикле:
по электронному строению:
по числу циклических фрагментов в молекуле различают:
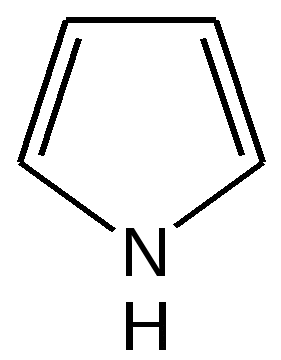
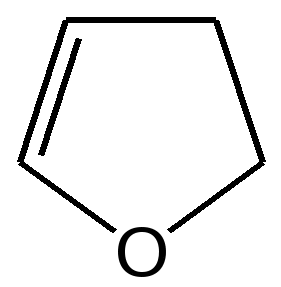
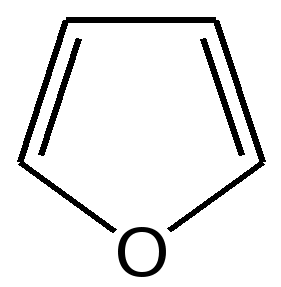
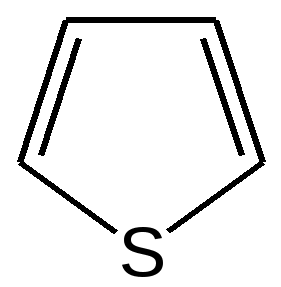
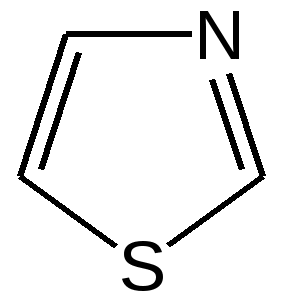
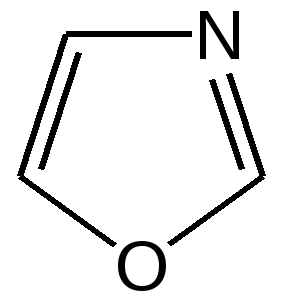
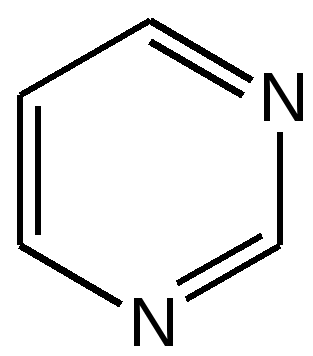
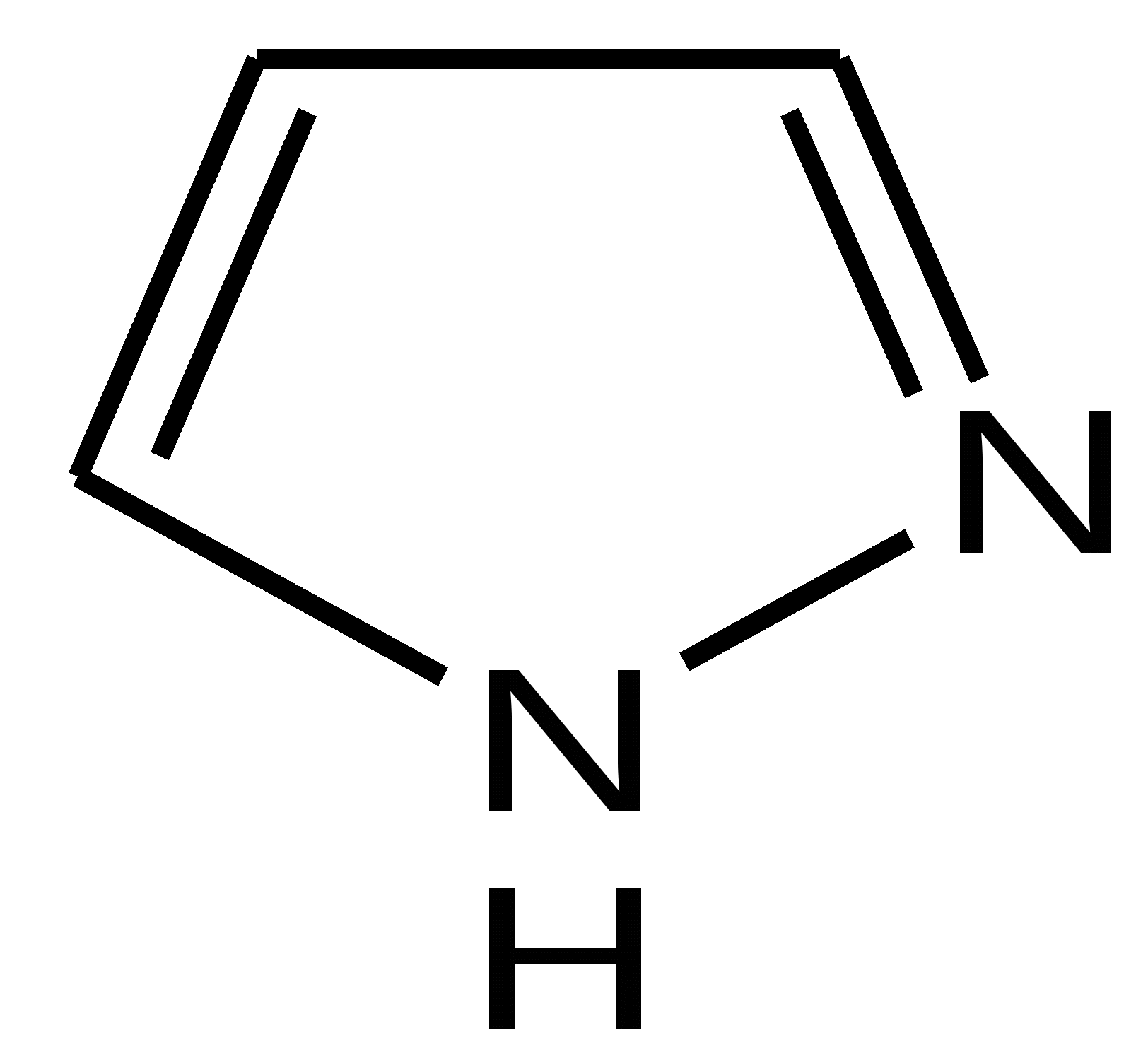
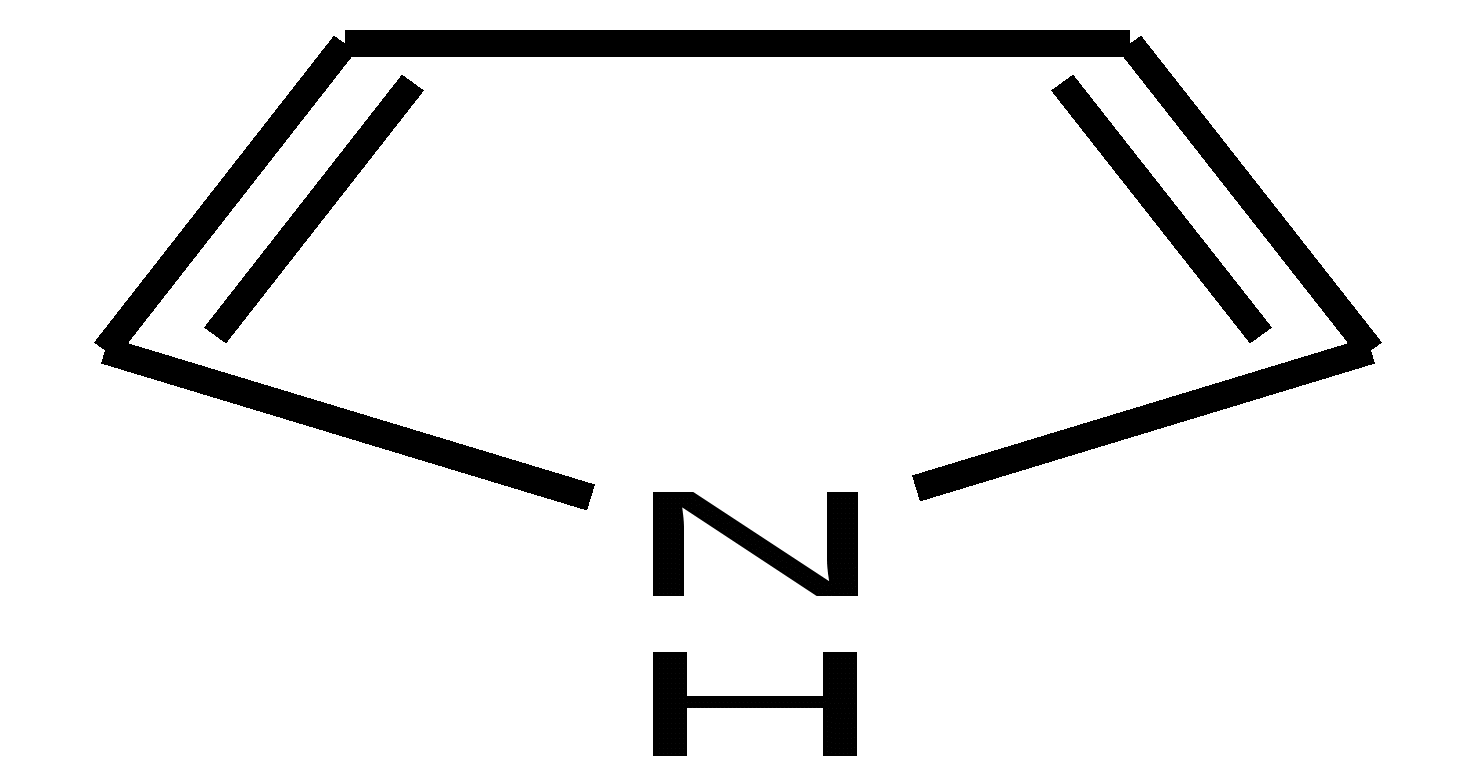
4.1 ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ С ОДНИМ ГЕТЕРОАТОМОМ Общая характеристика пятичленных гетероциклов с одним гетероатомом. К простейшим ароматическим пятичленным гетеро-циклическим соединениям с одним гетероатомом относятся фуран, пиррол и тиофен:
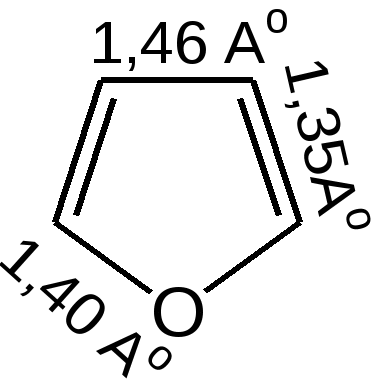
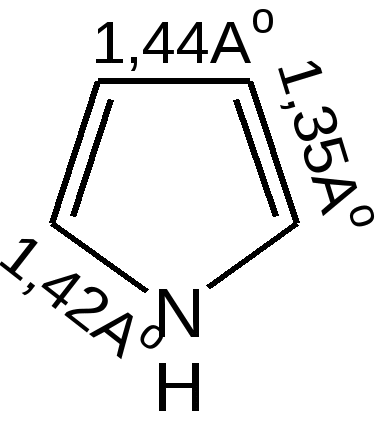
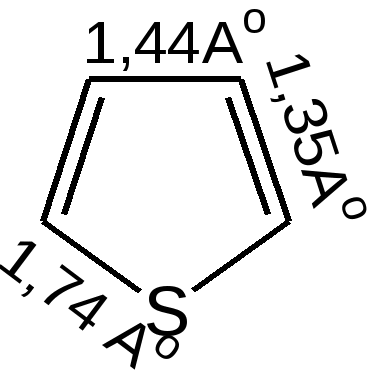
Способы получения. Для построения пятичленного гетеро-циклического кольца чаще всего применяют разнообразные реакции замыкания цикла, включающие внутримолекулярное образование σ-связи. 1. Синтез по Паалю–Кнорру. При проведении этого синтеза 1,4-дикарбонильные соединения нагревают в присутствии либо серной кислоты, либо с аммиаком, либо с сульфидом, в зависимости от вещества, которое хотят получить: 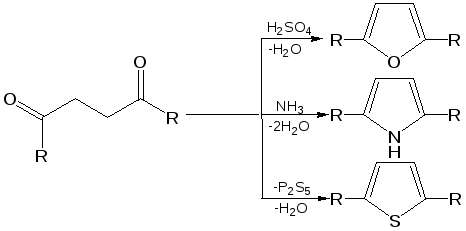 В реакциях Пааля-Кнорра в качестве 1,4-дикарбонильного соединения используют дикетоны, сложные эфиры дикарбоновых кислот, дикарбоновые кислоты или кетокислоты. Используя различные «строи-тельные блоки», этим методом можно синтезировать разнообразные гомологи и производные пятичленных гетероциклов с одним гетероатомом. 2. Реакция 1,4-диоксосоединенийс водоотнимающими соединениями. Действуют на ароматические гетероциклы с одним гетероатомом исходят из 1,4-диоксосоединений, на которые для получения фурана и его гомологов действуют водоотнимающими веществами (Р2О6, СН3СОСl), для получения тиофена и его гомологов – пятисернистым фосфором, для синтеза пиррола и его производных – аммиаком: 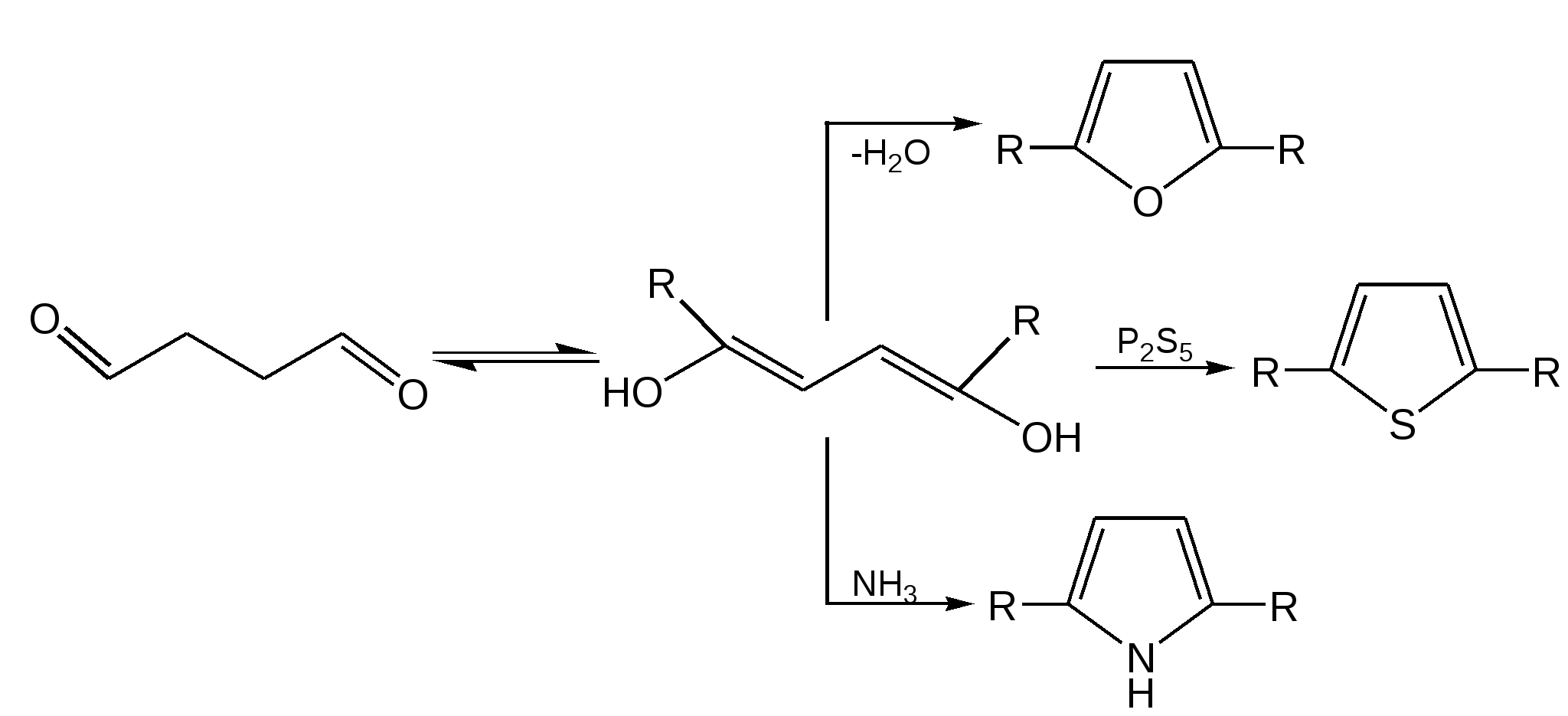 3. Получение пятичленных гетероциклов из продуктов окисления сахаров. Сухая перегонка слизевой кислоты ведет к пирослизевой кислоте (так называется α-фуранкарбоновая кислота), а пиролиз аммониевой соли слизевой кислоты – обычный путь синтеза пиррола. В первом случае происходит потеря одного карбоксила в виде СО2, во втором – полное декарбоксиливование: 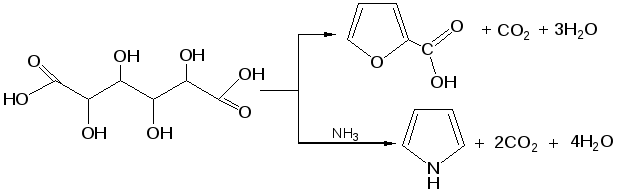 Для синтеза тиофена и его производных этого типа реакция не применяется, но тиофен можно получить, действуя P2S3. нa янтарную кислоту. 4. Взаимные превращения фурана, тиофена и пиррола. Между фураном, тиофеном и пирролом существует взаимосвязь, открытая советским ученым Ю.К. Юрьевым, которая заключается в превращении указанных гетероциклов друг в друга при температуре 450 С в присутст-вии оксида алюминия (реакция обмена гетероатома): 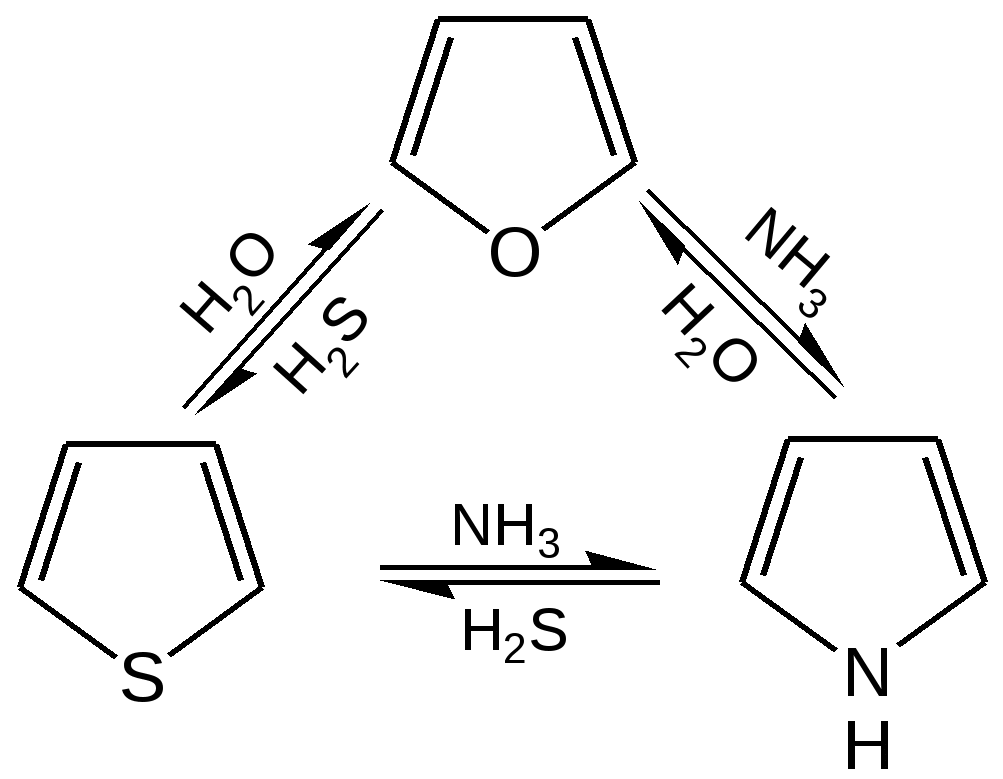 5. Получение гетероциклов из олефинов. Хьюсген обобщил ряд давно известных реакций (открытых Ганчем, Димротом, Килико и др.) и нашел серию новых реакций «присоединения» к олефинам, ацетиленам, а также нитрилам, ведущих к замыканию пятичленных гетероциклов. По этой причине данный тип присоединения был назван биполярным.Присоединение по кратной связи диполярофила(так по аналогии с диено-филом называется присоединяющий диполярную триаду ацетилен, олефин и т. д.) происходит по следующему типу:  6. Синтез пятичленных гетероциклов с одним гетероатомом из диацетилена (Шульте): 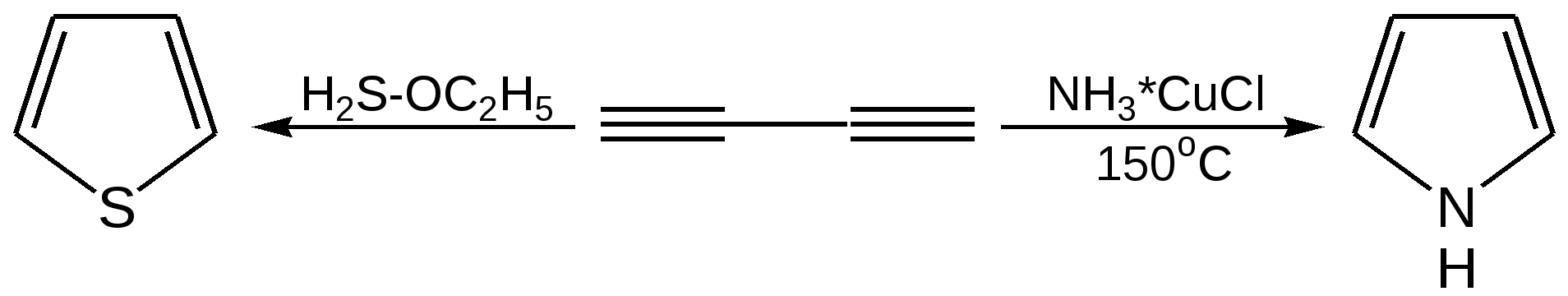 Электронное строение пятичленных гетероциклов на примере пиррола. Молекула пиррола плоская, что свидетельствует о гибридизации как атомов углерода, так и гетероатома азота. Причем три гибридизованные орбитали атома азота, принимающие участие в образовании σ-связей, лежат в плоскости кольца. Негибридизованная p-орбиталь гетероатома, расположенная перпендикулярно плоскости кольца, несет неподеленную пару электронов. При перекрывании π-орбитали кольцевого азота с негибридизованными π-орбиталями четырех атомов углерода кольца, несущих по одному электрону, образуется единая π-молекулярная система, содержащая в общей сложности шесть электронов (ароматический секстет). Таким образом, пиррол, как и бензол, и пиридин, подчиняется правилу ароматичности Хюккеля. Гетероциклы фуран и тиофен представляют собой плоские молекулы, имеющие подобный пирролу тип делокализованной структуры, где одна из неподеленных электронных пар гетероатома (кислорода и серы, соответственно) участвует в образовании ароматического секстета. Геометрия молекул и расчеты по методу МО: длины связей в пирроле, фуране и тиофене свидетельствуют об образовании сопряженной системы, т. е. связи короче обычных (длина связи С–С = 0,154 нм, С–N = 0,145-0,147 нм, С–O = 0,140-0,142 нм, С–S = 0,18 нм), но длиннее двойных (длина связи С=С = 0,134 нм): 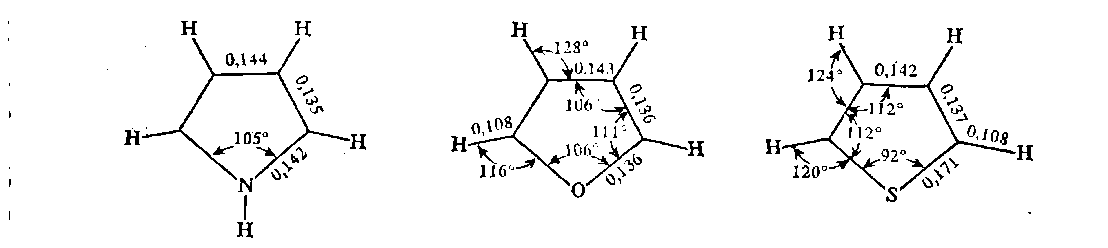 Расчеты по методу МО в приближении Хюккеля свидетельствуют о том, что все эти системы стабилизированы вследствие циклической делокализации л-электронов. Энергия циклической делокализации зависит от электроотрицательности гетероатома и резонансного интеграла связи С–X. При увеличении электроотрицательности гетероатома энергия уменьшается. В целом следствием высокой электроотрицательности гетероатома кислорода является уменьшение влияния +М эффекта (р, π-сопряжения), и, вероятно, поэтому фуран имеет менее выраженный ароматический характер, чем пиррол, и склонен к реакциям, характерным для сопряженных диенов. Если для фурана и пиррола допустима только одна незаряженная предельная структура, то с тиофеном дело обстоит несколько иначе. Наименее ароматичен фуран, у него наиболее выражены диеновые свойства, так как кислород – самый электроотрицательный из трех рассматриваемых элементов, он меньше всего склонен отдавать свою электронную пару на образование ароматического секстета. Наиболее выражены ароматические свойства у тиофена, он больше всего напоминает бензол, т. к. пара р-электронов атома серы более удалена от ядра и легче смещается для образования сопряженной -электронной оболочки. Пиррол в этом ряду занимает промежуточное положение. Гетероатом, поставляя р-электроны в цикл, теряет долю своей электроотрицательности, в то же время имеет место повышенная нуклеофильность атомов углерода, в особенности соседних с гетероатомом. Свободная электронная пара гетероатома сдвинута на двойные связи цикла и электроны способны переходить из октета одного углеродного атома в октет другого углеродного атома. 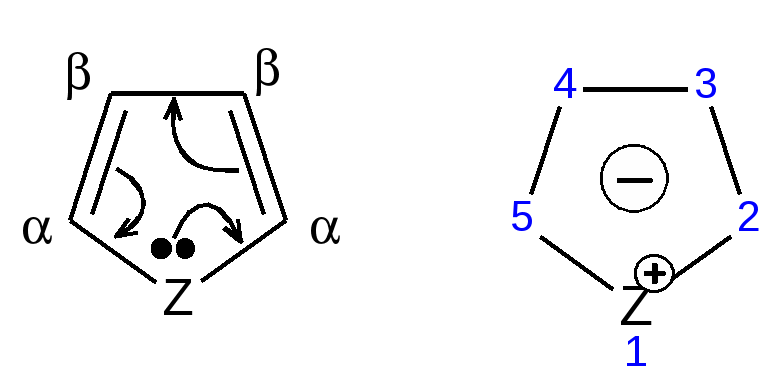 Рисунок 1 – Общая формула пятичленных гетероциклов, где Z = O, S, NH; 2, 5 – -положения; 3, 4 – -положения Такая формула объясняет повышенную активность к электрофильному замещению атомов углерода циклов, особенно, в положениях 2, 5 (-положения). На полярную природу этих соединений указывает также наличие дипольных моментов в отличие от бензола, а также отсутствие выравненности углерод-углеродных связей, хотя в результате имеющегося сопряжения двойные связи в них удлинены, а простые укорочены: Дипольный момент μ (D)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||