акушерство по практике. Размере истинной конъюгаты
 Скачать 4.82 Mb. Скачать 4.82 Mb.
|
|
Cм. Инфекции в гинекологии См. Принципы лечения воспалительных заболеваний в гинекологии Вы пришли к гинекологу с жалобами на выделения. Для того, чтобы определить возбудителя инфекции и выбрать правильное лечение, врач назначает анализы. Какие и в какой последовательности? 1. Бактериоскопия (мазок на флору) . Берется после вставления влагалищного зеркала, под контролем глаза, с помощью одноразового шпателя (пластмассовой палочки с расширенным концом). Если Вы позаботились о себе в условиях бесплатной медицины и принесли с собой одноразовый набор для гинекологического обследования, шпатель в него входит. Неправильным является забор материала для мазка перчаткой (т.к. тальк, которым обработаны перчатки, может исказить картину); зеркалом (иногда, вынимая зеркало, врач переносит попавшие в него выделения на стекло), т.к. туда попадают, в основном, слущенные клетки из заднего свода влагалища; после двуручного исследования без вставления зеркала (т.к. взятие материала нужно производить под контролем глаза, т.е. видеть, что берешь). Взятие мазка - это вторая манипуляция врача после того, как Вы оказались на кресле, первая - введение влагалищного зеркала. Затем в зеркало направляется свет, и врач прицельно берет шпателем материал желательно из трех участков, но как минимум, из двух последних: из наружного отверстия мочеиспускательного канала, влагалища и шейки матки. Только после этого возможно проведение расширенной кольпоскопии (окраска шейки матки растворами) и двуручное исследование. Такой порядок объясняется тем что растворы, использующиеся для кольпоскопии, убивают бактерий, делая мазок бессмысленным, а при двуручном исследовании происходит микротравмирование поверхности шейки матки, в мазок попадают слущенные клетки, клетки крови, и затрудняют диагностику инфекций. Материал, взятый шпателем, равномерно распределяют по чистому предметному стеклу широким мазком. Неправильным является нанесение материала толстым слоем, каплей, небольшим мазком - так врачу-лаборанту гораздо труднее будет делать свою работу. Материал из разных участков помещается на стекле отдельно, с обратной стороны стекла отмечается место взятия мазка: "U" - мочеиспускательный канал, "C" - шейка матки, "V" - влагалище. После этого стекло высушивается на воздухе и отправляется в лабораторию. В лаборатории мазок окрашивают и рассматривают в микроскоп. Что может увидеть врач-лаборант: а) Эпителий. Клетки, покрывающие влагалище и шейку матки. В норме должны присутствовать. Их количество меняется в зависимости от фазы менструального цикла, применяемых гормональных препаратов. Чем больше женских половых гормонов (середина цикла, прием эстрогенов, беременность), тем больше эпителия. Отсутствие эпителиальных клеток может говорить об атрофии эпителия, недостатке эстрогенов, избытке мужских половых гормонов. б) Лейкоциты.Клетки, выполняющие защитную функцию, "поедающие" возбудителей инфекций. При воспалении во влагалище (кольпит, вагинит) их количество увеличивается пропорционально его остроте и количеству возбудителей. В норме количество лейкоцитов в первую фазу менструального цикла составляет до 10 в поле зрения (участок стекла, видимый под микроскопом), во вторую - 10-15 в поле зрения. Повышенное содержание лейкоцитов достаточно для установления факта инфекции, но недостаточно для определения ее возбудителя. А возбудителя найти очень желательно для того, чтобы правильно подобрать антибиотики. в) Палочковая флора (морфотип лактобактерий). Это нормальная флора (микроорганизмы, которые должны жить в кислой среде влагалища), кроме которой в мазке ничего не должно определяться. Всего, представленного ниже, в нормальном мазке быть не должно: г) Кокки. Бактерии шаровидной формы (в отличие от палочек). Иногда внешнего вида достаточно для постановки диагноза (диплококки (двойные) - гонорея, совокупность кокков, мелкой палочки и "ключевых" клеток - бактериальный вагиноз), иногда для точного диагноза необходим посев. д. Мелкая палочка. Чаще всего анаэробные (не использующие кислород) бактерии, гарднереллы. Признак либо инфекции, либо дисбактериоза влагалища, особенно когда их больше, чем лактобактерий. е. "Ключевые" клетки. Клетки эпителия, "облепленные" мелкой палочкой. Признак бактериального вагиноза - дисбактериоза влагалища - состояния, при котором вместо аэробной (кислородолюбивой) молочной бактерии во влагалище размножаются анаэробные организмы, в том числе мелкие палочки. См. статью "Бактериальный вагиноз (гарднереллез)" ж. Грибы. Возбудители кандидоза (молочницы). В зависимости от выраженности процесса в мазке могут присутствовать споры грибов (невыраженный кандидоз, возможно, без проявлений), гифы, мицелий грибов (распространенный кандидоз). См. статьи "Молочница" и "Кандидоз и беременность" з. Трихомонады. Целые или разрушенные. Возбудители трихомониаза. Крупные одноклеточные организмы со жгутиками. Обнаружение в мазке пунктов "г - з" помогает установить возбудителя кольпита и подобрать соответствующие антибиотики. Однако Вы можете столкнуться с ситуацией, когда кроме лейкоцитов в мазке больше ничего не обнаружено. Причины: а). Определение возбудителей требует большей квалификации лаборанта, чем нахождение лейкоцитов. б). Вирусная, микоплазменная, хламидийная инфекция. Эти микроорганизмы настолько малы, что их не видно в микроскоп. Для их диагностики используются другие методы. в). Слишком большой лейкоцитоз, когда их количество составляет более 100 в поле зрения (иногда лаборанты пишут "лейкоциты покрывают сплошь все поля зрения"). Это означает, что в мазок попал материал, содержащий только разрушенные клетки и лейкоциты, - гной. Возбудителей в гное обнаружить почти никогда не удается. г). Неправильное взятие материала (см. выше). Это тот самый случай, когда выделения беспокоят, врач признает, что мазок плохой и надо лечиться, но ничего конкретного не найдено, и чем лечиться - непонятно. Тут возможны 3 варианта: а) если есть сомнения в правильности взятия материала и квалифицированности лаборанта - пересдать мазок б) если сомнений нет - сдать материал для посева или ПЦР-диагностики. Эти методы более чувствительны. Последний позволяет обнаружить вирусы, хламидии, микоплазмы. в) если "лейкоциты покрывают сплошь все поля" - назначается универсальная лечебная схема, т.е. набор антибиотиков широкого спектра действия, влияющий на все возможные бактерии. Если это не приводит к полному выздоровлению, то по крайней мере уменьшает количество лейкоцитов, что позволяет взять материал для дальнейшего поиска возбудителей. Бактериоскопия мазка выполняется в течение одного дня, при обычной окраске метиленовой синью - в течение 15 минут. Качество мазка и результат зависят в первую очередь от правильности взятия материала, во вторую очередь - от квалификации лаборанта. Эффективность лечения, кроме этого, зависит также от знаний врача-гинеколога, назначающего лечебную схему. Расшифровка цитологических мазков по Папаниколау -См. сравнительную таблицу гистологических и цитологических диагнозов по различным классификационным системам 2.Бактериологическое исследование (посев, культуральный метод). Выращивание бактерий на питательных средах. Метод гораздо более чувствительный, чем микроскопия, потому что позволяет обнаружить возбудителя при его небольшой концентрации, когда он не попадает в мазок. Анализ берут опять же после вставления зеркала, под контролем глаза из канала шейки матки специальным стерильным тампоном. При Вас вскрывают одноразовую пробирку с тампоном (она заклеена заводским способом) и, ничего не касаясь, вводят тампон в канал шейки матки. Одно движение и, ничего не касаясь, тампон возвращают в пробирку и наглухо ее закрывают. Самое главное при взятии материала для посева - стерильность, чтобы попали бактерии именно из исследуемой области, а не из воздуха, кожи и т.д. В лаборатории тампоном касаются питательной среды (желатин или агар-агар), на которой и растут бактерии. Обычный посев производится при доступе воздуха, т.е анаэробные (не использующие кислород) бактерии вырасти не могут. Их посев тоже возможен, но это специальное исследование, которое делается не во всех лабораториях. Для выращивания вирусов (герпес), хламидий также требуются специальные условия и среды (поскольку это внутриклеточные паразиты, то они не могут расти просто на питательном веществе, им нужна культура живых клеток. Поэтому в обычном посеве Вам не могут определить присутствие хламидий), это отдельные анализы. Культуральный метод (бактериологический, бакпосев) - это т.н. "золотой стандарт" диагностики многих инфекций и основной метод контроля эффективности лечения. Он гораздо чувствительнее и специфичнее (см. ниже) обычного мазка и имеет преимущества перед ДНК-диагностикой (ПЦР). Дело в том, что важно не обнаружение микроба, а доказательство того, что именно он является возбудителем инфекции, а это не одно и то же. В организме часто присутствуют микроорганизмы, т.н. "условные патогены" (например, гарднереллы), которые в норме не вызывают болезни, а при снижении иммунитета, развитии дисбактериоза - могут вызывать. Их обнаружение не доказывает их роли в развитии инфекции. А вот их рост на питательных средах говорит о том, что они, во-первых, жизнеспособны (могут вырасти и вызвать болезнь), во-вторых, многочисленны (отдельные микроорганизмы подавляются теми, кого больше, и тогда на среде вырастает не возбудитель инфекции, а нормальная флора). Еще одно преимущество бактериологического исследования заключается в том, что оно позволяет посчитать количество возбудителя (по числу выросших колоний), а также определить чувствительность к антибиотикам (в питательную среду добавляют разные антибиотики и смотрят, от какого препарата бактерии гибнут). Единственным недостатком метода является длительность его исполнения (бактерии растут несколько дней) и требовательность к лаборатории. 3. ДНК-диагностика (ПЦР). К ДНК-диагностике относят несколько методов, но самый распространенный - полимеразная цепная реакция (ПЦР). Это обнаружение в материале ДНК возбудителя. ДНК - это молекула, в которой заключена вся информация о клетке. В клетках организмов одного вида (например, микоплазма генитальная) определенные участки ДНК одинаковые. Поэтому, зная строение этих участков у основных возбудителей, можно создать зеркальные копии, которые будут находить и связываться с ними. Нахождение даже одного такого участка достаточно для того, чтобы ПЦР была положительной. Это говорит о крайне высокой чувствительности метода. Метод хорош для диагностики инфекций, не обнаруживаемых в мазках: хламидиоза, генитального герпеса. Однако для определения эффективности лечения тех же заболеваний метод неприемлем, т.к. и после распада клеток в организме могут остаться кусочки ДНК. Признаком неизлеченности могут служить только жизнеспособные размножающиеся микроорганизмы, а их можно обнаружить только с помощью посева. Однако не все желаемые методы доступны. Внутриклеточных паразитов в обычном посеве определить нельзя, и если в лаборатории не делают специального бактериологического исследования на культуре клеток - приходится довольствоваться ПЦР - тогда его надо сдавать не раньше чем через 3-4 недели после окончания лечения Также нежелательно использоваться метод ПЦР для диагностики гарднереллеза, т.к. эти бактерии и в норме содержатся во влагалище. Их не должно быть в мазке, и в данном случае бактериоскопия - достаточный метод для диагностики гарднереллеза и контроля лечения. А ДНК этих бактерий может и должна находиться, это не есть критерий болезни. Положительный результат ПЦР на уреаплазму (биовары) и микоплазму не является критерием диагностики и лечения - см. статью Микоплазмы и уреаплазмы Материал для ПЦР берут из канала шейки матки, иногда - из наружного отверстия мочеиспускательного канала специальной стерильной одноразовой щеточкой. Перед взятием материала обязательно удаляют слизь и выделения ватным тампоном, невыполнение этого правила часто ведет к ложным результатам. Большинство исследуемых микроорганизмов - внутриклеточные паразиты, поэтому для их обнаружения необходим соскоб клеток, а не выделения, которые мешают добраться до эпителия. Затем материал со щеточки помещают в контейнер с физраствором, который до выполнения анализа должен храниться в холодильнике. Главное - соблюдение стерильности. Причины ложных результатов ПЦР: 1. Несоблюдение правил забора материала - неудаление слизи из канала шейки матки. Самая частая причина. Вы не можете ее контролировать. Единственное, что Вы можете - выбрать врача-гинеколога, которому доверяете. 2. Несоблюдение правил постановки ПЦР в лаборатории. Эту причину вы тоже не можете контролировать, она лежит на совести лабораторий. 3. Опять же несоблюдение правил взятия материала - попадание в материал ДНК бактерий из воздуха, с рук, покровного стекла (почему-то часто материал на ПЦР сдается в виде обычного мазка на стекле. Это неправильно, ведь стекло не может быть стерильным). Стерильность может быть нарушена и в лаборатории, если посторонние люди будут часто ходить вокруг рабочего образца и "насыплют" разные ДНК со своей одежды. Это вы тоже никак не проверите. Поэтому, несмотря на то, что ПЦР - самый чувствительный и специфичный метод диагностики, у него есть свои недостатки. Результаты должны быть проанализированы лечащим врачом с учетом возможности всего вышесказанного. Диагноз ставится на основании жалоб и симптомов. Любой диагностический метод -вспомогательный, на него нельзя 100%-но полагаться. 4.Определение антител в крови (серологический метод) - чаще всего методом ИФА (иммуноферментный анализ).. Дополнительный метод диагностики, позволяющий отличить острое заболевание, его первый эпизод от обострения хронической инфекции. Особенно часто этот метод используется у беременных после обнаружения возбудителя методом ПЦР для определения вероятности заражения ребенка. Наиболее опасна для организма и наиболее часто передается ребенку именно первичная инфекция (первое попадание возбудителя), когда иммунная система еще не встречалась с этим микроорганизмом и не имеет опыта борьбы с ним. В ответ на попадание возбудителя в кровь образуются антитела - вещества, которые связываются с ним и стараются вывести из организма. При первичной инфекции вырабатываются антитела одного класса - т.н. иммуноглобулины М. Их нахождение в крови говорит о том, что организм болеет, и является показанием для лечения инфекции. Позднее начинают вырабатываться другие антитела - иммуноглобулины класса G. Они сохраняются и после излечения, для некоторых инфекций (например, краснуха) - навсегда. Нахождение в крови иммуноглобулинов G говорит о том, что организм раньше встречался с инфекцией и выработал против нее иммунитет, это благоприятный признак, он не требует лечения. Одновременное присутствие обоих классов иммуноглобулинов говорит об обострении хронической инфекции и требует лечения. При нахождении только иммуноглобулинов G и подозрении на инфекцию (признаки внутриутробной инфекции плода) через 2 недели делают повторный анализ с определением титра (количества) антител. Резкое возрастание титра (в 4 раза) говорит об активации инфекции и требует лечения. Определение антител в крови к основным возбудителям (токсоплазма, краснуха, цитомегаловирус, герпес) у беременных называется TORCH-комплекс. Для всех этих инфекций очень важно, болела ли женщина ими раньше, т.е. есть ли у нее в крови иммуноглобулины G. Если нет, то есть вероятность развития первичной инфекции во время беременности и поражения плода. В этом случае нужно более тщательно беречься от возможного заражения и регулярно перепроверять содержание антител. Антитела к герпесу .Чаще всего, если на бланке не указывается отдельно - антитела к ВПГ1 и ВПГ 2 (и не берется двойная цена) - берут кровь на определения смешанных антител к обоим типам вируса. А так как герпесом 1 типа мы почти все переболели в детстве, 98% взрослого населения имеет к нему антитела, и анализ будет положительным, даже если Вы никогда не болели генитальным герпесом. Поэтому этот анализ почти не имеет ценности и на нем можно сэкономить деньги. Единственное показание - Вы беременны, и Вам кажется, что и 1 типа герпеса (лихорадки на губах) у Вас никогда не было. Тогда проводят этот анализ, и если действительно антител нет вообще, то тем более надо предохраняться от возможного заражения даже этим "безобидным" герпесом 1 типа, т.к. и его первичная инфекция может повредить плоду. (В Москве есть лаборатории, которые делают АТ к ВПГ 2 типа без АТ к ВПГ 1 типа, но, ввиду высокой стоимости импортных реагентов, такие анализы - редкость). Для определения антител берут кровь из вены. Опять же многое зависит от уровня лаборатории и качества реактивов. См. статью "Обследование в гинекологии" . Примечание: Термины: Чувствительность метода - число положительных результатов (обнаруженные бактерии) при наличии возбудителей в материале. Чувствительность 80% означает, что в 80% случаев присутствия бактерий в материале указанный метод позволит их обнаружить. Специфичность метода - вероятность того, что положительный результат - истинный. Специфичность 80% означает, что в 80% положительного результата анализа этот возбудитель действительно присутствует. Остальные 20% положительных анализов на самом деле ложноположительные. Ложноположительный результат - ситуация, когда результат анализа положительный (бактерия обнаружена), но на самом деле ее нет. Чем выше чувствительность и меньше специфичность метода, тем больше вероятность ложноположительных результатов. Для пациента ложноположительный результат означает лишнее беспокойство, поиск супружеской измены (кто заразил) и неоправданное лечение. Особенно нежелательно получение ложноположительного результата после лечения. Лечился-лечился, а хламидии остались. Значит, неправильно лечили? Или опять партнер заразил? Или они передаются бытовым способом? Это самые частые из присылаемых на сайт гинекологических вопросов. Основная причина в том, что для контроля эффективности лечения использовали те же высокочувствительные методы (например, ПЦР), что и для первичной диагностики. Одна несчастная, давно мертвая молекула ДНК из разрушенной клетки хламидии может попасться и дать ложноположительный результат, а хламидиоза нет. Поэтому "золотым стандартом" для повторного анализа после лечения является посев. Если инфекция побеждена, она точно не вырастет. Ложноотрицательный результат - отрицательный результат анализа (ненахождение возбудителя) при его наличии в организме. Возникает при использовании низкочувствительных методов (бактериоскопия). Для пациента неприятен необходимостью повторной сдачи платных анализов. Способы борьбы с ложными результатами: 1. Поиск квалифицированной лаборатории и врача-гинеколога 2. Выбор правильного метода диагностики для конкретной ситуации и соблюдение правил взятия анализа. 3. Лечение симптомов, а не результатов анализов. Модная ПЦР дает достаточное количество ложноположительных результатов. Для коммерческих центров это очень ценная особенность метода. Но грамотный пациент не должен давать лечить свои анализы. Очень частая ситуация - "пошел обследоваться, нашли уреаплазму. Что делать?" Лечить то, что Вас беспокоит. Если ничего, то неизбежное носительство некоторых неопасных и небеспокоящих микроорганизмов (уреаплазма, микоплазма, гарднерелла, единичная кандида, ВПЧ, герпес, ЦМВ) не требует лечения, а в случае нахождения абсолютного патогена (гонококк, хламидии, трихомонады) анализ пересдается, в том числе другими методами - и при подтверждении диагноза проводится лечение. 39. Какие данные заносятся в историю болезни после переливания крови. Заполнение документации. Перед гемотрансфузией врач пишет краткий эпикриз с обоснованием показаний к гемотрансфузии. После окончания трансфузии врач записывает в историю болезни протокол переливания крови: показания к трансфузии, паспортные данные с каждого флакона: фамилия донора, группа крови, резус-принадлежность, номер флакона, дата заготовки крови, группа крови и Rh-фактор реципиента и донора, результаты проб на индивидуальную совместимость крови донора и реципиента по системе АВО и Rh-фактору, результат биологической пробы, наличие реакций и осложнений, дата, фамилия врача, переливавшего кровь, подпись. Соответствующую запись с указанием основных данных истории болезни пациента (ФИО, возраст, диагноз, № истории болезни) врач производит и в специальной "Книге регистрации переливания крови, ее компонентов и препаратов". Наблюдение за больным после гемотрансфузии. Реципиент после переливания крови соблюдает в течение 2-х часов постельный режим и наблюдается лечащим и дежурным врачом в течение суток. Особенно тщательное наблюдение проводится в течение первых трех часов после гемотрансфузии. Оценивается наличие жалоб, изменение общего состояния, каждый час измеряется температура тела, частота пульса и артериальное давление. Эти данные фиксируются в истории болезни. Необходимо макроскопически оценить первую порцию мочи после переливания крови, обращают внимание на сохранение мочеотделения и окраску мочи (при гемотрансфузионных осложнениях моча приобретает бурую окраску). После переливания крови под наркозом на операционном столе следует вывести мочу катетером и также оценить ее макроскопически. На следующий день обязательно выполнение клинического анализа крови и общего анализа мочи. 40. Правила определения группы крови, проведение пробы на совместимость, биологической пробы. 3. Порядок проведения проб на совместимость Целью проведения проб на совместимость является предотвращение трансфузии консервированной крови и её компонентов, несовместимых с кровью реципиента. Для проб на совместимость используют сыворотку крови реципиента и образец крови донора. Если больному переливается консервированная кровь и её компоненты из нескольких контейнеров, пробы на совместимость проводят с каждым контейнером, даже если на них обозначено, что компоненты крови получены от одного и того же донора. 3.1 Пробы на индивидуальную совместимость по системе АВО 3.1.1 Проба на совместимость по группам крови системы АВО (на плоскости) Порядок проведения исследования: Пробу производят на планшете со смачиваемой поверхностью. 1. Планшет маркируют, для чего указывают Ф.И.О. и группу крови реципиента, Ф.И.О. и группу крови донора и номер контейнера с кровью. 2. Из пробирки с исследуемой кровью реципиента берут осторожно пипеткой сыворотку и наносят на планшет 1 большую каплю (100 мкл). 3. Из сегмента трубки пластикового мешка с трансфузионной средой, которая приготовлена для трансфузии именно этому больному, берут маленькую каплю (10 мкл) донорских эритроцитов и наносят рядом с сывороткой реципиента (соотношение сыворотки и эритроцитов 10:1). 4. Капли перемешивают стеклянной палочкой. 5. Наблюдают за реакцией 5 минут, при постоянном покачивании планшета. По истечении этого времени добавляют 1-2 капли (50-100 мкл) раствора натрия хлорида, 0,9%. Трактовка результатов реакции: реакция в капле может быть положительной или отрицательной. а) положительный результат (+) выражается в агглютинации эритроцитов, агглютинаты видны невооруженным глазом в виде мелких или крупных красных агрегатов. Кровь несовместима, переливать нельзя! (см. рисунок 1). Рисунок 1. Кровь реципиента и донора несовместима 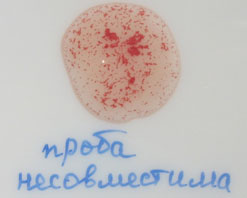 б) при отрицательном результате (-) капля остаётся гомогенно окрашенной в красный цвет, агглютинаты в ней не обнаруживаются. Кровь донора совместима с кровью реципиента (см. рисунок 2). б) при отрицательном результате (-) капля остаётся гомогенно окрашенной в красный цвет, агглютинаты в ней не обнаруживаются. Кровь донора совместима с кровью реципиента (см. рисунок 2).Рисунок 2. Кровь донора совместима с кровью реципиента  3.2. Пробы на индивидуальную совместимость по системе Резус 3.2. Пробы на индивидуальную совместимость по системе Резус3.2.1. Проба на совместимость с использованием 33 % раствора полиглюкина Порядок проведения исследования: 1. Для исследования берут пробирку (центрифужную или любую другую, вместимостью не менее 10 мл). Пробирку маркируют, для чего указывают Ф.И.О. и группу крови реципиента, и Ф.И.О донора, номер контейнера с кровью. 2. Из пробирки с исследуемой кровью реципиента осторожно берут пипеткой сыворотку и вносят 2 капли (100 мкл) на дно пробирки. 3. Из сегмента трубки пластикового мешка с трансфузионной средой, которая приготовлена для трансфузии именно этому больному, берут одну каплю (50 мкл) донорских эритроцитов вносят в эту же пробирку, добавляют 1 каплю (50 мкл) 33% раствора полиглюкина. 4. Содержимое пробирки перемешивают путём встряхивания и затем медленно поворачивают по оси, наклоняя почти до горизонтального положения так, чтобы содержимое растекалось по ее стенкам. Эту процедуру выполняют в течение пяти минут. 5. Через пять минут в пробирку добавляют по 3-5 мл физ. раствора. Содержимое пробирок перемешивают 2-3-кратным перевертыванием пробирок (не встряхивая!) Трактовка результатов реакции: результат учитывают, просматривая пробирки на свет невооружённым глазом или через лупу. Если в пробирке наблюдается агглютинация в виде взвеси мелких или крупных красных комочков на фоне просветлённой или полностью обесцвеченной жидкости, значит, кровь донора не совместима с кровью реципиента. Переливать нельзя! Если в пробирке равномерно окрашенная, слегка опалесцирующая жидкость без признаков агглютинации эритроцитов — это значит, что кровь донора совместима с кровью реципиента в отношении антигенов системы Резус и другими клинически значимыми системами (см. рисунок 3). Рисунок 3. Результаты исследования проб на совместимость по системе Резус (с использованием 33% раствора полиглюкина и 10% раствора желатина)  3.2.2. Проба на совместимость с использованием 10 % раствора желатина 3.2.2. Проба на совместимость с использованием 10 % раствора желатинаРаствор желатина необходимо тщательно просмотреть перед употреблением. При помутнении или появлении хлопьев, а также при потере свойств застудневания при t+4 0С...+8 0С желатин непригоден. Порядок проведения исследования: 1. Для исследования берут пробирку (ёмкость не менее 10 мл). Пробирку маркируют, для чего указывают Ф.И.О., группу крови реципиента и донора, номер контейнера с кровью. 2. Из сегмента трубки пластикового мешка с трансфузионной средой, которая приготовлена для трансфузии именно этому больному, берут одну каплю (50 мкл) донорских эритроцитов, вносят в пробирку, добавляют 2 капли (100 мкл) 10% раствора желатина, прогретого на водяной бане до разжижения при температуре +460С...+48 0С. Из пробирки с кровью реципиента осторожно берут пипеткой сыворотку и вносят 2 капли (100 мкл) на дно пробирки. 3. Содержимое пробирки встряхивают для перемешивания и помещают на водяную баню (t+46 0С...+48 0С) на 15 минут или в термостат (t+460С...+480С) на 45 минут. 4. После окончания инкубации пробирку извлекают, добавляют 5-8 мл физ. раствора, содержимое пробирки перемешивают путём одно-двукратного перевёртывания и оценивают результат исследования. Трактовка результатов реакции. результат учитывают, просматривая пробирки на свет невооружённым глазом или через лупу, а затем просматривают путём микроскопирования. Для этого каплю содержимого пробирки помещают на предметное стекло и просматривают под малым увеличением. Если в пробирке наблюдается агглютинация в виде взвеси мелких или крупных красных комочков на фоне просветлённой или полностью обесцвеченной жидкости — это значит, что кровь донора несовместима с кровью реципиента и не должна быть ему перелита. Если в пробирке равномерно окрашенная, слегка опалесцирующая жидкость без признаков агглютинации эритроцитов — это значит, что кровь донора совместима с кровью реципиента в отношении антигенов системы Резус и другим клинически значимым системам (см. рисунок 3). 3.3. Проба на совместимость в гелевом тесте При постановке в гелевом тесте пробы на совместимость проводятся сразу по системе АВО (в микропробирке Neutral) и проба на совместимость по системе Резус (в микропробирке Coombs). Порядок проведения исследования: 1. Перед исследованием проверяют диагностические карты. Не используют карты, если в геле имеются взвешенные пузырьки, микропробирка не содержит надосадочной жидкости, наблюдается уменьшение объёма геля или его растрескивание. 2. Микропробирки подписывают (фамилия реципиента и номер донорского образца). 3. Из сегмента трубки пластикового мешка с трансфузионной средой, которая приготовлена для трансфузии именно этому больному, автоматической пипеткой берут 10 мкл донорских эритроцитов, помещают в центрифужную пробирку. 4. Добавляют 1 мл разводящего раствора. 5. Вскрывают необходимое количество микропробирок (по одной микропробирке Coombs и Neutral). 6. Автоматической пипеткой вносят по 50 мкл разведенных донорских эритроцитов в микропробирки Coombs и Neutral. 7. Добавляют в обе микропробирки по 25 мкл сыворотки реципиента. 8. Инкубируют при t+370С 15 минут. 9. После инкубации карточку центрифугируют в центрифуге для гелевых карт (время и скорость задаются автоматически). Трактовка результатов: если осадок эритроцитов расположен на дне микропробирки, то проба считается совместимой (см. рисунок 4 №1). Если агглютинаты задерживаются на поверхности геля или в его толще, то проба несовместима (см. рисунок 4 №№2-6). №1 №2 №3 №4 №5 №6 Рисунок 4. Результаты исследования проб на индивидуальную совместимость по системе Резус гелевой методикой 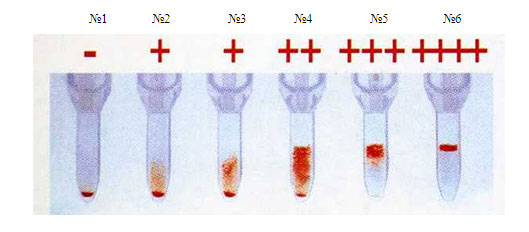 3.4. Биологическая проба 3.4. Биологическая пробаДля проведения биологической пробы используются подготовленные к трансфузии кровь и её компоненты. Биологическую пробу проводят независимо от объема гемотрансфузионной среды и скорости ее введения. При необходимости переливания нескольких доз крови и её компонентов биологическую пробу проводят перед началом переливания каждой новой дозы. Техника проведения: однократно переливают 10 мл гемотрансфузионной среды со скоростью 2-3 мл (40-60 капель) в минуту, затем переливание прекращают и в течение 3 мин наблюдают за реципиентом, контролируя у него пульс, частоту дыхания, артериальное давление, общее состояние, цвет кожи, измеряют температуру тела. Такую процедуру повторяют еще дважды. Появление в этот период даже одного из таких клинических симптомов, как озноб, боли в пояснице, чувство жара и стеснения в груди, головной боли, тошноты или рвоты, требует немедленного прекращения трансфузии и отказа от переливания данной трансфузионной среды. Образец крови направляют в специализированную лабораторию службы крови для проведения индивидуального подбора эритроцитной массы. Экстренность трансфузии компонентов крови не освобождает от выполнения биологической пробы. Во время ее проведения возможно продолжение переливания солевых растворов. При переливании крови и её компонентов под наркозом о реакции или начинающихся осложнениях судят по немотивированному усилению кровоточивости в операционной ране, снижению артериального давления и учащению пульса, изменению цвета мочи при катетеризации мочевого пузыря, а также по результатам пробы на выявление раннего гемолиза. В таких случаях переливание данной гемотрансфузионной среды прекращается, врач-хирург и врач анестезиолог-реаниматолог совместно с врачом-трансфузиологом обязаны выяснить причину гемодинамических нарушений. Если ничто, кроме трансфузии, не могло их вызвать, то данная гемотрансфузионная среда не переливается, вопрос дальнейшей трансфузионной терапии решается ими в зависимости от клинических и лабораторных данных. Биологическая проба, также как и проба на индивидуальную совместимость, обязательно проводится и в тех случаях, когда переливается индивидуально подобранная в лаборатории или фенотипированная эритроцитная масса или взвесь. После окончания переливания донорский контейнер с небольшим количеством оставшейся гемотрансфузионной среды, использованной для проведения проб на индивидуальную совместимость, подлежит обязательному сохранению в течение 48 часов при температуре +20С...+80С. Реципиент после переливания соблюдает в течение двух часов постельный режим и наблюдается лечащим или дежурным врачом. Ежечасно ему измеряют температуру тела, артериальное давление, фиксируя эти показатели в медицинской карте больного. Контролируется наличие и почасовой объем мочеотделения и цвет мочи. Появление красной окраски мочи при сохранении прозрачности свидетельствует об остром гемолизе. На следующий день после переливания обязательно производят клинический анализ крови и мочи. При амбулаторном проведении гемотрансфузии реципиент после окончания переливания должен находиться под наблюдением врача не менее трех часов. Только при отсутствии каких-либо реакций, наличии стабильных показателей артериального давления и пульса, нормальном мочеотделении пациент может быть отпущен из лечебного учреждения. 3.5. Регистрация результатов проб на совместимость Результат контрольных исследований проб на совместимость (раздельно по каждому виду) заносят в трансфузионную карту медицинской карты больного (см. приложение 2). Показания: проведение гемотрансфузионной терапии Техника выполнения биологической пробы на резус-совместимость• Закончив заполнение системы, определить группу крови и пробу на совместимость. • Осуществить пункцию вены и присоединить систему для трансфузии крови. • Перелить 15-20 мл крови струйно. • Прекратить переливание крови. Оценить состояние пациента. • При отсутствии жалоб продолжить переливание крови - 15-20 мл. • Прекратить переливание крови. Определить общее состояние пациента. • При нормальном самочувствии больного струйно перелить следующую порцию крови (на 20 мл). • При нормальном самочувствии пациента, при отсутствии жалоб, учащения пульса, болей в области поясницы, чувство стеснения в груди, чувство беспокойства и прочее перелить оставшуюся часть крови. При переливании крови необходимо соблюдать следующие правила: 1. Контрольное определение группы крови и сверка с записями в истории болезни. 2. Определение годности крови во флаконе согласно требованиям. 3. Определение резус-фактора. 4. Определение индивидуальной совместимости донора и реципиента по резус-фактору. 5. В начале переливания крови провести биологическую пробу. 6. Для контрольного исследования необходимо оставить во флаконе небольшое количество крови. 7. Тщательный контроль над состоянием реципиента в посттрансфузионном периоде. 8. Заполнить форму №9. 41. Последовательность выполнения проведения выскабливания слизистой тела матки. |
