Рецензенты кандидат химических наук В. Г. Коробко доктор биологических наук В. А. Гвоздев Патрушев Л. И
 Скачать 5.83 Mb. Скачать 5.83 Mb.
|
|
Факторы транскрипции в роли позитивных регуляторов (активаторов) синтеза РНК. Изучение механизмов функционирования белковых факторов транскрипции – задача непростая. Прежде всего, это связано с их малой концентрацией в клетках и большими сложностями получения факторов в очищенном состоянии для дальнейших биохимических исследований. Развитие генно-инженерных методов позволило получать факторы транскрипции в неограниченных количествах, что не замедлило принести плоды в виде новой информации (подробнее о методах клонирования генов см. в главе 7). Для того чтобы фактор транскрипции оказал специфическое действие на синтез РНК определенным геном, он, прежде всего, должен распознать этот ген и связаться с определенной последовательностью ДНК. Затем фактор транскрипции должен взаимодействовать с другими факторами или непосредственно с самой РНК-полимеразой для стимуляции или подавления транскрипции на этом гене. Кроме того, необходимость включения и выключения транскрипции в строго определенных месте и времени (тканеспецифический характер экспрессии генов на разных стадиях онтогенеза организма) предполагает наличие механизмов контроля биосинтеза или активации самих факторов транскрипции для упорядочивания их функционирования. Ниже будут рассмотрены механизмы, обеспечивающие эти три этапа функционирования факторов транскрипции – связывание с ДНК, влияние на процесс транскрипции и регуляция их собственной активности. Механизмы взаимодействия факторов транскрипции с ДНК. Клонирование генов факторов транскрипции (и их фрагментов), а также выделение соответствующих рекомбинантных белков позволили идентифицировать участки их полипептидных цепей, обеспечивающие специфическое взаимодействие факторов с ДНК. Очищенные фрагменты белков были исследованы на способность взаимодействовать с определенными последовательностями ДНК. Это позволило обнаружить несколько структурных элементов (доменов) полипептидных цепей, общих для факторов транскрипции разных типов, которые легли в основу их современной классификации. 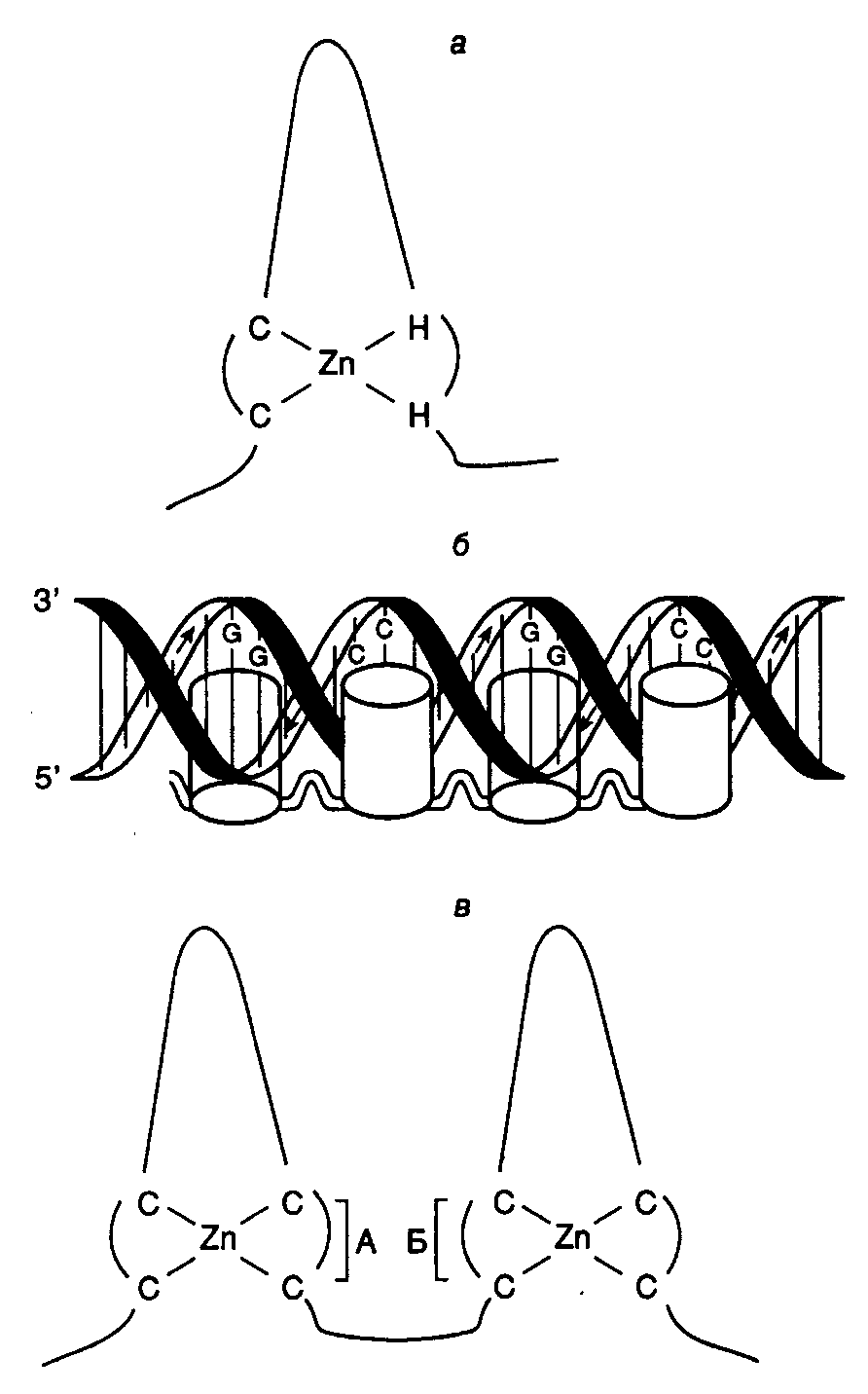 Рис. I.24. Особенности структуры полипептидных доменов типа "цинковые пальцы" и их взаимодействие с ДНК а – схема строения домена, содержащего Zn-связывающие остатки Cys (C) и Hys (H); б – предполагаемый механизм взаимодействия доменов типа "цинковые пальцы", изображенных в виде цилиндров, с ДНК. Стрелки указывают полярность цепей ДНК 5’3’; в – схема строения доменов типа "цинковые пальцы", содержащих только Zn-связывающие остатки Cys. Квадратными скобками отмечены участки полипептидных цепей, участвующие в распознавании палиндромных последовательностей ДНК (А и Б) Домены типа "цинковые пальцы". Одним из первых факторов транскрипции, полученных в виде очищенного рекомбинантного белка, был фактор TFIIIA, который играет ключевую роль в транскрипции генов 5S рРНК РНК-полимеразой III. ДНК-связывающий участок полипептидной цепи этого фактора содержит девять 30-звенных повторов: Tyr/Phe-Xaa-Cys-Xaa-Cys-Xaa2,4-Cys-Xaa3-Phe-Xaa5-Leu-Xaa2-His-Xaa3,4-His-Xaa5, где Xaa – остаток любой аминокислоты. Таким образом, каждый из повторов содержит две строго консервативные пары остатков Cys и His, которые взаимодействуют с одним ионом цинка. Это приводит к образованию в свернутой полипептидной цепи пространственной структуры, сформированной консервативными остатками Phe, Leu и несколькими остатками основных аминокислот. Структура выступает над поверхностью белковой глобулы в виде "пальца" (рис. I.24,а). Вершины пальцев непосредственно контактируют с большой бороздкой ДНК, причем соседние пальцеобразные структуры связываются противоположными сторонами спирали ДНК (см. рис. I.24,б). Домены типа "цинковые пальцы" обнаружены у многих факторов транскрипции, обеспечивающих функционирование РНК-полимеразы II, в том числе у фактора Sp1, Kruppel-белка Drosophila, белков ADRI и GAL4 дрожжей и белка аденовируса E1A. Интересно, что точковая мутация в гене Kruppel-белка, приводящая к замене лишь одного из остатков Cys на Ser, что, в свою очередь, предотвращает связывание иона Zn2+, фенотипически проявляется как делеция целого гена этого фактора. На данном основании был сделан вывод о том, что способность связывать ионы Zn2+ является критической для проявления ДНК-связывающей активности факторов такого типа. Аналогичные домены обнаружены в полипептидных цепях семейства рецепторов тиреоидных или стероидных гормонов, которые в комплексе с гормонами после переноса в ядра специфически взаимодействуют с определенными последовательностями ДНК, изменяя уровни транскрипции соответствующих генов-мишеней. Однако в этом случае ДНК-связывающие участки состоят из двух пальцев, каждый из которых содержит четыре остатка Cys, взаимодействующие с ионом Zn2+, вместо двух Cys и двух His (см. рис. I.24,в); у них также отсутствуют консервативные остатки Phe и Leu. Кроме того, элемент из двух цинковых пальцев встречается в полипептидных цепях таких рецепторов только один раз, тогда как в генах, кодирующих цинковые пальцы с Cys–His, подобный элемент может повторяться от 2 до 37 раз. Исследование мест связывания различных рецепторов стероидных гормонов с ДНК показало, что они взаимодействуют с гомологичными, но не идентичными регуляторными последовательностями нуклеотидов (подчеркнуты):
где N – любые нуклеотиды, --- – отсутствие нуклеотидов. Методами направленного мутагенеза установлено, что специфичность взаимодействия этих рецепторов со своими последовательностями определяется небольшим числом аминокислотных остатков. Так, замена всего лишь двух аминокислотных остатков в N-концевой части цинкового пальца рецептора глюкокортикоидов на аминокислотные остатки, обнаруживаемые в том же самом участке рецептора эстрогенов, приводит к тому, что мутантный рецептор начинает взаимодействовать с регуляторными последовательностями, узнаваемыми рецепторами эстрогенов, и активировать гены, контролируемые этими последовательностями. Аналогичные замены пяти аминокислотных остатков во втором пальце рецептора эстрогенов также приводят к изменению его специфичности: он приобретает способность взаимодействовать с регуляторной последовательностью тиреоидных гормонов. Как уже упоминалось выше, оба рецептора узнают одни и те же последовательности нуклеотидов, различающиеся лишь расстояниями между ними. При этом первый цинковый палец играет ключевую роль в узнавании последовательности как таковой, а второй определяет оптимальное для взаимодействия расстояние между двумя половинками этой последовательности. Факторы транскрипции, содержащие мотив "спираль–поворот–спираль". Другой тип пептидных доменов, специфически распознающих регуляторные последовательности на ДНК, характерен для белковых продуктов гомеотических (гомеозисных) генов, впервые обнаруженных у дрозофилы. Гомеотические гены позвоночных и растений играют ключевую роль в их морфогенезе. Полипептидные цепи белков, кодируемых этими генами, содержат высококонсервативную последовательность длиной в 60 аминокислотных остатков, называемую гомеобоксом, или гомеодоменом, которая определяет специфичность взаимодействия белков с регуляторными последовательностями ДНК. Анализ третичной структуры гомеодоменов показал, что они образуют структуру типа "спираль–поворот–спираль" (helix–turn–helix), в которой за -спиральным участком следует -структура с последующим еще одним -спиральным участком (рис. I.25,а). Наличие этой пространственной структуры, существование которой было впервые предсказано на основании гомологии с соответствующими аминокислотными последовательностями бактериальных белков-репрессоров, в настоящее время строго доказано методами ЯМР-спектроскопии, в частности для гомеодомена продукта гена Antennapedia дрозофилы. 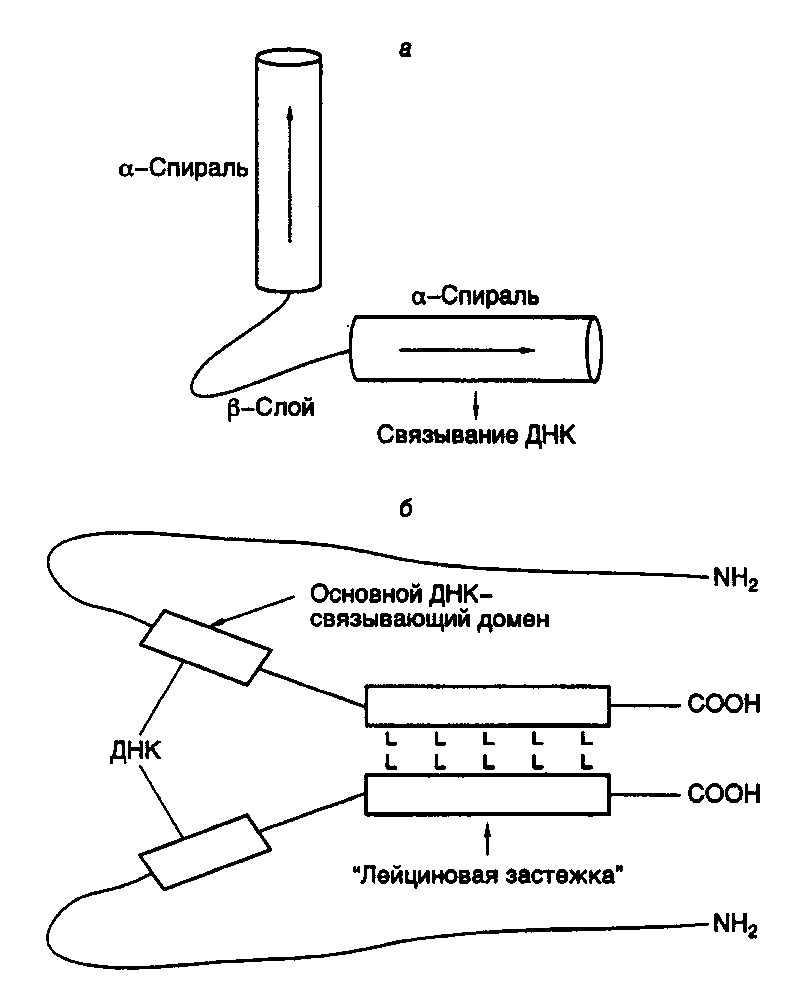 Рис. I.25. Структуры полипептидных доменов типа "спираль–поворот–спираль" (а) и "лейциновая застежка" (б) L – остатки Leu Для бактериальных белков-репрессоров было показано, что при образовании специфических комплексов с ДНК первый -спиральный участок расположен перпендикулярно большой бороздке ДНК, тогда как второй частично находится в ней и обеспечивает специфические контакты репрессора с операторным участком ДНК. Ключевая роль второго -спирального участка гомеодомена при изучении специфичности взаимодействия этих белков с ДНК была определена с помощью мутаций. Так, замена только одного остатка Ser в положении 9 -спирали белка Prd на Gln, присутствующий в гомеозисном белке Ftz, приводит к связыванию белка Prd с Ftz-сайтами на ДНК. Позднее была обнаружена большая группа регуляторных белков, в которых гомеобоксы формируют лишь одну часть более протяженного консервативного домена, названного POU-доменом. Эти белки, к которым относятся, в частности, октамерсвязывающие белки (octamer binding proteins) Oct-1 и Oct-2, белок гипофиза Pit-1 и продукт гена unc-86 нематод, используют POU-домены для специфического взаимодействия с ДНК. Относительный вклад аминокислотной последовательности гомеобокса и негомебоксной POU-последовательности в специфичность связывания белок-ДНК не одинаков для разных белков. Так, в белке Pit-1 специфичность в основном достигается за счет гомеодомена, тогда как в белке Oct-1 основную роль играет другая последовательность POU-домена. ДНК-связывающий домен типа "лейциновая застежка". Сравнение аминокислотных последовательностей ряда других факторов транскрипции: фактора транскрипции печени C/EBP, дрожжевого фактора GCN4, а также белков-продуктов протоонкогенов Myc, Fos и Jun (протоонкогены – это гены, мутации в которых могут приводить к злокачественному перерождению клеток), позволило выявить еще одну консервативную аминокислотную последовательность, образующую пространственную структуру, названную "лейциновой застежкой" (leucine zipper). В этой структуре остатки Leu, находящиеся в составе -спирального участка полипептидных цепей факторов, расположены через каждые шесть аминокислотных остатков на равном расстоянии друг от друга и оказываются на одной стороне -спирали через каждые два витка (см. рис. I.25,б). Такие домены сами по себе не связываются с ДНК, однако обеспечивают димеризацию содержащих их факторов путем взаимопроникновения лейциновых -спиралей двух молекул факторов. В результате в димере появляются две правильно расположенные друг относительно друга полипептидные цепи, составленные преимущественно из основных аминокислотных остатков, которые и образуют ДНК-связывающий центр фактора транскрипции. Димеры белков Fos и Jun связываются с Ap-1-последовательностями ДНК, что сопровождается активацией соответствующих генов в ответ на воздействие форболовыми эфирами. Однако если белок Jun связывается с Ap-1-последовательностями нуклеотидов в виде гомодимера (белкового комплекса, состоящего из двух идентичных полипептидных цепей), то белок Fos специфически взаимодействует с ДНК только после образования комплекса (гетеродимера) с белком Jun. Эти свойства двух белков являются следствием различий в структуре их лейциновых доменов, которые не позволяют образовываться гомодимеру из полипептидных цепей Fos. Искусственная замена лейцинового домена Fos на соответствующий домен белка Jun обеспечивает условия для получения гомодимера из таких химерных полипептидных цепей. Необходимость образования димера этих двух регуляторных белков перед взаимодействием с ДНК создает дополнительную возможность воздействия на экспрессию соответствующих генов путем контроля над формированием самого белкового комплекса фактора транскрипции. Основной ДНК-связывающий домен, впервые обнаруженный у белков, содержащих "лейциновую застежку", позднее был найден и у ряда других белков, регулирующих транскрипцию, в частности у двух белков E12 и E47, которые взаимодействуют с энхансерами иммуноглобулиновых генов, у регуляторного белка мышц MyoD1 и у некоторых белков дрозофилы. Однако в этих случаях основной домен расположен по соседству с участком полипептидной цепи, образующим домен типа "спираль–поворот–спираль", в котором две амфипатические спирали (содержащие все заряженные аминокислотные остатки на одной стороне спирали) разделены неспирализованной петлей. Предполагают, что такой домен играет ту же роль в димеризации полипептидных цепей и формировании ДНК-связывающего центра, что и описанные выше регуляторные полипептиды, содержащие лейциновые домены. Следует еще раз подчеркнуть, что структуры типа "лейциновая застежка" и "спираль–поворот–спираль" необходимы для димеризации полипептидных цепей транскрипционных факторов, принадлежащих к данной группе, что сопровождается формированием основного ДНК-связывающего участка регуляторных белков. Белок протоонкогена myc содержит как лейциновый домен, так и домен типа "спираль–поворот–спираль" по соседству с основным ДНК-связывающим доменом. В соответствии с этим все данное семейство регуляторных белков можно разделить на подсемейства, в которых полипептидные цепи факторов транскрипции содержат порознь или одновременно домены типа "лейциновая застежка" или "спираль–поворот–спираль". Таковы особенности структуры некоторых наиболее хорошо изученных доменов факторов транскрипции, обеспечивающих специфичность взаимодействия последних с регуляторными последовательностями ДНК, что необходимо для их регуляторного воздействия на транскрипцию соответствующих генов. Количество известных доменов у факторов транскрипции быстро возрастает с развитием исследований в этой области. Так, новые ДНК-связывающие участки полипептидных цепей недавно обнаружены у фактора транскрипции AP2, факторов, обеспечивающих регуляторное действие сыворотки, белков CTF/NTF, взаимодействующих с CAAT-боксом, факторов транскрипции дрожжей HAP-2 и HAP-3. В белках существует несколько структур, обеспечивающих специфическое распознавание определенных последовательностей ДНК, что позволяет осуществлять передачу регуляторных сигналов к определенным генам-мишеням и служит основой для обеспечения их дифференциальной экспрессии на уровне транскрипции. Данные о некоторых наиболее важных с функциональной точки зрения доменах факторов транскрипции суммированы в табл. I.14. Несмотря на то что специфическое связывание с ДНК является обязательным этапом для регуляторного воздействия белковых факторов на транскрипцию, реализация активности факторов часто требует их специфического взаимодействия с другими регуляторными белками, а также с самой РНК-полимеразой II. Большинство таких воздействий приводит к активации транскрипции. Однако результатом некоторых из них может быть и репрессия синтеза мРНК. Ниже будут рассмотрены условия, необходимые для осуществления позитивного действия факторов транскрипции. Для идентификации участков полипептидных цепей факторов транскрипции, непосредственно участвующих в активации синтеза РНК, чаще всего конструируют химерные рекомбинантные белки (некоторые из них кратко описаны выше), объединяющие в одной цепи ДНК-связывающий домен и участки полипептидных цепей других факторов, и изучают влияние таких гибридных факторов на транскрипцию in vitro. В ходе исследований, основанных на подобных подходах, были идентифицированы функциональные домены факторов транскрипции, в том числе домены, участвующие в активации транскрипции, которые, как правило, отличаются от ДНК-связывающих участков их полипептидных цепей. Доменную структуру факторов транскрипции можно проиллюстрировать на примере семейства рецепторов стероидных/тиреоидных гормонов (рис. I.26). В полипептидной цепи таких факторов четко видны три функциональных модуля: ДНК- 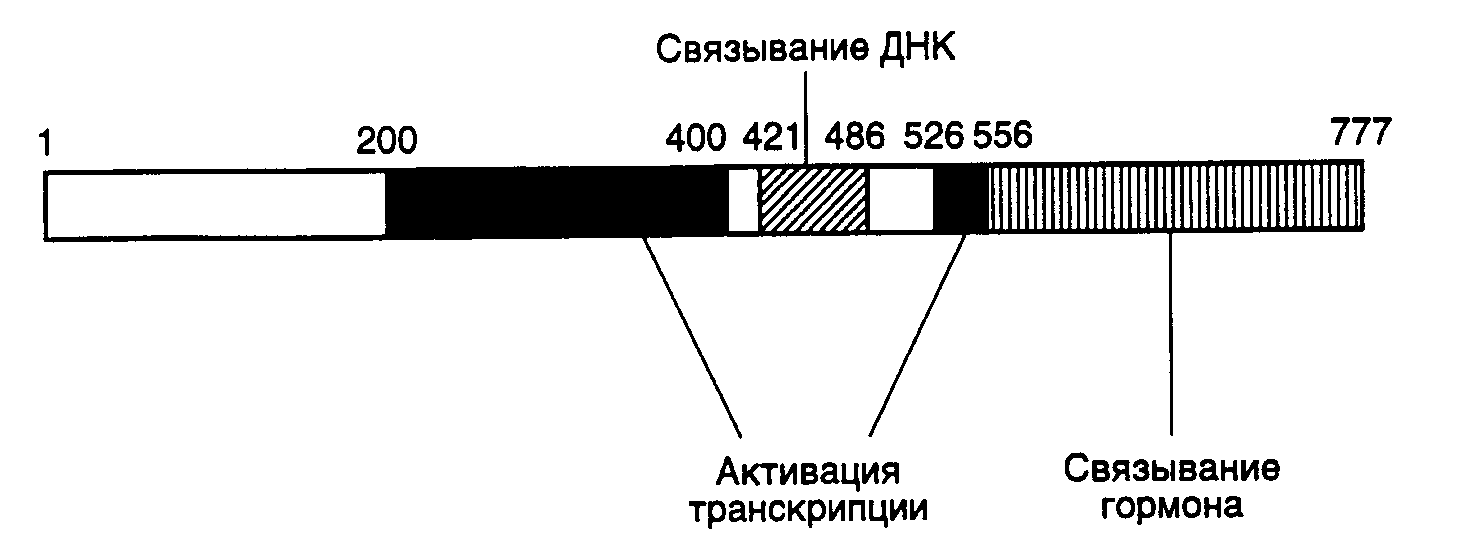 Рис. I.26. Доменная структура полипептидной цепи рецептора глюкокортикоидов Цифрами указаны номера аминокислотных остатков на границах функциональных доменов, участвующих в активации транскрипции, связывании ДНК и гормона Таблица I.14 Функциональные домены факторов транскрипции
Таблица I.13 (окончание)
связывающий домен, домен, участвующий в связывании гормона, а также домены, необходимые для активации транскрипции. В отличие от этого белок VP16 вириона вируса простого герпеса содержит активирующий участок полипептидной цепи, однако в нем отсутствует ДНК-связывающий домен. Белок VP16 образует специфический комплекс с клеточным ДНК-связывающим белком Oct-1, после чего происходят взаимодействие комплекса с ДНК и активация транскрипции. Таким образом, в этом случае ДНК-связывающий и активирующий домены комплексного фактора транскрипции локализованы в разных полипептидных цепях. Сравнение структур активирующих доменов различных факторов транскрипции показало, что хотя подобные домены не обладают выраженной гомологией, все они обогащены кислыми аминокислотами. Эти аминокислотные остатки организованы таким образом, что образуют амфипатическую -спираль, в которой все отрицательно заряженные остатки аминокислот расположены на поверхности спирали. Для подтверждения важной роли данной структуры в активации транскрипции пептид, образующий "кислую" (обогащенную остатками Asp, Glu) амфипатическую -спираль, генно-инженерными методами соединяли с ДНК-связывающим доменом дрожжевого фактора транскрипции GAL4. Такой гибридный белок приобретал способность активировать транскрипцию. Однако этого не происходило, если с ДНК-связывающим доменом соединяли пептид, образующий неамфипатическую -спираль, в которой те же самые аминокислотные остатки были расположены случайным образом (рис. I.27). Хотя такие кислые активирующие домены обнаружены у многих активаторов транскрипции разных организмов (от дрожжей до человека), описаны и другие домены, выполняющие аналогичную функцию. Так, активирующий домен фактора Sp1 содержит участок, обогащенный остатками Gln. Однако в соответствующем домене факторов CTF/NF1 преобладают остатки Pro. Такие Pro- и Gln-богатые участки обнаружены и у других факторов транскрипции. Следовательно, данная структура факторов транскрипции не является исключением. В настоящее время становится все более очевидным, что различные активирующие домены осуществляют стимуляцию транскрипции с участием других белковых факторов, хотя тот же самый эффект может достигаться и путем непосредственного их взаимодействия с РНК-полимеразой II. В частности, действие кислого активирующего домена опосредовано фактором TFIID, связывающим TATA-последовательность промоторных участков ДНК. Например, соединение дрожжевого фактора транскрипции GAL4 и фактора млекопитающих ATF со своими специфическими последовательностями в регулируемых промоторах меняют конформацию уже связанного с этим промотором фактора TFIID таким образом, что последний начинает контактировать не только с самим TATA-боксом, но и с последовательностью нуклеотидов вблизи точки инициации транскрипции. Как было упомянуто выше, такое изменение конформации фактора TFIID необходимо для вхождения в стабильный транскрипционный комплекс других факторов, в частности TFIIC и TFIIE, а также и самой РНК-полимеразы. Следовательно, специфические участки полипептидных цепей факторов транскрипции осуществляют свое активирующее действие и путем изменения конформации других факторов, связанных с промотором, что обеспечивает дальнейшую сборку стабильных транскрипционных комплексов. Генетический контроль активности факторов транскрипции. Первичная роль многих факторов транскрипции заключается в активации некоторых групп генов в определенных тканях в ответ на поступление специфических сигналов, например как следствие действия стероидных гормонов. Для достижения данной цели конкретные факторы транскрипции должны быть активны только в строго детерминированных тканях или в ответ на появление соответствующего сигнала. Включение фактора транскрипции в каскад этих реакций может быть достигнуто путем тканеспецифического синтеза соответствующего белка или регулируемой активации белка-предшественника в определенном месте и в заданное время (рис. I.28). Регуляция на уровне биосинтеза факторов транскрипции. Для многих регуляторных белков биосинтез ограничен клетками строго определенных типов. Например, октамерсвязывающий белок Oct-2, участвующий в активации экспрессии генов иммуноглобулинов в B-лимфоцитах, обнаруживают только в клетках, синтезирующих иммуноглобулины, но не в других клетках, например HeLa. Экспрессия рекомбинантного гена, кодирующего Oct-2, в клетках HeLa приводит к активации экспрессии генов иммуноглобулинов на уровне транскрипции. Таким образом, для осуществления тканеспецифической регуляции экспрессии генов в этом примере необходим тканеспецифический синтез белка-активатора транскрипции (см. рис. I.28,а). 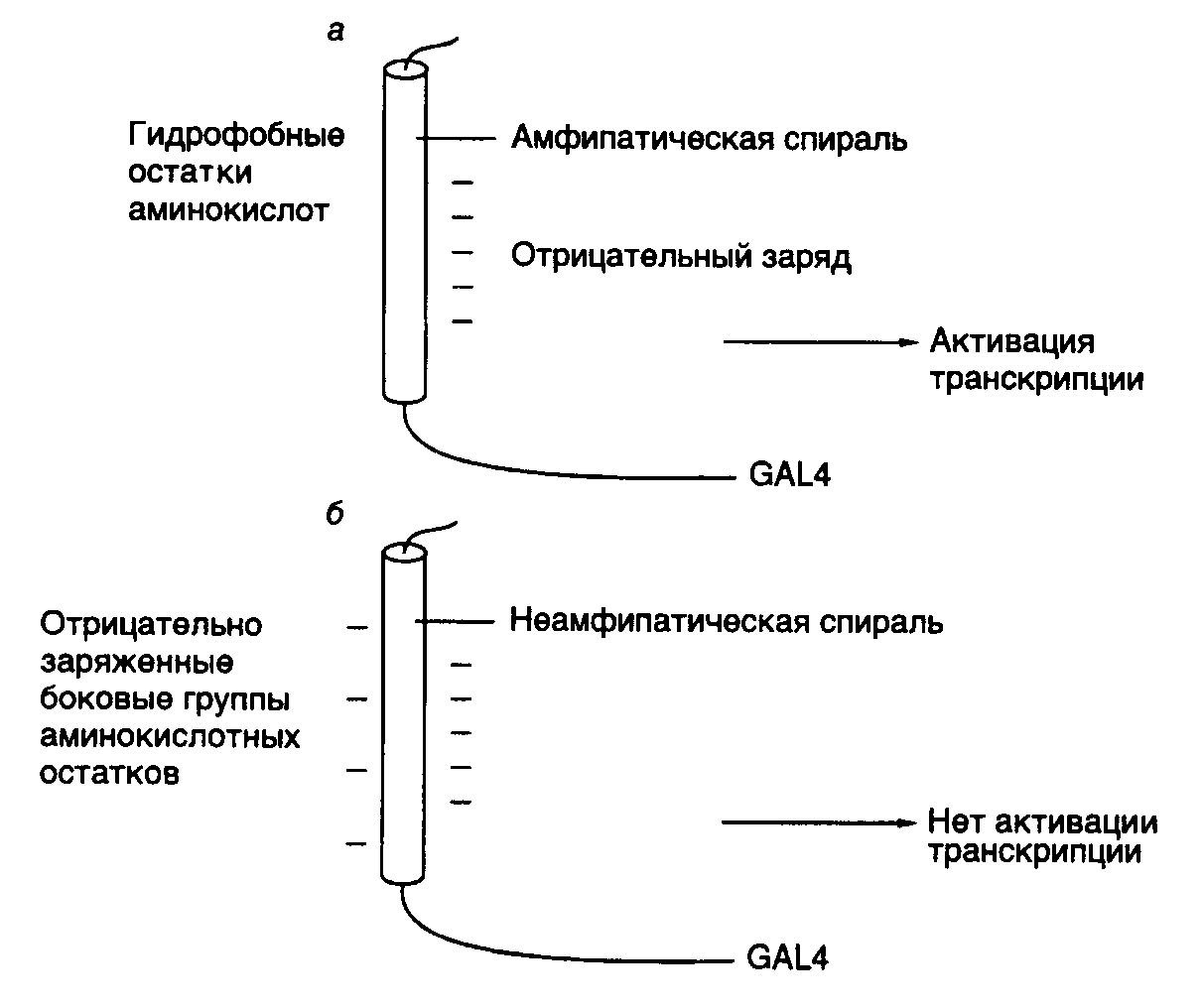 Рис. I.27. Роль структуры типа амфипатической -спирали в составе полипептидной цепи рекомбинантного фактора транскрипции GAL4 Транскрипция активируется за счет полипептидного домена, содержащего амфипатическую -спираль (а), и не активируется, когда в той же самой аминокислотной последовательности отрицательно заряженные боковые группы распределены случайным образом (б) Во многих случаях регулируемая экспрессия генов факторов транскрипции достигается путем соответствующего управления транскрипцией генов этих факторов. В частности, в клетках HeLa отсутствует не только белок Oct-2, но и его мРНК. Точно так же транскрипция гена фактора C/EBP происходит только в ядрах клеток печени. Очевидно, что такой способ контроля транскрипции у эукариот не решает полностью проблему регуляции экспрессии генов, поскольку предполагает необходимость наличия регуляторных генов, влияющих на транскрипцию генов факторов транскрипции, регулируемая экспрессия которых, в свою очередь, требует новых факторов, и так далее до бесконечности. В этой связи не является неожиданным, что регуляция экспрессии генов многих факторов транскрипции происходит на посттранскрипционном уровне. Например, возрастание уровня биосинтеза дрожжевого фактора GCN4, активирующего гены биосинтеза аминокислот, является следствием ускорения трансляции его мРНК рибосомами в ответ на недостаток внутриклеточного содержания аминокислот. 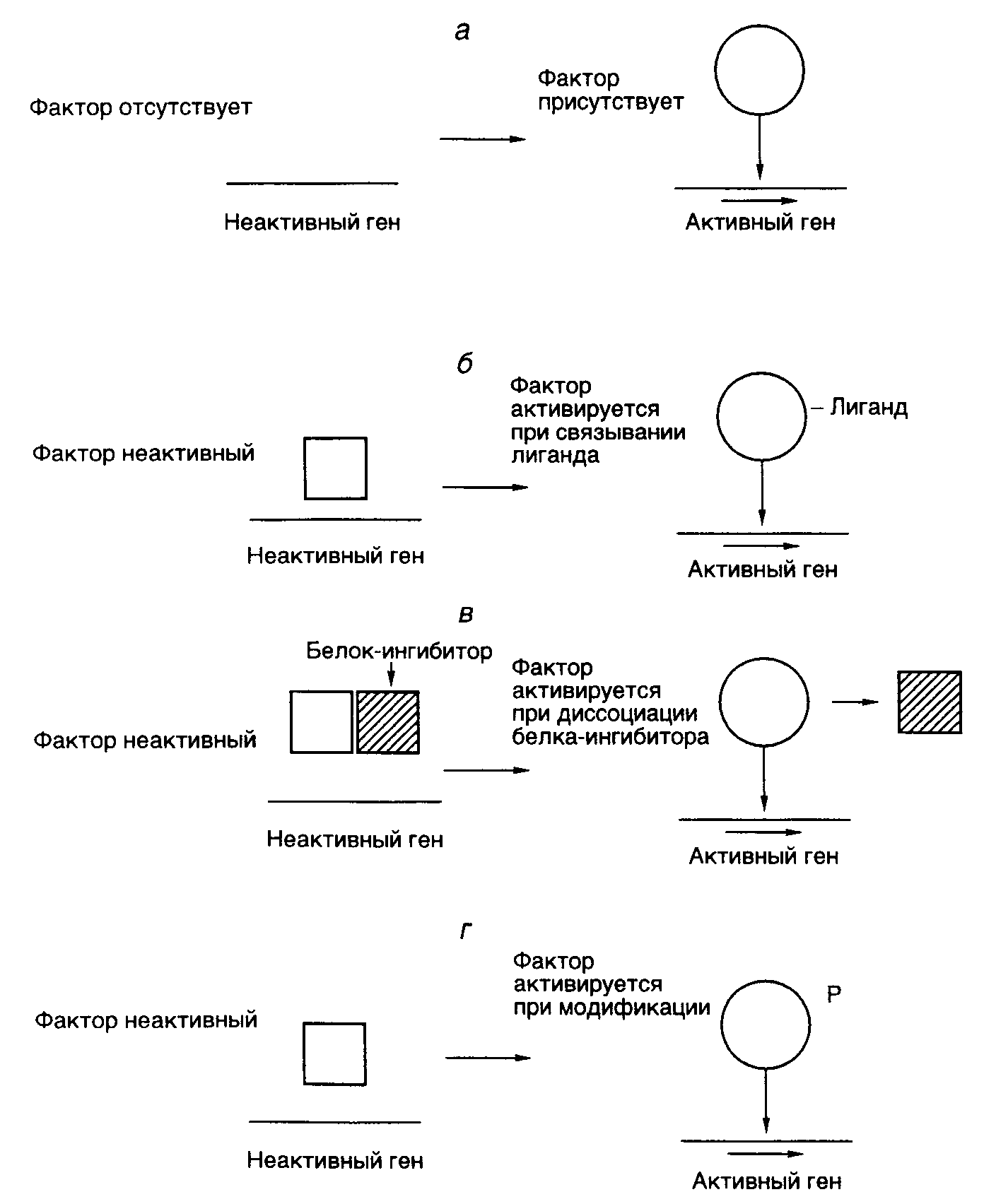 Рис. I.28. Способы регуляции активности факторов транскрипции у эукариот (а–г) Регуляция экспрессии генов факторов транскрипции может происходить и на уровне сплайсинга соответствующих РНК. В частности, существуют две формы рецептора тиреоидных гормонов, образующиеся в результате альтернативного сплайсинга. У одной из них отсутствует домен, связывающий гормон, и она способна распознавать те же последовательности ДНК, что и гормонсвязывающий рецептор, однако не может активировать транскрипцию в присутствии гормона. Таким образом, эта форма действует как доминантный репрессор соответствующих генов. Подобный механизм описан также и для онкогена v-erbA вируса эритробластоза птиц, кодирующего укороченную форму рецептора тиреоидных гормонов, у которой отсутствует домен, связывающий гормон. Регуляция активности факторов транскрипции. Белковые продукты генов многих специфически действующих факторов транскрипции часто присутствуют во всех тканях, однако специфический характер их воздействия достигается путем их посттрансляционной активации в строго определенном месте или же в ответ на соответствующий сигнал. Простым примером такого рода является активация дрожжевого фактора транскрипции ACE1, который стимулирует транскрипцию гена металлотионеина в присутствии ионов меди. В этом случае ионы Cu2+, взаимодействуя с фактором, вызывают конформационные изменения в его полипептидной цепи, после чего фактор приобретает способность связываться с регуляторным участком гена металлотионеина и активировать его транскрипцию (см. рис. I.28,б). Аналогичную зависимость от активирующего лиганда демонстрируют молекулы факторов транскрипции, принадлежащие к семейству рецепторов стероидных/тиреоидных гормонов (см. рис. I.26). Молекулы таких рецепторов для осуществления активирующего действия на гены-мишени должны вначале специфически связать эквимолярные количества соответствующего гормона-эффектора. Как уже упоминалось, эти рецепторы обладают специальным С-концевым доменом, выполняющим данную функцию. Несмотря на то что in vivo такие рецепторы приобретают способность взаимодействовать с регуляторными последовательностями ДНК только в присутствии гормона, in vitro они связываются специфическими последовательностями ДНК как при наличии гормона, так и без него. Оказалось, что в клетках рецепторы находятся в комплексе с белком, предотвращающим их связывание соответствующими регуляторными последовательностями ДНК, и гормоны после взаимодействия с рецепторами в этих комплексах вызывают диссоциацию последних (см. рис. I.28,в). Следовательно, в рассмотренном выше случае активация факторов транскрипции происходит не в результате конформационного изменения их пространственной структуры под действием лигандов, а путем лигандзависимого разрушения ингибирующего белок–белкового взаимодействия. Подобный механизм активации продемонстрирован для белкового фактора GAL4 в ответ на действие галактозы, а также белка NFB под воздействием форболовых эфиров в Т-лимфоцитах или клетках HeLa. Более того, аналогичный механизм обеспечивает активацию транскрипции генов в определенных тканях. Так, фактор транскрипции MyoD1 играет ключевую роль в активации экспрессии генов, происходящей в тканях мышц во время дифференцировки миобластов в мышечные волокна (миотубы). Такая активация наблюдается не из-за увеличения содержания MyoD1 в дифференцирующихся клетках, а как следствие уменьшения содержания белка-ингибитора Id, образующего комплекс с MyoD1 и препятствующего его взаимодействию с регуляторными последовательностями ДНК. Интересно, что ингибитор Id, как и сам MyoD1, содержит мотив "спираль–поворот–спираль", который опосредует димеризацию соответствующих белков. Однако в составе Id-белка отсутствует основный ДНК-связывающий домен, функционирование которого обсуждалось выше. Предполагается, что Id димеризуется с MyoD1, подавляя его способность взаимодействовать с ДНК, по аналогии с тем, как это происходит в опытах с укороченными белками MyoD1, не содержащими ДНК-связывающий домен. Активация факторов транскрипции может осуществляться не только путем изменения белок–белковых взаимодействий, но и под действием ковалентных модификаций самих факторов в ответ на появление специфических сигналов (см. рис. I.28,г). Примером может служить механизм активации фактора транскрипции CREB, который обеспечивает активацию некоторых клеточных генов в ответ на воздействие циклическим АМР. О подобных механизмах речь уже шла в разделе о вторичных мессенджерах. В этом случае сАМР стимулирует протеинкиназу А, которая, в свою очередь, фосфорилирует CREB, что сопровождается активацией домена, расположенного в полипептидной цепи фактора по соседству с сайтом фосфорилирования. Тот же механизм функционирует при активации фактора транскрипции генов теплового шока дрожжей в ответ на повышение температуры, а также при активации фактора NKB под действием форболовых эфиров. В последнем случае фосфорилирование белка-ингибитора, находящегося в комплексе с белком NKB, приводит к диссоциации комплекса, что допускает последующее связывание NKB с регуляторными последовательностями ДНК, сопровождаемое активацией транскрипции соответствующих генов. Фосфорилирование не является единственной модификацией, приводящей к активации факторов транскрипции. Аналогичный эффект достигается и при гликозилировании некоторых белков. 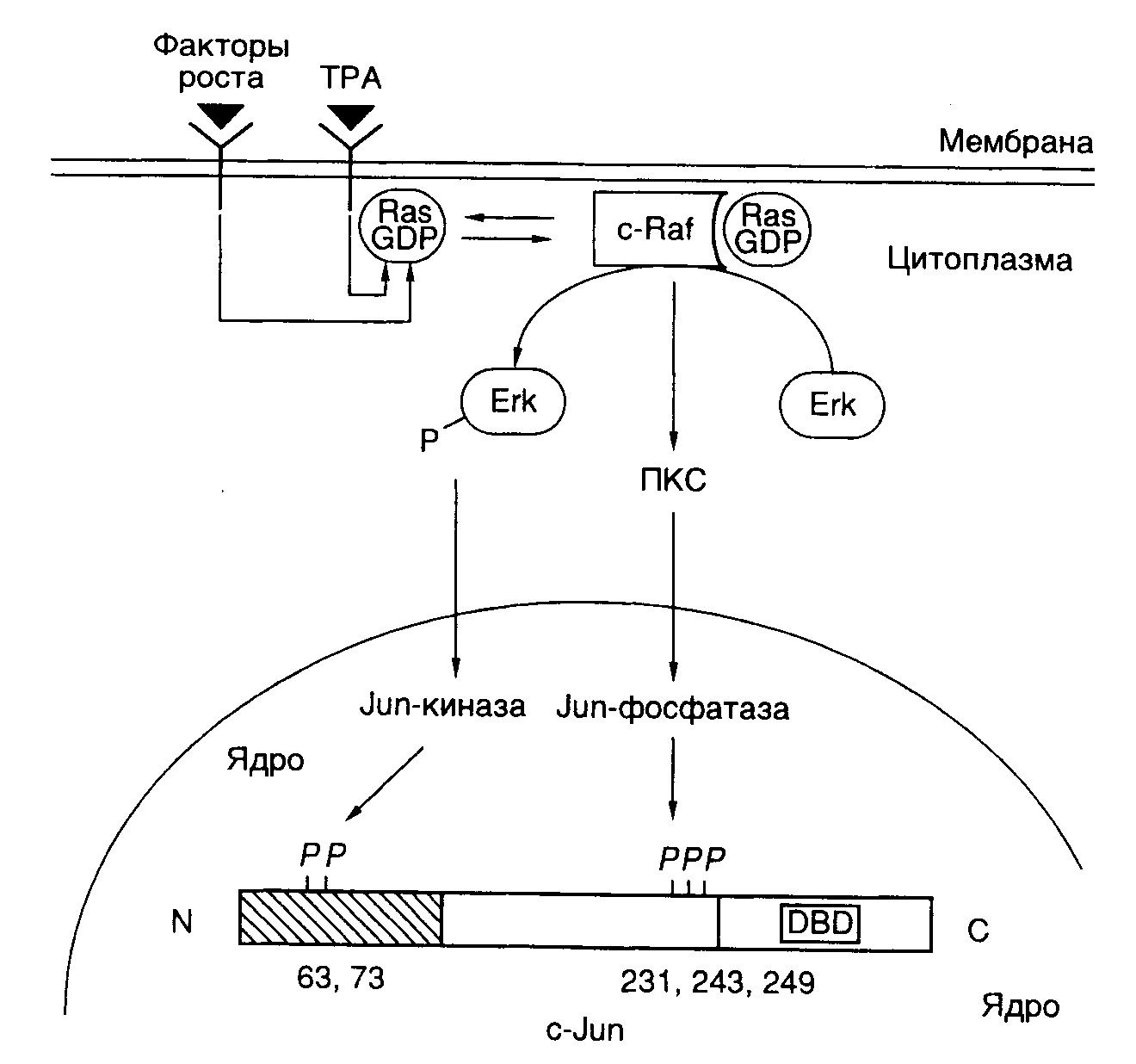 Рис. I.29. Схема регуляции активности фактора транскрипции c-Jun ПKC – протеинкиназа С, DBD – ДНК-связывающий домен; 12-O-тетрадеканоилфорбол-13-ацетат. Цифрами обозначены номера остатков аминокислот в полипептидной цепи c-Jun, подвергающихся регуляторному фосфорилированию/дефосфорилированию. Заштрихован N-концевой домен, участвующий в активации транскрипции В заключение рассмотрим несколько подробнее механизм регуляции активности факторов транскрипции класса 1.1 (факторы с доменами типа "лейциновая застежка"), которые, как уже упоминалось, относятся к Bzip-белкам, так как содержат основной домен (B – basic) и домен типа "лейциновая застежка". Данный пример поучителен потому, что приоткрывает завесу над некоторыми молекулярными механизмами канцерогенеза, поскольку многие белковые компоненты этой системы регуляции (Src, Ras, Raf, Jun, Sis, Fos) являются продуктами экспрессии протоонкогенов. Как уже упоминалось выше, семейство AP-1-подобных факторов транскрипции, предсуществующих в клетках в латентной форме, активируется классическим промотором химического канцерогенеза – 12-О-тетрадеканоилфорбол-13-ацетатом (TPA), а также различными пептидными гормонами, факторами роста, цитокинами и нейромедиаторами. Одновременно происходит индукция транскрипции генов c-fos, уровень экспрессии которых в нестимулированных клетках низок. Латентная форма фактора c-Jun фосфорилирована вблизи C-концевого ДНК-связывающего домена и слабо фосфорилирована в N-концевом активирующем домене. Как следует из упрощенной схемы, представленной на рис. I.29, эта последовательность реакций инициируется после взаимодействия с рецепторами на поверхности клетки соответствующих лигандов – цитокинов или факторов роста. Под действием протеинкиназ Src или PTK гуанозинтрифосфатаза Ras связывает молекулу GTP и переходит в активную конформацию, что позволяет эффекторному участку полипептидной цепи белка взаимодействовать с N-концевым доменом c-Raf. Процесс сопровождается переносом последнего к цитоплазматической мембране, его активацией и запуском каскада реакций, осуществляемых протеинкиназами, активируемыми митогенами (MAP), к которым относятся белки Erk-1 и Erk-2. Активность MAP-киназ зависит от фосфорилирования их полипептидных цепей по остаткам Thr и Ser киназой MAP-киназ (MAPKK), которая сама активизируется в результате фосфорилирования ее полипептидной цепи. Белок c-Raf в этом каскаде реакций выполняет роль такой MAPKK. Активированные Erk-1 и Erk-2 далее транслоцируются в ядро, где инициируют Jun-киназу, которая фосфорилирует фактор транскрипции c-Jun в N-концевом домене. Одновременно с участием протеинкиназы C происходит активация Jun-фосфатазы, которая дефосфорилирует полипептидную цепь c-Jun вблизи ее C-концевого домена. В результате реакций фосфорилирования и дефосфорилирования полипептидной цепи c-Jun этот фактор транскрипции приобретает способность взаимодействовать с регуляторными последовательностями генов, называемых TPA-респонсивными элементами, и далее активирует транскрипцию соответствующих генов. Рассмотрение механизмов позитивного контроля транскрипции продолжим на примере механизмов функционирования регуляторных последовательностей нуклеотидов высших организмов – энхансеров – специфических регуляторных последовательностей, обеспечивающих высокий уровень транскрипции определенных генов после взаимодействия с регуляторными белками. Энхансеры. Энхансерами называют определенный класс регуляторных последовательностей нуклеотидов, которые обладают рядом существенных особенностей, резко отличающих их от других регуляторных последовательностей эукариот, регулирующих транскрипцию. Энхансеры представляют собой протяженные последовательности нуклеотидов, которые содержат сайты связывания нескольких факторов транскрипции. Характерными свойствами энхансера являются его способность осуществлять регуляторное действие на промотор на больших расстояниях от него, достигающих 60 т.п.о. и более, независимость его активности от ориентации по отношению к промоторам, а также от расположения относительно регулируемого гена. 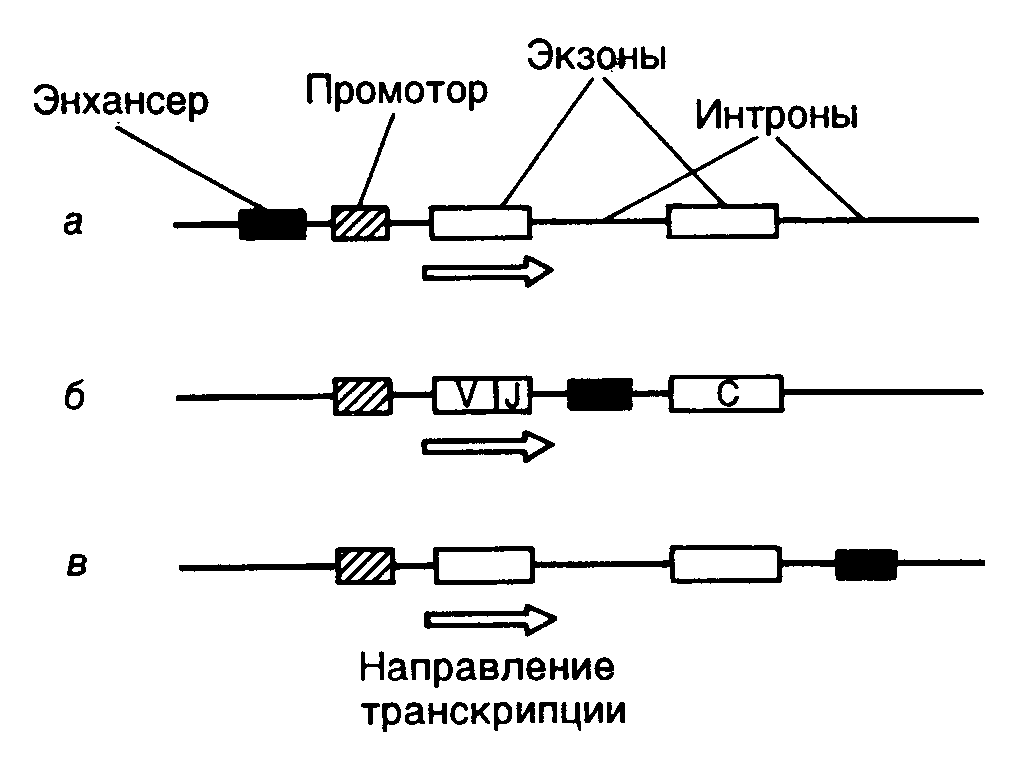 Рис. I.30. Варианты взаимного расположения регуляторных и структурных частей генов эукариот Регуляторные части генов представлены энхансером и промотором, структурные части – экзонами и интронами. а – ген альбумина, энхансер располагается перед промотором; б – ген иммуноглобулина, энхансер расположен в центре гена между последовательностями, кодирующими константную и вариабельную части белка; в – ген -глобина, энхансер расположен вслед за кодирующей частью гена На рис. I.30 приведены схемы строения нескольких эукариотических генов, которые отражают взаимное расположение их структурных и регуляторных частей. Если у гена альбумина (см. рис. I.30,а) энхансер находится перед промотором, а вся регуляторная часть предшествует его структурной части, то в случае генов иммуноглобулинов регуляторные элементы локализованы в интронах самого гена (см. рис. I.30,б). Энхансер может быть расположен и ниже гена на значительном от него расстоянии, как это имеет место у -глобинового гена (см. рис. I.30,в). 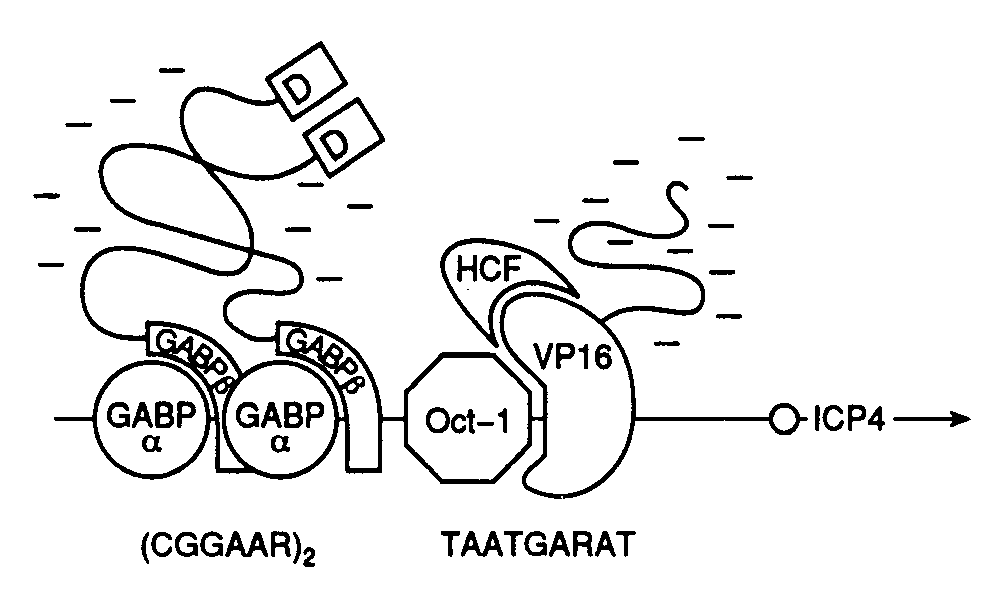 Рис. I.31. Схема белок-белковых и белково-нуклеиновых взаимодействий на энхансерах непосредственно-ранних генов ВПГ D – домены димеризации соответствующих факторов, Отмечены отрицательно заряженные "кислые" участки их полипептидных цепей, непосредственно участвующие в активации транскрипции гена ICP4, направление транскрипции которого обозначено стрелкой Исследование молекулярных взаимодействий факторов транскрипции с энхансерами привело к пониманию того, что такие регуляторные последовательности являются своеобразными матрицами для сборки сложных белковых комплексов, структура которых обеспечивает высокоспецифические белок-белковые связывания и передачу регуляторных сигналов РНК-полимеразе II, находящейся в составе инициационного комплекса. Как и в большинстве других случаев, основной прогресс в изучении молекулярных механизмов регуляции экспрессии генов с помощью энхансеров у эукариот был достигнут с использованием вирусов животных в качестве объектов исследования. У вируса простого герпеса (ВПГ) был обнаружен транскрипционный фактор VP16, участвующий в активации его непосредственно-ранних генов и присутствующий в зрелом вирионе в количестве 1000 копий. Белок VP16 взаимодействует с энхансерами, расположенными перед каждым из непосредственно-ранних генов вируса, что приводит к активации их транскрипции. Детальное изучение регуляторных участков этих генов показало, что каждый из энхансеров содержит одну или несколько копий цис-регуляторных последовательностей нонануклеотидную последовательность 5’-TAATGARAT-3’ (так называемая tat-garat) и прямые повторы гексануклеотидной последовательности 5’-CGGAAR-3’ ("cigar"). В очищенном состоянии белок VP16 не взаимодействует ни с одной из них. Однако в присутствии белковых факторов экстрактов ядер клеток-хозяев VP16 входит в состав многокомпонентного белкового комплекса, формирующегося на последовательности "tat-garat" (рис. I.31). Сходство последовательностей нуклеотидов мотива "tat-garat" и сайтов связывания Oct-белков, ранее обнаруженных в регуляторных последовательностях генов гистонов и иммуноглобулинов, заставило проверить эти белки на способность взаимодействовать с ВПГ-энхансерами. Было выяснено, что Oct-1 является вторым белковым компонентом, соединяющимся с "tat-garat"-последовательностью энхансера и облегчающим связывание с ним белка VP16. Эффективное образование вышеупомянутого белкового комплекса требует участия других компонентов клетки-хозяина, поскольку очищенные белки Oct-1, VP16 и последовательность "tat-garat" формируют стабильный комплекс только в присутствии экстрактов ядер клеток HeLa. Белковый фактор, названный HCF, может непосредственно взаимодействовать с VP16 в отсутствие других компонентов комплекса. С помощью мутационного анализа было установлено, что 5’-концевой сегмент "tat-garat" (последовательность "tat") необходим для связывания белка Oct-1, тогда как ее 3’-концевая последовательность ("garat") требуется для образования полного белкового комплекса Oct-1VP16HCF. Таким образом, по крайней мере, четыре молекулярных поверхности (интерфейса) участвуют в формировании функционально активного комплекса на матричной поверхности мотива "tat-garat" энхансеров непосредственно-ранних генов ВПГ. Одна группа контактов образуется между белками Oct-1 и VP16, вторая – между VP16 и HCF, третья – между Oct-1 и последовательностью "tat" и, наконец, четвертая – между VP16 и последовательностью "garat" (см. рис. I.31). Не менее сложная серия молекулярных интерфейсов участвует и в формировании функционального макромолекулярного комплекса на мотиве "cigar" энхансера непосредственно-ранних генов ВПГ. Белок, взаимодействующий с этим мотивом, выделен из экстрактов ядер печени крыс и получил название GABP (GA-binding protein). Он состоит из двух разных субъединиц – GABP и GABP. Белковые комплексы, похожие на GABP, выделены и из культивируемых клеток человека. Часть аминокислотной последовательности GABP оказалась гомологичной участку ДНК-связывающего домена транскрипционных факторов, принадлежащих к семейству ETS. Все представители этого семейства обладают последовательностью из 85 аминокислотных остатков, которая необходима для их специфического взаимодействия с ДНК. Таким образом, ETS-домен белка GABP образует первый молекулярный интерфейс, обеспечивающий связывание белка с мотивом "cigar" энхансера. В смеси с GABP -субъединица образует белковый комплекс, который обладает бòльшим сродством к мотиву "cigar" энхансера, чем сама -субъединица. Анализ особенностей взаимодействия GABP-комплекса с энхансером позволил обнаружить три высокоспецифичных молекулярных интерфейса. Это прежде всего домен полипептида GABP, необходимый для его взаимодействия с белком GABP и включающий ETS-домен, а также последовательность из 35 С-концевых аминокислотных остатков GAPB. У полипептидной цепи GABP во взаимодействии с GABP принимают участие четыре тандемных повтора, состоящие из 33 аминокислотных остатков каждый и расположенные в N-концевой части белка. Анализ аминокислотных последовательностей, гомологичных этому повтору у ряда других известных белков, позволил выявить высококонсервативную последовательность TPLH, из-за которой данный мотив и получил свое название. Дополнительные молекулярные взаимодействия между белковым комплексом и последовательностью нуклеотидов "cigar" осуществляются через повторы TPLH после того, как они образуют требуемый комплекс с GABP. При этом аминокислотные последовательности повторов непосредственно контактируют с ДНК. Наконец, в последнем из известных контактов, имеющих место после сборки белкового комплекса на последовательности нуклеотидов "cigar", участвует так называемый домен димеризации полипептидной цепи GABP, расположенный вблизи ее С-конца. Очищенные субъединицы GABP в растворе ассоциируют с образованием гомодимеров, которые в присутствии субъединиц GABP формируют гетеродимерный комплекс 22, хорошо приспособленный для взаимодействия с гексануклеотидным повтором "cigar" (CGGAAR)2 энхансера. Анализируя все вышеперечисленные компоненты энхансеров непосредственно-ранних генов ВПГ, можно сделать вывод, что в их активации принимают участие не менее пяти белков (VP16, Oct-1, HCF, GABP и GABP), которые участвуют, как минимум, в пяти белок-белковых контактах и шести специфических контактах белок–ДНК (см. рис. I.31). Прежде всего, обращает на себя внимание кооперативность взаимодействия компонентов, активирующих энхансеры. Ключевые белки этого комплекса Oct-1, VP-16 и GABP сами по себе слабо взаимодействуют со специфическими последовательностями ДНК, но обладают способностью собираться в стабильный функционально активный комплекс, по крайней мере, двумя путями: во-первых, объединяясь с кофакторами, которые самостоятельно не способны взаимодействовать с ДНК (например VP16 с HCF и GABP с GABP); во-вторых, контактируя с последовательностью нуклеотидов энхансера, содержащей функциональные участки "tat" и "garat", а также повтор "cigar" и образующей матрицу для геометрически правильной сборки всего активирующего комплекса. При исследовании механизмов действия многочисленных факторов транскрипции удивляет то, что специфичность взаимодействия с ДНК многих белков этих подсемейств, по крайней мере, определенная in vitro, невысока. В очищенном состоянии факторы часто узнают одни и те же последовательности нуклеотидов. Каким же образом данные белки осуществляют специфические регуляторные воздействия на регулируемые гены? Как уже было видно при обсуждении функционирования энхансеров непосредственно-ранних генов ВПГ, такую специфичность обеспечивают другие, вспомогательные белки, взаимодействующие с основными регуляторными белками. В частности, несмотря на сходство в специфичности распознавания последовательностей нуклеотидов, истинные регуляторные белки обладают бòльшим сродством к последовательностям-мишеням, еще более усиливающимся под влиянием белок-белковых взаимодействий. Недавно было показано, что белок GABP не связывается с другими белками, обладающими ETS-доменами, и, следовательно, лишь один белок из этого семейства, а именно GABP, образуя комплекс с GABP, обеспечивает специфичность взаимодействия последнего с энхансером. Рассмотренный нами пример регуляции экспрессии непосредственно-ранних генов ВПГ хорошо иллюстрирует те многочисленные белок-белковые и белково-нуклеиновые взаимодействия, которые требуются для функционирования сложной системы дифференциально экспрессирующихся генов высших организмов. Несмотря на то что с развитием молекулярной генетики число известных регуляторных механизмов будет увеличиваться, именно этот принцип, основанный на возможности специфических взаимодействий макромолекул друг с другом, по-видимому, останется доминирующим в регуляторных механизмах эукариот. Коактиваторы транскрипции. Энхансеры обнаруживают одну из специфических черт регуляции транскрипции у эукариот: влияние на синтез РНК регуляторных последовательностей нуклеотидов, расположенных на больших расстояниях от инициаторной последовательности промоторов. Еще недавно совершенно непонятный механизм этого явления стал проясняться с открытием специфических регуляторных белков – коактиваторов транскрипции. Коактиваторы транскрипции были впервые обнаружены у дрожжей при исследовании одного из основных факторов транскрипции TFIID, который необходим для полноценной инициации транскрипции РНК-полимеразой II. Было установлено, что один из основных компонентов TFIID – TATA-связывающий белок TBP способен обеспечивать базальную, но не индуцированную транскрипцию in vitro. На основании этого было высказано предположение, что он дополнительно должен содержать TBP-ассоциированные факторы (TAF), которые отличаются от основных факторов и активаторов транскрипции. После клонирования генов TAF-факторов и очистки кодируемых этими генами белков выяснилось, что TAF-белки обеспечивают физическое взаимодействие между активаторами транскрипции и основными факторами, поскольку они обладают способностью связывать белки обеих групп. Те же функции присущи и упомянутым выше SRB-белкам дрожжей. Таким образом, коактиваторы транскрипции являются белками-адаптерами, обеспечивающими перенос регуляторного сигнала от тканеспецифических белков-активаторов транскрипции к РНК-полимеразе II. 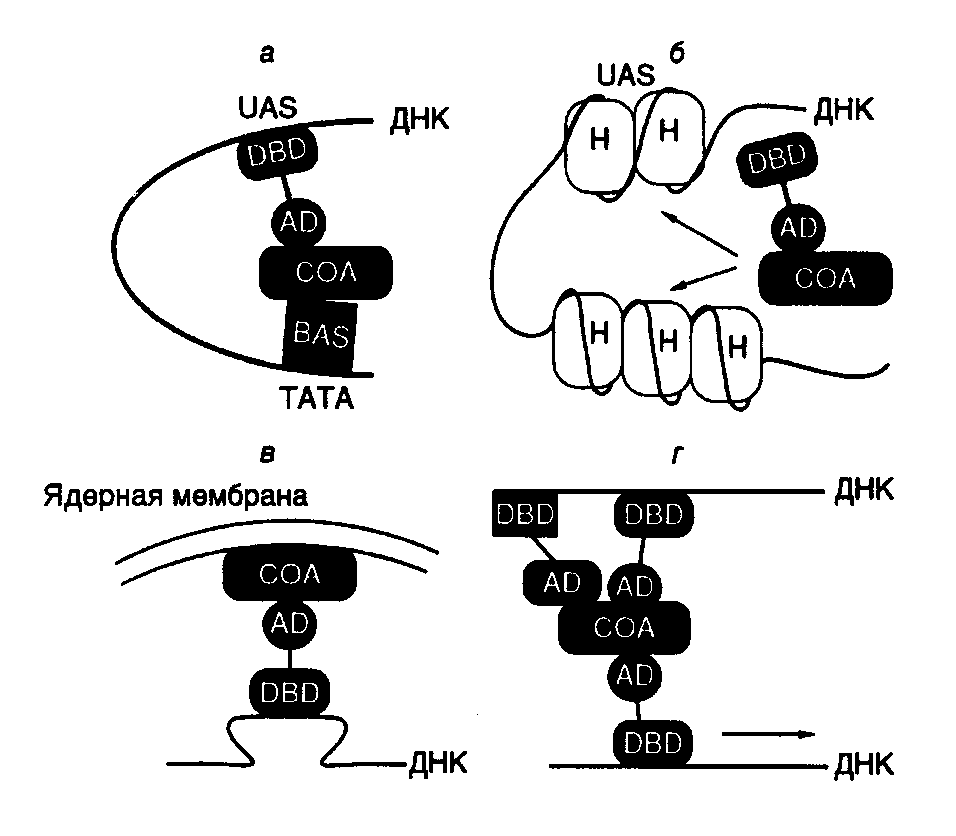 Рис. I.32. Гипотетические модели механизма действия коактиваторов транскрипции а – передача сигнала от активаторов транскрипции, взаимодействующих с дистальными регуляторными последовательностями нуклеотидов промоторов (UAS); б – разрушение нуклеосомной структуры в регуляторных последовательностях промоторов; в – поддержание определенной пространственной структуры транскрибируемых участков хроматина; г – обеспечение трансвекции AD и DBD – активирующий и ДНК-связывающий домены активатора транскрипции соответственно; COA – коактиватор транскрипции; BAS – основные факторы транскрипции; H – гистоны На рис. I.32 суммированы современные представления о механизмах действия коактиваторов транскрипции. Во всех четырех моделях подчеркивается адаптерная (медиаторная) функция этих белков, которые выступают в роли посредников между другими регуляторными белками. Прежде всего, акцентируется их роль в передаче сигнала от белков-активаторов транскрипции, реагирующих с дистальными регуляторными последовательностями промоторов (UAS – upstream activation sites), к основным факторам транскрипции и РНК-полимеразе II (см. рис. I.32,а). В этом случае коактиваторы транскрипции могут усиливать взаимодействие основных факторов транскрипции с инициаторными последовательностями промотора. Имеются экспериментальные данные, указывающие на то, что другая функциональная роль коактиваторов транскрипции заключается в дерепрессии промоторов, доступ к которым для основных факторов транскрипции блокирован гистонами, входящими в состав нуклеосом (см. рис. I.32,б). В этом случае коактиваторы транскрипции могут участвовать в разрушении структуры хроматина в окрестностях промоторов. После удаления гистонов или изменения структуры нуклеосом регуляторные последовательности становятся доступными для основных факторов транскрипции и РНК-полимеразы II. Коактиваторы транскрипции могут играть определенную роль и в создании топологии транскрибируемых участков хроматина в интерфазных ядрах (см. рис. I.32,в). В этом случае коактиваторы удерживают активно транскрибируемые участки хроматина в тех микрокомпартментах интерфазных ядер, которые обеспечивают эффективную экспрессию генов. Такая роль коактиваторов отчетливо проявляется в функционировании инсуляторов и сайленсеров (см. ниже, а также раздел 3.2.3). И, наконец, последняя модель (см. рис. I.32,г) объясняет механизм явлений, аналогичных процессу трансвекции, впервые описанному у дрозофилы. Сущность этого явления заключается в том, что взаимодействие двух различных мутантных аллелей одного гена, присутствующих на разных гомологичных хромосомах, приводит к функциональной компенсации мутаций и усилению экспрессии соответствующего гена, т.е. трансвекция является одной из разновидностей генетической комплементации. Трансвекция происходит, когда, например энхансер гена, структурная часть которого инактивирована мутацией, активирует транскрипцию другого аллеля этого гена с поврежденным мутацией энхансером, находящегося на гомологичной хромосоме. В таком случае трансхромосомная активация транскрипции обеспечивается действием белков-коактиваторов транскрипции, с участием которых происходит передача регуляторного сигнала от активатора транскрипции, ассоциированного с энхансером одной хромосомы, к основным факторам транскрипции гомологичного аллеля этого гена другой хромосомы. Белки-коактиваторы обеспечивают и синапсис (конъюгацию, объединение) гомологичных хромосом на протяженном участке. Наличие у эукариот регуляторных белков-коактиваторов транскрипции объясняет одну из сторон механизма действия энхансеров, расположенных дистально по отношению к точке инициации транскрипции. В соответствии с этой концепцией дистальные и проксимальные регуляторные элементы промотора, сближенные в результате образования петли, разделяющей их ДНК, удерживаются вместе коактиваторами транскрипции. Однако остается необъясненной еще одна сторона механизма действия энхансеров. Действительно, энхансеры как регуляторные последовательности нуклеотидов обладают рядом уникальных свойств. Их стимулирующее действие на промоторы регулируемых генов не зависит от ориентации, а также положения по отношению к гену и проявляется даже в том случае, если энхансеры удалены от генов-мишеней на значительное (несколько десятков тысяч пар оснований) расстояние. Последнее обстоятельство кажется наиболее загадочным, так как непонятно, каким образом удается избежать активации промоторов гетерологичных генов, которые могут быть расположены в пределах досягаемости действия этих энхансеров. Как оказалось, специфичность действия энхансеров обеспечивается еще одним весьма своеобразным механизмом регуляции экспрессии генов у высших организмов, в котором участвуют специфические регуляторные последовательности нуклеотидов – так называемые пограничные последовательности, или инсуляторы (раздел 3.2.4). |
