ПРАКТИЧЕСКОЕ РУКОВОДСВО ПО ХИМИИ ПОЧВ. Руководство по химии почв учебное пособие
 Скачать 2.43 Mb. Скачать 2.43 Mb.
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Количество рабочего рас-твора СаС12 на 5 мл гумата, мл | Н2О для уравнивания объема, мл | Соответствующие количества СаС12 в пересчете на 1 л гумата, мг-экв |
| 0,05 | 0,95 | 1 |
| 0,10 | 0,90 | 2 |
| 0,15 | 0,85 | 3 |
| 0,20 | 0,80 | 4 |
| 0,25 | 0,75 | 5 |
| 0,30 | 0,70 | 6 |
| 0,35 | 0,65 | 7 |
| 0,40 | 0,60 | 8 |
| 0,45 0,50 | 0,55 0,50 | 9 10 |
| 0,55 | 0,45 | 11 |
| 0,60 | 0,40 | 12 |
| 0,65 | 0,35 | 13 |
| 0,70 | 0,30 | 14 |
| 0,75 | 0,25 | 15 |
| 0,80 | 0,20 | 16 |
| 0,85 | 0,15 | 17 |
| 0 90 | 0,10 | 18 |
| 0,95 | 0,05 | 19 |
| 1,00 | 0,00 | 20 |
Заданные объемы рабочего раствора СаС12 и дистиллированной воды приливают при помощи микробюреток емкостью 3-5 мл; пробы гумата натрия берут пипеткой на 5 мл.
Необходимо строго соблюдать внесение растворов в такой последовательности: раствор СаС12, вода, раствор гумата. После того как раствор гумата прилит в пробирки, их закрывают резиновыми пробками и перемешивают содержимое. Отмечают время (в часах) и соответствующее ему количество электролита (в мг-экв) для следующих моментов: а) начало коагуляции, о котором судят по появлению мути в прозрачном в начале растворе гумата; б) полная коагуляция, когда раствор над осадком остается прозрачным и бесцветным.
Приготовление раствора СаС12: 6,66 г в пересчете на безводный СаС12 растворяют в дистиллированной воде и доводят до объема 1 л.
В таблице 28 приводится пример расчетов для приведения исходных растворов гуматов к заданной концентрации.
Таблица 28. Пример расчетов для стандартизации растворов
гуматов натрия (М.М. Кононова, 1963)
| Почва | Концентрация углерода в испытуемом растворе гумата натрия, г/л | Заданная концентрация углерода в растворе гумата натрия, г/л | Превышение концентрации углерода в испытуемом растворе гумата натрия по сравнению с заданной | Разбавление испытуемого раствора гумата натрия | Общий объем раствора гумата натрия после разбавления, мл | |
| Взять испытуемого раствора гумата натрия, мл | Добавить дистиллированной воды, мл | |||||
| Сильноподзолистая | 0,1717 | 0,136 | 0,1717/0,136=1,26* | 100,0 | 26,0 | 126,0 |
| Чернозем обыкновенный | 0,4259 | 0,136 | 0,4259/0,136 =3,13* | 50 | 106,5 | 156,5 |
*величина, показывающая, во сколько раз следует разбавить 1 мл испытуемого раствора, чтобы концентрация углерода в нем была равной 0,136 гл.
3.6.2. Оптические свойства гумусовых веществ.
Оригинальные исследования М.М. Кононовой и Н.П. Бельчиковой (1961) показали четкую зависимость между оптическими характеристиками гумусовых кислот, их свойствами и условиями образования.
Гумусовые вещества активно взаимодействуют с электромагнитными колебаниями, образуя спектры поглощения в широком диапазоне длин волн. Наиболее хорошо изучены спектры поглощения гумусовых кислот в интервале 220-750 нм – электронные спектры поглощения и в интервале 2-25 мкм – молекулярные спектры.
3.6.2.1. Электронные спектры поглощения гумусовых веществ
Электронные спектры характеризуют поглощение электромагнитных колебаний в ультрафиолетовом и видимом диапазонах. При изучении органического вещества почвы их используют: 1) для сравнительной характеристики гумусовых веществ и их фракций; 2) для изучения строения и свойств гуминовых кислот и фульвокислот; 3) для идентификации и количественного определения отдельных компонентов органической природы присутствующих в щелочных и спиртобензольных экстрактах из почв (хлорофилл, липиды, пигмент Рg) и других целей.
Обычно снимают электронные спектры поглощения растворов гуминовых кислот или фульвокислот полученных при растворении в 0,1 н. NaOH специально выделенных препаратов. Однако целесообразно проводить съемку спектров поглощения и тех растворов гуминовых кислот и фульвокислот, которые получаются при анализе группового и фракционного состава гумуса.
Для получения сравнимых и наглядных результатов М.М. Кононова рекомендует исследуемые растворы доводить до одинаковой концентрации по углероду – 0,136 г/л. Эта концентрация выбрана условно, можно использовать любую иную концентрацию растворов гумусовых веществ. Главное чтобы сравниваемые растворы были выровнены по содержанию в них углерода. Если были сняты спектры растворов с разной концентрацией углерода то найденные значения оптических плотностей приводят к стандартной концентрации по углероду по формуле:
где Dо – оптическая плотность раствора при концентрации углерода выбранной в качестве стандартной Dх – измеренная оптическая плотность раствора с концентрацией углерода Сх; Со – концентрация углерода в растворе выбранная в качестве стандартной, г/л; Сх – концентрация углерода в растворе при которой проводилось определение оптической плотности Dх, г/л.
Следует учесть, что растворы фульвокислот получаемые при анализе качественного состава гумуса имеют сильнокислую реакцию среды. В сильнокислой и кислой среде интенсивность окраски фульвокислот сильно уменьшается. Для получения сравнимых результатов реакцию среды доводят до рН = 12. В этой области окраска фульвокислот мало зависит от рН, а условия съемки спектров Гк и Фк оказываются одинаковыми.
Ход анализа. После приведения анализируемых растворов к стандартным условиям (концентрация углерода, реакция среды) измеряют величину оптической плотности при различных длинах волн. По полученным значениям оптических плотностей строят графики электронных спектров поглощения. На графике отображают изменение величины D раствора гумусовой кислоты (ось ординат) в зависимости от длины волны (λ) в нм (ось абсцисс). Наиболее точные результаты получают при использовании спектрофотометров с автоматической записью спектра.
Обычно электронные спектры поглощения гумусовых кислот в широком диапазоне длин волн от 240-260 до 750 нм не имеют четко выраженных полос или максимумов поглощения. В координатах D – λ спектры выглядят, как пологие кривые с постепенным уменьшением оптической плотности по мере увеличения длины волны (рис. 5).
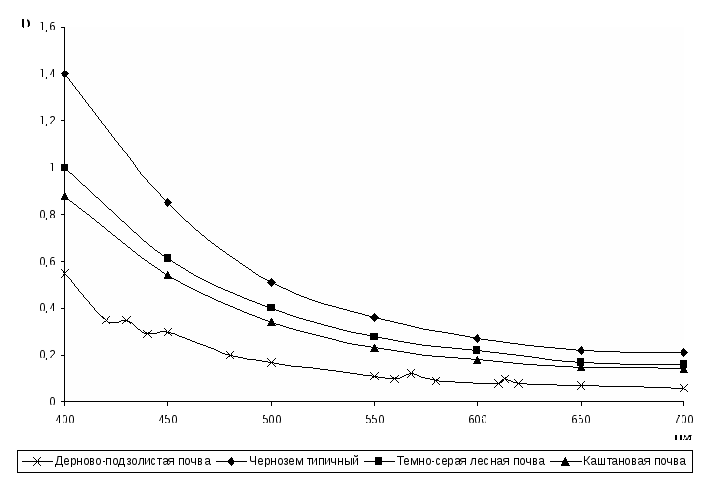
Рис. 5. Электронные спектры поглощения гуматов натрия
В связи с этим, при характеристике электронных спектров поглощения часто ограничиваются только видимой областью – от 400 до 750 нм, поскольку в ультрафиолетовой части спектра получают практически идентичную информацию. На спектрах гумусовых веществ некоторых типов почв (дерново-подзолистые, бурые лесные, луговые) часто обнаруживаются две пары максимумов при 420-425, 450-460 нм и 570-580, 615-620 нм, принадлежащие своеобразному зеленому пигменту, первоначально названному «зеленой гуминовой кислотой». В настоящее время он обозначается символом Рg. Содержание его в почвах иногда бывает столь значительно, что щелочная вытяжка имеет ясно выраженный зеленоватый оттенок. Обычно фракция Рg встречается в почвах, испытывающих повышенное увлажнение, хотя бы временное.
3.6.2.2. Определение коэффициента цветности Q4/6
При анализе состава гумуса можно ограничиться определением оптической плотности при двух длинах волн: 465 и 650нм, или при близких к ним значениях. Пользуясь полученными значениями оптической плотности, находят коэффициент цветности:
Q4/6 = D465/D650,
где D465 – величина оптической плотности при длине волны 465 нм; D650 – величина оптической плотности при длине волны 650 нм.
По мнению М.М. Кононовой и Н.П. Бельчиковой (1961) надежные результаты при определении величины отношения Q4/6 получаются в том случае, когда содержание углерода в темноокрашенных растворах (вытяжки из черноземов, каштановых почв) колеблется от 0,03 до 0,15 г/л, в светлоокрашенных (вытяжки из подзолистых почв, красноземов, сероземов) от 0,06 до 0,18 г/л. Толщина кюветы и в том и в другом случае 1 см.
Д.С. Орлов и Л.А. Гришина (1981) рекомендуют определять величину Q4/6, используя две кюветы разных размеров.
Наиболее точны измерения оптической плотности при значениях D в интервале 0,15-0,9. Если при 465 нм оптическая плотность имеет значения около 0,3, то при 650 она будет всего лишь 0,04 - 0,1. Это может привести к большим ошибкам в измерениях. Что бы избежать этого сначала измеряют оптическую плотность для области 400 нм, затем повторяют съемку спектра от 600 до 700 нм с кюветой, рабочая длина которой больше в 3-5 раз первой кюветы. Затем по спектрам находят искомые оптические плотности для соответствующих длин волн - 465 и 650 нм Отношение Q4/6 вычисляют, учитывая размер кювет по формуле:
где L465 и L650 – толщина кювет, с которыми были произведены измерения оптической плотности при 465 (D465) и 650 нм (D650) соответственно.
Величина отношения Q4/6 не зависит от концентрации углерода в растворе и, отражая степень крутизны спектрофотометрических кривых, является характерной для гумусовых кислот того или иного типа почв. Используется этот показатель для сравнительной характеристики степени конденсированности молекул гумусовых кислот.
Чем больше величина отношения Е4:Е6, тем более развита периферическая часть молекулы и тем меньшую долю составляет ароматическое ядро.
По данным М.М. Кононовой и Н.П. Бельчиковой (1961) отношение коэффициент цветности Q4/6 у гуминовых кислот разных типов почв имеет следующие значения: для подзолистых почв – около 5,0; темно-серой лесной почвы – 3,5; обыкновенного чернозема – 3,0-3,5; каштановых почв – 3,8-4,0; сероземов – 4,0-4,5; красноземов – около 5,0. У фульвокислот коэффициент Q4/6 колеблется в пределах 6,0 – 8,5.
3.6.3. Гель-хроматография гумусовых веществ
Определение молекулярных масс является одной из наиболее сложных проблем химии гумусовых веществ. Гумусовые вещества полидисперсны, причем даже относительно гомогенная фракция любой гумусовой кислоты, полученная одним способом, другим методом может быть еще разделена на ряд фракций.
Гумусовые кислоты довольно интенсивно окрашены и содержат большой набор функциональных групп и, кроме того, склонны к образованию ассоциатов. Все это ограничивает круг пригодных методов. В настоящее время одним из наиболее эффективных приемов определения молекулярных масс гумусовых веществ считается метод гель-хроматографии.
Сущность метода гель-хроматографии заключается в пространственном разделении молекул различных размеров с помощью пористых гелей. Специально для целей гель-хроматографии создано несколько типов гелей. При изучении гумусовых веществ наиболее часто используются сефадексы. Сефадекс – это декстрановый гель, который получают на основе полисахарида, продуцируемого бактериями.
Существуют различные типы гелей, различающиеся пределом разделения (табл. 29).
Таблица 29. Пределы разделения различных типов гелей
| Тип геля | Область фракционирования пептидов и глобулярных белков |
| G-10 | < 700 |
| G15 | <1500 |
| G-25 | 1000-5000 |
| G-50 | 1000-30 000 |
| G-75 | 3000-70 000 |
| G-100 | 4000-150 000 |
| G-150 | 5000-400 000 |
| G-200 | 5000-800 000 |
Колонка для гелевой хроматографии содержит набухшие гранулы геля, пространство между гранулами геля и его поры заполнены растворителем. Колонка характеризуется следующими параметрами. Объем матрицы, или объем сухого геля, обозначают Vm. Объем растворителя внутри гранул («связанный» растворитель) называется внутренним объемом и обозначается Vi. Объем растворителя между гранулами называется внешним объемом или свободным объемом и обозначается V0. Общий объем геля будет равен:
Vt = Vm + Vi + V0.
На поверхность геля в колонке помещают определенный объем раствора гумусовой кислоты. Если гумусовая кислота содержит молекулы, различающиеся по размерам, то они будут неравномерно распределяться между гелем и растворителем. Молекулы меньшего размера будут проникать в поры геля, а крупные молекулы будут оставаться только во внешнем по отношению к гелю объеме раствора. Молекулы меньших размеров будут также находиться и во внешнем объеме раствора, но их доля в этом объеме будет меньше чем в исходном веществе, что зависит от соотношения Vt и V0.
Промывание колонки растворителем приведет к вертикальному перемещению молекул исследуемого вещества вдоль колонки. Крупные молекулы будут двигаться свободно с растворителем. Молекулы меньшего размера в каждом новом слое колонки будут распределяться по всему объему геля, т.е. проникать в его поры и вымываться из них медленнее, чем движутся крупные молекулы. В результате этого крупные молекулы будут двигаться по колонке быстрее, чем молекулы меньшего размера, движение которых тормозится диффузией в поровое пространство геля. В результате этого в колонке будут формироваться зоны (слои), содержащие молекулы различных размеров и движущиеся с неодинаковой скоростью (рис. 6).
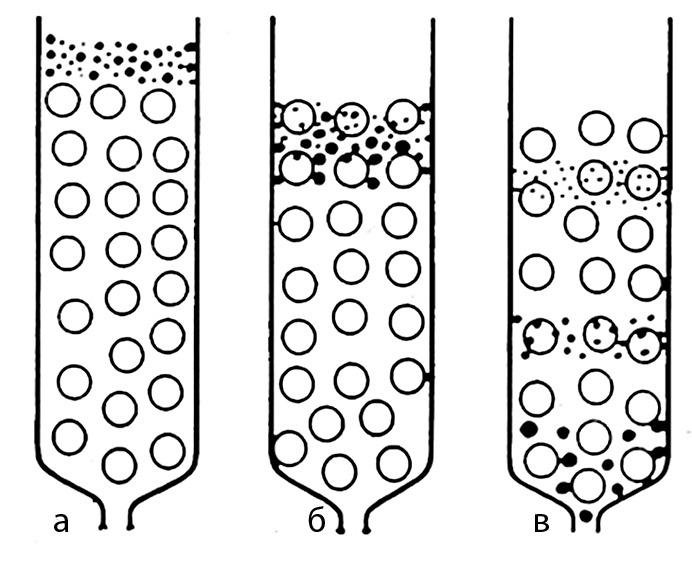
Рис. 6. Схема процесса гель-хроматографии.
а – момент внесения смеси веществ на колонку; б – начало фракционирования; в – начало выхода из колонки фракции наиболее крупных молекул.
Вытекающий из колонки раствор (элюат) собирают порциями по 2-5 мл и в каждой порции определяют оптическую плотность при длине волны 215-240 нм или содержание углерода. По полученным результатам строят график, на котором по оси абсцисс откладывают объем элюата (мл), а по оси ординат – величину оптической плотности D (или концентрацию углерода) каждой порции элюата (рис. 7).
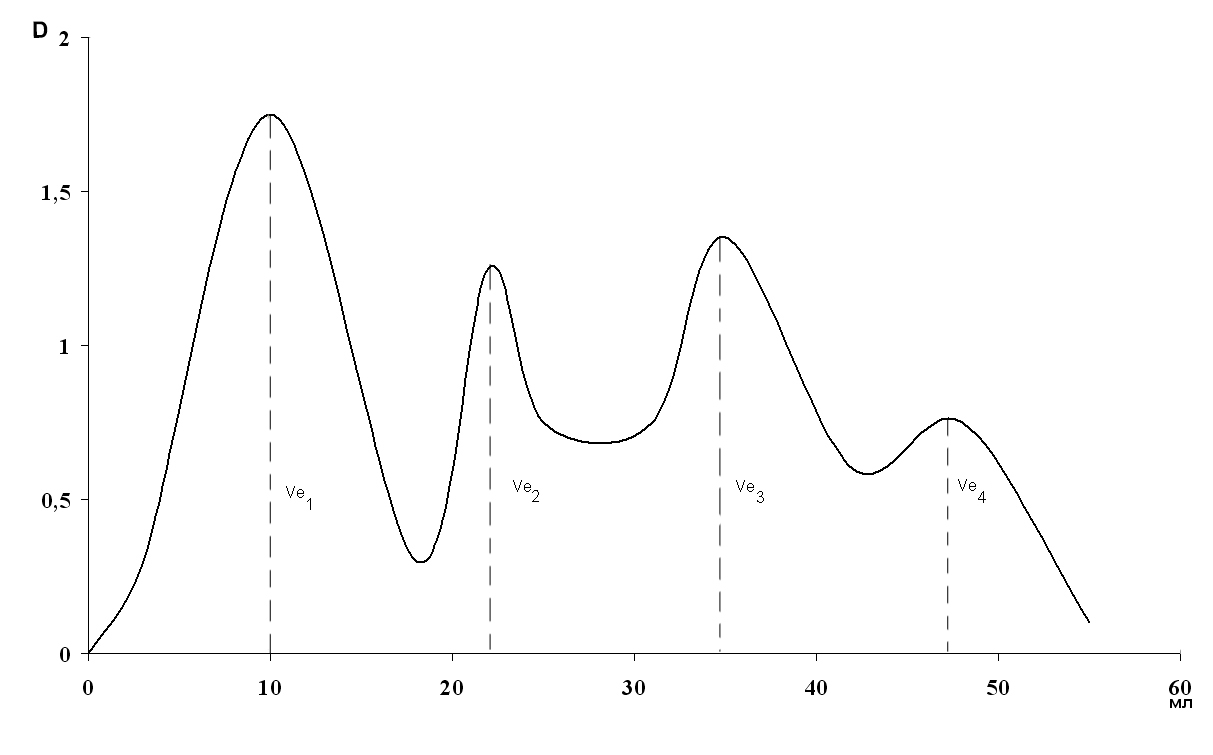
Рис. 7. Гель-хроматограмма гумата натрия.
Полученная таким образом кривая элюирования или гель-хроматограмма дает представление о соотношении молекул (частиц) с разными молекулярными массами, или о молекулярно-массовом распределении. Максимумы на гель-хроматограмме характеризуют отдельные сравнительно монодисперсные фракции, доля которых в составе препарата в первом приближении пропорциональна площади, ограниченной кривой элюирования для каждой фракции. Кроме того, с помощью максимумов на гель-хроматограмме находят молекулярные массы фракций.
Важнейшим показателем, необходимым для вычисления молекулярных масс является объем выхода элюата Ve. Это объем элюата, собранный с момента нанесения вещества на колонку и до того момента, когда на кривой появляется максимум выхода вещества.
Между объемом выхода и молекулярной массой хроматографируемого вещества существует определенная зависимость. Для глобулярных белков формула имеет вид:
lg M = M0 – (6,062 – 5,00d) ∙ (Vt/V0),
где M – молекулярная масса; M0 – константа; d – плотность набухшего геля.
Для различных типов сефадексов (G-50, G-75, G-100, G-150) эта формула имеет конкретный вид:
для G-50: lg M = 4,79 – 0,42(Ve/V0),
для G-75: lg M = 5,624 – 0,752(Ve/V0),
для G-100: lg M = 5,941 – 0,847(Ve/V0),
для G-150: lg M = 6,698 – 0,987(Ve/V0).
Для определения свободного объема (V0) используется вещество с известной молекулярной массой, которая заведомо значительно больше предела разделения геля. Обычно используется голубой декстран, молекулярная масса которого составляет 2 ∙ 106 Дальтон.
После нахождения молекулярных масс индивидуальных фракций находят среднечисловое значение молекулярной массы анализируемого вещества по формуле:
где Mn – среднечисловое значение молекулярной массы анализируемого вещества; Mi – молекулярная масса отдельной фракции; ni – содержание этой фракции в %.
Полученные результаты сводят в таблицу (табл. 30).
Таблица 30. Молекулярно-массовый состав гуминовых кислот обыкновенного чернозема, сефадекс G-75.
| Почва | Горизонт | Номер фракции | Молекулярная масса фракций | Относительное содержание, % | Примерная среднечисловая молекулярная масса |
| Чернозем обыкновенный | Апах | 1 | ≥75000 | 60 | 50700 |
| 2 | 16400 | 33 | |||
| 3 | 3600 | 7 | |||
| АВ1 | 1 | ≥75000 | 73 | 57700 | |
| 2 | 13200 | 20 | |||
| 3 | 4500 | 7 |
Результаты гель-хроматографии гумусовых веществ во многом зависят от применяемого растворителя. При неудачно выбранном растворителе может происходить агрегирование гуминовых и гиматомелановых кислот в случае недостаточно высоких значений рН и в присутствии избытка электролита и, кроме того, адсорбция гумусовых веществ матрицей геля, что отчетливо проявляется при гель-хроматографии гумусовых кислот с высокой зольностью. Все это искажает результаты исследования.
Агрегирование способствует кажущемуся увеличению высокомолекулярной фракции в составе анализируемого вещества, тогда как частичная адсорбция изменяет соотношение в сторону кажущегося увеличения доли низкомолекулярных фракций. При необратимой адсорбции результаты становятся неопределенными и характеризуют только ту часть вещества, которая была элюирована из колонки.
Необратимую адсорбцию гумусовых кислот можно наблюдать визуально; в этом случае в верхней части колонки остается неподвижная окрашенная зона. Если взаимодействие гумусовой кислоты с гелем сефадекса обратимо, то оно тормозит передвижение вещества по колонке. Взаимодействие гумусовой кислоты с гелем можно установить на основании коэффициента распределения (Kd):
Все величины в правой части находятся опытным путем. V0 – объем элюата очень крупных молекул известного вещества, Vi – объем элюата очень мелких молекул известного вещества, Ve – объем элюата фракции анализируемого вещества. Если коэффициент Kd превышает 1, то вполне вероятно, что имело место взаимодействие гумусовой кислоты с матрицей геля. Однако при таком определении остается сомнение – не происходит ли частичная сорбция мелких молекул внутри гранул, что приведет к завышенному значению Vi. Поэтому на практике нередко предпочитают использовать другой коэффициент, характеризующий движение хроматографической зоны вдоль колонки (Kav):
Объем колонки (Vt) легко определить по ее внутреннему диаметру и длине.
Существенное влияние на результаты гель-хроматографии гумусовых веществ оказывает явление ассоциации их молекул, т.е. взаимодействие их друг с другом. В результате этого происходит кажущееся увеличение молекулярных масс фракций или появление фракций, которых в реальности не существует. Ассоциация молекул возможна за счет водородной или межмолекулярной связи, в результате взаимодействия положительно и отрицательно заряженных функциональных групп гумусовых кислот, а при недостаточной очистке препарата и за счет металлов служащих мостиками между молекулами гумусовых кислот. Для предотвращения ассоциации молекул гумусовых кислот применяют различные детергенты, подавляющие этот процесс, однако полностью исключить ассоциацию молекул, по-видимому, затруднительно.
3.7.Показатели гумусового состояния почв
В почвенных исследованиях для всесторонней оценки органического вещества используется широкий набор показателей, которые в совокупности характеризуют гумусовое состояние почв (табл. 31). К числу важнейших из них относят содержание и запасы гумуса, его профильное распределение, обогащенность азотом, тип гумуса и специфику органоминеральных производных. Однако в целом, выбор показателей, используемых для характеристики органического вещества почвы, будет определяться поставленными задачами.
Ряд показателей гумусового состояния почв получают на основании анализа группового и фракционного состава гумуса, для получения других требуется проведение специальных исследований.
Использование системы показателей гумусового состояния позволяет получить целостную и объективную картину об особенностях органической части почвы и характере ее трансформации под влиянием природных или антропогенных факторов. Так, черноземам свойственно высокое содержание гумуса и его постепенное уменьшение с глубиной. Дерново-подзолистые почвы характеризуются низким содержанием гумуса, количество которого с глубиной резко падает. Бимодальное распределение гумуса, то есть наличие двух максимумов в его содержании один из которых приурочен к гумусовому горизонту, а второй находится на той или иной глубине почвенного профиля, свидетельствует об иллювиировании гумуса, или о реликтовой природе второго гумусового горизонта.
Таблица 31. Показатели гумусового состояния почв
(Л.А.Гришина и Д.С. Орлов, 1978)
| Показатель, единицы измерения | Уровень, характер проявления | Пределы величин |
| Мощность подстилки (для лесных почв), см | Очень мощная Мощная Средней мощности Маломощная | >10 5-10 2-5 <2 |
| Отношение запасов органического вещества в подстилке и в минеральном профиле | Эктоморфное распределение Мезоморфное распределение Эндоморфное распределение | >1 1 <1 |
| Содержание гумуса в гумусовых горизонтах, % | Очень высокое Высокое Среднее Низкое Очень низкое | >10 6-10 4-6 2-4 <2 |
| Запас гумуса в слоях 0-20 см (0-100 см), т/га | Очень высокий Высокий Средний Низкий Очень низкий | >200 (>600) 150-200(400-600) 100-150(200-400) 50-100(100-200) <50(<100) |
| Профильное распределение гумуса в метровой толще | Резко убывающее Постепенно убывающее Равномерное Нарастающее Бимодальное | --- --- --- --- --- |
| Обогащенность гумуса азо- том по отношению С : N | Очень высокая Высокая Средняя Низкая Очень низкая | <5 5-8 8-11 11-14 >14 |
| Степень гумификации орга- нического вещества. СГк/Собщ ∙ 100% | Очень высокая Высокая Средняя Слабая Очень слабая | >40 30-40 20-30 10-20 <10 |
| Тип гумуса, СГк : СФк | Гуматный Фульватно-гуматный Гуматно-фульватный Фульватный | >2 1-2 0,5-1 <0,5 |
| Содержание "свободных" гуминовых кислот, % к сумме Гк | Очень высокое Высокое Среднее Низкое Очень низкое | >80 60-80 40-60 20-40 <20 |
Продолжение таблицы 31
| Содержание гуминовых ки- слот, связанных с Са2+, % к сумме Гк | Очень высокое Высокое Среднее Низкое Очень низкое | >80 60-80 40-60 20-40 <20 |
| Содержание прочно связных гуминовых кислот, % к сумме Гк | Высокое Среднее Низкое | >20 10-20 <10 |
| Содержание негидролизуемого остатка, % к Собщ | Высокое Среднее Низкое | >60 40-60 <40 |
| Оптическая плотность гу- миновых кислот. Е465 нм0,001%гк1 см | Очень высокая Высокая Средняя Слабая Очень слабая | >0,20 0,10-0,20 0,06-0,10 0,03-0,06 <0.03 |
| Присутствие пигментов Pg в гумусе | Да Нет | --- --- |
| Присутствие хлорофиллов в спиртобензольной вытяжке | Да Нет | --- --- |
Тип гумуса оценивается по отношению углерода гуминовых кислот к углероду фульвокислот (СГк : СФк). Границей раздела типов гумуса условно принято отношение СГк : СФк, равное единице. Величинами больше единицы характеризуется гуматный тип, который подразделяется на собственно гуматный (СГк : СФк > 2) и фульватно-гуматный (СГк : СФк в пределах 1-2). Таков гумус черноземов, темно-каштановых почв, темно-серых лесных, некоторых дерновых почв. При фульватном типе гумуса, подразделяющегося на гуматно-фульватный и собственно фульватный величина отношения СГк : СФк < 1. Такой тип гумуса свойственен подзолистым и дерново-подзолистым почвам, светло-серым лесным, светло-каштановым, бурым почвам, сероземам.
Содержание различных фракции Гк и Фк дает представление о характере связи гумусовых веществ с минеральной частью почвы, а также их активности в почвенном профиле. При высоком содержании свободных гуминовых кислот, как правило, мало их связано с кальцием. На основании этого можно выделить почвы, где гуматы кальцияиграют большую роль в формировании мощных гумусово-аккумулятивных горизонтов (чёрноземы, темно-каштановые почвы), и почвы, где велика роль гумусовых веществ в трансформации их минеральной части (подзолистые, дерново-подзолистые почвы).
В целом наиболее рельефные различия обнаруживаются в том случае, когда с помощью системы показателей гумусового состояния сопоставляются почвы, существенно различающиеся по условиям почвообразования, например черноземы и сероземы, или черноземы и дерново-подзолистые почвы. Высокая биологическая активность черноземов, нейтральная реакция среды, отсутствие сквозного промачивания и достаточно длинный вегетационный период способствуют формированию гуматного гумуса и конденсированных гуминовых кислот с высокой оптической плотностью.
Неспецифические органические вещества, фульвокислоты, периферическая часть гуминовых кислот в черноземах быстрее минерализуются и вовлекаются в процессы трансформации, чем в других почвах. В почвах таежно-лесной зоны интенсивность биохимических процессов ограничена невысокими температурами, кислой реакцией, наличием токсичных соединений алюминия и марганца. В почвах аридных областей из-за дефицита влаги резко сокращается период трансформации органических остатков и продуктов их разложения. Кроме того, негативное влияние на процесс гумусообразования оказывает карбонатность, засоление и солонцеватость почв. Поэтому в таких условиях начинают доминировать фульвокислоты, в составе гумуса обнаруживается довольно много неспецифических соединений, гуминовые кислоты содержат меньше углерода, но больше азота, в них велика доля периферических алифатических цепей.
Менее наглядная картина получается при сравнительной характеристике почв, формирующихся в сходных природных условиях. В этом случае, различия, обнаруживающиеся между почвами, могут и не выходить за количественные границы уровня того или иного признака.
Однако в целом, при использовании системы показателей гумусового состояния почв применительно к генетическим исследованиям, можно получить довольно много ценной информации об особенностях органической части изучаемых почв.
В меньшей степени система показателей гумусового состояния почв будет полезной при агрономической оценке органического вещества, поскольку не позволяет идентифицировать и количественно оценить агрономическую ценность гумуса и его отдельных компонентов. Также она часто оказывается недостаточно информативной при наблюдениях за изменениями, происходящими с гумусовым состоянием почв различного сельскохозяйственного использования. Все это делает ее малопригодной для прогностических целей и эффективного использования в агрономической практике.
3.8. Методы определения содержания и состава органического вещества в болотных торфяных почвах.
Торфяные почвы характеризуются высоким содержанием органического вещества неоднородного и грубодисперсного по составу, особенно при низкой степени разложения торфа. Такие же особенности присущи и органогенным горизонтам заболоченных минеральных почв – болотно-подзолистым и лугово-болотным. В ряде случаев возникает необходимость анализа лесных подстилок, органических удобрений, компостов и других органогенных материалов. Однако методы, разработанные для изучения органического вещества минеральных почв, непригодны для исследования подобного рода объектов и требуют соответствующих изменений. Кроме того, применяются и другие виды анализов.
3.8.1. Определение потери при прокаливании и зольности торфа.
Метод основан на сжигании навески торфа в муфельной печи при температуре 800 оС. Потери при прокаливании характеризуют убыль массы торфа при нагревании его до указанной температуры, зольность – содержание золы (минеральных веществ) в абсолютно сухом торфе.
Ход анализа. В предварительно прокаленный и взвешенный тигель с крышкой берут навеску торфа от 1-2 до 6-12 г. Взвешивание производят на аналитических весах. Одновременно в сушильный стаканчик берут навеску торфа 3-5 г для определения влажности.
Тигель без крышки помещают в холодную или подогретую до 200 оС муфельную печь, находящуюся в вытяжном шкафу, и постепенно повышают температуру до 800 оС. Через 2-3 часа тигель с зольным остатком вынимают из печи, закрывают крышкой, охлаждают в течение 5 минут и помещают в эксикатор на 30 минут до полного охлаждения.
Охлажденный тигель взвешивают на аналитических весах, после чего повторяют прокаливание в течение 40 минут, охлаждают и взвешивают. Прокаливание повторяют до тех пор, пока изменение массы не будет превышать 0,001 г. Если в процессе сжигания торфа произошло сплавление золы, то после охлаждения тигля ее растворяют несколькими каплями азотной кислоты, затем добавляют 1 мл насыщенного раствора NH4NO3, высушивают и снова озоляют. Определение влажности и зольности торфа выполняют в 2-кратной повторности.
Зольность в процентах от массы абсолютно сухого торфа вычисляют по формуле:
где ЗТ – зольность торфа, %; m1 – навеска воздушно-сухого (влажного) торфа, г; m2 – масса золы, г; W – влажность торфа, %.
Расхождения между параллельными определениями зольности торфа не должны превышать 0,3 % для образцов с зольностью до 8,0 %, 0,5 % при зольности 8,1-20,0 % и 1,0 % при зольности больше 20,1 %.
Потери от прокаливания вычисляются по формуле:
ПП = 100 – ЗТ,
где ПП – потери при прокаливании, в % от массы абсолютно сухого торфа; ЗТ – зольность торфа, %.
Полученные данные используют для оценки запасов органических и минеральных веществ, а зольность торфа служит для его диагностики. При необходимости определяют химический состав золы. Аналогично анализируют и другие органогенные материалы.
3.8.2. Одновременное определение общего содержания углерода и азота в торфяных почвах методом Анстета в модификации В.В. Пономаревой и Т. А. Николаевой
Принцип метода состоит в окислении навески вещества, содержащей от 50 до 100 мг органического С, серно-хромовой смесью с концентрацией 3,0 н. по CrO3 при отношении H2SO4 : H2O, равным 3:2.
В оригинальном методе Анстета описанная им техника окисления органического вещества не безопасна и не безупречна по точности получаемых результатов из-за мгновенного и сильного разогревания окислительной смеси и бурного разложения органического вещества. Поэтому в аналитической практике обычно используется модифицированная методика, предложенная В.В. Пономаревой и Т.А. Николаевой.
Они рекомендуют предварительно готовить большой запас охлажденной смеси из двух объемов 12 %-ного водного раствора CrO3 и одного объема концентрированной H2SO4 и приливать к навеске вещества 30 мл этой смеси, а затем 20 мл концентрированной H2SO4.
Ход анализа. Навески для анализа берут в зависимости от содержания в исследуемом материале золы, а именно:
| Зола, % | Навеска, г |
| <10 | 0,2 |
| 10-25 | 0,2-0,25 |
| 25-50 | 0,25-0,4 |
| 50-75 | 0,4-0,75 |
На аналитических весах берут навеску воздушно-сухого торфа или другого растительного материала (пропущенного через сито с диаметром отверстий 0,25 мм) и переносят в коническую колбу на 200-250 мл из термостойкого стекла. Для равномерного кипения окислительной смеси к навеске добавляют немного (на кончике ножа) прокаленной пемзы или почвы. Затем приливают очень точно из бюретки со стеклянным краном 30 мл серно-хромовой смеси и 20 мл концентрированной Н2SO4 из другой бюретки или мерным цилиндром на 25 мл. Большая точность объема прибавляемой Н2SO4 не обязательна, но необходима высокая точность объема прибавляемого раствора серно-хромовой смеси. Очень важно всегда придерживаться одинаковой, малой скорости стекания из бюретки хромовой смеси.
Колбу закрывают маленькой воронкой в качестве холодильника, содержимое её осторожно перемешивают и по окончании бурного разложения органического вещества колбу ставят на заранее разогретую этернитовую плитку или песчаную баню, содержимое ее доводят до кипения и умеренно кипятят точно 5 мин по секундомеру или песочным часам. Не следует принимать за начало кипения интенсивное выделение мелких пузырьков диоксида углерода, которое происходит еще до закипания. Кипение смеси начинается тогда, когда на ее поверхности появляются крупные пузырьки газа.
После охлаждения содержимое колбы осторожно переносят при помощи воды из промывалки в мерную колбу на 250 мл. После окончательного охлаждения жидкость доводят в колбе до метки и очень хорошо перемешивают. Берут точно пипеткой две парные пробы по 25 мл на титрование солью Мора (с фенилантраниловой кислотой) для определения органического С по окисляемости и две пробы по 50 мл, для отгонки аммиака и определения N. Отгонку аммиака производят с 25 мл 50 %-ного раствора NаОН и кусочком гранулированного цинка или цинковой пылью. В приемную колбу наливают 25 мл 0,01 н. раствора Н2SO4. Избыток кислоты титруют 0,01 н. раствором NаОН с индикатором метилрот + метиленблау. При низком содержании азота в анализируемом веществе для отгонки NH3 лучше взять не 50, а 100 мл раствора и соответственно 50 мл 50%-ного раствора NаОН.
В точно таких же условиях проводят холостой опыт для установления соотношения между серно-хромовой смесью и раствором соли Мора, с одной стороны, и растворами 0,01 н. Н2SO4 0,01 н. NаОН при определении N - с другой.
Результаты определения С и N вычисляют в процентах от абсолютно сухой массы анализируемого вещества. Найденное количество N умножают на коэффициент 1,03 с учетом того, что при данном методе минерализуется в среднем 97% N .
Вычисление результатов анализа
Содержание органического С торфа находят по следующей формуле:
где V1 – количество раствора соли Мора, израсходованное на титрование хромовой смеси в холостом опыте, мл; V2 – количество раствора соли Мора, израсходованное на титрование избытка хромовой смеси в опыте с торфом, мл; н – нормальность раствора соли Мора; 0,003- молярная масса эквивалента углерода; V0 – объем мерной колбы, куда перенесена жидкость после окисления торфа, мл; V3 – объем жидкости взятой для титрования раствором соли Мора, мл; m - навеска торфа взятая для анализа, г; 100 – множитель для пересчета результатов анализа на 100 г торфа.
Содержание органического N торфа находят по формуле:
где V1 – количество раствора NaОН, израсходованное на титрование серной кислоты в холостом опыте, мл; V2 – количество раствора NаОН, израсходованное на титрование избытка серной кислоты в опыте с торфом, мл; н – нормальность раствора NaОН; 0,014 – молярная масса эквивалента азота; V0 – объем мерной колбы, куда перенесена жидкость после окисления торфа, мл; V3 – объем жидкости взятой для отгонки аммиака, мл; m – навеска торфа, г; 100 – множитель для пересчета результатов анализа на 100 г торфа; 1,03 – коэффициент для пересчета результатов анализа, введенный с учетом неполноты минерализации азота при данном методе.
Пример расчета. Навеска торфа, взятая для анализа равна 0,22 г. После кипячения с окислительной смесью содержимое колбы перенесено в мерную колбу объемом 250 мл. Из нее для определения органического углерода взято 25 мл, на титрование которых пошло 10,8 мл 0,208 н. раствора соли Мора. В холостом опыте на титрование пошло 22,6 мл раствора соли Мора. Для отгонки аммиака взято 50 мл жидкости из мерной колбы объемом 250 мл. На титрование серной кислоты в холостом опыте пошло 22,6 мл 0,02 н. раствора NaOH, на титрование избытка кислоты в опытном образце – 20,8 мл. Содержание органического С и N равно:
